生物等效性评价的若干问题的探讨
作者:刘晓东 杨劲
单位:中国药科大学药代研究中心,南京 210009
关键词:
中国临床药理学与治疗学000317
中图分类号 R969
在进行制剂的生物等效性评价时,通常以认可的制剂作为参比制剂,采用双交叉试验设计,即将受试者等分成两组,一组先服用参比制剂后服用受试制剂,另一组先服用受试制剂后服用参比制剂。两种制剂间隔一定的清洗期。分析血药浓度,计算有关药动学参数并采用双单侧t检验进行生物等效性评价[1]。但在生物等效性评价试验实施过程中,往往因一些非人为因素影响实验结果,或是欠妥的规定或观点,使一些客观存在的,符合实际的研究资料被退回。本文通过理论与实际例子来说明在有些情况下,尽管不符合某些规定,但确实是符合实际的。
, 百拇医药
1生物等效性试验中序列均匀性被破坏
在生物等效研究中,在试验开始阶段,设计是非常严密,要求双交叉,但在试验实施过程中因各种原因如受试者中途要求退出试验(知情同意书中规定受试者的权力)或因药物出现不良反应等特殊原因而中止相应的受试者的试验,不得不将该受试者数据排除,造成了试验设计序列间的均匀性破坏。最终研究报告中会出现两序列间受试者例数不等的现象,导致序列间的不均匀性。由于生物等效评价的方差分析中不分析序间变异,因此这些结果不影响等效性评价。在研究报告中出现这种结果应该是允许的,当然在报告中应说明产生这种现象的原因。
例如,某公司研究卡马西平缓释制剂的生物等效性试验,在计划制订阶段,设计18例受试者,采用双交叉进行试验,采用多剂量给药方式,分析稳态的药代动力学参数。由于在试验实施过程中,一些受试者因胃肠道反应或嗜睡等不良反应而中途退出试验。结果正式报告中只有12例受试者有完整的数据。
, 百拇医药 表1 受试者多剂量口服卡马西平缓释制剂后稳态峰浓度(μg.ml-1) 受试者
服药顺序
试验制剂A
参比制剂B
Cmax
lnCmax
Cmax
lnCmax
1
8.110
2.0931
, http://www.100md.com
14.066
2.6438
2
17.809
2.8797
14.044
2.6422
4
17.644
2.8704
14.696
2.6876
6
, 百拇医药
14.552
2.6777
13.913
2.6328
7
16.310
2.7918
12.264
2.5067
8
14.640
2.6838
10.272
, 百拇医药
2.3294
12
12.775
2.5475
13.653
2.6140
13
9.720
2.2742
8.276
2.1134
14
9.526
, http://www.100md.com
2.2540
9.117
2.2101
15
13.380
2.5938
10.754
2.3753
16
12.235
2.5043
12.765
2.5467
, 百拇医药
17
8.543
2.1451
8.111
2.0932
12.937
2.5263
11.828
2.4496
s
3.4123
0.2760
, 百拇医药
2.417
2.2179
表1给出了完整试验的12例受试者Cmax值。
其方差分析结果见表2。 表2 表1的方差分析结果 变异来源
SS
自由度
MS
P
总
1.45
23
剂间
, http://www.100md.com
0.035
1
0.035
0.97
周期
0.028
1
0.0028
0.08
个体
1.0518
11
0.09562
, 百拇医药
2.65
误差
0.3604
10
0.03604
经双单侧t检验公式算得t1=3.87,t2=1.89,大于临界值t1-2*0.05(10)=1.812,通过生物等效检验。该实例说明尽管两实验组A/B和B/A组的例数不等,造成了序列间的不均匀性,但仍可进行生物等效性评价。作者认为随着生物等效性研究材料增多,将会出现更多的类似的情况,有时是不可避免的,在资料审核过程中,对于这样的资料应该认可。
2血药浓度峰时间(tmax)生物等效判别标准偏高
, http://www.100md.com
目前,血药浓度峰时间(peaktime,tmax)生物等效的判别仍按照80%~120%的标准。作者认为这个标准要求偏高,有时是不切实际的。下面我们对这个问题进行讨论。双单侧t检验的统计量: (1)
(1)
式中 分别为受试制剂和参比制剂相应参数均数,S
分别为受试制剂和参比制剂相应参数均数,S 为标准误(方差分析求得),n为例数。为了讨论方便,我们定义
为标准误(方差分析求得),n为例数。为了讨论方便,我们定义 与
与 的比为k(k=
的比为k(k= /
/ ),S
),S 与
与 的比值
的比值 为相对标准误。这样,(1)式可改写为:
为相对标准误。这样,(1)式可改写为: (2)
(2)
, 百拇医药
由(2)式可见,统计量t1与t2是k,a及N的函数。
图1给出了接受生物等效时受试制剂均数( )、参比制剂均数(
)、参比制剂均数( )、受试者例数(n)以及相对标准误(a)关系曲线。
)、受试者例数(n)以及相对标准误(a)关系曲线。
图1中曲线表示接受生物等效检验假设时相对标准误a的临界值,如用24人进行试验,当 /
/ 为1.0时,只有相对标准误小于40%时,才能接受生物等效假设,否则生物不等效。当
为1.0时,只有相对标准误小于40%时,才能接受生物等效假设,否则生物不等效。当 /
/ 接近0.8或1.2时(t1或t2接近于0),不可能接受生物等效要求,除非相对标准误非常之小。相对标准误是误差均方平方根S
接近0.8或1.2时(t1或t2接近于0),不可能接受生物等效要求,除非相对标准误非常之小。相对标准误是误差均方平方根S 和
和 值的函数,当
值的函数,当 /
/ 、S
、S 一定时,
一定时, 大,相对标准误的比值小,接受生物等效性可能性大,反之接受生物等效性的可能性小。在生物等性研究中,AUC和峰浓度(Cmax)有较大的基数(
大,相对标准误的比值小,接受生物等效性可能性大,反之接受生物等效性的可能性小。在生物等性研究中,AUC和峰浓度(Cmax)有较大的基数( ),其相对标准误小,容易达到达到生物等效性,而对于tmax而言,影响因素较多,S
),其相对标准误小,容易达到达到生物等效性,而对于tmax而言,影响因素较多,S 较大,且
较大,且 值较小,必然导致较大的相对标准误,因而往往会得出AUC和Cmax均生物等效,而tmax不等效的结论。
值较小,必然导致较大的相对标准误,因而往往会得出AUC和Cmax均生物等效,而tmax不等效的结论。 24901.gif (2215 bytes)" width="245" height="142">
24901.gif (2215 bytes)" width="245" height="142">
, http://www.100md.com
图1接受生物等效时受试制剂参数均数( )、参比制剂参数均数
)、参比制剂参数均数 、相对标准误(S
、相对标准误(S /
/ )以及受试者例数n之间的关系
)以及受试者例数n之间的关系
再者,在生物等效性试验中,峰时间用实测值。在实际工作中,血药浓度在峰值左右波动大,加上实验误差,不能准确地测定峰时间。其准确性也往往因取样点的分散而降低。尤其是峰值不明显的或者达峰时间短的药物,tmax接受生物等效的假设相当困难的或无意义。例如,我们在进行国产降糖药瑞格列奈的生物等效性评价时,以进口品为参比制剂tmax列于表3。
, 百拇医药 经方差分析算得S =0.3454,S
=0.3454,S /
/ =45.4%,
=45.4%, /
/ =1.04,代入(2)得到t1=1.74,t2=1.17,其临界值t1~0.05(20)=1.725,即峰时间生物不等效,而其它参数如AUC,Cmax均已通过生物等效性检验。实际上两制剂的峰时间是非常接近的,不能受等效的原因之一可能是
=1.04,代入(2)得到t1=1.74,t2=1.17,其临界值t1~0.05(20)=1.725,即峰时间生物不等效,而其它参数如AUC,Cmax均已通过生物等效性检验。实际上两制剂的峰时间是非常接近的,不能受等效的原因之一可能是 值较小,相对标准误偏大。此外,峰时间短,取样点造成峰时不准也是造成生物不等效的原因之一。
值较小,相对标准误偏大。此外,峰时间短,取样点造成峰时不准也是造成生物不等效的原因之一。
, http://www.100md.com
表322名受试者口服瑞格列奈后实测的峰时间/h 受试者
国产
进口
1
0.75
0.75
2
0.50
0.75
3
1.50
0.75
4
, 百拇医药
1.50
1.50
5
0.75
0.50
6
0.75
0.75
7
1.00
1.50
8
0.50
, http://www.100md.com
0.75
9
0.50
0.50
10
0.50
1.50
11
0.50
0.25
12
0.50
0.75
, 百拇医药
13
0.50
0.75
14
0.50
0.50
15
0.50
0.25
16
0.75
1.00
17
, 百拇医药
1.00
0.25
18
1.50
.75
19
0.75
1.50
20
1.50
0.50
21
0.50
, 百拇医药
0.50
22
0.75
0.50
0.79
0.76
s
0.37
0.40 25001.gif (2344 bytes)" width="245" height="194">
25001.gif (2344 bytes)" width="245" height="194">
, http://www.100md.com
图2某受试者口服美洛昔康后血药浓度-时间数据
又如,我们在研究美洛昔康时,发现该药的达峰时间很慢,不典型,多数受试者服药后3~10h内血药浓度上下波动,在此种情况下,确定达峰时间是十分困难的,有时是不准确的。如图2为一受试者服药后的血药浓度-时间一段曲线。可见受试制剂出现3个波动点时间分别为3,5和10h,相应浓度分别为1.57,1.62和1.54μg.ml-1,三个点的浓度非常接近,确定峰时非常困难。按常规,峰时应定为5,参比制剂的峰时为6,两者比值为0.83。由于测定误差的存在,5h点的浓度波动也可能被认为是误差造成的,设定高估5%,则实际浓度=1.62-0.08=1.54μg.ml-1。这时峰时定义为3h,则比值由0.83变为0.5.。可见对于该受试者来说,峰时选定3,5或10h,都有可能。对于缓释制剂也可能出现类似的情况。在这种情况下,确定峰时的准确值是不可能的,峰时本身意义也不大,tmax是否生物等效已失去了意义。作者建议在生物等效性研究时采纳以AUC和Cmax为主,tmax是否生物等效,只能作为参考的观点[2],才符合实际情况。
, http://www.100md.com
3缓控释制剂与常释制剂的波动性和波动系数的比较
波动系数FI是作为评价缓释制剂的重要参数之一,因与常释制剂给药频率不同,造成比较上的困难。波动系数的计算公式: (3)
(3)
式中 分别为稳态时的峰浓度,谷浓度和坪浓度。
分别为稳态时的峰浓度,谷浓度和坪浓度。
理论上,缓释制剂的波动系数不大于常释制剂,但在实际工作中比较困难,甚致是不可能的。下面对此进行讨论。
为了讨论方面,对于一室处置的药物,假设吸收常数ka与消除常数k的比值为b(b=ka/k),表观分布容积为V,按等间隔τ多剂量给药达稳态时: (4)
(4) (5)
(5) (6)
(6)
 (7)
(7)
, 百拇医药
现要制成缓释制剂,因药物的消除速率常数和分布容积不变,仅吸收速率降低。设定给药间隔为常释制剂的N倍,吸收速率常数为常释制剂的1/m,则得到缓释制剂的波动系数FI: (8)
(8)
缓释制剂与常释制剂的波动系数比R: (9)
(9)
如常释制剂按消除半衰期间隔给药,则得到 (10)
(10)
由(10)式可见其波动系数的比值大小取决缓释制剂的时间间隔与常数制剂间隔之比N、常释制剂吸收常数与消除常数之比b和常释制剂与缓释制剂吸收常数之比m大小。图3给出了在缓释制剂波动系数不大于常释制剂时N,b和m三者间的关系。
, http://www.100md.com
图3中的线表示缓释制剂的波动系数小于或等于常释制剂时,m最小值。由图3可见,对特定的药物来说,b为定值,此时的R大小取决于N和m。给药间隔加大,N大,则对制剂的要求加大。如b=5时,N=2,3,4时m值分别为2.75,3.89和5.32。b=10时,m值分别为4.39,7.15和8.66。例如,已知某药物半衰期为8小时,Vd=101,生物利用度为100%。消除速率k=0.0866h-1,ka=0.866h-1,常释制剂按半衰期给药,每日3次,每次100mg。峰浓度为16.7μg.ml-1,谷浓度为11.1μg.ml-1,坪浓度为14.4μg.ml-1,波动系数为0.389。现欲制成24h缓释制剂,即N=3,查图3得m=7.15。即将该药物的吸收速度降至常释制剂的1/7.15,方可使波动系数不大于常释制剂。在总剂量不变的情况下,算得的峰浓度为20.7μg.ml-1,谷浓度为15.1μg.ml-1,波动系数为0.389。波动系数与与常释制剂的比为1。需要注意的是若按这种吸收速率,即ka=0.1211h-1,吸收半衰期为5.7h,经过1个吸收半衰期后,药物可能已通过最佳吸收部位(吸收窗),生物利用度往往难达到要求。在实际工作中,因考虑生物利用度等要求,m值可能要小一些,必然导致缓释制剂的波动系数会比常释制剂大。
, 百拇医药
在总药量不变的情况下,我们也可获得谷浓度和峰浓度的比值关系 (11)
(11)
图4给出了缓释制剂谷浓度不小于常释制剂时,N,m和b三者之间的关系曲线。 25101.gif (2263 bytes)" width="250" height="176">
25101.gif (2263 bytes)" width="250" height="176">
图3缓释制剂波动系数不大于常释制剂时,给药次数N、药物吸收常数与消除速率常数比和缓释制剂与常释制剂吸收常数比关系 25102.gif (2318 bytes)" width="270" height="184">
25102.gif (2318 bytes)" width="270" height="184">
图4缓释制剂谷浓度不小于常释制剂时N,b和m三者关系比较
, 百拇医药
可见图3和图4在保证缓释制剂谷浓度不低于常释情况下的m值比波系数的要求小。如b=10,N=3时,波动系数比较中的m值为7.15,而谷浓度比较中的m=6.15。即保证谷浓度不降低的要求较低,当然是以有较大波动系数为代价的。如前例按m=6.15,算得峰浓度为19.5,谷浓度为11.14,波动系数为0.582,高于常释制剂的0.389。
同理得到缓释制剂与常释制剂稳态峰浓度比R为: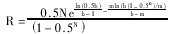 (12)
(12)
由(12)可见,要使R值小于或等于1是困难的,除非生物利用度降低,当然这样制剂其吸收程度生物不等效,不符合要求。也就是说要求在不改变总剂量的情况下,要求缓释制剂的稳态峰浓度低于常释制剂是不可能的。
因此,将常释制剂制成缓释制剂,给药次数减少,即N增加,要求降低药物的释放和吸收速度即增大m值,但由于受生物利用度及药物胃肠停留时间的限制,m不可能无限加大,往往低于理论值,在这种情况下,缓释制剂的波动系数大于常释制剂是客观存在。要求缓释制剂同时满足峰浓度低于常释制剂、谷浓度不低于常释制剂,波动系数不大于常释制剂[3,4]是不可能。因此,作者认为对于缓释制剂的评价应作面分析,根据药物的有效浓度、安全范围作具体分析,不能一概而论。
, http://www.100md.com
刘晓东,男,41岁,博士,教授,主要从事药物动力学研究。
参考文献
1,黄圣凯,韩可勤.生物等效性评价的几种统计方法.中国临床药理学杂志,1993;9(1):43
2,桂常青,孙瑞元,李金恒.生物等效性试验实施注意事项及计算简法.国内外药物代谢与药代动力学研究新进展研讨会资料汇编,1998:35
3,刘昌孝,孙瑞元,编著药物评价实验设计与统计学基础.北京:军事医学科学出版社,1999:107
4,刘晓东.缓释制剂生物利用度研究技术规范修订参考.中国临床药理学与治疗学杂志,1997;2(3):217
2000-06-12收稿,2000-06-28修回, 百拇医药
单位:中国药科大学药代研究中心,南京 210009
关键词:
中国临床药理学与治疗学000317
中图分类号 R969
在进行制剂的生物等效性评价时,通常以认可的制剂作为参比制剂,采用双交叉试验设计,即将受试者等分成两组,一组先服用参比制剂后服用受试制剂,另一组先服用受试制剂后服用参比制剂。两种制剂间隔一定的清洗期。分析血药浓度,计算有关药动学参数并采用双单侧t检验进行生物等效性评价[1]。但在生物等效性评价试验实施过程中,往往因一些非人为因素影响实验结果,或是欠妥的规定或观点,使一些客观存在的,符合实际的研究资料被退回。本文通过理论与实际例子来说明在有些情况下,尽管不符合某些规定,但确实是符合实际的。
, 百拇医药
1生物等效性试验中序列均匀性被破坏
在生物等效研究中,在试验开始阶段,设计是非常严密,要求双交叉,但在试验实施过程中因各种原因如受试者中途要求退出试验(知情同意书中规定受试者的权力)或因药物出现不良反应等特殊原因而中止相应的受试者的试验,不得不将该受试者数据排除,造成了试验设计序列间的均匀性破坏。最终研究报告中会出现两序列间受试者例数不等的现象,导致序列间的不均匀性。由于生物等效评价的方差分析中不分析序间变异,因此这些结果不影响等效性评价。在研究报告中出现这种结果应该是允许的,当然在报告中应说明产生这种现象的原因。
例如,某公司研究卡马西平缓释制剂的生物等效性试验,在计划制订阶段,设计18例受试者,采用双交叉进行试验,采用多剂量给药方式,分析稳态的药代动力学参数。由于在试验实施过程中,一些受试者因胃肠道反应或嗜睡等不良反应而中途退出试验。结果正式报告中只有12例受试者有完整的数据。
, 百拇医药 表1 受试者多剂量口服卡马西平缓释制剂后稳态峰浓度(μg.ml-1) 受试者
服药顺序
试验制剂A
参比制剂B
Cmax
lnCmax
Cmax
lnCmax
1
8.110
2.0931
, http://www.100md.com
14.066
2.6438
2
17.809
2.8797
14.044
2.6422
4
17.644
2.8704
14.696
2.6876
6
, 百拇医药
14.552
2.6777
13.913
2.6328
7
16.310
2.7918
12.264
2.5067
8
14.640
2.6838
10.272
, 百拇医药
2.3294
12
12.775
2.5475
13.653
2.6140
13
9.720
2.2742
8.276
2.1134
14
9.526
, http://www.100md.com
2.2540
9.117
2.2101
15
13.380
2.5938
10.754
2.3753
16
12.235
2.5043
12.765
2.5467
, 百拇医药
17
8.543
2.1451
8.111
2.0932

12.937
2.5263
11.828
2.4496
s
3.4123
0.2760
, 百拇医药
2.417
2.2179
表1给出了完整试验的12例受试者Cmax值。
其方差分析结果见表2。 表2 表1的方差分析结果 变异来源
SS
自由度
MS
P
总
1.45
23
剂间
, http://www.100md.com
0.035
1
0.035
0.97
周期
0.028
1
0.0028
0.08
个体
1.0518
11
0.09562
, 百拇医药
2.65
误差
0.3604
10
0.03604
经双单侧t检验公式算得t1=3.87,t2=1.89,大于临界值t1-2*0.05(10)=1.812,通过生物等效检验。该实例说明尽管两实验组A/B和B/A组的例数不等,造成了序列间的不均匀性,但仍可进行生物等效性评价。作者认为随着生物等效性研究材料增多,将会出现更多的类似的情况,有时是不可避免的,在资料审核过程中,对于这样的资料应该认可。
2血药浓度峰时间(tmax)生物等效判别标准偏高
, http://www.100md.com
目前,血药浓度峰时间(peaktime,tmax)生物等效的判别仍按照80%~120%的标准。作者认为这个标准要求偏高,有时是不切实际的。下面我们对这个问题进行讨论。双单侧t检验的统计量:
 (1)
(1)式中
 分别为受试制剂和参比制剂相应参数均数,S
分别为受试制剂和参比制剂相应参数均数,S 为标准误(方差分析求得),n为例数。为了讨论方便,我们定义
为标准误(方差分析求得),n为例数。为了讨论方便,我们定义 与
与 的比为k(k=
的比为k(k= /
/ ),S
),S 与
与 的比值
的比值 为相对标准误。这样,(1)式可改写为:
为相对标准误。这样,(1)式可改写为: (2)
(2), 百拇医药
由(2)式可见,统计量t1与t2是k,a及N的函数。
图1给出了接受生物等效时受试制剂均数(
 )、参比制剂均数(
)、参比制剂均数( )、受试者例数(n)以及相对标准误(a)关系曲线。
)、受试者例数(n)以及相对标准误(a)关系曲线。图1中曲线表示接受生物等效检验假设时相对标准误a的临界值,如用24人进行试验,当
 /
/ 为1.0时,只有相对标准误小于40%时,才能接受生物等效假设,否则生物不等效。当
为1.0时,只有相对标准误小于40%时,才能接受生物等效假设,否则生物不等效。当 /
/ 接近0.8或1.2时(t1或t2接近于0),不可能接受生物等效要求,除非相对标准误非常之小。相对标准误是误差均方平方根S
接近0.8或1.2时(t1或t2接近于0),不可能接受生物等效要求,除非相对标准误非常之小。相对标准误是误差均方平方根S 和
和 值的函数,当
值的函数,当 /
/ 、S
、S 一定时,
一定时, 大,相对标准误的比值小,接受生物等效性可能性大,反之接受生物等效性的可能性小。在生物等性研究中,AUC和峰浓度(Cmax)有较大的基数(
大,相对标准误的比值小,接受生物等效性可能性大,反之接受生物等效性的可能性小。在生物等性研究中,AUC和峰浓度(Cmax)有较大的基数( ),其相对标准误小,容易达到达到生物等效性,而对于tmax而言,影响因素较多,S
),其相对标准误小,容易达到达到生物等效性,而对于tmax而言,影响因素较多,S 较大,且
较大,且 值较小,必然导致较大的相对标准误,因而往往会得出AUC和Cmax均生物等效,而tmax不等效的结论。
值较小,必然导致较大的相对标准误,因而往往会得出AUC和Cmax均生物等效,而tmax不等效的结论。 24901.gif (2215 bytes)" width="245" height="142">
24901.gif (2215 bytes)" width="245" height="142">, http://www.100md.com
图1接受生物等效时受试制剂参数均数(
 )、参比制剂参数均数
)、参比制剂参数均数 、相对标准误(S
、相对标准误(S /
/ )以及受试者例数n之间的关系
)以及受试者例数n之间的关系再者,在生物等效性试验中,峰时间用实测值。在实际工作中,血药浓度在峰值左右波动大,加上实验误差,不能准确地测定峰时间。其准确性也往往因取样点的分散而降低。尤其是峰值不明显的或者达峰时间短的药物,tmax接受生物等效的假设相当困难的或无意义。例如,我们在进行国产降糖药瑞格列奈的生物等效性评价时,以进口品为参比制剂tmax列于表3。
, 百拇医药 经方差分析算得S
 =0.3454,S
=0.3454,S /
/ =45.4%,
=45.4%, /
/ =1.04,代入(2)得到t1=1.74,t2=1.17,其临界值t1~0.05(20)=1.725,即峰时间生物不等效,而其它参数如AUC,Cmax均已通过生物等效性检验。实际上两制剂的峰时间是非常接近的,不能受等效的原因之一可能是
=1.04,代入(2)得到t1=1.74,t2=1.17,其临界值t1~0.05(20)=1.725,即峰时间生物不等效,而其它参数如AUC,Cmax均已通过生物等效性检验。实际上两制剂的峰时间是非常接近的,不能受等效的原因之一可能是 值较小,相对标准误偏大。此外,峰时间短,取样点造成峰时不准也是造成生物不等效的原因之一。
值较小,相对标准误偏大。此外,峰时间短,取样点造成峰时不准也是造成生物不等效的原因之一。, http://www.100md.com
表322名受试者口服瑞格列奈后实测的峰时间/h 受试者
国产
进口
1
0.75
0.75
2
0.50
0.75
3
1.50
0.75
4
, 百拇医药
1.50
1.50
5
0.75
0.50
6
0.75
0.75
7
1.00
1.50
8
0.50
, http://www.100md.com
0.75
9
0.50
0.50
10
0.50
1.50
11
0.50
0.25
12
0.50
0.75
, 百拇医药
13
0.50
0.75
14
0.50
0.50
15
0.50
0.25
16
0.75
1.00
17
, 百拇医药
1.00
0.25
18
1.50
.75
19
0.75
1.50
20
1.50
0.50
21
0.50
, 百拇医药
0.50
22
0.75
0.50

0.79
0.76
s
0.37
0.40
 25001.gif (2344 bytes)" width="245" height="194">
25001.gif (2344 bytes)" width="245" height="194">, http://www.100md.com
图2某受试者口服美洛昔康后血药浓度-时间数据
又如,我们在研究美洛昔康时,发现该药的达峰时间很慢,不典型,多数受试者服药后3~10h内血药浓度上下波动,在此种情况下,确定达峰时间是十分困难的,有时是不准确的。如图2为一受试者服药后的血药浓度-时间一段曲线。可见受试制剂出现3个波动点时间分别为3,5和10h,相应浓度分别为1.57,1.62和1.54μg.ml-1,三个点的浓度非常接近,确定峰时非常困难。按常规,峰时应定为5,参比制剂的峰时为6,两者比值为0.83。由于测定误差的存在,5h点的浓度波动也可能被认为是误差造成的,设定高估5%,则实际浓度=1.62-0.08=1.54μg.ml-1。这时峰时定义为3h,则比值由0.83变为0.5.。可见对于该受试者来说,峰时选定3,5或10h,都有可能。对于缓释制剂也可能出现类似的情况。在这种情况下,确定峰时的准确值是不可能的,峰时本身意义也不大,tmax是否生物等效已失去了意义。作者建议在生物等效性研究时采纳以AUC和Cmax为主,tmax是否生物等效,只能作为参考的观点[2],才符合实际情况。
, http://www.100md.com
3缓控释制剂与常释制剂的波动性和波动系数的比较
波动系数FI是作为评价缓释制剂的重要参数之一,因与常释制剂给药频率不同,造成比较上的困难。波动系数的计算公式:
 (3)
(3)式中
 分别为稳态时的峰浓度,谷浓度和坪浓度。
分别为稳态时的峰浓度,谷浓度和坪浓度。理论上,缓释制剂的波动系数不大于常释制剂,但在实际工作中比较困难,甚致是不可能的。下面对此进行讨论。
为了讨论方面,对于一室处置的药物,假设吸收常数ka与消除常数k的比值为b(b=ka/k),表观分布容积为V,按等间隔τ多剂量给药达稳态时:
 (4)
(4) (5)
(5) (6)
(6)
 (7)
(7), 百拇医药
现要制成缓释制剂,因药物的消除速率常数和分布容积不变,仅吸收速率降低。设定给药间隔为常释制剂的N倍,吸收速率常数为常释制剂的1/m,则得到缓释制剂的波动系数FI:
 (8)
(8)缓释制剂与常释制剂的波动系数比R:
 (9)
(9)如常释制剂按消除半衰期间隔给药,则得到
 (10)
(10)由(10)式可见其波动系数的比值大小取决缓释制剂的时间间隔与常数制剂间隔之比N、常释制剂吸收常数与消除常数之比b和常释制剂与缓释制剂吸收常数之比m大小。图3给出了在缓释制剂波动系数不大于常释制剂时N,b和m三者间的关系。
, http://www.100md.com
图3中的线表示缓释制剂的波动系数小于或等于常释制剂时,m最小值。由图3可见,对特定的药物来说,b为定值,此时的R大小取决于N和m。给药间隔加大,N大,则对制剂的要求加大。如b=5时,N=2,3,4时m值分别为2.75,3.89和5.32。b=10时,m值分别为4.39,7.15和8.66。例如,已知某药物半衰期为8小时,Vd=101,生物利用度为100%。消除速率k=0.0866h-1,ka=0.866h-1,常释制剂按半衰期给药,每日3次,每次100mg。峰浓度为16.7μg.ml-1,谷浓度为11.1μg.ml-1,坪浓度为14.4μg.ml-1,波动系数为0.389。现欲制成24h缓释制剂,即N=3,查图3得m=7.15。即将该药物的吸收速度降至常释制剂的1/7.15,方可使波动系数不大于常释制剂。在总剂量不变的情况下,算得的峰浓度为20.7μg.ml-1,谷浓度为15.1μg.ml-1,波动系数为0.389。波动系数与与常释制剂的比为1。需要注意的是若按这种吸收速率,即ka=0.1211h-1,吸收半衰期为5.7h,经过1个吸收半衰期后,药物可能已通过最佳吸收部位(吸收窗),生物利用度往往难达到要求。在实际工作中,因考虑生物利用度等要求,m值可能要小一些,必然导致缓释制剂的波动系数会比常释制剂大。
, 百拇医药
在总药量不变的情况下,我们也可获得谷浓度和峰浓度的比值关系
 (11)
(11)图4给出了缓释制剂谷浓度不小于常释制剂时,N,m和b三者之间的关系曲线。
 25101.gif (2263 bytes)" width="250" height="176">
25101.gif (2263 bytes)" width="250" height="176">图3缓释制剂波动系数不大于常释制剂时,给药次数N、药物吸收常数与消除速率常数比和缓释制剂与常释制剂吸收常数比关系
 25102.gif (2318 bytes)" width="270" height="184">
25102.gif (2318 bytes)" width="270" height="184">图4缓释制剂谷浓度不小于常释制剂时N,b和m三者关系比较
, 百拇医药
可见图3和图4在保证缓释制剂谷浓度不低于常释情况下的m值比波系数的要求小。如b=10,N=3时,波动系数比较中的m值为7.15,而谷浓度比较中的m=6.15。即保证谷浓度不降低的要求较低,当然是以有较大波动系数为代价的。如前例按m=6.15,算得峰浓度为19.5,谷浓度为11.14,波动系数为0.582,高于常释制剂的0.389。
同理得到缓释制剂与常释制剂稳态峰浓度比R为:
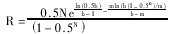 (12)
(12)由(12)可见,要使R值小于或等于1是困难的,除非生物利用度降低,当然这样制剂其吸收程度生物不等效,不符合要求。也就是说要求在不改变总剂量的情况下,要求缓释制剂的稳态峰浓度低于常释制剂是不可能的。
因此,将常释制剂制成缓释制剂,给药次数减少,即N增加,要求降低药物的释放和吸收速度即增大m值,但由于受生物利用度及药物胃肠停留时间的限制,m不可能无限加大,往往低于理论值,在这种情况下,缓释制剂的波动系数大于常释制剂是客观存在。要求缓释制剂同时满足峰浓度低于常释制剂、谷浓度不低于常释制剂,波动系数不大于常释制剂[3,4]是不可能。因此,作者认为对于缓释制剂的评价应作面分析,根据药物的有效浓度、安全范围作具体分析,不能一概而论。
, http://www.100md.com
刘晓东,男,41岁,博士,教授,主要从事药物动力学研究。
参考文献
1,黄圣凯,韩可勤.生物等效性评价的几种统计方法.中国临床药理学杂志,1993;9(1):43
2,桂常青,孙瑞元,李金恒.生物等效性试验实施注意事项及计算简法.国内外药物代谢与药代动力学研究新进展研讨会资料汇编,1998:35
3,刘昌孝,孙瑞元,编著药物评价实验设计与统计学基础.北京:军事医学科学出版社,1999:107
4,刘晓东.缓释制剂生物利用度研究技术规范修订参考.中国临床药理学与治疗学杂志,1997;2(3):217
2000-06-12收稿,2000-06-28修回, 百拇医药