17β-雌二醇对大鼠破骨细胞内钙浓度影响的研究
作者:王真 裴著果 刘洁
单位:王真(110003 沈阳 中国医科大学附属二院);裴著果(110003 沈阳 中国医科大学附属二院);刘洁(110003 沈阳 中国医科大学附属二院)
关键词:17β雌二醇;破骨细胞 钙浓度;伪足;Fura-2/AM
中国骨质疏松杂志000306 [摘要] 目的 探讨雌激素调节破骨细胞活性机制。方法 以Chamber方法加以改良,常规体外培养新生Wister大鼠破骨细胞(Osteoclast,OC)。镜下观察细胞形态,测定不同浓度17β-雌二醇(17βE2)在有钙与无钙溶液中对破骨细胞钙浓度(OC[Ca2+]i)的影响。结果 30 min后OC贴壁生长,胞浆伸展。2 h后细胞形态为多形性,有片状或丝状伪足,常规生存52 h。17βE2使细胞变小。除去17βE2,OC形态恢复原状。不同浓度17βE2在不同时间,有钙与无钙溶液中均可诱发OC[Ca2+]i升高。结论 OC是17βE2的靶细胞。[Ca2+]i升高是细胞外Ca2+流动与细胞内存钙释放的综合作用。OC[Ca2+]i升高后,细胞变小,伪足回缩,骨吸收活性被抑制。17βΕ2可能是通过OC[Ca2+]i途径抑制骨吸收。
, http://www.100md.com
Effects of estrogen on intracellular calcium concentration in isolated rat osteoclasts
Wang Zhen,Pei Zhuguo,Liu Jie
(The 2nd Clinical Hospital,China Medical University,Shenyang 110003,China)
[Abstract] To further elucidate whether estrogen mediates osteoclastic activity by the way of intracellular calcium concentration([Ca2+]i),isolated newborn Wistar rat osteoclasts were involved in our study.[Ca2+]i was measured by spectrofluorometer after osteoclasts were loaded by acetoxymethylester of fura-2(Fura-2/AM).We demonstrated that 17β-estradiol(E2) acted on [Ca2+]i in osteoclasts.17βE2 induced changes of osteoclastic shapes,and stimulated the elevation of [Ca2+]i buffered in calcium and calcium-free medium.Increase of [Ca2+]i induced by 17βE2 resulted from Ca2+ influx from extracelluar milieu and Ca2+ release from internal stores.The reasons might be as follows:Ca2+-itself,Ca2+receptors and G protein or protein kinase may be activated after 17βE2 has combined with its membrane receptors.In addition,second messenger may be involved.Gelsolin,a calcium-dependent actin regulating protein present in osteoclst podosomes,after completing calcium,is capable of fragmenting pre-existing microfilaments and nucleating new ones,thereby contributing to the rearrangement of the microfilament network of the cells.The podosomes start to shrink.Then osteoclasts do not attach the bone surface and their activity is suppressed.
, http://www.100md.com
[Key words] 17β-Estradiol; Osteoclasts; Calcium concentration; Podosomes; Fura-2/AM
细胞内钙浓度([Ca2+]i)是快速调节OC活性的重要因素之一[1],但雌激素是否通过[Ca2+]i快速调节骨吸收,是我们尚未了解的,为了探讨这个问题我们于1998年6月至1999年6月,利用体外培养的OC,观察17βE2作用于OC后[Ca2+]i的变化,研究绝经后妇女骨质疏松的发病机制,为应用雌激素治疗骨质疏松症提供新的理论根据。
1 材料和方法
1.1 仪器
F-3000荧光分度计,Olympus相差显微镜,高速低温台式离心机,抽滤泵,超净台,CO2孵箱(HITECIT-41型)。
, http://www.100md.com
1.2 试剂
17βE2和牛血清白蛋白(BSA)购于美国Sigma公司,Fura-2/AM购于医科院药物所,RPMI 1640购于美国Gigoco公司。胎牛血清(FCS)为杭州生物制品厂出品,胰酶进口分装。其他均为分析纯试剂,由中国医科大学药品库提供,其中:溶液A(mmol/L):130 NaCl,5 KCl,1.25 CaCl2,0.8 MgCl2,5 Glucose和10 Hepes(pH7.4);溶液B(mmol/L):130 NaCl,4 KCl,0.8 MgCl2,5 Glucose和10 Hepes 1.25 EGTA(无钙溶液)(pH7.4,细胞外液[Ca2+]i<10 nmol/L)。
台式液(mmol/L):140 NaCl,3 KCl,1 MgSO4,10 Hepes和10 Glucose(pH7.4)。
, 百拇医药
1.3 细胞培养
应用改良的Chamber方法[2]。拉颈处死新生1~4天Wistar大鼠(由中国医科大学实验动物部提供)。分离四肢长骨,清除附着于表面的软组织与骨骺,骨干部分用生理盐水清洗2次后放入玻璃培养皿(含1 640,25 mmol/L Hepes,10%Fcs,青霉素100μ/ml,链霉素100μg/ml,pH7.2)内,将长骨剪碎,再用圆头吸管反复吹打骨质碎片2 min,静置30 s,将200μl细胞悬液置入50 ml克氏瓶中(含3ml 10%Fcs1640),放入CO2培养箱,在5%CO2、37℃,相对湿度30%~40%的条件下培养30 min,倒出培养液,用不含Fcs的1640冲洗掉未贴壁细胞,再加入10%Fcs1640液3 ml,继续培养,条件同前,24 h换液。
1.4 细胞形态学观察
培养4 h后,将生理浓度(10-7mol/L)17βE2加入培养瓶内,连续观察20 min,然后倒掉培养液,加入10%Fcs1640液继续培养。10 min过后,继续观察细胞形态。
, http://www.100md.com
1.5 [Ca2+]i测定
将培养的OC随机分成对照组和实验组,加入溶液A,实验组加入17βE2,浓度分别10-5~10-8mol/L,对照组加等量无水乙醇,作用时间为2、3、4和8 min。作用后,按常规方法制备细胞悬液,台式离心机1500转,离心8 min。计数细胞。台式液清洗2次。将细胞沉淀加入2%BSA的台式液1 ml,加入20μlFura-2/AM,37℃水浴避光温育30 min,然后将细胞离心,台式液再洗2次。沉淀中加入无BSA的台式液1 ml,F-3000荧光分度计于激发波长340 nm和380 nm,发射波长505 nm条件下测定基础值F。加入15μl Triton(20%)测定Fmax,加入30μl EGTA(1 mol/L)测定Fmin,根据Grzegorz方法[3]计算[Ca2+]i。
, http://www.100md.com
另外,在无钙溶液中,加入10-7mol/L 17 βE2分别作用2 min和3 min后测定[Ca2+]i,操作及计算同上。各组实验重复3~4次。
1.6 统计分析
结果以均值±标准差表示(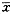 ±s),组间比较采用t检验。
±s),组间比较采用t检验。
2 结果
2.1 OC形态及伪足运动观察
30 min后OC贴壁生长,胞浆开始伸展。2 h后细胞形态清晰,为多形性,有片状或丝状伪足。伪足运动活跃,常规培养生存52 h,比文献报道多4 h。52 h后,细胞死亡,核碎裂。
, http://www.100md.com
2.2 17βE2对OC形态的影响
加17βE2(10-7mol/L)后20 min内观察。3~4 min后,OC形态开始改变,伪足逐渐回缩,细胞慢慢变小。除去17βE2后继续培养,OC形态恢复原状。结果表明17βE2对OC的作用是功能抑制。恢复原状后的OC仍具有骨吸收功能,可在骨片上形成吸收陷窝[4]。
2.3 17βE2在有Ca2+溶液中对OC[Ca2+]i的影响
在本实验体系中,大鼠OC[Ca2+]i基本值为35.09±4.55(n=5)。17βE2对OC[Ca2+]i的作用具有时间依赖性。2 minOC[Ca2+]i已明显升高(见表1),3 min略有下降(见表1),4 min迅速下降(见表2),8 min已基本下降到基线(见表2)。
, 百拇医药
表1 2 min及3 min17βE2对OC[Ca2i]i的影响 17βE2(nmol/L)
n
[Ca2+]i nmol/L
T(min)
对照组
实验组
10-5
4
2
34.77±3.66
, http://www.100md.com
105.77±3.57*
10-6
4
2
33.29±4.13
106.52±5.20*
10-7
4
2
30.56±4.29
96.57±3.77*
, 百拇医药
10-8
4
2
33.39±2.61
36.43±6.18
10-5
4
3
37.28±3.99
102.73±2.66*
10-6
4
, 百拇医药
3
35.75±1.78
101.17±5.71*
10-7
4
3
30.61±5.06
91.99±3.40*
10-8
4
3
29.26±1.91
, 百拇医药
34.49±4.67
注:细胞外液[Ca2+]i=1.25 mmol/L,实验组与对照组相比*P<0.01
从表1、2可以看出,17βE2对OC[Ca2+]i作用具有剂量依赖性。生理浓度(10-7mol/L)17βE2可使OC[Ca2+]i明显升高(P<0.01),浓度为10-6mol/L时,OC[Ca2+]i升高幅度略有增大,而再增大浓度(10-5mol/L)OC[Ca2+]i无明显升高趋势,基本同于10-6mol/L。低于生理浓度10-8M的17βE2使[Ca2+]i略有升高,但无显著性差异(P>0.05)。
, 百拇医药
2.4 17βE2在无Ca2+溶液中对OC[Ca2+]i的影响
10-7mol/L 17βE2作用于无钙培养体系中(溶液B),在2 min和3 min时,[Ca2+]i仍有升高,但升高幅度减小(表3)。
结果表明,17βE2作用OC[Ca2+]i升高是细胞外液Ca2+流动和细胞内存Ca2+释放的综合作用。表2 4 min及8 min17βE2对OC[Ca2i]i的影响 17βE2(nmol/L)
n
, 百拇医药
[Ca2+]i nmol/L
T(min)
对照组
实验组
10-5
4
4
32.49±2.20
84.34±2.85*
10-6
4
, 百拇医药
4
29.35±3.74
83.91±4.39*
10-7
4
4
33.77±1.95
72.93±3.37*
10-8
4
4
35.79±4.18
, http://www.100md.com
34.49±4.67
10-6
4
8
34.26±3.50
33.18±3.63
10-7
4
8
35.72±3.30
34.29±3.88
注:细胞外液[Ca2+]i=1.25 mmol/L实验组与对照组相比,*P<0.01表3 2 min及3 min17βE2在无钙溶液中
, 百拇医药
对OC[Ca2+]i的作用 17βE2(nmol/L)
n
[Ca2+]i nmol/L
T(min)
对照组
实验组
10-7
3
2
32.39±4.33
76.88±2.92*
, 百拇医药
10-7
3
3
30.41±5.30
73.37±4.70*
注:溶液中含1.25 mmol/LEGTA,细胞外液Ca2+浓度<10nmol/L。实验组与对照组相比,*P<0.01
3 讨论
本实验表明,17βE2可直接作用于OC,改变OC的形状,说明OC是17βE2的靶细胞。17βE2可引发OC[Ca2+]i升高。这可能是:(1)细胞外Ca2+流动与细胞内存Ca2+释放的综合作用。因为在细胞外液Ca2+浓度为1.25 mmol/L时,17βE2可诱发[Ca2+]i升高(见表1,2),而在无Ca2+溶液中,仍可诱发[Ca2+]i升高(见表3)。(2)Na+/Ca2+交换。电压依从性Ca2+转移也可能参与Ca2+流动。(3)P2X受体也可能参与钙流动。P2X是一种非选择性的配体调节通道,在ATP诱发的Ca2+流动中起重要作用。(4)第二信号三磷肌醇、cAMP以及蛋白激酶A、C都可能参与Ca2+流动[5]。cAMP是降钙素抑制骨吸收的第二信号,能诱导OC回缩[4]。而cAMP又可激活蛋白激酶A、C,以协同作用共同调解OC活性。至于细胞内存Ca2+的释放,除了17βE2通过受体触发Ca2+释放外,也可能与钙离子受体(CaR)激活有关。CaR是OC膜上的一种复合蛋白,被激活可引起Ca2+释放[6]。另外,双向机制即Ca2+流动诱发Ca2+释放和Ca2+释放促进Ca2+流动,也可能是[Ca2+]i升高的主要原因之一。
, http://www.100md.com
在本实验中,17βE2对OC作用表现出剂量依赖性。这可能与膜受体水平有关,二者的结合具有饱和性。因为17βE2荧光轭合物与膜的结合具有饱和性,另外,OC膜受体水平也可能直接控制17βE2对OC的作用[7]。生理浓度下(10-8mol/L)17βE2虽对OC[Ca2+]i略有作用,但无显著性差异(P>0.05),这说明小于生理浓度的17βE2对OC的活性无调节作用,从而解释了为什么绝经后妇女易发生骨质疏松症的原因。
本实验表明,17βE2作用OC[Ca2+]i升高后,细胞形态便发生变化,即伪足回缩,细胞变小。这说明[Ca2+]i直接影响OC形态,从而改变骨吸收活性。具有吸收活性的OC,必须是附着于骨基质表面并且形成细胞极性,而这个过程与细胞的伪足密切相关。伪足是Ca2+调节性结构,而伪足上对Ca2+敏感的结构是凝胶溶素——一种Ca2+依赖性肌动蛋白[8]。凝胶溶素与Ca2+结合后,微丝断裂,中心重组,形成新的排列组合,改变细胞形态,从而抑制OC的骨吸收活性[9]。因此,我们认为,同其他抗骨吸收因子一样,17βE2作用OC[Ca2+]i升高,引起伪足回缩,减少骨吸收。
, 百拇医药
总之17βE2快速引发OC[Ca2+]i升高是细胞外液Ca2+流动和细胞内存Ca2+释放综合作用的结果。而17βE2抗骨吸收作用则是通过影响细胞形态完成的,即17βE2作用使OC[Ca2+]i升高,形成对伪足的抑制,使OC不能附着于骨,从而减弱OC骨吸收活性。 参考文献
1,Miyamchi A,Hruska KA,Greenfield,et al.Osteoclast cytosolic calcium regulated by voltage-gated calcium channels and extracellular calcium,control podosome assembly and bone resorption.J Cell Biol,1990,111:2543-2552.
, http://www.100md.com
2,Chamber TJ,Magnas GJ.Calcitonin alters behaviors of isolated osteoclasts.Pathology,1982,136:27-29.
3,Gregorz G,Martin P,Roger YT,et al.A new generation of Ca2+ indicators with greatly improved fluorescence properties.Am Soc Biol Chem,1985,6(26):3440-3450.
4,Warshafsky B,Aubin JE,Heersche JNM,et al.Cytoskeleton rearrangements during calcitonin induced changes in osteocalst mobility in vitro.Bone,1985,6:179-185.
, 百拇医药
5,Bizzarri C,Shiou A,Teitelbaum SL,et al.Interleukin-4 inhibits bone resorption and acutely increases cytosolic Ca2+ in murine osteoclasts.J Biol Chem,1994,19(269):13817-13824.
6,Shanker VS,Hvang CLH,Aacbanjo O,et al.Effect of membrane potential on surface Ca2+ receptor activation in rat osteoclasts.J Cell Physiol,1995,162:1-8.
7,Pederson L,Kremer M,Figed NT.Evidence of a correlation of estrogen receptor level and avian osteoclast estrogen responsiveness.J Bone Miner Res,1997,12(5):742-52.
, http://www.100md.com
8,Marchisio PC,Cirillo D.Rous sarcoma virus-transformed fibroblasts and cells of monocytic origin display a peculiar clot-like organization of cytoskeletal protein involved in microfilament rane interaction.Exp Cell Res,1987,169:202-24.
9,Janmey PA,Matsudaira PT.Functional comparison of villin and gelsolin effect of [Ca2+]i,KCL and poly-phosphoinositides.J Biol Chem,1988,263:16738-16743., 百拇医药
单位:王真(110003 沈阳 中国医科大学附属二院);裴著果(110003 沈阳 中国医科大学附属二院);刘洁(110003 沈阳 中国医科大学附属二院)
关键词:17β雌二醇;破骨细胞 钙浓度;伪足;Fura-2/AM
中国骨质疏松杂志000306 [摘要] 目的 探讨雌激素调节破骨细胞活性机制。方法 以Chamber方法加以改良,常规体外培养新生Wister大鼠破骨细胞(Osteoclast,OC)。镜下观察细胞形态,测定不同浓度17β-雌二醇(17βE2)在有钙与无钙溶液中对破骨细胞钙浓度(OC[Ca2+]i)的影响。结果 30 min后OC贴壁生长,胞浆伸展。2 h后细胞形态为多形性,有片状或丝状伪足,常规生存52 h。17βE2使细胞变小。除去17βE2,OC形态恢复原状。不同浓度17βE2在不同时间,有钙与无钙溶液中均可诱发OC[Ca2+]i升高。结论 OC是17βE2的靶细胞。[Ca2+]i升高是细胞外Ca2+流动与细胞内存钙释放的综合作用。OC[Ca2+]i升高后,细胞变小,伪足回缩,骨吸收活性被抑制。17βΕ2可能是通过OC[Ca2+]i途径抑制骨吸收。
, http://www.100md.com
Effects of estrogen on intracellular calcium concentration in isolated rat osteoclasts
Wang Zhen,Pei Zhuguo,Liu Jie
(The 2nd Clinical Hospital,China Medical University,Shenyang 110003,China)
[Abstract] To further elucidate whether estrogen mediates osteoclastic activity by the way of intracellular calcium concentration([Ca2+]i),isolated newborn Wistar rat osteoclasts were involved in our study.[Ca2+]i was measured by spectrofluorometer after osteoclasts were loaded by acetoxymethylester of fura-2(Fura-2/AM).We demonstrated that 17β-estradiol(E2) acted on [Ca2+]i in osteoclasts.17βE2 induced changes of osteoclastic shapes,and stimulated the elevation of [Ca2+]i buffered in calcium and calcium-free medium.Increase of [Ca2+]i induced by 17βE2 resulted from Ca2+ influx from extracelluar milieu and Ca2+ release from internal stores.The reasons might be as follows:Ca2+-itself,Ca2+receptors and G protein or protein kinase may be activated after 17βE2 has combined with its membrane receptors.In addition,second messenger may be involved.Gelsolin,a calcium-dependent actin regulating protein present in osteoclst podosomes,after completing calcium,is capable of fragmenting pre-existing microfilaments and nucleating new ones,thereby contributing to the rearrangement of the microfilament network of the cells.The podosomes start to shrink.Then osteoclasts do not attach the bone surface and their activity is suppressed.
, http://www.100md.com
[Key words] 17β-Estradiol; Osteoclasts; Calcium concentration; Podosomes; Fura-2/AM
细胞内钙浓度([Ca2+]i)是快速调节OC活性的重要因素之一[1],但雌激素是否通过[Ca2+]i快速调节骨吸收,是我们尚未了解的,为了探讨这个问题我们于1998年6月至1999年6月,利用体外培养的OC,观察17βE2作用于OC后[Ca2+]i的变化,研究绝经后妇女骨质疏松的发病机制,为应用雌激素治疗骨质疏松症提供新的理论根据。
1 材料和方法
1.1 仪器
F-3000荧光分度计,Olympus相差显微镜,高速低温台式离心机,抽滤泵,超净台,CO2孵箱(HITECIT-41型)。
, http://www.100md.com
1.2 试剂
17βE2和牛血清白蛋白(BSA)购于美国Sigma公司,Fura-2/AM购于医科院药物所,RPMI 1640购于美国Gigoco公司。胎牛血清(FCS)为杭州生物制品厂出品,胰酶进口分装。其他均为分析纯试剂,由中国医科大学药品库提供,其中:溶液A(mmol/L):130 NaCl,5 KCl,1.25 CaCl2,0.8 MgCl2,5 Glucose和10 Hepes(pH7.4);溶液B(mmol/L):130 NaCl,4 KCl,0.8 MgCl2,5 Glucose和10 Hepes 1.25 EGTA(无钙溶液)(pH7.4,细胞外液[Ca2+]i<10 nmol/L)。
台式液(mmol/L):140 NaCl,3 KCl,1 MgSO4,10 Hepes和10 Glucose(pH7.4)。
, 百拇医药
1.3 细胞培养
应用改良的Chamber方法[2]。拉颈处死新生1~4天Wistar大鼠(由中国医科大学实验动物部提供)。分离四肢长骨,清除附着于表面的软组织与骨骺,骨干部分用生理盐水清洗2次后放入玻璃培养皿(含1 640,25 mmol/L Hepes,10%Fcs,青霉素100μ/ml,链霉素100μg/ml,pH7.2)内,将长骨剪碎,再用圆头吸管反复吹打骨质碎片2 min,静置30 s,将200μl细胞悬液置入50 ml克氏瓶中(含3ml 10%Fcs1640),放入CO2培养箱,在5%CO2、37℃,相对湿度30%~40%的条件下培养30 min,倒出培养液,用不含Fcs的1640冲洗掉未贴壁细胞,再加入10%Fcs1640液3 ml,继续培养,条件同前,24 h换液。
1.4 细胞形态学观察
培养4 h后,将生理浓度(10-7mol/L)17βE2加入培养瓶内,连续观察20 min,然后倒掉培养液,加入10%Fcs1640液继续培养。10 min过后,继续观察细胞形态。
, http://www.100md.com
1.5 [Ca2+]i测定
将培养的OC随机分成对照组和实验组,加入溶液A,实验组加入17βE2,浓度分别10-5~10-8mol/L,对照组加等量无水乙醇,作用时间为2、3、4和8 min。作用后,按常规方法制备细胞悬液,台式离心机1500转,离心8 min。计数细胞。台式液清洗2次。将细胞沉淀加入2%BSA的台式液1 ml,加入20μlFura-2/AM,37℃水浴避光温育30 min,然后将细胞离心,台式液再洗2次。沉淀中加入无BSA的台式液1 ml,F-3000荧光分度计于激发波长340 nm和380 nm,发射波长505 nm条件下测定基础值F。加入15μl Triton(20%)测定Fmax,加入30μl EGTA(1 mol/L)测定Fmin,根据Grzegorz方法[3]计算[Ca2+]i。

, http://www.100md.com
另外,在无钙溶液中,加入10-7mol/L 17 βE2分别作用2 min和3 min后测定[Ca2+]i,操作及计算同上。各组实验重复3~4次。
1.6 统计分析
结果以均值±标准差表示(
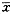 ±s),组间比较采用t检验。
±s),组间比较采用t检验。2 结果
2.1 OC形态及伪足运动观察
30 min后OC贴壁生长,胞浆开始伸展。2 h后细胞形态清晰,为多形性,有片状或丝状伪足。伪足运动活跃,常规培养生存52 h,比文献报道多4 h。52 h后,细胞死亡,核碎裂。
, http://www.100md.com
2.2 17βE2对OC形态的影响
加17βE2(10-7mol/L)后20 min内观察。3~4 min后,OC形态开始改变,伪足逐渐回缩,细胞慢慢变小。除去17βE2后继续培养,OC形态恢复原状。结果表明17βE2对OC的作用是功能抑制。恢复原状后的OC仍具有骨吸收功能,可在骨片上形成吸收陷窝[4]。
2.3 17βE2在有Ca2+溶液中对OC[Ca2+]i的影响
在本实验体系中,大鼠OC[Ca2+]i基本值为35.09±4.55(n=5)。17βE2对OC[Ca2+]i的作用具有时间依赖性。2 minOC[Ca2+]i已明显升高(见表1),3 min略有下降(见表1),4 min迅速下降(见表2),8 min已基本下降到基线(见表2)。
, 百拇医药
表1 2 min及3 min17βE2对OC[Ca2i]i的影响 17βE2(nmol/L)
n
[Ca2+]i nmol/L
T(min)
对照组
实验组
10-5
4
2
34.77±3.66
, http://www.100md.com
105.77±3.57*
10-6
4
2
33.29±4.13
106.52±5.20*
10-7
4
2
30.56±4.29
96.57±3.77*
, 百拇医药
10-8
4
2
33.39±2.61
36.43±6.18
10-5
4
3
37.28±3.99
102.73±2.66*
10-6
4
, 百拇医药
3
35.75±1.78
101.17±5.71*
10-7
4
3
30.61±5.06
91.99±3.40*
10-8
4
3
29.26±1.91
, 百拇医药
34.49±4.67
注:细胞外液[Ca2+]i=1.25 mmol/L,实验组与对照组相比*P<0.01
从表1、2可以看出,17βE2对OC[Ca2+]i作用具有剂量依赖性。生理浓度(10-7mol/L)17βE2可使OC[Ca2+]i明显升高(P<0.01),浓度为10-6mol/L时,OC[Ca2+]i升高幅度略有增大,而再增大浓度(10-5mol/L)OC[Ca2+]i无明显升高趋势,基本同于10-6mol/L。低于生理浓度10-8M的17βE2使[Ca2+]i略有升高,但无显著性差异(P>0.05)。
, 百拇医药
2.4 17βE2在无Ca2+溶液中对OC[Ca2+]i的影响
10-7mol/L 17βE2作用于无钙培养体系中(溶液B),在2 min和3 min时,[Ca2+]i仍有升高,但升高幅度减小(表3)。
结果表明,17βE2作用OC[Ca2+]i升高是细胞外液Ca2+流动和细胞内存Ca2+释放的综合作用。表2 4 min及8 min17βE2对OC[Ca2i]i的影响 17βE2(nmol/L)
n
, 百拇医药
[Ca2+]i nmol/L
T(min)
对照组
实验组
10-5
4
4
32.49±2.20
84.34±2.85*
10-6
4
, 百拇医药
4
29.35±3.74
83.91±4.39*
10-7
4
4
33.77±1.95
72.93±3.37*
10-8
4
4
35.79±4.18
, http://www.100md.com
34.49±4.67
10-6
4
8
34.26±3.50
33.18±3.63
10-7
4
8
35.72±3.30
34.29±3.88
注:细胞外液[Ca2+]i=1.25 mmol/L实验组与对照组相比,*P<0.01表3 2 min及3 min17βE2在无钙溶液中
, 百拇医药
对OC[Ca2+]i的作用 17βE2(nmol/L)
n
[Ca2+]i nmol/L
T(min)
对照组
实验组
10-7
3
2
32.39±4.33
76.88±2.92*
, 百拇医药
10-7
3
3
30.41±5.30
73.37±4.70*
注:溶液中含1.25 mmol/LEGTA,细胞外液Ca2+浓度<10nmol/L。实验组与对照组相比,*P<0.01
3 讨论
本实验表明,17βE2可直接作用于OC,改变OC的形状,说明OC是17βE2的靶细胞。17βE2可引发OC[Ca2+]i升高。这可能是:(1)细胞外Ca2+流动与细胞内存Ca2+释放的综合作用。因为在细胞外液Ca2+浓度为1.25 mmol/L时,17βE2可诱发[Ca2+]i升高(见表1,2),而在无Ca2+溶液中,仍可诱发[Ca2+]i升高(见表3)。(2)Na+/Ca2+交换。电压依从性Ca2+转移也可能参与Ca2+流动。(3)P2X受体也可能参与钙流动。P2X是一种非选择性的配体调节通道,在ATP诱发的Ca2+流动中起重要作用。(4)第二信号三磷肌醇、cAMP以及蛋白激酶A、C都可能参与Ca2+流动[5]。cAMP是降钙素抑制骨吸收的第二信号,能诱导OC回缩[4]。而cAMP又可激活蛋白激酶A、C,以协同作用共同调解OC活性。至于细胞内存Ca2+的释放,除了17βE2通过受体触发Ca2+释放外,也可能与钙离子受体(CaR)激活有关。CaR是OC膜上的一种复合蛋白,被激活可引起Ca2+释放[6]。另外,双向机制即Ca2+流动诱发Ca2+释放和Ca2+释放促进Ca2+流动,也可能是[Ca2+]i升高的主要原因之一。
, http://www.100md.com
在本实验中,17βE2对OC作用表现出剂量依赖性。这可能与膜受体水平有关,二者的结合具有饱和性。因为17βE2荧光轭合物与膜的结合具有饱和性,另外,OC膜受体水平也可能直接控制17βE2对OC的作用[7]。生理浓度下(10-8mol/L)17βE2虽对OC[Ca2+]i略有作用,但无显著性差异(P>0.05),这说明小于生理浓度的17βE2对OC的活性无调节作用,从而解释了为什么绝经后妇女易发生骨质疏松症的原因。
本实验表明,17βE2作用OC[Ca2+]i升高后,细胞形态便发生变化,即伪足回缩,细胞变小。这说明[Ca2+]i直接影响OC形态,从而改变骨吸收活性。具有吸收活性的OC,必须是附着于骨基质表面并且形成细胞极性,而这个过程与细胞的伪足密切相关。伪足是Ca2+调节性结构,而伪足上对Ca2+敏感的结构是凝胶溶素——一种Ca2+依赖性肌动蛋白[8]。凝胶溶素与Ca2+结合后,微丝断裂,中心重组,形成新的排列组合,改变细胞形态,从而抑制OC的骨吸收活性[9]。因此,我们认为,同其他抗骨吸收因子一样,17βE2作用OC[Ca2+]i升高,引起伪足回缩,减少骨吸收。
, 百拇医药
总之17βE2快速引发OC[Ca2+]i升高是细胞外液Ca2+流动和细胞内存Ca2+释放综合作用的结果。而17βE2抗骨吸收作用则是通过影响细胞形态完成的,即17βE2作用使OC[Ca2+]i升高,形成对伪足的抑制,使OC不能附着于骨,从而减弱OC骨吸收活性。 参考文献
1,Miyamchi A,Hruska KA,Greenfield,et al.Osteoclast cytosolic calcium regulated by voltage-gated calcium channels and extracellular calcium,control podosome assembly and bone resorption.J Cell Biol,1990,111:2543-2552.
, http://www.100md.com
2,Chamber TJ,Magnas GJ.Calcitonin alters behaviors of isolated osteoclasts.Pathology,1982,136:27-29.
3,Gregorz G,Martin P,Roger YT,et al.A new generation of Ca2+ indicators with greatly improved fluorescence properties.Am Soc Biol Chem,1985,6(26):3440-3450.
4,Warshafsky B,Aubin JE,Heersche JNM,et al.Cytoskeleton rearrangements during calcitonin induced changes in osteocalst mobility in vitro.Bone,1985,6:179-185.
, 百拇医药
5,Bizzarri C,Shiou A,Teitelbaum SL,et al.Interleukin-4 inhibits bone resorption and acutely increases cytosolic Ca2+ in murine osteoclasts.J Biol Chem,1994,19(269):13817-13824.
6,Shanker VS,Hvang CLH,Aacbanjo O,et al.Effect of membrane potential on surface Ca2+ receptor activation in rat osteoclasts.J Cell Physiol,1995,162:1-8.
7,Pederson L,Kremer M,Figed NT.Evidence of a correlation of estrogen receptor level and avian osteoclast estrogen responsiveness.J Bone Miner Res,1997,12(5):742-52.
, http://www.100md.com
8,Marchisio PC,Cirillo D.Rous sarcoma virus-transformed fibroblasts and cells of monocytic origin display a peculiar clot-like organization of cytoskeletal protein involved in microfilament rane interaction.Exp Cell Res,1987,169:202-24.
9,Janmey PA,Matsudaira PT.Functional comparison of villin and gelsolin effect of [Ca2+]i,KCL and poly-phosphoinositides.J Biol Chem,1988,263:16738-16743., 百拇医药