肝素及小肝素分子对培养平滑肌细胞的双重调节作用
作者:丛祥凤 刘学文 张英珊
单位:中国医学科学院心血管病研究所 协和医科大学阜外心血管病医院,北京市 100037
关键词:肝素,;小分子;肌,;平滑;抑制作用;增殖作用
中国动脉硬化杂志000313[摘 要] 为研究肝素及小肝素分子对培养的平滑肌细胞生长的作用,以探讨其是否可以作为一种抗血管平滑肌细胞增殖的药物,采用3H-胸腺嘧啶脱氧核苷掺入法观察肝素及小肝素分子对培养的人主动脉平滑肌细胞合成DNA的影响。肝素及小肝素分子的量以糖醛酸表示,以其浓度计算(18、 35和70 mg/L)。结果发现,肝素及小肝素分子对生长良好的平滑肌细胞有抑制作用,不同浓度肝素的抑制率分别为66%、69%和69%,而不同浓度小肝素分子抑制率分别为60%、68%和67%。肝素及小肝素分子对生长不良的平滑肌细胞有促增殖作用,肝素促增殖率为149%、140%和180%,小肝素分子为207%、246%和309%。结果提示肝素及小肝素分子对培养不同状态的平滑肌细胞有抑制或促进增殖的双重调节作用。
, 百拇医药
[中图分类号] R364.3 [文献标识码] A
[文章编号] 1007-3949(2000)-03-0237-04
Dual Effect of Heparin and Low Molecular Weight Heparin on Cultured Smooth Muscle Cells
CONG Xiang-Feng,LIU Xue-Wen,ZHANG Ying-Shan
(Cardiovascular Institute, CAMS and PUMC, Beijing 100037, China)
ABSTRACT Aim The effects of heparin and low molecular weight heparin (LMWH) on the growth of cultured human aortic smooth muscle cells(hASMCs) was studied in this article. Methods The thirth-passage hASMCs were planted onto 24-well plate. After incubated for 24 h in media supplemented with 10%human serum(HS) and 10%fetal calf serum(FCS), media were changed into low concentration serum(0.5% HS, 0.5%FCS)and continued to incubate for 24 h and cultured by DMEM containing 10%HS either old or fresh, 10%FCS and different concentration of heparin or LMWH (heparin and LMWH were presented as hexuronic acid) together with corresponding control groups (without heparin or LMWH) for 24 h, hASMCs growth was estimated both morphologically and by 3 H-TdR incorporation. Results Both heparin and LMWH inhibited the proliferation of well-growth hASMCs, the inhibition rates were 66%, 69%, 69%, and 60%, 68%, 67%, respectively, with no concentration dependent relationship. hASMCs of control (with old HS stored at 4℃ for 2 years) shrank and showed poor-growth pattern while those in groups of different concentrations of LMWH or heparin became well-spread and well-growth pattern. Both heparin and LMWH promoted the proliferation of poor-growth hASMCs, the stimulation rates were 149%, 140%, 180%, and 207%, 246%, 309%, respectively. Conclusions Heparin and LMWH have a dual regulative role (inhibition and promotion) in hASMCs growth. It indicate that they may play an important role in controlling the proliferation of vascular smooth muscle cells and maintaining the integrity of vascular structure.
, 百拇医药
MeSH Heparin, Low Molecular Weight; Muscle, Smooth; Inhibition; Proliferation
血管平滑肌细胞(smooth muscle cell, SMC)增殖是动脉粥样硬化(atherosclerosis, As)斑块形成的主要因素之一。肝素能抑制培养的鼠血管平滑肌细胞增殖[1,2],但在小肝素分子(low molecular weight heparin, LMWH)这方面的研究较少。本研究以肝素分子为参照,观察用肝素酶降解产生的小肝素分子是否保留其抑制平滑肌细胞增殖的特性,为其作为一种抗血管细胞增殖的药物应用于临床进行初步探讨。
1 材料和方法
1.1 试剂与材料
肝素(上海生化制药厂),小肝素分子(中国科学院微生物所提供),胰蛋白酶(Difco),DMEM培养粉(Gibco),胎牛血清(Gibco, FCS), 混合人血清(天津血研所, HS),3 H-胸腺嘧啶脱氧核苷(中科院原子能所),其他均为北京化工厂AR级产品。
, 百拇医药
1.2 含肝素及小肝素分子培养基的制备
将肝素及小肝素分子分别溶于双蒸水,测其糖醛酸含量,以mg/L表示。将一定量的DMEM培养粉分别溶于肝素和小肝素分子的水溶液内,以滤膜过滤,4°C储存备用。
1.3 平滑肌细胞的培养及分组
将冻存的第二代胎儿主动脉平滑肌细胞37℃迅速解冻,加入含血清的培养基离心5 min(1 000 rpm),弃上清,加入含10%HS和10%FCS的DMEM培养基,接种于塑料培养瓶(25 cm2,95%空气+5%CO2, 37℃)培养,隔2~3天换液一次,5~6天汇合。将培养的人主动脉平滑肌细胞以含0.125%胰蛋白酶和0.02%EDTA-Na2的磷酸缓冲液消化传代,接种于24孔培养板。每孔1 mL(1×104细胞),用含10%HS和10%FCS的DMEM培养基培养24 h后,换低浓度血清(0.5%HS和0.5%FCS)培养基继续培养24 h。
, 百拇医药
实验共分六组。①不同浓度肝素(含糖醛酸18、35和70 mg/L), 10%HS (放置2年),10%FCS的DMEM培养基。②不同浓度小肝素分子(含糖醛酸18、35和70 mg/L),其他同①。③不同浓度肝素(同①),10%HS (新制备),10%FCS的DMEM培养基。④不同浓度小肝素(同②),其他同③。⑤对照组a:不含肝素及小肝素分子,其他同①或②。⑥对照组b:不含肝素及小肝素分子,其他同③或④。六组hASMC(每种浓度肝素及小肝素分子均种5孔)继续培养24 h。
1.4 3H-胸腺嘧啶脱氧核苷掺入法
每孔加50 μL(10 mCi/L)氚标记胸腺嘧啶脱氧核苷, 于37°C、95%空气+5%CO2条件下孵育3 h,吸去培养基加预冷的10%三氯乙酸0.5 mL,4℃固定细胞30 min,吸去三氯乙酸,用冷的磷酸缓冲液洗两次。每孔加0.5 mL 1%SDS-0.1 mol/L NaOH,37℃ 孵育14 h。然后将细胞裂解液混匀,每孔取300 μL移至装有8 mL闪烁液的闪烁瓶中混匀放置过夜,液闪仪记数。 实验重复一次得到类似的结果。
, 百拇医药
培养的平滑肌细胞生长的抑制率(%)
=(1-实验组每分钟计数/对照组每分钟计数)×100%
培养的平滑肌细胞生长的促增殖率(%)
=(实验组每分钟计数/对照组每分钟计数-1)×100%
2 结 果
2.1 培养的人主动脉平滑肌细胞的形态
用放置2年混合人血清培养的细胞皱缩,呈现不良的生长状态(图1a, Figure 1a),而同时加入了肝素和小肝素分子培养的细胞伸展,呈现良好的生长状态(图1b和c,Figure 1 and c)。用新制备的混合人血清培养的细胞伸展,呈现良好的生长状态,同时加入了肝素和小肝素分子培养的细胞形态与正常细胞形态相似,但细胞密度有所降低。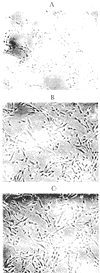
, 百拇医药
图1 培养的人主动脉平滑肌细胞形态
Figure 1 A: hASMCs poor-growth pattern (control a); B: Stimulation of heparin on poor-growth hASMCs cultured in DMEM; C: Stimulation of LMWH on poor-growth hASMCs cultured in DMEM
2.2 肝素及小肝素分子的促增殖作用
从图2(Figure 2)可见,不同浓度的肝素及小肝素分子均能促进生长不良的hASMC DNA合成,其促增殖率分别为149%、140%、180%和207%、246%、309%。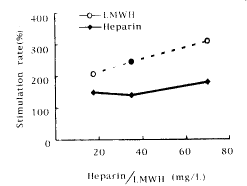
图2 不同浓度的肝素及小肝素分子对生长不良的人主动脉平滑肌细胞生长的影响
, 百拇医药
Figure 2 Stimulation rate(%) of poor-growth hASMCs cultured in DMEM containing heparin or LMWH at different concentrations
2.3 肝素及小肝素分子的抑制作用
从图3(Figure 3)可见,三种浓度的肝素及小肝素分子对生长良好的hASMC DNA合成均有抑制作用,按照使用的量(18~70 mg 己糖醛酸/L),肝素及小肝素分子对培养的hASMC DNA合成的抑制率分别为66%、69%、69%和60%、68%、67%,二者均无浓度依赖性。
3 讨 论
肝素是蛋白聚糖的一种,在临床上一直作为一种重要的抗凝药物。小肝素分子是通过化学方法或特异的酶降解肝素分子所产生的分子量约为4 000~5 000的片断分子。八十年代,国外的研究者一致提出肝素能抑制培养的平滑肌细胞增殖。Pukac等[3]观察到肝素抑制c-fos和c-myc基因的表达。Reilly等[4]提出肝素可阻止细胞进入S期而抑制细胞增殖。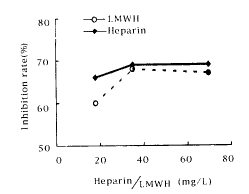
, 百拇医药
图3 不同浓度的肝素及小肝素分子对生长良好的人主动脉平滑肌细胞生长的影响
Figure 3 Inhibition rate(%) of well-growth hASMCs cultured in DMEM containing heparin or LMWH at different concentrations
本研究首次发现肝素和小肝素分子对培养的hASMC具有双重调节作用。对生长良好的hASMC有抑制作用,而对生长不良的hASMC有保护和促增殖作用。这一研究结果提示,机体内某些生物活性物质可能也存在类似的调节机制,这对维持正常生物学功能是非常重要的,为今后的研究提供新的启示。平滑肌细胞是血管壁重要的细胞成分,在正常生理条件下,细胞的增殖和凋亡处于一种动态平衡,肝素或肝素类似物可能参与调节这种平衡。尽管血管壁的平滑肌细胞和内皮细胞不能合成和分泌肝素,但它们能产生硫酸乙酰肝素蛋白聚糖[5],硫酸乙酰肝素蛋白聚糖中的糖链硫酸乙酰肝素在结构上与肝素相类似,生物学功能也有许多共同点,如它们都是肝素结合类生长因子的低亲和受体[6~8],同时它们还能与这些生长因子的高亲和受体结合[9,10]。我们以往的实验结果揭示人主动脉硫酸乙酰肝素蛋白聚糖抑制培养的hASMC增殖[11]。
, 百拇医药
最近的研究发现肝素及硫酸乙酰肝素诱导生长因子的二聚化[12~14],导致受体激酶的二聚化并产生受体的自我磷酸化,将信号向下游传递,硫酸乙酰肝素可能通过破坏细胞表面其他分子对生长因子与受体结合的负调控起作用。这些研究都反映了硫酸乙酰肝素或肝素调节生长因子作用的复杂性。
本研究结果提示,肝素和小肝素分子对生长不同状态的hASMC表现出不同的生物学效应,其机制尚不清楚,可能涉及生长因子及其受体和信号传导网络系统,这些生物学作用可能由细胞的内在因素调节控制。
[作者简介] 丛祥凤,女,1950年出生,副研究员,硕士研究生导师,多年从事蛋白聚糖与动脉粥样硬化发病机制的研究。
参考文献
[1] Guyton JR, Rosenberg RD, Haering WY, et al. Inhibition of rat arterial smooth muscle cell proliferation by heparin I in vivo studies with anticoagulant and non-anticoagulant heparin [J]. Circ Res, 1980, 46: 625-634
, 百拇医药
[2] Hoover RL, Rosenberg RD, Haering W, et al. Inhibition of rat arterial smooth muscle cell proliferation by heparin II in vivo studies [J]. Circ Res, 1980, 47: 578-583
[3] Pukac LA, Castellot JJ, Wright TC, et al. Heparin inhibition c-fos and c-myc mRNA expression in vascular smooth muscle cells [J]. Cell Regul, 1990, 1: 435-443
[4] Reilly CF, Kindy M, Brown KE, et al. Heparin prevents vascular smooth muscle cell progression through the G1 phase of the cell cycle [J]. J Biol Chem, 1989, 264(6): 990-995
, http://www.100md.com
[5] Walker A, Turnbull JE, Gallagher JT. Specific heparan sulfate saccharides mediate the activity of basic fibroblast growth factor [J]. J Biol Chem, 1994, 269: 931-935
[6] Brickman YG, Ford MD, Small DH, et al. Heparan sulfate mediate the binding of basic fibroblast growth factor to a specific receptor on neural precursor cells [J]. J Biol Chem, 1995, 270: 24 941-948
[7] Raab G, Klagsbrun M. Heparin-binding EGF-like growth factor [J]. Biochem Biophys Acta, 1997, 1 333: F179-199
, http://www.100md.com
[8] Markku M, Elenius K, Heini MM, et al. Inhibition of basic fibroblast growth factor-2 induced growth promotion by overexpression of syndecan-1 [J]. J Biol Chem, 1993, 268: 24 215-222
[9] Ornitz DM, Yayon A, Flanagan JG, et al. Heparin is repuired for cell-Free binding of basic fibroblast growth factor to a soluble receptor and for mitogenesis in whole cells [J]. Mol Cell Biol, 1992, 12: 240-247
[10] Liekens S, Leali D, Neyts J, et al. Modulation of fibroblast growth factor-2 receptor binding, signaling,and mitogenic activity by heparin-mimicking polysulfonated compounds [J]. Mol Pharmacol, 1999, 56: 204-213
, 百拇医药
[11] 张春玲, 丛祥凤, 张英珊. 人主动脉壁硫酸乙酰肝素蛋白聚糖对培养的人主动脉平滑肌细胞生长的影响 [J]. 生物化学杂志, 1996, 12: 191-195
[12] Schwall RH, Chang LY, Godowski PJ, et al. Heparin induces dimerization and confers proliferative activity onto the hepatocyte growth factor antagonists NK1 and NK2 [J]. J Cell Biol, 1996, 133: 709-718
[13] Miao HQ, Ornitz DM, Aingorn E, et al. Modulation of fibroblast growth factor-2 receptor binding, dimerization signaling, and angiogenic activity by a synthetic heparin-mimicking [J]. J Clin Invest, 1997, 99: 1 565-575
[14] Kinnunen T, Kaksonen M, Swarinen J, et al. Cortactin-Src kinase signaling pathway is involved in N-Syndecan-dependent neurite out-growth [J]. J Biol Chem, 1998, 273: 10 702-708
(此文2000-01-29收到,2000-07-29修回), http://www.100md.com
单位:中国医学科学院心血管病研究所 协和医科大学阜外心血管病医院,北京市 100037
关键词:肝素,;小分子;肌,;平滑;抑制作用;增殖作用
中国动脉硬化杂志000313[摘 要] 为研究肝素及小肝素分子对培养的平滑肌细胞生长的作用,以探讨其是否可以作为一种抗血管平滑肌细胞增殖的药物,采用3H-胸腺嘧啶脱氧核苷掺入法观察肝素及小肝素分子对培养的人主动脉平滑肌细胞合成DNA的影响。肝素及小肝素分子的量以糖醛酸表示,以其浓度计算(18、 35和70 mg/L)。结果发现,肝素及小肝素分子对生长良好的平滑肌细胞有抑制作用,不同浓度肝素的抑制率分别为66%、69%和69%,而不同浓度小肝素分子抑制率分别为60%、68%和67%。肝素及小肝素分子对生长不良的平滑肌细胞有促增殖作用,肝素促增殖率为149%、140%和180%,小肝素分子为207%、246%和309%。结果提示肝素及小肝素分子对培养不同状态的平滑肌细胞有抑制或促进增殖的双重调节作用。
, 百拇医药
[中图分类号] R364.3 [文献标识码] A
[文章编号] 1007-3949(2000)-03-0237-04
Dual Effect of Heparin and Low Molecular Weight Heparin on Cultured Smooth Muscle Cells
CONG Xiang-Feng,LIU Xue-Wen,ZHANG Ying-Shan
(Cardiovascular Institute, CAMS and PUMC, Beijing 100037, China)
ABSTRACT Aim The effects of heparin and low molecular weight heparin (LMWH) on the growth of cultured human aortic smooth muscle cells(hASMCs) was studied in this article. Methods The thirth-passage hASMCs were planted onto 24-well plate. After incubated for 24 h in media supplemented with 10%human serum(HS) and 10%fetal calf serum(FCS), media were changed into low concentration serum(0.5% HS, 0.5%FCS)and continued to incubate for 24 h and cultured by DMEM containing 10%HS either old or fresh, 10%FCS and different concentration of heparin or LMWH (heparin and LMWH were presented as hexuronic acid) together with corresponding control groups (without heparin or LMWH) for 24 h, hASMCs growth was estimated both morphologically and by 3 H-TdR incorporation. Results Both heparin and LMWH inhibited the proliferation of well-growth hASMCs, the inhibition rates were 66%, 69%, 69%, and 60%, 68%, 67%, respectively, with no concentration dependent relationship. hASMCs of control (with old HS stored at 4℃ for 2 years) shrank and showed poor-growth pattern while those in groups of different concentrations of LMWH or heparin became well-spread and well-growth pattern. Both heparin and LMWH promoted the proliferation of poor-growth hASMCs, the stimulation rates were 149%, 140%, 180%, and 207%, 246%, 309%, respectively. Conclusions Heparin and LMWH have a dual regulative role (inhibition and promotion) in hASMCs growth. It indicate that they may play an important role in controlling the proliferation of vascular smooth muscle cells and maintaining the integrity of vascular structure.
, 百拇医药
MeSH Heparin, Low Molecular Weight; Muscle, Smooth; Inhibition; Proliferation
血管平滑肌细胞(smooth muscle cell, SMC)增殖是动脉粥样硬化(atherosclerosis, As)斑块形成的主要因素之一。肝素能抑制培养的鼠血管平滑肌细胞增殖[1,2],但在小肝素分子(low molecular weight heparin, LMWH)这方面的研究较少。本研究以肝素分子为参照,观察用肝素酶降解产生的小肝素分子是否保留其抑制平滑肌细胞增殖的特性,为其作为一种抗血管细胞增殖的药物应用于临床进行初步探讨。
1 材料和方法
1.1 试剂与材料
肝素(上海生化制药厂),小肝素分子(中国科学院微生物所提供),胰蛋白酶(Difco),DMEM培养粉(Gibco),胎牛血清(Gibco, FCS), 混合人血清(天津血研所, HS),3 H-胸腺嘧啶脱氧核苷(中科院原子能所),其他均为北京化工厂AR级产品。
, 百拇医药
1.2 含肝素及小肝素分子培养基的制备
将肝素及小肝素分子分别溶于双蒸水,测其糖醛酸含量,以mg/L表示。将一定量的DMEM培养粉分别溶于肝素和小肝素分子的水溶液内,以滤膜过滤,4°C储存备用。
1.3 平滑肌细胞的培养及分组
将冻存的第二代胎儿主动脉平滑肌细胞37℃迅速解冻,加入含血清的培养基离心5 min(1 000 rpm),弃上清,加入含10%HS和10%FCS的DMEM培养基,接种于塑料培养瓶(25 cm2,95%空气+5%CO2, 37℃)培养,隔2~3天换液一次,5~6天汇合。将培养的人主动脉平滑肌细胞以含0.125%胰蛋白酶和0.02%EDTA-Na2的磷酸缓冲液消化传代,接种于24孔培养板。每孔1 mL(1×104细胞),用含10%HS和10%FCS的DMEM培养基培养24 h后,换低浓度血清(0.5%HS和0.5%FCS)培养基继续培养24 h。
, 百拇医药
实验共分六组。①不同浓度肝素(含糖醛酸18、35和70 mg/L), 10%HS (放置2年),10%FCS的DMEM培养基。②不同浓度小肝素分子(含糖醛酸18、35和70 mg/L),其他同①。③不同浓度肝素(同①),10%HS (新制备),10%FCS的DMEM培养基。④不同浓度小肝素(同②),其他同③。⑤对照组a:不含肝素及小肝素分子,其他同①或②。⑥对照组b:不含肝素及小肝素分子,其他同③或④。六组hASMC(每种浓度肝素及小肝素分子均种5孔)继续培养24 h。
1.4 3H-胸腺嘧啶脱氧核苷掺入法
每孔加50 μL(10 mCi/L)氚标记胸腺嘧啶脱氧核苷, 于37°C、95%空气+5%CO2条件下孵育3 h,吸去培养基加预冷的10%三氯乙酸0.5 mL,4℃固定细胞30 min,吸去三氯乙酸,用冷的磷酸缓冲液洗两次。每孔加0.5 mL 1%SDS-0.1 mol/L NaOH,37℃ 孵育14 h。然后将细胞裂解液混匀,每孔取300 μL移至装有8 mL闪烁液的闪烁瓶中混匀放置过夜,液闪仪记数。 实验重复一次得到类似的结果。
, 百拇医药
培养的平滑肌细胞生长的抑制率(%)
=(1-实验组每分钟计数/对照组每分钟计数)×100%
培养的平滑肌细胞生长的促增殖率(%)
=(实验组每分钟计数/对照组每分钟计数-1)×100%
2 结 果
2.1 培养的人主动脉平滑肌细胞的形态
用放置2年混合人血清培养的细胞皱缩,呈现不良的生长状态(图1a, Figure 1a),而同时加入了肝素和小肝素分子培养的细胞伸展,呈现良好的生长状态(图1b和c,Figure 1 and c)。用新制备的混合人血清培养的细胞伸展,呈现良好的生长状态,同时加入了肝素和小肝素分子培养的细胞形态与正常细胞形态相似,但细胞密度有所降低。

, 百拇医药
图1 培养的人主动脉平滑肌细胞形态
Figure 1 A: hASMCs poor-growth pattern (control a); B: Stimulation of heparin on poor-growth hASMCs cultured in DMEM; C: Stimulation of LMWH on poor-growth hASMCs cultured in DMEM
2.2 肝素及小肝素分子的促增殖作用
从图2(Figure 2)可见,不同浓度的肝素及小肝素分子均能促进生长不良的hASMC DNA合成,其促增殖率分别为149%、140%、180%和207%、246%、309%。

图2 不同浓度的肝素及小肝素分子对生长不良的人主动脉平滑肌细胞生长的影响
, 百拇医药
Figure 2 Stimulation rate(%) of poor-growth hASMCs cultured in DMEM containing heparin or LMWH at different concentrations
2.3 肝素及小肝素分子的抑制作用
从图3(Figure 3)可见,三种浓度的肝素及小肝素分子对生长良好的hASMC DNA合成均有抑制作用,按照使用的量(18~70 mg 己糖醛酸/L),肝素及小肝素分子对培养的hASMC DNA合成的抑制率分别为66%、69%、69%和60%、68%、67%,二者均无浓度依赖性。
3 讨 论
肝素是蛋白聚糖的一种,在临床上一直作为一种重要的抗凝药物。小肝素分子是通过化学方法或特异的酶降解肝素分子所产生的分子量约为4 000~5 000的片断分子。八十年代,国外的研究者一致提出肝素能抑制培养的平滑肌细胞增殖。Pukac等[3]观察到肝素抑制c-fos和c-myc基因的表达。Reilly等[4]提出肝素可阻止细胞进入S期而抑制细胞增殖。

, 百拇医药
图3 不同浓度的肝素及小肝素分子对生长良好的人主动脉平滑肌细胞生长的影响
Figure 3 Inhibition rate(%) of well-growth hASMCs cultured in DMEM containing heparin or LMWH at different concentrations
本研究首次发现肝素和小肝素分子对培养的hASMC具有双重调节作用。对生长良好的hASMC有抑制作用,而对生长不良的hASMC有保护和促增殖作用。这一研究结果提示,机体内某些生物活性物质可能也存在类似的调节机制,这对维持正常生物学功能是非常重要的,为今后的研究提供新的启示。平滑肌细胞是血管壁重要的细胞成分,在正常生理条件下,细胞的增殖和凋亡处于一种动态平衡,肝素或肝素类似物可能参与调节这种平衡。尽管血管壁的平滑肌细胞和内皮细胞不能合成和分泌肝素,但它们能产生硫酸乙酰肝素蛋白聚糖[5],硫酸乙酰肝素蛋白聚糖中的糖链硫酸乙酰肝素在结构上与肝素相类似,生物学功能也有许多共同点,如它们都是肝素结合类生长因子的低亲和受体[6~8],同时它们还能与这些生长因子的高亲和受体结合[9,10]。我们以往的实验结果揭示人主动脉硫酸乙酰肝素蛋白聚糖抑制培养的hASMC增殖[11]。
, 百拇医药
最近的研究发现肝素及硫酸乙酰肝素诱导生长因子的二聚化[12~14],导致受体激酶的二聚化并产生受体的自我磷酸化,将信号向下游传递,硫酸乙酰肝素可能通过破坏细胞表面其他分子对生长因子与受体结合的负调控起作用。这些研究都反映了硫酸乙酰肝素或肝素调节生长因子作用的复杂性。
本研究结果提示,肝素和小肝素分子对生长不同状态的hASMC表现出不同的生物学效应,其机制尚不清楚,可能涉及生长因子及其受体和信号传导网络系统,这些生物学作用可能由细胞的内在因素调节控制。
[作者简介] 丛祥凤,女,1950年出生,副研究员,硕士研究生导师,多年从事蛋白聚糖与动脉粥样硬化发病机制的研究。
参考文献
[1] Guyton JR, Rosenberg RD, Haering WY, et al. Inhibition of rat arterial smooth muscle cell proliferation by heparin I in vivo studies with anticoagulant and non-anticoagulant heparin [J]. Circ Res, 1980, 46: 625-634
, 百拇医药
[2] Hoover RL, Rosenberg RD, Haering W, et al. Inhibition of rat arterial smooth muscle cell proliferation by heparin II in vivo studies [J]. Circ Res, 1980, 47: 578-583
[3] Pukac LA, Castellot JJ, Wright TC, et al. Heparin inhibition c-fos and c-myc mRNA expression in vascular smooth muscle cells [J]. Cell Regul, 1990, 1: 435-443
[4] Reilly CF, Kindy M, Brown KE, et al. Heparin prevents vascular smooth muscle cell progression through the G1 phase of the cell cycle [J]. J Biol Chem, 1989, 264(6): 990-995
, http://www.100md.com
[5] Walker A, Turnbull JE, Gallagher JT. Specific heparan sulfate saccharides mediate the activity of basic fibroblast growth factor [J]. J Biol Chem, 1994, 269: 931-935
[6] Brickman YG, Ford MD, Small DH, et al. Heparan sulfate mediate the binding of basic fibroblast growth factor to a specific receptor on neural precursor cells [J]. J Biol Chem, 1995, 270: 24 941-948
[7] Raab G, Klagsbrun M. Heparin-binding EGF-like growth factor [J]. Biochem Biophys Acta, 1997, 1 333: F179-199
, http://www.100md.com
[8] Markku M, Elenius K, Heini MM, et al. Inhibition of basic fibroblast growth factor-2 induced growth promotion by overexpression of syndecan-1 [J]. J Biol Chem, 1993, 268: 24 215-222
[9] Ornitz DM, Yayon A, Flanagan JG, et al. Heparin is repuired for cell-Free binding of basic fibroblast growth factor to a soluble receptor and for mitogenesis in whole cells [J]. Mol Cell Biol, 1992, 12: 240-247
[10] Liekens S, Leali D, Neyts J, et al. Modulation of fibroblast growth factor-2 receptor binding, signaling,and mitogenic activity by heparin-mimicking polysulfonated compounds [J]. Mol Pharmacol, 1999, 56: 204-213
, 百拇医药
[11] 张春玲, 丛祥凤, 张英珊. 人主动脉壁硫酸乙酰肝素蛋白聚糖对培养的人主动脉平滑肌细胞生长的影响 [J]. 生物化学杂志, 1996, 12: 191-195
[12] Schwall RH, Chang LY, Godowski PJ, et al. Heparin induces dimerization and confers proliferative activity onto the hepatocyte growth factor antagonists NK1 and NK2 [J]. J Cell Biol, 1996, 133: 709-718
[13] Miao HQ, Ornitz DM, Aingorn E, et al. Modulation of fibroblast growth factor-2 receptor binding, dimerization signaling, and angiogenic activity by a synthetic heparin-mimicking [J]. J Clin Invest, 1997, 99: 1 565-575
[14] Kinnunen T, Kaksonen M, Swarinen J, et al. Cortactin-Src kinase signaling pathway is involved in N-Syndecan-dependent neurite out-growth [J]. J Biol Chem, 1998, 273: 10 702-708
(此文2000-01-29收到,2000-07-29修回), http://www.100md.com