氧化型低密度脂蛋白和普伐他汀对人脐静脉内皮细胞细胞间粘附分子-1表达的影响
作者:张新超 徐成斌 张彤
单位:张新超(北京大学人民医院心内科, 北京 100044);徐成斌(北京大学人民医院心内科, 北京 100044);张彤(北京大学人民医院心内科, 北京 100044)
关键词:脂蛋白,低密度;内皮;细胞间粘附分子-1;动脉粥样硬化
中国动脉硬化杂志000311[摘 要] 观察氧化型低密度脂蛋白对人脐静脉内皮细胞细胞间粘附分子-1表达的诱导及普伐他汀对它的抑制影响,以期探讨氧化型低密度脂蛋白致动脉粥样硬化的机制及普伐他汀可能的非调脂抗动脉粥样硬化作用。体外培养人脐静脉内皮细胞,分别加氧化型低密度脂蛋白50 mg/L、100 mg/L、200 mg/L及氧化型低密度脂蛋白(100 mg/L)+普伐他汀(10-4~-6 mol/L),孵育12 h、24 h和36 h,采用细胞酶联免疫吸附试验、流式细胞技术和反转录聚合酶链反应分别测定细胞间粘附分子-1蛋白水平及mRNA水平。结果发现,氧化型低密度脂蛋白呈浓度依赖性和时间依赖性诱导细胞间粘附分子-1蛋白表达及mRNA表达,而普伐他汀对其诱导作用有浓度依赖性和时间依赖性的抑制影响。研究表明,氧化型低密度脂蛋白诱导血管内皮细胞细胞间粘附分子-1的表达,可能代表了其在动脉粥样硬化形成与发展的一个关键环节致动脉粥样硬化的又一机制;普伐他汀抑制氧化型低密度脂蛋白诱导的血管内皮细胞细胞间粘附分子-1表达,可能是其独立于调脂之外的另一抗动脉粥样硬化作用。
, http://www.100md.com
[中图分类号] R363 [文献标识码] A
[文章编号]1007-3949(2000)-03-0229-04
The Influence of Oxidized Low Density Lipoprotein and Pravastatin on Expression of Intercellular Adhesion Molecule-1 in Human Umbilical Vein Endothelial Cells
ZHANG Xin-Chao,XU Cheng-Bin,ZHANG Tong
(Department of Cardiology, People's Hospital, Beijing University, Beijing 100044, China)
, 百拇医药
ABSTRACT Aim To investigate the influence of oxidized low density lipoprotein (ox-LDL) and pravastatin on expression of intercellular adhesion molecule-1 (ICAM-1) in human umbilical vein endothelial cells (HUVEC) in order to elucidate one of the molecular mechanisms of ox-LDL on pro-atherosclerosis and to explore non-lipid mechanism of pravastatin on anti-atherosclerosis. Methods HUVEC was incubated in vitro. Ox-LDL of 50 mg/L, 100 mg/L, 200 mg/L and pravastatin of 10-6~-4mol/L were co-incubated with HUVEC for 12 h, 24 h and 36 h respectively. The expression of ICAM-1 in protein level and mRNA level was detected by enzyme linked immunosorbent assay (ELISA), flow cytometric technique and reverse transcription-polymerase chain reaction (RT-PCR). Results Ox-LDL induced ICAM-1 expression in HUVEC in concentration-dependent and time-dependent manner. Pravastatin exerted inhibitory effect on ox-LDL-induced ICAM-1 expression, which was also dosage-dependent and time-dependent. Conclusions Ox-LDL could induce or up-regulate ICAM-1 expression in HUVEC, which probably reflected a new mechanism of ox-LDL to atherogenesis. Pravastatin inhibited ox-LDL-induced ICAM-1 expression, which may crucially contribute to the clinical benefits of HMG-CoA reductase inhibitors on coronary artery disease, beyond the cholesterol-lowering effects.
, 百拇医药
MeSH Lipoprotein, LDL; Endothelium; Intercellular Adhesion Molecule-1; Atherosclerosis
细胞粘附分子介导的单核细胞与血管内皮细胞粘附及其相互作用是贯穿于动脉粥样硬化 (atherosclerosis, As)形成与发展不同环节中的重要事件之一。氧化型低密度脂蛋白(oxidized low density li-poprotein, ox-LDL)虽可通过多种途径加速As病变形成和进展,但能否诱导或上调内皮细胞表达As相关粘附分子的研究报告甚多[1~6]。HMG-CoA还原酶抑制剂他汀类药调脂以外的抗As作用近年来愈益受到重视[7]。有报道认为一些他汀类药具有抗氧化效应及抑制高胆固醇血症患者增高的单核细胞与血管内皮细胞的粘附[8~10]。本文观察ox-LDL对人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVEC)细胞间粘附分子-1(intercellular adhesion molecule-1, ICAM-1)表达的影响及普伐他汀可能的抑制作用,探讨ox-LDL致As作用和普伐他汀的非调脂抗As机制。
, 百拇医药
1 材料与方法
1.1 氧化型低密度脂蛋白的制备及鉴定
低密度脂蛋白(low density lipoprotein, LDL)的制备采用密度梯度超速离心法。终浓度5 μmol/L的Cu2+氧化修饰LDL(37℃,16 h)。电泳显示,氧化修饰后的LDL即ox-LDL较LDL有更快的泳动率;LDL和ox-LDL的硫代巴比妥酸反应物质的值分别为1.81 mol/g蛋白和11.21 mol/g蛋白。蛋白定量采用考马斯亮蓝比色法。
1.2 人脐静脉内皮细胞的培养及鉴定
人新鲜脐带由本院产房提供。0.25%胰蛋白酶(Gibco公司)消化脐静脉内皮,消化下的内皮细胞以20%FCS的M199(Gibco公司)培养基、置5%CO2孵箱(Heraeus公司)、37℃培养至融合状态,用含有内皮细胞生长因子20 mg/L (Boehriner Mannheim公司)、肝素50 mg/L的20% FCS的M199传代培养。培养的内皮细胞形态学符合内皮细胞特征,抗VIII因子抗体(Zymed公司)染色阳性。细胞毒性试验采用Trypan Blue染色及细胞记数法。ox-LDL和普伐他汀的浓度和剂量对HUVEC生长无任何毒性,细胞存活率在93.0%以上。
, 百拇医药
1.3 酶联免疫吸附试验
生长良好的内皮细胞用0.25%胰蛋白酶和0.02% EDTA混合液消化,以5×104~1×105个细胞/孔接种于96孔板(Costar公司),待细胞融合生长,换2% FCS的M199过夜,然后用5%FCS的M199培养,分别加50、100、200 mg/L ox-LDL及ox-LDL(100 mg/L)+普伐他汀(10-4~-6mol/L)共孵育,作用时间分别为12 h、24 h及36 h。
0.05%Tween-PBS、PBS洗;0.25%戊二醛固定20 min,2%脱脂奶粉37℃封闭2 h,PBS清洗;1∶1 000 鼠抗人ICAM-1单克隆抗体(100 mg/L, Santa Cruz公司)50 μL、 4℃过夜,PBS洗;1∶500生物素标记抗鼠IgG(1.5 g/L, Vector公司)50 μL、37℃孵育1 h,PBS洗;1∶500亲和素标记辣根酶(1.0 g/L,Vector公司)50 μL 、37℃孵育1 h,PBS洗;0.06%DAB(含0.03% H2O2)60 μL 、室温30 min,2 mol/L H2SO4 40 μL中止反应,492 nm酶标仪读数(OD值)。试验重复两次,每个观察值设4个复孔。
, 百拇医药
1.4 流式细胞技术
生长良好的内皮细胞用2%FCS M199过夜,再用5%FCS M199培养,并加ox-LDL 100 mg/L或ox-LDL 100 mg/L+普伐他汀10-4 mol/L孵育24 h。0.25%胰蛋白酶和0.02% EDTA混合液消化,PBS收集细胞,1 200~1 600 r/min 离心10 min,弃上清;1∶200 ICAM-1单克隆抗体重悬细胞,4℃ 孵育1 h,10倍PBS重悬,离心弃上清;1∶100 荧光素标记抗鼠IgG(1.4 g/L,Jackson 公司)重悬细胞,4℃ 孵育1 h,10倍PBS重悬,离心弃上清;0.5 mL PBS重悬细胞,流式细胞仪(FACSort BD)检测相对荧光强度。
1.5 反转录聚合酶链反应
生长良好的内皮细胞换液后加ox-LDL 100 mg/L或ox-LDL 100 mg/L+普伐他汀10-4 mol/L孵育24 h。 细胞总RNA提取采用异硫氰酸胍-酚-氯仿(Gibco公司)一步抽提法,紫外分光光度计测260 nm、280 nm的OD值和1%甲醛变性琼脂糖电泳分析RNA质量。 RT:AMV(10 000 u/L,Promega公司)1 μL、5×RT缓冲液4 μL、RNAsin(40 000 u/L,Sabc公司)0.5 μL、随机引物(500 mg/L,Promega公司)1 μL、dNTP(10 mmol/L,Sigma公司) 2 μL、RNA 1 μg、补水至20 μL,37℃反应1 h,95℃、灭活AMV 5 min。 PCR:PCR反应体系为 cDNA 2 μL、Taq 酶(5 000 u/L, Sabc公司)0.5 μL、10×buffer 3 μL、dNTP 1.5 μL、Mg2+1.5 μL、上游引物和下游引物(美国赛百盛公司合成)各0.5 μL、补水至30 μL。PCR反应条件为预变性94℃ 3 min、变性94℃ 40 s、退火57℃ 60 s、延伸72℃ 60 s,循环35轮后延伸5 min。ICAM-1引物序列[11] 正义:5'-GTCCCCCTCAAAAGTCATCC-3'(105~124),反义:5'-AACCCCATTCAGCGTCA-CCT-3' (1 028~1 047);GAPDH引物序列 正义:5'-CGGAGTCAACGGATTTGGTGGTAT-3',反义:5'-AGCCTTCTCCATGGTGGTGAAGAC -3'。PCR产物经1%琼脂糖凝胶电泳,紫外灯下照片,PCR Marker购自Sabc公司。
, 百拇医药
1.6 统计学处理
数据以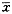 ±s表示,采用方差分析及t检验。
±s表示,采用方差分析及t检验。
2 结 果
2.1 细胞间粘附分子-1的表达
不同浓度ox-LDL与HUVEC作用不同时间所表达的ICAM-1水平皆明显增高(P<0.001),并呈浓度和时间依赖性。HUVEC基础表达的ICAM-1水平不随时间延长而明显改变。普伐他汀明显抑制ox-LDL诱导的HUVEC ICAM-1表达(P<0.001),也呈浓度和时间依赖性(表1,Table 1)。
表1 氧化型低密度脂蛋白对人静脉内皮细胞粘附分子-1表达的诱导和普伐他汀的抑制影响
, 百拇医药
Table 1 Inducible influence of ox-LDL on ICAM-1expression in HUVEC and inhibitory effect of pravastatin (OD value, n=8) Groups
12 h
24 h
36 h
Control
0.133±0.017
0.130±0.012
0.138±0.023
Ox-LDL
, http://www.100md.com
50 mg/L
0.465±0.020a
0.483±0.032a
0.514±0.037a
100 mg/L
0.493±0.038a
0.542±0.011a
0.665±0.042a
200 mg/L
0.585±0.036a
, http://www.100md.com
0.636±0.053a
0.786±0.074a
Ox-LDL+pravastatin
100 mg/L+10-4 mol/L
0.318±0.043b(35.50)
0.343±0.034b(36.72)
0.357±0.040b(46.32)
100 mg/L+10-5 mol/L
, http://www.100md.com 0.381±0.043b(22.72)
0.384±0.034b(29.15)
0.412±0.049b(38.05)
100 mg/L+10-6 mol/L
0.389±0.030b(21.09)
0.401±0.036b(26.01)
0.418±0.045b(37.14)
Inhibitory rate(in brackets)=[(OD value of ox-LDL-OD value of pravastatin)/OD value of ox-LDL]×100%. a: P<0.001, Compared with control group, b: P<0.001, Compared with 100 mg/L ox-LDL group.
, 百拇医药
2.2 流式细胞检测结果
100 mg/L ox-LDL诱导的HUVEC ICAM-1表达的平均荧光强度为37.61±3.12(n=3),加10-4mol/L普伐他汀作用后ICAM-1表达的平均荧光强度为16.46±1.67(n=3)。ox-LDL明显上调ICAM-1表达,普伐他汀则显示明显的抑制效应。
2.3 细间粘附分子-1 mRNA的表达
RT-PCR结果显示, ox-LDL明显诱导HUVEC ICAM-1 mRNA的表达,普伐他汀则抑制ox-LDL对 HUVEC ICAM-1表达的诱导(图1,Figure 1)。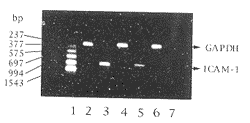
图1 氧化型低密度脂蛋白对人静脉内皮细胞细胞间粘附分子-1 mRNA表达的诱导及普伐他汀的抑制影响
, 百拇医药
Figure 1 ox-LDL induced ICAM-1 expression in HUVEC and inhibitory effect of pravastatin. 1:Marker; 2,3: Ox-LDL; 4,5: Ox-LDL+Pravastatin; 6,7: Control.
3 讨 论
1992年,研究人员首先发现人冠状动脉弥慢性增厚的内膜内皮细胞和粥样斑块的内皮细胞、巨噬细胞以及有明显T细胞和巨噬细胞浸润的邻近病变内皮下区域的内皮细胞均表达ICAM-1,正常动脉内皮及没有炎性细胞浸润区域的内皮细胞不表达ICAM-1,并认为ICAM-1在内皮细胞表达的作用涉及单核细胞、淋巴细胞向内皮的粘附及迁移[12~15]。最近,Patel等[16]采用载脂蛋白缺陷自发性As小鼠模型直接在体观察了ICAM-1介导巨噬细胞归巢到As斑块中的作用。许多研究都已证明,ox-LDL通过多重途径参与或促进As的发生、发展,但能否诱导As相关粘附分子ICAM-1表达近几年的报道结果各异。本文结果显示,ox-LDL呈浓度和时间依赖性诱导HUVEC ICAM-1表达。
, 百拇医药
Nie等[1]发现,正常饮食饲养的鼠动脉壁罕有ICAM-1表达,富胆固醇饲养4周鼠动脉内膜内皮细胞表达ICAM-1增加,尤以病损区域突出,且与粘附到病损区的巨噬细胞、T细胞增加相一致,该病变部位85%以上的巨噬细胞在膜表面表达LFA-1。如果给高胆固醇饲养2周的鼠抗ICAM-1单克隆抗体或抗LFA-1单克隆抗体治疗2周,粘附到内膜的巨噬细胞则明显受抑,这种巨噬细胞几乎是LFA-1阳性巨噬细胞。研究证明,LDL增加ICAM-1表达并通过ICAM-1/LFA-1机制促进单核细胞向内皮粘附、迁移[1,2]。Weber等[3]研究显示,ox-LDL和轻微修饰的LDL增加单核细胞向HUVEC粘附也是通过ICAM-1/CD11b途径所介导。Kume等[4]认为,ox-LDL的重要组成成分溶血磷脂胆碱诱导ICAM-1表达的意义较ox-LDL本身更为重要。然而,Amberger等[5]研究认为,仅人主动脉内皮细胞非人静脉内皮细胞受ox-LDL刺激可表达ICAM-1,提示不同来源的血管内皮细胞对炎性因子刺激表达ICAM-1可能是不同的。Khan等[6]则发现,虽然天然LDL 、ox-LDL及糖基化LDL皆不能诱导内皮细胞表达ICAM-1,但ox-LDL确实增加肿瘤坏死因子α(TNFα)诱导人主动脉内皮细胞ICAM-1表达。最近,Calara等[17]研究证实,ox-LDL可激活血管内皮细胞核转录因子(NF-κB),诱导或上调ICAM-1表达。研究发现,高胆固醇血症患者血单核细胞与内皮细胞的粘附明显增加,洛伐他汀和辛伐他汀可明显降低增高的粘附状态;给高胆固醇血症大鼠服用氟伐他汀,其白细胞对血小板激活因子和白三烯B4刺激的粘附及迁移反应明显受抑[8,9]。 Niwa等[10]发现,氟伐他汀抑制人单核细胞系-U937膜上LFA-1和ICAM-1表达。最近的动物实验显示,HMG-CoA还原酶抑制剂可减少内膜和中膜的巨噬细胞,有益于防止As并使斑块趋于稳定[18]。本研究首次证实,普伐他汀可抑制ox-LDL对血管内皮细胞ICAM-1表达的诱导,从而从细胞和分子水平为他汀类药物降低临床心血管病事件提供了又一可能的基础机制。由于普伐他汀等HMG-CoA还原酶抑制剂可改善LDL总的耐氧化能力[7],其对ox-LDL诱导的内皮细胞 ICAM-1表达的抑制可能与此有关。
, 百拇医药
本研究表明,ox-LDL诱导或上调内皮细胞 ICAM-1表达,进而介导血单核细胞-内皮细胞间粘附及其相互作用,是其致As的新的机制,普伐他汀抑制ox-LDL对血管内皮细胞ICAM-1表达的诱导,是其独立于调脂以外的又一抗As作用。
[作者简介] 张新超,男,1962年出生。医学博士研究生,副主任医师。现阶段研究:①细胞粘附分子在动脉粥样硬化发生与发展中的意义及进展;②HMG-CoA 还原酶抑制剂的非调脂抗动脉粥样硬化作用;③LDL 和 ox-LDL对细胞粘附分子表达的影响。
参考文献
[1] Nie Q, Fan JL, Haraoka S,et al. Inhibition of mononuclear cell recruitment in aortic intima by treatment with anti-ICAM-1 and anti-LFA-1 monoclonal antibodies in hypercholesterolemic rats: implications of the ICAM-1 and LFA-1 pathway in atherogenesis [J]. Lab Invest, 1997, 77: 469-482
, http://www.100md.com
[2] Smalley DM, Li JH, Italiano ML, et al. Native low density lipoprotein increases endothelial cell adhesiveness by inducing ICAM-1 [J]. Arterioscler Thromb Vasc Biol, 1996, 16:585-590
[3] Weber C, Erl W, Weber PC. Enhancement of monocyte adhesion to endothelial cells by oxidatively modified low-density lipoprotein is mediadted by activation of CDllb [J]. Biochem Biophys Res Comm, 1995, 206:621-628
[4] Kume N, Cybulsky MI, Gimbrone MA Jr. Lysophosphatidylcholine, a component of atherogenic lipoproteins,induces mononuclear leukocyte adhesion molecules in cultured human and rabbit arterial endothelial cells [J]. J Clin Invest, 1992, 90: 1 138-144
, http://www.100md.com
[5] Amberger A, Maczek C, Jurgens G, et al. Co-expression of ICAM-1, VCAM-1, ELAM-1 and Hsp60 in human arterial and venous endothelial cells in response to cytokines and oxidized low-density lipoprotein [J]. Cell Stress Chaperones, 1997, 2: 94-104
[6] Khan BV, Parthasarathy SS, Alexander RW, et al. Modified low density lipoprotein and its constituents augment cytokine-activated vascular cell adhesion molecule-1 gene expression in human vascular endothelial cells [J]. J Clin Invest, 1995, 95: 1 262-270
, http://www.100md.com
[7] Rosenson RS, Tangney CC. Antiatherothrombotic properties of statins: implications for cardiovascular event reduction [J]. JAMA, 1998, 279: 1 643-650
[8] Kimura M, Kurose I, Russell J, et al. Effects of fluvastatin on leukocyte-endothelial cell adhesion in hypercholesterolemic rats [J]. Arterioscler Thromb Vasc Biol, 1997, 17: 1 521-526
[9] Weber C, Erl W , Weber KSC, et al. HMG-CoA reductase inhibitors decrease CD11b expression and CD11b-dependent adhesion of monocytes to endothelium and reduce increased adhesiveness of monocytes isolated from patients with hypercholesterolemia [J]. J Am Coll Cardiol, 1997, 30: 1 212-217
, 百拇医药
[10] Niwa S, Totsuka T, Hayashi S. Inhibitory effect of fluvastatin, an HMG-CoA reductase inhibitor, on the expression of adhesion molecules on human monocyte cell line [J]. Int J Immunopharmacol, 1996, 18: 669-675
[11] Couffinhal T, Duplaa C, Moreau C, et al. Regulation of vascular cell adhesion molecule-1 and intercellular adhesion molecule-1 in human vascular smooth muscle cells [J]. Circ Res, 1994, 74: 225-234
[12] Poston RN, Haskard DO, Coucher J R, et al. Expression of intercellular adhesion molecule-1 in atherosclerotic plaques [J]. Am J Pathol, 1992, 140: 665-673
, http://www.100md.com
[13] Printeseva OY, Peclo MM, Gown AM. Various cell types in human atherosclerotic lesions express ICAM-1: Further immunocytechemical and immuno chemical studies employing monoclonal antibody 10F3 [J]. Am J Pathol, 1992, 140: 889-896
[14] van der Wal AC, Das PK, Tigges AJ. Adhesion molecules on the endothelium and mononuclear cells in human atherosclerotic lesions [J]. Am J Pathol, 1992, 141: 1 427-433
[15] Wood KM, Cadogan MD, Ramshaw AL, et al. The distribution of adhesion molecules in human atherosclerosis [J]. Histopathology, 1993, 22: 437-444
, 百拇医药
[16] Patel SS, Thiagarajan R, Willerson JT, et al. Inhibition of a4 integrin and ICAM-1 markedly attenuate macrophage homing to atherosclerotic plaques in apoE-deficient mice [J]. Circulation, 1998, 97: 75-81
[17] Calara F, Dimayuga P, Niemann A, et al. An animal model to study local oxidation of LDL and its biological effects in the arterial wall [J]. Arterioscler Thromb Vasc Biol, 1998, 18: 884-893
[18] Williams JK, Sukhova GK, Herrington DM, et al. Pravastatin has cholesterol-lowering independent effects on the artery wall of atherosclerotic monkeys [J]. J Am Coll Cardiol, 1998, 31: 684-691
(此文2000-02-17收到,2000-07-22修回), http://www.100md.com
单位:张新超(北京大学人民医院心内科, 北京 100044);徐成斌(北京大学人民医院心内科, 北京 100044);张彤(北京大学人民医院心内科, 北京 100044)
关键词:脂蛋白,低密度;内皮;细胞间粘附分子-1;动脉粥样硬化
中国动脉硬化杂志000311[摘 要] 观察氧化型低密度脂蛋白对人脐静脉内皮细胞细胞间粘附分子-1表达的诱导及普伐他汀对它的抑制影响,以期探讨氧化型低密度脂蛋白致动脉粥样硬化的机制及普伐他汀可能的非调脂抗动脉粥样硬化作用。体外培养人脐静脉内皮细胞,分别加氧化型低密度脂蛋白50 mg/L、100 mg/L、200 mg/L及氧化型低密度脂蛋白(100 mg/L)+普伐他汀(10-4~-6 mol/L),孵育12 h、24 h和36 h,采用细胞酶联免疫吸附试验、流式细胞技术和反转录聚合酶链反应分别测定细胞间粘附分子-1蛋白水平及mRNA水平。结果发现,氧化型低密度脂蛋白呈浓度依赖性和时间依赖性诱导细胞间粘附分子-1蛋白表达及mRNA表达,而普伐他汀对其诱导作用有浓度依赖性和时间依赖性的抑制影响。研究表明,氧化型低密度脂蛋白诱导血管内皮细胞细胞间粘附分子-1的表达,可能代表了其在动脉粥样硬化形成与发展的一个关键环节致动脉粥样硬化的又一机制;普伐他汀抑制氧化型低密度脂蛋白诱导的血管内皮细胞细胞间粘附分子-1表达,可能是其独立于调脂之外的另一抗动脉粥样硬化作用。
, http://www.100md.com
[中图分类号] R363 [文献标识码] A
[文章编号]1007-3949(2000)-03-0229-04
The Influence of Oxidized Low Density Lipoprotein and Pravastatin on Expression of Intercellular Adhesion Molecule-1 in Human Umbilical Vein Endothelial Cells
ZHANG Xin-Chao,XU Cheng-Bin,ZHANG Tong
(Department of Cardiology, People's Hospital, Beijing University, Beijing 100044, China)
, 百拇医药
ABSTRACT Aim To investigate the influence of oxidized low density lipoprotein (ox-LDL) and pravastatin on expression of intercellular adhesion molecule-1 (ICAM-1) in human umbilical vein endothelial cells (HUVEC) in order to elucidate one of the molecular mechanisms of ox-LDL on pro-atherosclerosis and to explore non-lipid mechanism of pravastatin on anti-atherosclerosis. Methods HUVEC was incubated in vitro. Ox-LDL of 50 mg/L, 100 mg/L, 200 mg/L and pravastatin of 10-6~-4mol/L were co-incubated with HUVEC for 12 h, 24 h and 36 h respectively. The expression of ICAM-1 in protein level and mRNA level was detected by enzyme linked immunosorbent assay (ELISA), flow cytometric technique and reverse transcription-polymerase chain reaction (RT-PCR). Results Ox-LDL induced ICAM-1 expression in HUVEC in concentration-dependent and time-dependent manner. Pravastatin exerted inhibitory effect on ox-LDL-induced ICAM-1 expression, which was also dosage-dependent and time-dependent. Conclusions Ox-LDL could induce or up-regulate ICAM-1 expression in HUVEC, which probably reflected a new mechanism of ox-LDL to atherogenesis. Pravastatin inhibited ox-LDL-induced ICAM-1 expression, which may crucially contribute to the clinical benefits of HMG-CoA reductase inhibitors on coronary artery disease, beyond the cholesterol-lowering effects.
, 百拇医药
MeSH Lipoprotein, LDL; Endothelium; Intercellular Adhesion Molecule-1; Atherosclerosis
细胞粘附分子介导的单核细胞与血管内皮细胞粘附及其相互作用是贯穿于动脉粥样硬化 (atherosclerosis, As)形成与发展不同环节中的重要事件之一。氧化型低密度脂蛋白(oxidized low density li-poprotein, ox-LDL)虽可通过多种途径加速As病变形成和进展,但能否诱导或上调内皮细胞表达As相关粘附分子的研究报告甚多[1~6]。HMG-CoA还原酶抑制剂他汀类药调脂以外的抗As作用近年来愈益受到重视[7]。有报道认为一些他汀类药具有抗氧化效应及抑制高胆固醇血症患者增高的单核细胞与血管内皮细胞的粘附[8~10]。本文观察ox-LDL对人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVEC)细胞间粘附分子-1(intercellular adhesion molecule-1, ICAM-1)表达的影响及普伐他汀可能的抑制作用,探讨ox-LDL致As作用和普伐他汀的非调脂抗As机制。
, 百拇医药
1 材料与方法
1.1 氧化型低密度脂蛋白的制备及鉴定
低密度脂蛋白(low density lipoprotein, LDL)的制备采用密度梯度超速离心法。终浓度5 μmol/L的Cu2+氧化修饰LDL(37℃,16 h)。电泳显示,氧化修饰后的LDL即ox-LDL较LDL有更快的泳动率;LDL和ox-LDL的硫代巴比妥酸反应物质的值分别为1.81 mol/g蛋白和11.21 mol/g蛋白。蛋白定量采用考马斯亮蓝比色法。
1.2 人脐静脉内皮细胞的培养及鉴定
人新鲜脐带由本院产房提供。0.25%胰蛋白酶(Gibco公司)消化脐静脉内皮,消化下的内皮细胞以20%FCS的M199(Gibco公司)培养基、置5%CO2孵箱(Heraeus公司)、37℃培养至融合状态,用含有内皮细胞生长因子20 mg/L (Boehriner Mannheim公司)、肝素50 mg/L的20% FCS的M199传代培养。培养的内皮细胞形态学符合内皮细胞特征,抗VIII因子抗体(Zymed公司)染色阳性。细胞毒性试验采用Trypan Blue染色及细胞记数法。ox-LDL和普伐他汀的浓度和剂量对HUVEC生长无任何毒性,细胞存活率在93.0%以上。
, 百拇医药
1.3 酶联免疫吸附试验
生长良好的内皮细胞用0.25%胰蛋白酶和0.02% EDTA混合液消化,以5×104~1×105个细胞/孔接种于96孔板(Costar公司),待细胞融合生长,换2% FCS的M199过夜,然后用5%FCS的M199培养,分别加50、100、200 mg/L ox-LDL及ox-LDL(100 mg/L)+普伐他汀(10-4~-6mol/L)共孵育,作用时间分别为12 h、24 h及36 h。
0.05%Tween-PBS、PBS洗;0.25%戊二醛固定20 min,2%脱脂奶粉37℃封闭2 h,PBS清洗;1∶1 000 鼠抗人ICAM-1单克隆抗体(100 mg/L, Santa Cruz公司)50 μL、 4℃过夜,PBS洗;1∶500生物素标记抗鼠IgG(1.5 g/L, Vector公司)50 μL、37℃孵育1 h,PBS洗;1∶500亲和素标记辣根酶(1.0 g/L,Vector公司)50 μL 、37℃孵育1 h,PBS洗;0.06%DAB(含0.03% H2O2)60 μL 、室温30 min,2 mol/L H2SO4 40 μL中止反应,492 nm酶标仪读数(OD值)。试验重复两次,每个观察值设4个复孔。
, 百拇医药
1.4 流式细胞技术
生长良好的内皮细胞用2%FCS M199过夜,再用5%FCS M199培养,并加ox-LDL 100 mg/L或ox-LDL 100 mg/L+普伐他汀10-4 mol/L孵育24 h。0.25%胰蛋白酶和0.02% EDTA混合液消化,PBS收集细胞,1 200~1 600 r/min 离心10 min,弃上清;1∶200 ICAM-1单克隆抗体重悬细胞,4℃ 孵育1 h,10倍PBS重悬,离心弃上清;1∶100 荧光素标记抗鼠IgG(1.4 g/L,Jackson 公司)重悬细胞,4℃ 孵育1 h,10倍PBS重悬,离心弃上清;0.5 mL PBS重悬细胞,流式细胞仪(FACSort BD)检测相对荧光强度。
1.5 反转录聚合酶链反应
生长良好的内皮细胞换液后加ox-LDL 100 mg/L或ox-LDL 100 mg/L+普伐他汀10-4 mol/L孵育24 h。 细胞总RNA提取采用异硫氰酸胍-酚-氯仿(Gibco公司)一步抽提法,紫外分光光度计测260 nm、280 nm的OD值和1%甲醛变性琼脂糖电泳分析RNA质量。 RT:AMV(10 000 u/L,Promega公司)1 μL、5×RT缓冲液4 μL、RNAsin(40 000 u/L,Sabc公司)0.5 μL、随机引物(500 mg/L,Promega公司)1 μL、dNTP(10 mmol/L,Sigma公司) 2 μL、RNA 1 μg、补水至20 μL,37℃反应1 h,95℃、灭活AMV 5 min。 PCR:PCR反应体系为 cDNA 2 μL、Taq 酶(5 000 u/L, Sabc公司)0.5 μL、10×buffer 3 μL、dNTP 1.5 μL、Mg2+1.5 μL、上游引物和下游引物(美国赛百盛公司合成)各0.5 μL、补水至30 μL。PCR反应条件为预变性94℃ 3 min、变性94℃ 40 s、退火57℃ 60 s、延伸72℃ 60 s,循环35轮后延伸5 min。ICAM-1引物序列[11] 正义:5'-GTCCCCCTCAAAAGTCATCC-3'(105~124),反义:5'-AACCCCATTCAGCGTCA-CCT-3' (1 028~1 047);GAPDH引物序列 正义:5'-CGGAGTCAACGGATTTGGTGGTAT-3',反义:5'-AGCCTTCTCCATGGTGGTGAAGAC -3'。PCR产物经1%琼脂糖凝胶电泳,紫外灯下照片,PCR Marker购自Sabc公司。
, 百拇医药
1.6 统计学处理
数据以
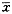 ±s表示,采用方差分析及t检验。
±s表示,采用方差分析及t检验。2 结 果
2.1 细胞间粘附分子-1的表达
不同浓度ox-LDL与HUVEC作用不同时间所表达的ICAM-1水平皆明显增高(P<0.001),并呈浓度和时间依赖性。HUVEC基础表达的ICAM-1水平不随时间延长而明显改变。普伐他汀明显抑制ox-LDL诱导的HUVEC ICAM-1表达(P<0.001),也呈浓度和时间依赖性(表1,Table 1)。
表1 氧化型低密度脂蛋白对人静脉内皮细胞粘附分子-1表达的诱导和普伐他汀的抑制影响
, 百拇医药
Table 1 Inducible influence of ox-LDL on ICAM-1expression in HUVEC and inhibitory effect of pravastatin (OD value, n=8) Groups
12 h
24 h
36 h
Control
0.133±0.017
0.130±0.012
0.138±0.023
Ox-LDL
, http://www.100md.com
50 mg/L
0.465±0.020a
0.483±0.032a
0.514±0.037a
100 mg/L
0.493±0.038a
0.542±0.011a
0.665±0.042a
200 mg/L
0.585±0.036a
, http://www.100md.com
0.636±0.053a
0.786±0.074a
Ox-LDL+pravastatin
100 mg/L+10-4 mol/L
0.318±0.043b(35.50)
0.343±0.034b(36.72)
0.357±0.040b(46.32)
100 mg/L+10-5 mol/L
, http://www.100md.com 0.381±0.043b(22.72)
0.384±0.034b(29.15)
0.412±0.049b(38.05)
100 mg/L+10-6 mol/L
0.389±0.030b(21.09)
0.401±0.036b(26.01)
0.418±0.045b(37.14)
Inhibitory rate(in brackets)=[(OD value of ox-LDL-OD value of pravastatin)/OD value of ox-LDL]×100%. a: P<0.001, Compared with control group, b: P<0.001, Compared with 100 mg/L ox-LDL group.
, 百拇医药
2.2 流式细胞检测结果
100 mg/L ox-LDL诱导的HUVEC ICAM-1表达的平均荧光强度为37.61±3.12(n=3),加10-4mol/L普伐他汀作用后ICAM-1表达的平均荧光强度为16.46±1.67(n=3)。ox-LDL明显上调ICAM-1表达,普伐他汀则显示明显的抑制效应。
2.3 细间粘附分子-1 mRNA的表达
RT-PCR结果显示, ox-LDL明显诱导HUVEC ICAM-1 mRNA的表达,普伐他汀则抑制ox-LDL对 HUVEC ICAM-1表达的诱导(图1,Figure 1)。

图1 氧化型低密度脂蛋白对人静脉内皮细胞细胞间粘附分子-1 mRNA表达的诱导及普伐他汀的抑制影响
, 百拇医药
Figure 1 ox-LDL induced ICAM-1 expression in HUVEC and inhibitory effect of pravastatin. 1:Marker; 2,3: Ox-LDL; 4,5: Ox-LDL+Pravastatin; 6,7: Control.
3 讨 论
1992年,研究人员首先发现人冠状动脉弥慢性增厚的内膜内皮细胞和粥样斑块的内皮细胞、巨噬细胞以及有明显T细胞和巨噬细胞浸润的邻近病变内皮下区域的内皮细胞均表达ICAM-1,正常动脉内皮及没有炎性细胞浸润区域的内皮细胞不表达ICAM-1,并认为ICAM-1在内皮细胞表达的作用涉及单核细胞、淋巴细胞向内皮的粘附及迁移[12~15]。最近,Patel等[16]采用载脂蛋白缺陷自发性As小鼠模型直接在体观察了ICAM-1介导巨噬细胞归巢到As斑块中的作用。许多研究都已证明,ox-LDL通过多重途径参与或促进As的发生、发展,但能否诱导As相关粘附分子ICAM-1表达近几年的报道结果各异。本文结果显示,ox-LDL呈浓度和时间依赖性诱导HUVEC ICAM-1表达。
, 百拇医药
Nie等[1]发现,正常饮食饲养的鼠动脉壁罕有ICAM-1表达,富胆固醇饲养4周鼠动脉内膜内皮细胞表达ICAM-1增加,尤以病损区域突出,且与粘附到病损区的巨噬细胞、T细胞增加相一致,该病变部位85%以上的巨噬细胞在膜表面表达LFA-1。如果给高胆固醇饲养2周的鼠抗ICAM-1单克隆抗体或抗LFA-1单克隆抗体治疗2周,粘附到内膜的巨噬细胞则明显受抑,这种巨噬细胞几乎是LFA-1阳性巨噬细胞。研究证明,LDL增加ICAM-1表达并通过ICAM-1/LFA-1机制促进单核细胞向内皮粘附、迁移[1,2]。Weber等[3]研究显示,ox-LDL和轻微修饰的LDL增加单核细胞向HUVEC粘附也是通过ICAM-1/CD11b途径所介导。Kume等[4]认为,ox-LDL的重要组成成分溶血磷脂胆碱诱导ICAM-1表达的意义较ox-LDL本身更为重要。然而,Amberger等[5]研究认为,仅人主动脉内皮细胞非人静脉内皮细胞受ox-LDL刺激可表达ICAM-1,提示不同来源的血管内皮细胞对炎性因子刺激表达ICAM-1可能是不同的。Khan等[6]则发现,虽然天然LDL 、ox-LDL及糖基化LDL皆不能诱导内皮细胞表达ICAM-1,但ox-LDL确实增加肿瘤坏死因子α(TNFα)诱导人主动脉内皮细胞ICAM-1表达。最近,Calara等[17]研究证实,ox-LDL可激活血管内皮细胞核转录因子(NF-κB),诱导或上调ICAM-1表达。研究发现,高胆固醇血症患者血单核细胞与内皮细胞的粘附明显增加,洛伐他汀和辛伐他汀可明显降低增高的粘附状态;给高胆固醇血症大鼠服用氟伐他汀,其白细胞对血小板激活因子和白三烯B4刺激的粘附及迁移反应明显受抑[8,9]。 Niwa等[10]发现,氟伐他汀抑制人单核细胞系-U937膜上LFA-1和ICAM-1表达。最近的动物实验显示,HMG-CoA还原酶抑制剂可减少内膜和中膜的巨噬细胞,有益于防止As并使斑块趋于稳定[18]。本研究首次证实,普伐他汀可抑制ox-LDL对血管内皮细胞ICAM-1表达的诱导,从而从细胞和分子水平为他汀类药物降低临床心血管病事件提供了又一可能的基础机制。由于普伐他汀等HMG-CoA还原酶抑制剂可改善LDL总的耐氧化能力[7],其对ox-LDL诱导的内皮细胞 ICAM-1表达的抑制可能与此有关。
, 百拇医药
本研究表明,ox-LDL诱导或上调内皮细胞 ICAM-1表达,进而介导血单核细胞-内皮细胞间粘附及其相互作用,是其致As的新的机制,普伐他汀抑制ox-LDL对血管内皮细胞ICAM-1表达的诱导,是其独立于调脂以外的又一抗As作用。
[作者简介] 张新超,男,1962年出生。医学博士研究生,副主任医师。现阶段研究:①细胞粘附分子在动脉粥样硬化发生与发展中的意义及进展;②HMG-CoA 还原酶抑制剂的非调脂抗动脉粥样硬化作用;③LDL 和 ox-LDL对细胞粘附分子表达的影响。
参考文献
[1] Nie Q, Fan JL, Haraoka S,et al. Inhibition of mononuclear cell recruitment in aortic intima by treatment with anti-ICAM-1 and anti-LFA-1 monoclonal antibodies in hypercholesterolemic rats: implications of the ICAM-1 and LFA-1 pathway in atherogenesis [J]. Lab Invest, 1997, 77: 469-482
, http://www.100md.com
[2] Smalley DM, Li JH, Italiano ML, et al. Native low density lipoprotein increases endothelial cell adhesiveness by inducing ICAM-1 [J]. Arterioscler Thromb Vasc Biol, 1996, 16:585-590
[3] Weber C, Erl W, Weber PC. Enhancement of monocyte adhesion to endothelial cells by oxidatively modified low-density lipoprotein is mediadted by activation of CDllb [J]. Biochem Biophys Res Comm, 1995, 206:621-628
[4] Kume N, Cybulsky MI, Gimbrone MA Jr. Lysophosphatidylcholine, a component of atherogenic lipoproteins,induces mononuclear leukocyte adhesion molecules in cultured human and rabbit arterial endothelial cells [J]. J Clin Invest, 1992, 90: 1 138-144
, http://www.100md.com
[5] Amberger A, Maczek C, Jurgens G, et al. Co-expression of ICAM-1, VCAM-1, ELAM-1 and Hsp60 in human arterial and venous endothelial cells in response to cytokines and oxidized low-density lipoprotein [J]. Cell Stress Chaperones, 1997, 2: 94-104
[6] Khan BV, Parthasarathy SS, Alexander RW, et al. Modified low density lipoprotein and its constituents augment cytokine-activated vascular cell adhesion molecule-1 gene expression in human vascular endothelial cells [J]. J Clin Invest, 1995, 95: 1 262-270
, http://www.100md.com
[7] Rosenson RS, Tangney CC. Antiatherothrombotic properties of statins: implications for cardiovascular event reduction [J]. JAMA, 1998, 279: 1 643-650
[8] Kimura M, Kurose I, Russell J, et al. Effects of fluvastatin on leukocyte-endothelial cell adhesion in hypercholesterolemic rats [J]. Arterioscler Thromb Vasc Biol, 1997, 17: 1 521-526
[9] Weber C, Erl W , Weber KSC, et al. HMG-CoA reductase inhibitors decrease CD11b expression and CD11b-dependent adhesion of monocytes to endothelium and reduce increased adhesiveness of monocytes isolated from patients with hypercholesterolemia [J]. J Am Coll Cardiol, 1997, 30: 1 212-217
, 百拇医药
[10] Niwa S, Totsuka T, Hayashi S. Inhibitory effect of fluvastatin, an HMG-CoA reductase inhibitor, on the expression of adhesion molecules on human monocyte cell line [J]. Int J Immunopharmacol, 1996, 18: 669-675
[11] Couffinhal T, Duplaa C, Moreau C, et al. Regulation of vascular cell adhesion molecule-1 and intercellular adhesion molecule-1 in human vascular smooth muscle cells [J]. Circ Res, 1994, 74: 225-234
[12] Poston RN, Haskard DO, Coucher J R, et al. Expression of intercellular adhesion molecule-1 in atherosclerotic plaques [J]. Am J Pathol, 1992, 140: 665-673
, http://www.100md.com
[13] Printeseva OY, Peclo MM, Gown AM. Various cell types in human atherosclerotic lesions express ICAM-1: Further immunocytechemical and immuno chemical studies employing monoclonal antibody 10F3 [J]. Am J Pathol, 1992, 140: 889-896
[14] van der Wal AC, Das PK, Tigges AJ. Adhesion molecules on the endothelium and mononuclear cells in human atherosclerotic lesions [J]. Am J Pathol, 1992, 141: 1 427-433
[15] Wood KM, Cadogan MD, Ramshaw AL, et al. The distribution of adhesion molecules in human atherosclerosis [J]. Histopathology, 1993, 22: 437-444
, 百拇医药
[16] Patel SS, Thiagarajan R, Willerson JT, et al. Inhibition of a4 integrin and ICAM-1 markedly attenuate macrophage homing to atherosclerotic plaques in apoE-deficient mice [J]. Circulation, 1998, 97: 75-81
[17] Calara F, Dimayuga P, Niemann A, et al. An animal model to study local oxidation of LDL and its biological effects in the arterial wall [J]. Arterioscler Thromb Vasc Biol, 1998, 18: 884-893
[18] Williams JK, Sukhova GK, Herrington DM, et al. Pravastatin has cholesterol-lowering independent effects on the artery wall of atherosclerotic monkeys [J]. J Am Coll Cardiol, 1998, 31: 684-691
(此文2000-02-17收到,2000-07-22修回), http://www.100md.com