中国人极低密度脂蛋白受体基因的克隆及其在中国仓鼠卵巢细胞中的表达
作者:屈伸 王剑波 刘志国 邓耀祖 冯宗忱
单位:同济医科大学生物化学教研室, 湖北省 武汉市 430030
关键词:脂蛋白,;低密度;基因;中国仓鼠卵巢细胞;动脉粥样硬化
中国动脉硬化杂志000301[摘 要] 为了研究极低密度脂蛋白受体结构与功能的关系,本文利用反转录聚合酶链反应技术从中国人心肌组织中克隆出极低密度脂蛋白受体的全长cDNA后,将其插入真核表达载体pcDNA3获得重组体pCD-VR。测序结果发现,这一源于中国人的极低密度脂蛋白受体基因cDNA的碱基序列与文献报道基本相符。反转录聚合酶链反应检测证实,转染 pCD-VR的中国仓鼠卵巢细胞可有效表达极低密度脂蛋白受体mRNA。脂蛋白结合实验结果发现,转染的中国仓鼠卵巢细胞结合极低密度脂蛋白的能力明显增高。
[中图分类号] Q78 [文献标识码] A
, 百拇医药
[文章编号] 1007-3949(2000)-03-0189-04
The Cloning and Expression on Chinese Hamster Ovary Cells of Chinese Very Low Density Lipoprotein Receptor Gene
QU Shen,WANG Jian-Bo,LIU Zhi-Guo,DENG Yao-Zu,FENG Zong-Chen
(Department of Biochemistry, Tongji Medical University, Wuhan 430030, China)
ABSTRACT Aim To study the relationship of very low density lipoprotein receptor (VLDLR) structure and its function. Methods The present paper reported the cloning of VLDLR gene cDNA from a chinese heart tissue by RT-PCR technology. A recombinant named pCD-VR was constructed in which the VLDLR cDNA was inserted a vector pcDNA3. Results Sequencing result confirmed that the chinese oriented VLDLR gene cDNA was in line with previously one. Then, the pCD-VR was transfected into CHO cells. Lipoprotein combination test and mRNA detection confirmed that this human VLDLR gene could express effectively in the CHO cells. Conclusion It was provided a new idea about the roles of VLDLR in atherosclerosis.
, 百拇医药
MeSH Lipoprotein, LDL; Genes; CHO Cells; Atherosclerosis
极低密度脂蛋白受体(very low density lipoprotein receptor, VLDLR)属低密度脂蛋白受体(low density lipoprotein receptor,LDLR)家族[1],由846个氨基酸组成,其蛋白质结构与LDLR非常相似,不同之处在于LDLR的配体结合域有7个重复序列,而VLDLR有8个重复序列,相应地其基因结构比LDLR多一个外显子。在功能上,LDLR主要与含有载脂蛋白B100和载脂蛋白E的脂蛋白结合;而VLDLR主要与富含载脂蛋白E的脂蛋白结合。LDLR活性受胆固醇下调,而VLDLR活性不受胆固醇下调。由此看来,VLDLR与LDLR在功能和调控方面的差异与受体结合域的结构差异存在必然联系。本文进行了中国人VLDLR基因的克隆、序列分析及在中国仓鼠卵巢(chinese hamster ovary, CHO)细胞中表达的检测,探讨VLDLR结合域中8个重复序列在执行结合脂蛋白功能中的作用及中国人较易罹患高甘油三酯血症的机理。
, http://www.100md.com
1 材料与方法
1.1 组织与细胞
心肌组织从施行心脏手术患者近心耳处采集。CHO-K1细胞株购自武汉大学中国典型培养物保藏中心。
1.2 试剂与仪器
DiI(Molecular probes,USA),F12培养基与胎牛血清(Gibco,USA),Lipofectin(Gibco,USA), ExpendTM长模板DNA聚合酶(BOEHRINGER MANNHEIM公司),PCR引物由GIBCO BRL公司合成。SuperScriptTM Preamplification System购自GIBCO BRL公司,限制性核酸内切酶及T4DNA 连接酶购自Bio-Lab公司,Sephadex G-25购自Phamacia。
, 百拇医药
1.3 总RNA提取
取少量心肌组织匀浆,用异硫氰酸胍一步法[2]提取细胞总RNA,再通过紫外分光测定含量及纯度,甲醛凝胶变性电泳检测其完整性。
1.4 反转录反应
按SuperScriptTM Preamplification System操作指南进行。取总RNA 5 μg,Oligo(dT)12~18 1 μL,补DEPC处理水至12 μL,混匀,70℃ 10 min后冰上冷却,加入反应混合液(10×buffer 2 μL,25 mmol/L MgCl2 2 μL,10 mmol/L dNTPs 1 μL,0.1 mmol/L DTT 2 μL)混匀,42℃预热5 min,加入1 μL反转录酶,42℃反应50 min,70℃灭活反转录酶15 min,-20℃保存。
, 百拇医药
1.5 扩增反应
根据Yamamoto等报道的人VLDLR cDNA序列设计了一对引物(P1、P2)。在P1 5’末端设计了一Bam HI酶切位点,P2 5’末端设计了一Xba I酶切位点。P1(sense) 5'-GGGATCCCCATCCAGGCGGGCAC
CATG-3’(-24~3), P2(antisense)(2 862~2 890) 5'-CGGATCCGGCCAGAGGTGGCAATACTGTC-3’,P3 5'-ACTGGGACAGGAACAGGTAT-3' (2 194~2 214)。 PCR反应总体积为50 μL:引物各20 μmol,dNTPs各10 mmol,Mg2+ 75 mmol,ExpendTM长模板DNA聚合酶2.5 u, cDNA模板2 μL。反应条件为:94℃ 4 min,然后94℃ 45 s,55℃ 45 s,68℃ 3 min,循环5次,更换循环条件为94℃ 45 s,62℃ 5 s,68℃ 3 min,循环35次,最后68℃延伸10 min。
, http://www.100md.com
1.6 重组体的构建和鉴定
将扩增的cDNA片段经琼脂糖凝胶电泳后采用透析袋挡板法回收,经酚、氯仿抽提,无水乙醇沉淀[3]。 载体pcDNA3与RT-PCR扩增的目的基因片段均用Xba I和Bam HI进行酶切,电泳回收纯化后,按摩尔比1∶3连接(总DNA 200 ng,1 μL 10×T4DNA连接酶缓冲液,1单位T4DNA连接酶,加水至10 μL, 15℃反应16 h)。取连接液转化感受态细菌后,在LB固体培养皿上取氨苄抗性菌落培养扩增,用碱变性法制备重组质粒。重组质粒经Bam HI、Nhe I、Hind Ⅲ、Apa I酶切电泳鉴定。重组质粒经氯化铯离心[4]纯化后测序。
1.7 细胞培养与基因转移
CHO-K1细胞用含10%胎牛血清的F12在37℃、5%CO2的条件下培养。基因转染用Lipofectin介导的方法进行。转染后48 h检测外源基因的表达。基因转染的CHO细胞用含G418(800 mg/L)的F12持续筛选至稳定表达VLDLR的CHO细胞。
, http://www.100md.com
1.8 极低密度脂蛋白受体表达
以反转录产物为模板,以P1、P3为引物,利用Taq DNA聚合酶进行PCR扩增,同时进行β-actin基因扩增作为内参。循环条件为:94℃变性4 min,94℃ 30 s,55℃ 45 s,72℃ 3 min,循环35次,最后72℃延伸10 min。
1.9 脂蛋白分离
取正常人空腹血400 mL,加入EDTA-Na2抗凝,8 000 r/min 离心15 min,分离血浆。加入PMSF 1 μmol/L、NaN3 1 mmol/L及谷胱甘肽,12 000 r/min离心30 min,除去顶层乳糜微粒。加入NaCl将血浆密度调至1.1 kg/L,55 000 r/min 10℃离心5 h后,吸取上层VLDL及LDL混合物。在35.5 mL Beckman离心管中,由上到下依此加入1.006 kg/L、1.063 kg/L梯度液及VLDL和LDL混合物,55 000 r/min离心3 h,分离VLDL及LDL[5]。
, http://www.100md.com
1.10 脂蛋白的DiI标记
分离的VLDL用PBS透析12 h,取出后用无菌的PBS将蛋白浓度稀释至1 g/L。同样用无菌的PBS调节去脂血清至其蛋白浓度为4 g/L。调好后的脂蛋白溶液与去脂血清溶液按1∶4体积比混合后,加DiI储液,比例为150 μg DiI∶1 mg脂蛋白,混匀,过滤除菌(0.45 μm),37℃避光孵育8~12 h。用NaCl 调密度至1.1 kg/L,超离(条件为:4℃~10℃,50 000 r/min,2.5 h)后,吸取上层VLDL,经PBS透析8~12 h,用0.45μm滤膜过滤除菌。测定溶液荧光强度和蛋白浓度,计算标记率。
1.11 脂蛋白结合实验
瞬时表达pCD-VR的CHO细胞与DiI标记的VLDL结合实验于转染后8~72 h进行。结合实验前48 h加25-羟胆固醇和胆固醇于细胞培养基中(终浓度分别为1 mg/L和10 mg/L),以抑制LDL受体表达。 结合开始时,弃细胞培养液,用PBS加入冰中预冷的含DiI标记脂蛋白的结合反应液,4℃孵育3 h,用含0.2%牛血清白蛋白的冰冷的PBS洗三次,以去除未结合的DiI标记的脂蛋白。然后每皿(35 mm)加入1 mL细胞裂解液(1 g/L SDS、0.1 mol/L NaOH),混匀,此细胞裂解液可同时用于荧光强度和蛋白浓度的测定,结果以DiI标记脂蛋白/细胞蛋白(mg/g),即DiI-VLDL/Cell protein(mg/g)表示。
, http://www.100md.com
2 结 果
2.1 总RNA的鉴定
总RNA经紫外分光光度计定量,OD260/OD280>1.9。RNA经甲醛变性凝胶电泳后,在紫外观测仪下可见清晰的28 S、18 S、5.8 S三条带,表明RNA纯度和完整性较好,可用于反转录反应。
2.2 反转录聚合酶链反应
从pCD-VR转染的CHO细胞中分离总RNA后,经RT-PCR反应获得的产物经琼脂糖凝胶电泳,在紫外灯下观察到一清晰条带,与期望的VLDLR cDNA长度(2.9 kb)相符(图1,Figure 1)。
图1 反转录聚合酶链反应扩增的极低密度脂蛋白受体cDNA片段的电泳图谱
, 百拇医药
Figure 1 The gel electrophoresis photograph of the RT-PCR amplication of the VLDLR cDNA fragment. 1:RT-PCR扩增产物; 2:λDNA/HindⅢ+EcoRⅠ.
2.3 重组体的酶切片段电泳鉴定
重组质粒用Bam HI、Nhe I、Hind Ⅲ、Apa I酶切鉴定,电泳结果显示:8.3 kb阳性重组体(pCD-VR)被HindⅢ切成2个片段,长度分别为5.53 kb和2.77 kb;经Nhe I、Bam HI酶切后成为8.4 kb线性片段;经ApaI酶切得1.9 kb和6.5 kb两片段。酶切产物电泳结果与预期相符(图2, Figure 2)。
图2 重组体酶切电泳图谱
, http://www.100md.com
Figure 2 The gel electrophoresis photograph of the recombinant after digested. 1: pCD-VR/Nhe I; 2: pCD-VR/Hind Ⅲ; 3: pCD-VR/Bam HI; 4: pCD-VR/Apa I; 5: λDNA/Hind Ⅲ.
2.4 极低密度脂蛋白受体cDNA的序列分析
重组质粒pCD-VR测序结果发现,与Yamamoto等报道的人VLDLR cDNA序列相比,仅在胞内域中第3 000位A变为G,第3 193位T变为 C 。故可认为,从中国人心肌组织中克隆获得的VLDLR cDNA与文献报道相符。
2.5 极低密度脂蛋白受体基因的表达
从转染pcDNA3、pCD-VR的CHO细胞提取总RNA,经反转录PCR扩增,同时以β-actin作为内参。扩增产物进行琼脂糖凝胶电泳,两细胞均扩增出与β-actin基因相应的条带;稳定转染pCD-VR的CHO细胞扩增出一2.2 kb的清晰条带,其电泳迁移率与预期VLDLR片段长度相符(图3,Figure 3)。提示外源性VLDLR基因在CHO细胞内得到了表达,而转染pcDNA3的CHO细胞未扩增出VLDLR cDNA片段。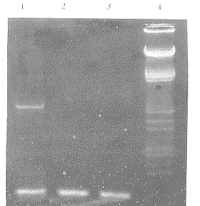
, 百拇医药
图3 反转录聚合酶链反应产物的凝胶电泳图谱
Figure 3 The gel electrophoresis photograph of the RT-PCR products. 1: RT-PCR products of β-actin and VLDLR from CHO cells transfected with pCD-VR; 2: RT-PCR results of β-actin from CHO cells; 3: RT-PCR products of β-actin from CHO cells transfected with pcDNA3; 4: λDNA/EcoRI+Hind Ⅲ
2.6 DiI标记的极低密度脂蛋白与基因转染后的中国仓鼠卵巢细胞结合后的荧光显微镜观察
转染VLDLR基因的CHO细胞与DiI-VLDL在4℃下孵育4 h后,荧光显微镜下观察发现,细胞膜上结合有荧光标记的VLDL(图4,Figure 4)。
, 百拇医药
2.7 脂蛋白结合实验结果
当脂蛋白浓度(DiI-VLDL)为10 mg/L时,转染全长VLDLR基因的CHO细胞结合脂蛋白能力(24.36±2.07)高于转染空载体的CHO细胞(19.84±1.38),差异有显著性(P<0.01),进一步证实人VLDLR基因可在CHO细胞中有效表达。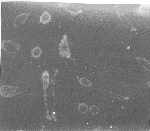
图4 荧光显微镜下中国仓鼠卵巢细胞结合DiI标记的极低密度脂蛋白结果
Figure 4 The result of CHO cells combining with DiI-labeled-lipoprotein under fluorescence microscopy.
3 讨 论
, 百拇医药
脂蛋白代谢异常是动脉粥样硬化发病的重要因素。胆固醇升高已被确认为冠心病发病危险因子,而甘油三酯及富含甘油三酯的脂蛋白,如VLDL的致动脉粥样硬化作用日益受到重视。脂蛋白受体在血浆脂类的代谢中起关键作用。LDLR能够与含载脂蛋白B100及载脂蛋白E的脂蛋白结合,如LDL、VLDL。成熟LDLR由五个功能域组成:N-端含七个重复序列的配体结合域、表皮生长因子前体同源域、O-连接糖蛋白域、跨膜域及胞浆域。研究表明,VLDLR也由上述几个功能域组成,结构与LDLR极为相近,不同处在于VLDLR的N-端配体结合域比LDLR多一重复序列。VLDLR能够结合VLDL、β-VLDL及IDL,但对LDL亲合力很低[5]。在LDLR分子上,结合LDL需重复序列3~7,结合β-VLDL需重复序列5[6,7],故推测VLDLR多出的重复序列可能影响其与脂蛋白的结合功能。
为探讨VLDLR结构与功能的关系,本实验从中国人心肌组织提取总RNA,利用RT-PCR技术,克隆出了中国人VLDLR cDNA。测序结果表明,这一源于中国人心肌的VLDLR cDNA序列与文献报道基本一致。将此全长受体基因导入体外培养的CHO细胞后,用RT-PCR扩增后出现一条2.2 kb的清晰条带,PCR反应中设计的人源性VLDLR基因特异引物的序列完全不同于鼠源性VLDLR的基因序列,表明其在CHO细胞内可有效表达。脂蛋白结合实验证明,该受体的全长基因的表达产物具有结合VLDL的功能。
, http://www.100md.com
我们拟在本文报道的结果基础之上,将VLDL受体配体结合域一个或几个重复序列逐一缺失,构建成缺失不同重复序列的VLDLR真核表达载体,将其转入相应受体缺失细胞,观察各种不同缺失表达载体转染细胞与脂蛋白结合功能,从而阐明VLDLR各重复序列在结合脂蛋白过程中所起的作用,为进一步了解VLDLR在动脉粥样硬化中所起作用提供新的认识。
[基金项目] 国家自然科学基金资助项目(项目编号39670162)
[作者简介] 屈伸,男,1954年8月出生,河南人,教授,副院长。现从事生物化学与分子生物学专业,主要研究方向为基因诊断与基因治疗。
参考文献
[1] Mehta KD, Chen WJ, Goldstein JL, et al. The low density lipoprotein receptor in Xenopus laevis.I.Five domains that resemble the human receptor [J]. J Biol Chem, 1991, 266: 10 406-414
, 百拇医药
[2] Yamamoto T, Davis CG, Brown MS, et al. The human LDL receptor :A cysteine-rich protein with multiple alu sequences in its mRNA [J]. Cell, 1984, 39: 27-38
[3] Yamamoto T, Bishop RW, Brown MS, et al. Deletion in cysteine-rich region of LDL receptor impedes transport to cell surface in WHHL rabbit [J]. Science, 1986, 232: 1 230-237
[4] Lee LY, Mohler WA, Schafer BL, et al. Nucleotide sequence of the rat low density lipoprotein receptor cDNA [J]. Nucleic Acids Res, 1989, 17: 1 259-260
, 百拇医药
[5] Takahashi S, Kawarabayasi Y, Nakai T, et al. Rabbit very low density lipoprotein receptor:a low density lipoprotein receptor like protein with distinct ligand specificity [J]. Proc Natl Acad Sci USA, 1992, 89: 9 252-256
[6] Esser V, Limbird LE, Brown MS, et al. Mutational analysis of the ligand binding domain of the low density lipoprotein receptor [J]. Biol Chem, 1988, 263: 13 283-290
[7] Russelt DW, Brown MS, Goldstein JL. Different combinations of cysteine-rich repeats mediate binding of low density lipoprotein receptor to two different proteins [J]. J Biol Chem, 1989, 264: 21 682-688
(此文 2000-01-13收到, 2000-07-27修回), 百拇医药
单位:同济医科大学生物化学教研室, 湖北省 武汉市 430030
关键词:脂蛋白,;低密度;基因;中国仓鼠卵巢细胞;动脉粥样硬化
中国动脉硬化杂志000301[摘 要] 为了研究极低密度脂蛋白受体结构与功能的关系,本文利用反转录聚合酶链反应技术从中国人心肌组织中克隆出极低密度脂蛋白受体的全长cDNA后,将其插入真核表达载体pcDNA3获得重组体pCD-VR。测序结果发现,这一源于中国人的极低密度脂蛋白受体基因cDNA的碱基序列与文献报道基本相符。反转录聚合酶链反应检测证实,转染 pCD-VR的中国仓鼠卵巢细胞可有效表达极低密度脂蛋白受体mRNA。脂蛋白结合实验结果发现,转染的中国仓鼠卵巢细胞结合极低密度脂蛋白的能力明显增高。
[中图分类号] Q78 [文献标识码] A
, 百拇医药
[文章编号] 1007-3949(2000)-03-0189-04
The Cloning and Expression on Chinese Hamster Ovary Cells of Chinese Very Low Density Lipoprotein Receptor Gene
QU Shen,WANG Jian-Bo,LIU Zhi-Guo,DENG Yao-Zu,FENG Zong-Chen
(Department of Biochemistry, Tongji Medical University, Wuhan 430030, China)
ABSTRACT Aim To study the relationship of very low density lipoprotein receptor (VLDLR) structure and its function. Methods The present paper reported the cloning of VLDLR gene cDNA from a chinese heart tissue by RT-PCR technology. A recombinant named pCD-VR was constructed in which the VLDLR cDNA was inserted a vector pcDNA3. Results Sequencing result confirmed that the chinese oriented VLDLR gene cDNA was in line with previously one. Then, the pCD-VR was transfected into CHO cells. Lipoprotein combination test and mRNA detection confirmed that this human VLDLR gene could express effectively in the CHO cells. Conclusion It was provided a new idea about the roles of VLDLR in atherosclerosis.
, 百拇医药
MeSH Lipoprotein, LDL; Genes; CHO Cells; Atherosclerosis
极低密度脂蛋白受体(very low density lipoprotein receptor, VLDLR)属低密度脂蛋白受体(low density lipoprotein receptor,LDLR)家族[1],由846个氨基酸组成,其蛋白质结构与LDLR非常相似,不同之处在于LDLR的配体结合域有7个重复序列,而VLDLR有8个重复序列,相应地其基因结构比LDLR多一个外显子。在功能上,LDLR主要与含有载脂蛋白B100和载脂蛋白E的脂蛋白结合;而VLDLR主要与富含载脂蛋白E的脂蛋白结合。LDLR活性受胆固醇下调,而VLDLR活性不受胆固醇下调。由此看来,VLDLR与LDLR在功能和调控方面的差异与受体结合域的结构差异存在必然联系。本文进行了中国人VLDLR基因的克隆、序列分析及在中国仓鼠卵巢(chinese hamster ovary, CHO)细胞中表达的检测,探讨VLDLR结合域中8个重复序列在执行结合脂蛋白功能中的作用及中国人较易罹患高甘油三酯血症的机理。
, http://www.100md.com
1 材料与方法
1.1 组织与细胞
心肌组织从施行心脏手术患者近心耳处采集。CHO-K1细胞株购自武汉大学中国典型培养物保藏中心。
1.2 试剂与仪器
DiI(Molecular probes,USA),F12培养基与胎牛血清(Gibco,USA),Lipofectin(Gibco,USA), ExpendTM长模板DNA聚合酶(BOEHRINGER MANNHEIM公司),PCR引物由GIBCO BRL公司合成。SuperScriptTM Preamplification System购自GIBCO BRL公司,限制性核酸内切酶及T4DNA 连接酶购自Bio-Lab公司,Sephadex G-25购自Phamacia。
, 百拇医药
1.3 总RNA提取
取少量心肌组织匀浆,用异硫氰酸胍一步法[2]提取细胞总RNA,再通过紫外分光测定含量及纯度,甲醛凝胶变性电泳检测其完整性。
1.4 反转录反应
按SuperScriptTM Preamplification System操作指南进行。取总RNA 5 μg,Oligo(dT)12~18 1 μL,补DEPC处理水至12 μL,混匀,70℃ 10 min后冰上冷却,加入反应混合液(10×buffer 2 μL,25 mmol/L MgCl2 2 μL,10 mmol/L dNTPs 1 μL,0.1 mmol/L DTT 2 μL)混匀,42℃预热5 min,加入1 μL反转录酶,42℃反应50 min,70℃灭活反转录酶15 min,-20℃保存。
, 百拇医药
1.5 扩增反应
根据Yamamoto等报道的人VLDLR cDNA序列设计了一对引物(P1、P2)。在P1 5’末端设计了一Bam HI酶切位点,P2 5’末端设计了一Xba I酶切位点。P1(sense) 5'-GGGATCCCCATCCAGGCGGGCAC
CATG-3’(-24~3), P2(antisense)(2 862~2 890) 5'-CGGATCCGGCCAGAGGTGGCAATACTGTC-3’,P3 5'-ACTGGGACAGGAACAGGTAT-3' (2 194~2 214)。 PCR反应总体积为50 μL:引物各20 μmol,dNTPs各10 mmol,Mg2+ 75 mmol,ExpendTM长模板DNA聚合酶2.5 u, cDNA模板2 μL。反应条件为:94℃ 4 min,然后94℃ 45 s,55℃ 45 s,68℃ 3 min,循环5次,更换循环条件为94℃ 45 s,62℃ 5 s,68℃ 3 min,循环35次,最后68℃延伸10 min。
, http://www.100md.com
1.6 重组体的构建和鉴定
将扩增的cDNA片段经琼脂糖凝胶电泳后采用透析袋挡板法回收,经酚、氯仿抽提,无水乙醇沉淀[3]。 载体pcDNA3与RT-PCR扩增的目的基因片段均用Xba I和Bam HI进行酶切,电泳回收纯化后,按摩尔比1∶3连接(总DNA 200 ng,1 μL 10×T4DNA连接酶缓冲液,1单位T4DNA连接酶,加水至10 μL, 15℃反应16 h)。取连接液转化感受态细菌后,在LB固体培养皿上取氨苄抗性菌落培养扩增,用碱变性法制备重组质粒。重组质粒经Bam HI、Nhe I、Hind Ⅲ、Apa I酶切电泳鉴定。重组质粒经氯化铯离心[4]纯化后测序。
1.7 细胞培养与基因转移
CHO-K1细胞用含10%胎牛血清的F12在37℃、5%CO2的条件下培养。基因转染用Lipofectin介导的方法进行。转染后48 h检测外源基因的表达。基因转染的CHO细胞用含G418(800 mg/L)的F12持续筛选至稳定表达VLDLR的CHO细胞。
, http://www.100md.com
1.8 极低密度脂蛋白受体表达
以反转录产物为模板,以P1、P3为引物,利用Taq DNA聚合酶进行PCR扩增,同时进行β-actin基因扩增作为内参。循环条件为:94℃变性4 min,94℃ 30 s,55℃ 45 s,72℃ 3 min,循环35次,最后72℃延伸10 min。
1.9 脂蛋白分离
取正常人空腹血400 mL,加入EDTA-Na2抗凝,8 000 r/min 离心15 min,分离血浆。加入PMSF 1 μmol/L、NaN3 1 mmol/L及谷胱甘肽,12 000 r/min离心30 min,除去顶层乳糜微粒。加入NaCl将血浆密度调至1.1 kg/L,55 000 r/min 10℃离心5 h后,吸取上层VLDL及LDL混合物。在35.5 mL Beckman离心管中,由上到下依此加入1.006 kg/L、1.063 kg/L梯度液及VLDL和LDL混合物,55 000 r/min离心3 h,分离VLDL及LDL[5]。
, http://www.100md.com
1.10 脂蛋白的DiI标记
分离的VLDL用PBS透析12 h,取出后用无菌的PBS将蛋白浓度稀释至1 g/L。同样用无菌的PBS调节去脂血清至其蛋白浓度为4 g/L。调好后的脂蛋白溶液与去脂血清溶液按1∶4体积比混合后,加DiI储液,比例为150 μg DiI∶1 mg脂蛋白,混匀,过滤除菌(0.45 μm),37℃避光孵育8~12 h。用NaCl 调密度至1.1 kg/L,超离(条件为:4℃~10℃,50 000 r/min,2.5 h)后,吸取上层VLDL,经PBS透析8~12 h,用0.45μm滤膜过滤除菌。测定溶液荧光强度和蛋白浓度,计算标记率。
1.11 脂蛋白结合实验
瞬时表达pCD-VR的CHO细胞与DiI标记的VLDL结合实验于转染后8~72 h进行。结合实验前48 h加25-羟胆固醇和胆固醇于细胞培养基中(终浓度分别为1 mg/L和10 mg/L),以抑制LDL受体表达。 结合开始时,弃细胞培养液,用PBS加入冰中预冷的含DiI标记脂蛋白的结合反应液,4℃孵育3 h,用含0.2%牛血清白蛋白的冰冷的PBS洗三次,以去除未结合的DiI标记的脂蛋白。然后每皿(35 mm)加入1 mL细胞裂解液(1 g/L SDS、0.1 mol/L NaOH),混匀,此细胞裂解液可同时用于荧光强度和蛋白浓度的测定,结果以DiI标记脂蛋白/细胞蛋白(mg/g),即DiI-VLDL/Cell protein(mg/g)表示。
, http://www.100md.com
2 结 果
2.1 总RNA的鉴定
总RNA经紫外分光光度计定量,OD260/OD280>1.9。RNA经甲醛变性凝胶电泳后,在紫外观测仪下可见清晰的28 S、18 S、5.8 S三条带,表明RNA纯度和完整性较好,可用于反转录反应。
2.2 反转录聚合酶链反应
从pCD-VR转染的CHO细胞中分离总RNA后,经RT-PCR反应获得的产物经琼脂糖凝胶电泳,在紫外灯下观察到一清晰条带,与期望的VLDLR cDNA长度(2.9 kb)相符(图1,Figure 1)。

图1 反转录聚合酶链反应扩增的极低密度脂蛋白受体cDNA片段的电泳图谱
, 百拇医药
Figure 1 The gel electrophoresis photograph of the RT-PCR amplication of the VLDLR cDNA fragment. 1:RT-PCR扩增产物; 2:λDNA/HindⅢ+EcoRⅠ.
2.3 重组体的酶切片段电泳鉴定
重组质粒用Bam HI、Nhe I、Hind Ⅲ、Apa I酶切鉴定,电泳结果显示:8.3 kb阳性重组体(pCD-VR)被HindⅢ切成2个片段,长度分别为5.53 kb和2.77 kb;经Nhe I、Bam HI酶切后成为8.4 kb线性片段;经ApaI酶切得1.9 kb和6.5 kb两片段。酶切产物电泳结果与预期相符(图2, Figure 2)。

图2 重组体酶切电泳图谱
, http://www.100md.com
Figure 2 The gel electrophoresis photograph of the recombinant after digested. 1: pCD-VR/Nhe I; 2: pCD-VR/Hind Ⅲ; 3: pCD-VR/Bam HI; 4: pCD-VR/Apa I; 5: λDNA/Hind Ⅲ.
2.4 极低密度脂蛋白受体cDNA的序列分析
重组质粒pCD-VR测序结果发现,与Yamamoto等报道的人VLDLR cDNA序列相比,仅在胞内域中第3 000位A变为G,第3 193位T变为 C 。故可认为,从中国人心肌组织中克隆获得的VLDLR cDNA与文献报道相符。
2.5 极低密度脂蛋白受体基因的表达
从转染pcDNA3、pCD-VR的CHO细胞提取总RNA,经反转录PCR扩增,同时以β-actin作为内参。扩增产物进行琼脂糖凝胶电泳,两细胞均扩增出与β-actin基因相应的条带;稳定转染pCD-VR的CHO细胞扩增出一2.2 kb的清晰条带,其电泳迁移率与预期VLDLR片段长度相符(图3,Figure 3)。提示外源性VLDLR基因在CHO细胞内得到了表达,而转染pcDNA3的CHO细胞未扩增出VLDLR cDNA片段。

, 百拇医药
图3 反转录聚合酶链反应产物的凝胶电泳图谱
Figure 3 The gel electrophoresis photograph of the RT-PCR products. 1: RT-PCR products of β-actin and VLDLR from CHO cells transfected with pCD-VR; 2: RT-PCR results of β-actin from CHO cells; 3: RT-PCR products of β-actin from CHO cells transfected with pcDNA3; 4: λDNA/EcoRI+Hind Ⅲ
2.6 DiI标记的极低密度脂蛋白与基因转染后的中国仓鼠卵巢细胞结合后的荧光显微镜观察
转染VLDLR基因的CHO细胞与DiI-VLDL在4℃下孵育4 h后,荧光显微镜下观察发现,细胞膜上结合有荧光标记的VLDL(图4,Figure 4)。
, 百拇医药
2.7 脂蛋白结合实验结果
当脂蛋白浓度(DiI-VLDL)为10 mg/L时,转染全长VLDLR基因的CHO细胞结合脂蛋白能力(24.36±2.07)高于转染空载体的CHO细胞(19.84±1.38),差异有显著性(P<0.01),进一步证实人VLDLR基因可在CHO细胞中有效表达。

图4 荧光显微镜下中国仓鼠卵巢细胞结合DiI标记的极低密度脂蛋白结果
Figure 4 The result of CHO cells combining with DiI-labeled-lipoprotein under fluorescence microscopy.
3 讨 论
, 百拇医药
脂蛋白代谢异常是动脉粥样硬化发病的重要因素。胆固醇升高已被确认为冠心病发病危险因子,而甘油三酯及富含甘油三酯的脂蛋白,如VLDL的致动脉粥样硬化作用日益受到重视。脂蛋白受体在血浆脂类的代谢中起关键作用。LDLR能够与含载脂蛋白B100及载脂蛋白E的脂蛋白结合,如LDL、VLDL。成熟LDLR由五个功能域组成:N-端含七个重复序列的配体结合域、表皮生长因子前体同源域、O-连接糖蛋白域、跨膜域及胞浆域。研究表明,VLDLR也由上述几个功能域组成,结构与LDLR极为相近,不同处在于VLDLR的N-端配体结合域比LDLR多一重复序列。VLDLR能够结合VLDL、β-VLDL及IDL,但对LDL亲合力很低[5]。在LDLR分子上,结合LDL需重复序列3~7,结合β-VLDL需重复序列5[6,7],故推测VLDLR多出的重复序列可能影响其与脂蛋白的结合功能。
为探讨VLDLR结构与功能的关系,本实验从中国人心肌组织提取总RNA,利用RT-PCR技术,克隆出了中国人VLDLR cDNA。测序结果表明,这一源于中国人心肌的VLDLR cDNA序列与文献报道基本一致。将此全长受体基因导入体外培养的CHO细胞后,用RT-PCR扩增后出现一条2.2 kb的清晰条带,PCR反应中设计的人源性VLDLR基因特异引物的序列完全不同于鼠源性VLDLR的基因序列,表明其在CHO细胞内可有效表达。脂蛋白结合实验证明,该受体的全长基因的表达产物具有结合VLDL的功能。
, http://www.100md.com
我们拟在本文报道的结果基础之上,将VLDL受体配体结合域一个或几个重复序列逐一缺失,构建成缺失不同重复序列的VLDLR真核表达载体,将其转入相应受体缺失细胞,观察各种不同缺失表达载体转染细胞与脂蛋白结合功能,从而阐明VLDLR各重复序列在结合脂蛋白过程中所起的作用,为进一步了解VLDLR在动脉粥样硬化中所起作用提供新的认识。
[基金项目] 国家自然科学基金资助项目(项目编号39670162)
[作者简介] 屈伸,男,1954年8月出生,河南人,教授,副院长。现从事生物化学与分子生物学专业,主要研究方向为基因诊断与基因治疗。
参考文献
[1] Mehta KD, Chen WJ, Goldstein JL, et al. The low density lipoprotein receptor in Xenopus laevis.I.Five domains that resemble the human receptor [J]. J Biol Chem, 1991, 266: 10 406-414
, 百拇医药
[2] Yamamoto T, Davis CG, Brown MS, et al. The human LDL receptor :A cysteine-rich protein with multiple alu sequences in its mRNA [J]. Cell, 1984, 39: 27-38
[3] Yamamoto T, Bishop RW, Brown MS, et al. Deletion in cysteine-rich region of LDL receptor impedes transport to cell surface in WHHL rabbit [J]. Science, 1986, 232: 1 230-237
[4] Lee LY, Mohler WA, Schafer BL, et al. Nucleotide sequence of the rat low density lipoprotein receptor cDNA [J]. Nucleic Acids Res, 1989, 17: 1 259-260
, 百拇医药
[5] Takahashi S, Kawarabayasi Y, Nakai T, et al. Rabbit very low density lipoprotein receptor:a low density lipoprotein receptor like protein with distinct ligand specificity [J]. Proc Natl Acad Sci USA, 1992, 89: 9 252-256
[6] Esser V, Limbird LE, Brown MS, et al. Mutational analysis of the ligand binding domain of the low density lipoprotein receptor [J]. Biol Chem, 1988, 263: 13 283-290
[7] Russelt DW, Brown MS, Goldstein JL. Different combinations of cysteine-rich repeats mediate binding of low density lipoprotein receptor to two different proteins [J]. J Biol Chem, 1989, 264: 21 682-688
(此文 2000-01-13收到, 2000-07-27修回), 百拇医药