恶性疟原虫海南株丝氨酸重复抗原部分基因序列分析
作者:肖建华 李明 毕惠祥 王萍 李英杰
单位:肖建华(衡阳医学院微生物学教研室 衡阳 421001);李明 毕惠祥 王萍 李英杰(第一军医大学热带病研究所 广州 510515)
关键词:恶性疟原虫;丝氨酸重复抗原;基因序列
中国现代医学杂志000411 该文采用PCR方法特异性扩增恶性疟原虫海南株(FCC-1/HN) SERA基因片段,并将该基因片克隆于M13噬菌体,用双脱氧链末端终止法进行测序,应用PCGENE软件对该基因序列进行了分析,结果显示该基因片段长度为453 bp,A+T/G+C为2.6∶1,符合恶性疟原虫结构基因的特点。同源性分析显示该基因在不同虫株间高度保守,我国FCC-1/HN虫株SERA与B1、B2、B3(巴西)株及S16(塞内加尔)株仅一个氨基酸不同,与FCR3(刚比亚)、FCBR(哥伦比亚)、及S14、S15(塞内加尔)等其它虫株SERA基因序列完全一致。抗原表位预测分析显示该多肽N端和C端可能有抗原表位存在。
, 百拇医药
分类号 R382.3
ANALYSIS OF THE SERINE-REPEAT ANTIGEN PARTIAL
GENE SEQUENCE OF A PLASMODIUM FALCIPARUM
STRAIN FROM HAINAN OF CHINA
Xiao Jianhua et al.
(Department of Microbiology, Hengyang Medical College, Hengyang, Hunan 421001)
The serine-repeat antigen gene fragment of Plasmodium falciparum FCC-1/HN from the China was amplified by polymerase chain reaction and cloned into M13 bacteriophage. M13-SERA single strand DNAs of the three positively clones was extracted respectively. Then, the nucleotide sequence of the SERA gene fagment, the gene fragment is 453bp and contains high A+T contents (A+T/G+C for 2.6:1), which accorded with the structure gene composition of Plasmodium falciparum. The homology analysis indicated that there was only one amino acid difference at the SERA 667 site among Plasmodium falciparum FCC-1/HN (from China), B1, B2, 3 and S16 isolates, there was no difference among Plasmodium falciparum PFD-3/YN, FCR3, FCBR, S14 and S15 isolates. The result indicated that the gene fragment is high conservation in the different isolates. The prediction of the antigenic epitope exhibited that the fragment may be carry antigenic epitopes at N terminal and C terminal.
, 百拇医药
Key words: Plasmodium falciparum; Serine-repeat antigen gene; Gene sequence
为了解我国恶性疟原虫株丝氨酸重复抗原(Serine-repeat antigen,SERA)的基因结构和基因序列,本文对海南株(FCC-1/HN) SERA进行了部分基因序列测定及分析。
1 材料和方法
1.1 试剂、 载体及宿主菌
TaqDNA聚合酶及dNTP为SIGMA公司产品;PRISMTM定序试剂盒为ABI公司产品;限制性内切酶及T4DNA连接酶为Boehringer Mannhein公司产品;X-gal、IPTG、蛋白酶K及琼脂糖购自SIGMA公司。M13 RF DNA购自华美生物工程公司;大肠杆菌TG1为复旦大学遗传所国家重点实验室保存菌株。
, 百拇医药
1.2 方法
1.2.1 红内期恶性疟原虫收集 参照Trager-Tensen蜡烛缸法进行连续体外培养[5],待原虫率达70%以上时经0.15%皂素溶解红细胞,收集虫体,液氮保存。
1.2.2 SERA部分基因扩增 采用酚抽提法提取恶性疟原虫海南株(FCC-1/HN)染色体DNA。根据引物设计原则设计了一对特异性引物,其5’端引物引入了EcoRI酶切点,3’端引物引入了SalⅠ酶切点。引物序列如下:SERA-P1(2 638 bp~2 649 bp) 5’-ATGGAATTCTTACAAATTATT-3’,SERA-P2(3 074~3 091 bp) 5’-GGGTCGACTCCCCAATATGGACCCCA-3’。SERA基因片段扩增在100 μl反应体系中进行,每一引物浓度为25 pmol/100 μl,疟原虫基因组DNA约100 ng,dNTP为200 μmol/L。95 ℃变性5 min,加Taq DNA 聚合酶2 μ。PCR循环参数为:94 ℃,30 s→46 ℃,40 s→72 ℃,50 s;扩增5个循环后改为94 ℃,30 s→48 ℃,40 s→72 ℃,50 s,共25个循环,最后一个循环在72 ℃延伸5 min。扩增产物用1.2%琼脂糖凝胶电泳进行鉴定。
, 百拇医药
1.2.3 SERA基因片段的克隆和鉴定 SERA基因片段扩增产物经酚-氯仿,氯仿抽提,乙醇沉淀,1.2%琼脂糖凝胶电泳割胶后,用套管离心法回收。将回收的SERA基因片断用EcoRⅠ+SalⅠ双酶切,并与经相同酶切和回收的M13载体定向连接,连接反应体积为10 μl,含3uT4DNA连接酶,目的基因与载体的摩尔比为5∶1,12 ℃水浴连接过夜。取相当于15 ng载体的连接液转化大肠杆菌TG1感受态,用X-gal/IPTG筛选重组质粒并进行阳性克隆鉴定。PCR鉴定:从半固体培养基上挑选数个无色噬菌斑,分别接入3 ml LB培养基中,加入30 μl 1TG1过夜菌,置37 ℃摇床培养4h扩增重组噬菌体。取0.5 ml菌液离心,菌体用等量ddH2O重悬,置沸水浴10 min,取1 μl做模板进行SERA基因扩增(反应体积为25 μl,Taq DNA聚合酶1 μ,其他条件同前),用1.2%琼脂糖凝胶电泳检测扩增产物,能扩增出SERA基因片段的重组子可初步确定为阳性重组克隆。电泳鉴定:将PCR鉴定的阳性克隆进行噬菌体扩增,碱法抽提重组噬菌体RF DNA,用0.8%琼脂糖凝胶电泳检测,泳动速度略慢于非重组噬菌体M13 RF DNA的为阳性克隆。酶切鉴定:用EcoRⅠ+SalⅠ对泳动速度慢及PCR能扩增出SERA基因片段的M13重组噬菌体的RF DNA进行双酶切,1.2%琼脂糖凝胶电泳检测酶切产物,切到目的片断的重组子为M13-SERA正确重组子。
, 百拇医药
1.2.4 SERA基因片段的序列测定及序列分析 按文献方法[6]制备了3个M13-SERA单链DNA,以M13-SERA单链DNA为模板用Dyeprimer PCR测序试剂盒进行PCR,16%聚丙烯酰胺变性凝胶电泳,ABI公司的373A DNA自动定序仪测序及读序(测序工作在上海复旦大学国家重点实验室遗传所进行)。
应用PCGENE软件对SERA基因片段序列进行了计算机辅助分析,将我国海南株SERA部分基因序列与FCR3(刚比亚)、FCBR(哥伦比亚)、B1、B2、B3(巴西)及S14、S15、S16(塞内加尔)等8个恶性疟原虫虫株的SERA基因相应已知序列进行了同源性比较和分析。
2 结果
2.1 SERA部分基因的扩增
用所设计的引物对我国恶性疟原虫海南株SERA部分基因进行扩增,其扩增的基因片断大小为453bp。
, 百拇医药
2.2 SERA基因片段的克隆和鉴定
正确重组克隆RF DNA为7.65Kb,用PCR方法可扩增出453bp的目的片断,用EcoRⅠ和SalⅠ双酶切可分离到453kb片断,结果见附图。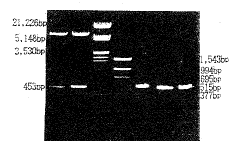
附图 PCR法及酶切法鉴定M13-SERA重组噬菌体
1~2:M13-SERA重组噬菌体EcoRⅠ+SalⅠ双酶切产物;
3:λ DNA/EcoRⅠ+HindⅢ markers;4:PCR markers;
5~6:重组噬菌体PCR扩增产物;7:SERA基历片段
2.3 SERA基因片段的DNA序列测定及分析
, 百拇医药
对所扩增的海南株(FCC-1/HN) SERA基因片段进行了基因序列的测定。该基因片段长度为453bp,A+T/G+C为2.6∶1,符合恶性疟原虫结构基因的特点,该基因编码151个氨基酸,其中天冬酰胺、甘氨酸、谷氨酸、赖氨酸、酪氨酸及丙氨酸含量稍高,内无重复序列。利用PCGENE软件进行多肽结构分析,显示其分子内部具有β-转角、β-折叠和α-螺旋等二级结构,且带电荷的极性氨基酸含量较高。同源性分析显示我国恶性疟原虫海南株(FCC-1/HN) SERA部分基因与已知的恶性疟原虫FCR3(刚比亚)、FCBR(哥伦比亚)、及S14、S15(塞内加尔)等虫株SERA相应基因序列完全一致;与B1、B2、B3(巴西)株及S16(塞内加尔)等虫株比仅667位氯基酸不同,我国虫株为Met(蛋氨酸),其它虫株为Val(缬氨酸),这是由于2 752位核苷酸由A突变为G导致蛋氨酸密码子ATG突变为缬氨酸密码子GTG。
通过PCGENE软件对SERA序列中抗原表位进行多参数综合分析,结果显示该序列内有3个高的亲水性峰,位于64~67、135~138及31~34位氨基酸区域。有数个易曲性峰,高峰区域在67位氨基酸之前及131位氨基酸之后,提示这些区域可能有抗原表位存在。
, 百拇医药
3 讨论
SERA主要位于滋养体和裂殖体的纳虫空泡膜,具体功能还不清楚,可能与棒状复合蛋白结合宿主红细胞膜参与裂殖子入侵红细胞过程相关,已证实抗原在疟疾疫苗研制和疟疾诊断应用中有一定价值。我们仅对该基因第2 368~3 091 bp序列进行了序列测定,该基因片段为453 bp,编码第631~782位氨基酸,其中天冬酰胺、甘氨酸含量较高,内无重复序列。我国海南株SERA 453bp基因序列与FCR3(刚比亚)、FCBR(哥伦比亚)、及S14、S15(塞内加尔)等虫株SERA基因序列完全一致;与B1、B2、B3(巴西)株及S16(塞内加尔)等虫株仅2752位核苷酸不同。我国虫株2 752位核苷酸为A,其它虫株为G,该核苷酸变异导致了667位氨基酸差异,我国虫株667位氨基酸为蛋氨酸(ATG),其它虫株为缬氨酸(GTG)。该基因在虫株间差异甚微,说明了该基因片段高度保守[7]。
根据该区域基因序列,我们通过PCGENE软件对其序列中抗原表位进行多参数综合分析,结果显示该序列内有3个高的亲水性峰,位于64~67、135~138及31~34位氨基酸区域,有数个易曲性峰,但也主要分布在两端,即67位氨基酸之前和131位氨基酸之后。这一预测结果与Roussilhon等人(1990)[8]实验结果相符。Roussilhon等人采用淋巴细胞增殖反应对SERA两个区域(631~684和631~892位氨基酸)的重组多肽进行检测,发现两种多肽均能特异性刺激T淋巴细胞增殖,其中631~684位氨基酸相当于我们所分析的SERA 1~53位氨基酸区域。提示该区域可能含T细胞表位,具体定位还需进一步做精细抗原表位分析。Enders等人(1992)[9]将该区域基因片段(2 641~3 045 bp即631~765位氨基酸)和HRPⅡ及MSA1基因片段进行连接,构建成杂合基因,将该杂合基因重组于表达载体,并在大肠杆菌中表达,表达的杂合多肽能诱导夜猴产生特异性抗疟保护性作用。Ragge等人(1990)[10]还发现SERA翻译后可通过寄生细胞内质网输送出来,成为血中循环抗原,故利用抗SERA抗体或单抗检测SERA,可以进行疟疾感染的诊断。Cruz等人(1992年)[4]用抗SERA单克隆抗体对间日疟和恶性疟病人血清进行免疫学检测,结果显示两种疟原虫混合感染者阳性率100%,检出的最低原虫密度为0.003%。这一结果表明SERA作为疟疾诊断的侯选抗原具有良好的前景。
, http://www.100md.com
参 考 文 献
1,Delplace P,Bhatia A,Cagnard M,et al.Protein p126:a parasitophorous vacuole antigen associated with the release of Plasmodium falciparum merozoites.Biol Cell,1998;64:215~221
2,Li Wubo,David JB,Toshihiro H,et al.Structure and expression of the Plasmodium falciparum SERA gene.Mol Biochem Parasitol,1989,33:13~26
3,Inselburg J,Bathurst IC,Kansopon J,et al.Protective immunity induced in Aotus monkeys by a recombinant SERA protein of Plasmodium falciparum:adjuvant effect on induction of protective immunity.Infect Immum,1993,61(5):2041~7
, 百拇医药
4,de la Cruz VE,Lal AF and McCutchan TF.Development of an immunoenzymatic assay using a monoclonal antibody against a 50KDa catabolite from the p126 Plasmodium falciparum protein to the diagnosis of malaria infection.Mem Inst Oswaldo Cruz,1992,87(3):187~92
5,Trager W and Jensen JB.Human malaria parasites in continuous culture.Science,1976,193:673~75
6,J.萨姆布鲁克,E.F.弗里奇,T.曼尼阿蒂斯.分子克隆实验指南.第2版.北京:科学出版社,1992:217~220
, 百拇医药
7,Knapp B,Nau U,Hundt E.Conservation of antigen components from two recombinant hybrid proteins protective against malaria.Infect Immun,1993;61(3):992~7
8,Roussilhon C,Hundt E,Agrapar M,et al.Responses of T cells from sensitized donors to recombinant and synthetic petides corresponding to sequences of the Plasmoduim falciparum SERP antigen.Immunol Lett,1990;25(1~3):149~53
9,Enders B,Hundt E,Knapp B.Protection of Aotus monkeys after immunization with recombinant antigens of Plasmdium falciparum.Mem Inst Oswaldo Cruz,1992;87(Suppl 3):413~22
10 Ragge K,Baruch DI,Aikawa W,et al.In vitro biosynthesis and membrane translocation of the serine rich protein of Plasmodium falciparum.Mol Biochem Parasitol,1990;42(1):93~100
收稿199910-12, http://www.100md.com
单位:肖建华(衡阳医学院微生物学教研室 衡阳 421001);李明 毕惠祥 王萍 李英杰(第一军医大学热带病研究所 广州 510515)
关键词:恶性疟原虫;丝氨酸重复抗原;基因序列
中国现代医学杂志000411 该文采用PCR方法特异性扩增恶性疟原虫海南株(FCC-1/HN) SERA基因片段,并将该基因片克隆于M13噬菌体,用双脱氧链末端终止法进行测序,应用PCGENE软件对该基因序列进行了分析,结果显示该基因片段长度为453 bp,A+T/G+C为2.6∶1,符合恶性疟原虫结构基因的特点。同源性分析显示该基因在不同虫株间高度保守,我国FCC-1/HN虫株SERA与B1、B2、B3(巴西)株及S16(塞内加尔)株仅一个氨基酸不同,与FCR3(刚比亚)、FCBR(哥伦比亚)、及S14、S15(塞内加尔)等其它虫株SERA基因序列完全一致。抗原表位预测分析显示该多肽N端和C端可能有抗原表位存在。
, 百拇医药
分类号 R382.3
ANALYSIS OF THE SERINE-REPEAT ANTIGEN PARTIAL
GENE SEQUENCE OF A PLASMODIUM FALCIPARUM
STRAIN FROM HAINAN OF CHINA
Xiao Jianhua et al.
(Department of Microbiology, Hengyang Medical College, Hengyang, Hunan 421001)
The serine-repeat antigen gene fragment of Plasmodium falciparum FCC-1/HN from the China was amplified by polymerase chain reaction and cloned into M13 bacteriophage. M13-SERA single strand DNAs of the three positively clones was extracted respectively. Then, the nucleotide sequence of the SERA gene fagment, the gene fragment is 453bp and contains high A+T contents (A+T/G+C for 2.6:1), which accorded with the structure gene composition of Plasmodium falciparum. The homology analysis indicated that there was only one amino acid difference at the SERA 667 site among Plasmodium falciparum FCC-1/HN (from China), B1, B2, 3 and S16 isolates, there was no difference among Plasmodium falciparum PFD-3/YN, FCR3, FCBR, S14 and S15 isolates. The result indicated that the gene fragment is high conservation in the different isolates. The prediction of the antigenic epitope exhibited that the fragment may be carry antigenic epitopes at N terminal and C terminal.
, 百拇医药
Key words: Plasmodium falciparum; Serine-repeat antigen gene; Gene sequence
为了解我国恶性疟原虫株丝氨酸重复抗原(Serine-repeat antigen,SERA)的基因结构和基因序列,本文对海南株(FCC-1/HN) SERA进行了部分基因序列测定及分析。
1 材料和方法
1.1 试剂、 载体及宿主菌
TaqDNA聚合酶及dNTP为SIGMA公司产品;PRISMTM定序试剂盒为ABI公司产品;限制性内切酶及T4DNA连接酶为Boehringer Mannhein公司产品;X-gal、IPTG、蛋白酶K及琼脂糖购自SIGMA公司。M13 RF DNA购自华美生物工程公司;大肠杆菌TG1为复旦大学遗传所国家重点实验室保存菌株。
, 百拇医药
1.2 方法
1.2.1 红内期恶性疟原虫收集 参照Trager-Tensen蜡烛缸法进行连续体外培养[5],待原虫率达70%以上时经0.15%皂素溶解红细胞,收集虫体,液氮保存。
1.2.2 SERA部分基因扩增 采用酚抽提法提取恶性疟原虫海南株(FCC-1/HN)染色体DNA。根据引物设计原则设计了一对特异性引物,其5’端引物引入了EcoRI酶切点,3’端引物引入了SalⅠ酶切点。引物序列如下:SERA-P1(2 638 bp~2 649 bp) 5’-ATGGAATTCTTACAAATTATT-3’,SERA-P2(3 074~3 091 bp) 5’-GGGTCGACTCCCCAATATGGACCCCA-3’。SERA基因片段扩增在100 μl反应体系中进行,每一引物浓度为25 pmol/100 μl,疟原虫基因组DNA约100 ng,dNTP为200 μmol/L。95 ℃变性5 min,加Taq DNA 聚合酶2 μ。PCR循环参数为:94 ℃,30 s→46 ℃,40 s→72 ℃,50 s;扩增5个循环后改为94 ℃,30 s→48 ℃,40 s→72 ℃,50 s,共25个循环,最后一个循环在72 ℃延伸5 min。扩增产物用1.2%琼脂糖凝胶电泳进行鉴定。
, 百拇医药
1.2.3 SERA基因片段的克隆和鉴定 SERA基因片段扩增产物经酚-氯仿,氯仿抽提,乙醇沉淀,1.2%琼脂糖凝胶电泳割胶后,用套管离心法回收。将回收的SERA基因片断用EcoRⅠ+SalⅠ双酶切,并与经相同酶切和回收的M13载体定向连接,连接反应体积为10 μl,含3uT4DNA连接酶,目的基因与载体的摩尔比为5∶1,12 ℃水浴连接过夜。取相当于15 ng载体的连接液转化大肠杆菌TG1感受态,用X-gal/IPTG筛选重组质粒并进行阳性克隆鉴定。PCR鉴定:从半固体培养基上挑选数个无色噬菌斑,分别接入3 ml LB培养基中,加入30 μl 1TG1过夜菌,置37 ℃摇床培养4h扩增重组噬菌体。取0.5 ml菌液离心,菌体用等量ddH2O重悬,置沸水浴10 min,取1 μl做模板进行SERA基因扩增(反应体积为25 μl,Taq DNA聚合酶1 μ,其他条件同前),用1.2%琼脂糖凝胶电泳检测扩增产物,能扩增出SERA基因片段的重组子可初步确定为阳性重组克隆。电泳鉴定:将PCR鉴定的阳性克隆进行噬菌体扩增,碱法抽提重组噬菌体RF DNA,用0.8%琼脂糖凝胶电泳检测,泳动速度略慢于非重组噬菌体M13 RF DNA的为阳性克隆。酶切鉴定:用EcoRⅠ+SalⅠ对泳动速度慢及PCR能扩增出SERA基因片段的M13重组噬菌体的RF DNA进行双酶切,1.2%琼脂糖凝胶电泳检测酶切产物,切到目的片断的重组子为M13-SERA正确重组子。
, 百拇医药
1.2.4 SERA基因片段的序列测定及序列分析 按文献方法[6]制备了3个M13-SERA单链DNA,以M13-SERA单链DNA为模板用Dyeprimer PCR测序试剂盒进行PCR,16%聚丙烯酰胺变性凝胶电泳,ABI公司的373A DNA自动定序仪测序及读序(测序工作在上海复旦大学国家重点实验室遗传所进行)。
应用PCGENE软件对SERA基因片段序列进行了计算机辅助分析,将我国海南株SERA部分基因序列与FCR3(刚比亚)、FCBR(哥伦比亚)、B1、B2、B3(巴西)及S14、S15、S16(塞内加尔)等8个恶性疟原虫虫株的SERA基因相应已知序列进行了同源性比较和分析。
2 结果
2.1 SERA部分基因的扩增
用所设计的引物对我国恶性疟原虫海南株SERA部分基因进行扩增,其扩增的基因片断大小为453bp。
, 百拇医药
2.2 SERA基因片段的克隆和鉴定
正确重组克隆RF DNA为7.65Kb,用PCR方法可扩增出453bp的目的片断,用EcoRⅠ和SalⅠ双酶切可分离到453kb片断,结果见附图。

附图 PCR法及酶切法鉴定M13-SERA重组噬菌体
1~2:M13-SERA重组噬菌体EcoRⅠ+SalⅠ双酶切产物;
3:λ DNA/EcoRⅠ+HindⅢ markers;4:PCR markers;
5~6:重组噬菌体PCR扩增产物;7:SERA基历片段
2.3 SERA基因片段的DNA序列测定及分析
, 百拇医药
对所扩增的海南株(FCC-1/HN) SERA基因片段进行了基因序列的测定。该基因片段长度为453bp,A+T/G+C为2.6∶1,符合恶性疟原虫结构基因的特点,该基因编码151个氨基酸,其中天冬酰胺、甘氨酸、谷氨酸、赖氨酸、酪氨酸及丙氨酸含量稍高,内无重复序列。利用PCGENE软件进行多肽结构分析,显示其分子内部具有β-转角、β-折叠和α-螺旋等二级结构,且带电荷的极性氨基酸含量较高。同源性分析显示我国恶性疟原虫海南株(FCC-1/HN) SERA部分基因与已知的恶性疟原虫FCR3(刚比亚)、FCBR(哥伦比亚)、及S14、S15(塞内加尔)等虫株SERA相应基因序列完全一致;与B1、B2、B3(巴西)株及S16(塞内加尔)等虫株比仅667位氯基酸不同,我国虫株为Met(蛋氨酸),其它虫株为Val(缬氨酸),这是由于2 752位核苷酸由A突变为G导致蛋氨酸密码子ATG突变为缬氨酸密码子GTG。
通过PCGENE软件对SERA序列中抗原表位进行多参数综合分析,结果显示该序列内有3个高的亲水性峰,位于64~67、135~138及31~34位氨基酸区域。有数个易曲性峰,高峰区域在67位氨基酸之前及131位氨基酸之后,提示这些区域可能有抗原表位存在。
, 百拇医药
3 讨论
SERA主要位于滋养体和裂殖体的纳虫空泡膜,具体功能还不清楚,可能与棒状复合蛋白结合宿主红细胞膜参与裂殖子入侵红细胞过程相关,已证实抗原在疟疾疫苗研制和疟疾诊断应用中有一定价值。我们仅对该基因第2 368~3 091 bp序列进行了序列测定,该基因片段为453 bp,编码第631~782位氨基酸,其中天冬酰胺、甘氨酸含量较高,内无重复序列。我国海南株SERA 453bp基因序列与FCR3(刚比亚)、FCBR(哥伦比亚)、及S14、S15(塞内加尔)等虫株SERA基因序列完全一致;与B1、B2、B3(巴西)株及S16(塞内加尔)等虫株仅2752位核苷酸不同。我国虫株2 752位核苷酸为A,其它虫株为G,该核苷酸变异导致了667位氨基酸差异,我国虫株667位氨基酸为蛋氨酸(ATG),其它虫株为缬氨酸(GTG)。该基因在虫株间差异甚微,说明了该基因片段高度保守[7]。
根据该区域基因序列,我们通过PCGENE软件对其序列中抗原表位进行多参数综合分析,结果显示该序列内有3个高的亲水性峰,位于64~67、135~138及31~34位氨基酸区域,有数个易曲性峰,但也主要分布在两端,即67位氨基酸之前和131位氨基酸之后。这一预测结果与Roussilhon等人(1990)[8]实验结果相符。Roussilhon等人采用淋巴细胞增殖反应对SERA两个区域(631~684和631~892位氨基酸)的重组多肽进行检测,发现两种多肽均能特异性刺激T淋巴细胞增殖,其中631~684位氨基酸相当于我们所分析的SERA 1~53位氨基酸区域。提示该区域可能含T细胞表位,具体定位还需进一步做精细抗原表位分析。Enders等人(1992)[9]将该区域基因片段(2 641~3 045 bp即631~765位氨基酸)和HRPⅡ及MSA1基因片段进行连接,构建成杂合基因,将该杂合基因重组于表达载体,并在大肠杆菌中表达,表达的杂合多肽能诱导夜猴产生特异性抗疟保护性作用。Ragge等人(1990)[10]还发现SERA翻译后可通过寄生细胞内质网输送出来,成为血中循环抗原,故利用抗SERA抗体或单抗检测SERA,可以进行疟疾感染的诊断。Cruz等人(1992年)[4]用抗SERA单克隆抗体对间日疟和恶性疟病人血清进行免疫学检测,结果显示两种疟原虫混合感染者阳性率100%,检出的最低原虫密度为0.003%。这一结果表明SERA作为疟疾诊断的侯选抗原具有良好的前景。
, http://www.100md.com
参 考 文 献
1,Delplace P,Bhatia A,Cagnard M,et al.Protein p126:a parasitophorous vacuole antigen associated with the release of Plasmodium falciparum merozoites.Biol Cell,1998;64:215~221
2,Li Wubo,David JB,Toshihiro H,et al.Structure and expression of the Plasmodium falciparum SERA gene.Mol Biochem Parasitol,1989,33:13~26
3,Inselburg J,Bathurst IC,Kansopon J,et al.Protective immunity induced in Aotus monkeys by a recombinant SERA protein of Plasmodium falciparum:adjuvant effect on induction of protective immunity.Infect Immum,1993,61(5):2041~7
, 百拇医药
4,de la Cruz VE,Lal AF and McCutchan TF.Development of an immunoenzymatic assay using a monoclonal antibody against a 50KDa catabolite from the p126 Plasmodium falciparum protein to the diagnosis of malaria infection.Mem Inst Oswaldo Cruz,1992,87(3):187~92
5,Trager W and Jensen JB.Human malaria parasites in continuous culture.Science,1976,193:673~75
6,J.萨姆布鲁克,E.F.弗里奇,T.曼尼阿蒂斯.分子克隆实验指南.第2版.北京:科学出版社,1992:217~220
, 百拇医药
7,Knapp B,Nau U,Hundt E.Conservation of antigen components from two recombinant hybrid proteins protective against malaria.Infect Immun,1993;61(3):992~7
8,Roussilhon C,Hundt E,Agrapar M,et al.Responses of T cells from sensitized donors to recombinant and synthetic petides corresponding to sequences of the Plasmoduim falciparum SERP antigen.Immunol Lett,1990;25(1~3):149~53
9,Enders B,Hundt E,Knapp B.Protection of Aotus monkeys after immunization with recombinant antigens of Plasmdium falciparum.Mem Inst Oswaldo Cruz,1992;87(Suppl 3):413~22
10 Ragge K,Baruch DI,Aikawa W,et al.In vitro biosynthesis and membrane translocation of the serine rich protein of Plasmodium falciparum.Mol Biochem Parasitol,1990;42(1):93~100
收稿199910-12, http://www.100md.com