尿嘧啶DNA糖苷酶防止PCR产物污染及其对核酸杂交的影响
作者:王省良 周东耀 王丽之 万成松 曾位森 彭华国 王虹
单位:王省良(第一军医大学 生物医学诊断研究心, 广东 广州 510515);周东耀(珠江医院检验科,广东 广州 510282);王丽之(珠江医院检验科,广东 广州 510282);万成松(第一军医大学 生物医学诊断研究心, 广东 广州 510515);曾位森(第一军医大学 生物医学诊断研究心, 广东 广州 510515);彭华国(第一军医大学 生物医学诊断研究心, 广东 广州 510515);王虹(第一军医大学 生物医学诊断研究心, 广东 广州 510515)
关键词:尿嘧啶;脱氧核糖核酸酶类;糖苷水解酶类;聚合酶链反应;抗污染;核酸杂交
第一军医大学学报000405 摘要:目的 采用PCR微板核酸杂交ELISA技术分析尿嘧啶DNA糖苷酶(UNG/UDG)防止PCR产物污染及其对PCR扩增效率的影响,探讨在不同A/T含量的微生物中含尿嘧啶的PCR产物对核酸杂交的影响。方法 以3组dUTP含量不同的PCR产物作模板,抗污染组用UNG处理,直接进行再次扩增。用微板核酸杂交ELISA检测第二次PCR扩增的结果。 结果 抗污染组中以含dUTP的PCR产物作模板,结果为阴性;而以不含dUTP的PCR产物作模板,结果为阳性。非抗污染组全部为阳性。对3组PCR产物再进行核酸杂交无明显差别,且在一定温度内,3组具有同样的稳定性。 结论 UNG能有效降解含dUTP的PCR产物,使之不能作为模板再次扩增,可以有效地防止PCR产物的污染。含有尿嘧啶的PCR产物对寡核苷酸探针的杂交无影响。
, 百拇医药
中图分类号:R342.5; R349.1; R914.4 文献标识码:A 文章编号:1000-2588(2000)04-0319-03
Prevention of contamination in PCR products by using uracil-DNA-glycosylase before amplification and its influence on nucleic acid hybridization
WANG Sheng-liang,WAN Cheng-song, ZENG Wei-sen, PENG Hua-guo, WANG Hong
(Institute of Molecular Biological Diagnosis, Frist Military Medical University, Guangzhou 510515, China)
, 百拇医药
ZHOU Dong-yao, WANG Li-zhi
(Department of Clinical Laboratory, Zhujiang Hospital, Frist Military Medical University, Guangzhou 510282, China)Abstract: Objectve To investigate the efficacy of uracil-DNA-glycosylase(UNG) in preventing contamination in the PCR products before amplication procedure and explore its effect on the amplification efficiency. Methods HBV core-region DNA was amplified from HBV genomic plasmid using PCR with or without dUTP. The amplified products were used as the templates for secondary amplification. In anticontamination group, UNG was used to lyse the initially amplified products before secondary amplication in each reaction tube. In contrast, UNG was not used in not-antitamination group. The results of amplification were detected by sandwich micro-well hybridization ELISA technique. Results The templates containing dUTP were not amplified after UNG treatment(negative). In contrast, the templates without dUTP could be amplified(positive). All templates were amplified in not-antitamination group(positive). Conclusion UNG could prevent PCR products contamination effectively, and its effect on amplification efficiency is not visible.
, 百拇医药
Key words: uracil;deoxyribonucleases;glycoside hydrolases;PCR; anti-contamination; nucleic acid hybridization
有多种方法,如引物3’端黄嘌呤修饰法、补骨脂素结合法等[1、2],可防止PCR产物污染。这些方法都是在PCR反应后对产物进行处理,称为“后PCR法”。但补骨脂素结合法其PCR产物不能用于杂交引物,3'端黄嘌呤修饰法对引物的特异性有一定影响。尿嘧啶DNA糖苷酶(uracil-DNA-glycosylase, UNG/UDG)是近年来用于防止PCR污染的新试剂,称为“前PCR法”[3、4]。UNG通过打断核酸链上dUTP的糖苷键,使含dUTP的核酸不能作为模板被扩增。因此使用dUTP扩增DNA,UNG就能在PCR反应前降解污染的PCR产物。UNG和dUTP的加入是否会对PCR扩增效率产生影响,UNG抗污染的效率又如何,掺入尿嘧啶的PCR产物是否影响与核酸探针的杂交?相关报道[5、6]的结果并不一致。我们试图解决这些问题。
, 百拇医药
1 材料与方法
1.1 试剂和仪器
Taq酶、TMB、辣根过氧化物酶(HRP)标记的链亲和素购自宝灵曼公司。dUTP购自发玛西亚公司。HBV微板核酸杂交ELISA试剂盒由本中心自行研制。550型酶标仪和热循环仪均为Bio-Rad公司产品。
1.2 质粒与标本
乙型肝炎病毒(HBV)标准品系我中心自行克隆的HBV全基因,用微量分光光度计测定质粒DNA浓度为100 μg/ml,并采用极限稀释法将质粒稀释为1 pg/ml和10 fg/ml。10例乙型肝炎患者血清采自佛山市第一人民医院,并经普通PCR方法证实HBV DNA阳性。解脲支原体(UU)菌株及结核杆菌(TB)菌株由中国生物制品检定所提供,其菌液浓度为103/ml。
1.3 杂交液主要配方
, http://www.100md.com
20×SSC、硫酸葡聚糖、去离子甲酰胺、PEG6000、SDS等;洗液:1×SSC;封闭剂:1% Ficoll 400、1% PVP(聚乙烯吡咯烷酮)、1% BSA、HS-DNA、脱脂奶粉、甘氨酸。以上溶液均由本中心自制。
1.4 引物与探针
HBV引物设计位于C基因,解脲支原体位于脲素酶基因,结核杆菌位于IS6110基因。用Primer软件分别设计上述引物及探针,由上海生工公司合成。包被探针在5'磷酸化,并用碳酸盐缓冲液(pH9.6)在微孔板上包被14 h[1]。
1.5 核酸的提取
本中心自制的处理液50 μl(主要成分为十二烷基肌氨酸钠)置于0.5 ml离心管内,加待测血清50 μl或菌液、100 ℃煮沸15 min,12 000 r/min离心5 min,上清液作为扩增模板。
, 百拇医药
1.6 分组扩增HBV C基因、解脲支原体及结核杆菌基因序列
HBV标准品两个浓度及10例乙型肝炎病人的阳性血清共12份阳性模板,解脲支原体及结核杆菌分别为1份阳性模板,分3组进行基因扩增。dTTP组:加dATP、dGTP、dCTP、dTTP,不加dUTP;dUTP/dTTP组:加dATP、dGTP、dCTP、dTTP/dUTP各一半;dUTP组:加dATP、dGTP、dCTP、dUTP,不加dTTP。3组中除dNTP不同外,其他成分均相同。循环条件:94oC预变性2 min,94 ℃50 s、55 ℃50 s、72 ℃60 s,35个循环,72 ℃延伸3 min。扩增产物用微板核酸杂交方法检测。
1.7 UNG抗污染试验
上述每组扩增产物分抗污染组和非抗污染组进行。非抗污染组中每管加上述各组扩增产物1μl,其余为dUTP/dTTP组PCR反应液组分。抗污染组除具有非抗污染组所有组分外,每管另加UNG 0.5 U。同时设阴性对照,混匀,37 ℃水浴10 min后94 ℃6 min,然后按常规方法上机扩增,循环条件同前。
, 百拇医药
1.8 特异性杂交试验
将HBV包被探针及显色探针在50 ℃分别与解脲支原体、结核杆菌3组第1次PCR扩增产物杂交。解脲支原体包被探针与显色探针分别与HBV质粒扩增产物、结核杆菌3组扩增产物在50 ℃杂交。结核杆菌包被探针与显色探针分别与HBV质粒扩增产物、解脲支原体3组扩增产物在50 ℃杂交。
1.9 3种PCR引物扩增特异性试验
用HBV引物分别扩增UU及TB菌株,用UU引物扩增HBV质粒血清标本及TB菌株,用TB引物扩增HBV质粒血清标本及UU菌株。
1.10 3种杂交温度试验
从dTTP、dTTP/dUTP、dUTP3组扩增产物每份中取20 μl分别加入已包被捕捉探针的微孔板内,再加显色探针10 μl、杂交液100 μl,并选取45 ℃、50 ℃、55 ℃3种杂交温度杂交1 h。用杂交洗液洗去非特异性杂交,HRP标记的链亲和素酶联显色8 min,加2 mmol/L硫酸溶液2滴终止反应。
, 百拇医药
1.11结果判断
PCR扩增及杂交的结果在Bio-Rad 550型酶标仪上测定450 nm处的吸光度[D(λ)值]。P/N值≥2.1为DNA阳性,P/N值<2.1为DNA阴性(阴性对照A值<0.05,按0.05计算;P/N比值=标本A值/阴性对照A值)。
1.12 统计学分析
结果以均数±标准差(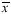 ±s)表示,并用卡方检验进行统计学分析。
±s)表示,并用卡方检验进行统计学分析。
2 结果
2.1 UNG抗污染实验结果
第1次PCR扩增HBV质粒与血清、解脲支原体及结核杆菌菌株共14份3组全部为阳性,第2次PCR扩增结果见表1。
, http://www.100md.com
表1 HBV、UU、TB 3组产物第2次PCR扩增结果(n=14)
Tab.1 The secondary PCR results of HBV、UU、TB products
(n=14)
Group
Anticontamination(UNG+)
Not- Anticontamination(UNG-)
dTTP
14
14
, http://www.100md.com dUTP/dTTP
0
14
dUTP
0
14
2.2 HBV、UU、TB第1次PCR产物杂交实验结果
2.2.1 HBV 3种不同的PCR产物在三种不同温度条件下杂交结果 在同一温度,含T或含U的产物与寡核苷酸探针杂交的稳定性无明显差异。而在不同温度下由U部分或全部取代T则对寡核苷酸探针的杂交无显著影响(表2)。
表2 HBV第1次PCR产物3种不同杂交温度D(λ)值(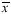 ±s)
±s)
, 百拇医药
Tab.2 D(? )values at 3 different hybridization temperatures of the
initial PCR products or HBV(Mean±SD)
Group
45 ℃
50 ℃
55 ℃
DTTP
0.548±0.097
0.552±0.110
0.553±0.106
, 百拇医药
dUTP/dTTP
0.530±0.099
0.537±0.096
0.539±0.098
dUTP
0.534±0.087
0.542±0.091
0.537±0.097
2.2.2 解脲支原体及结核杆菌3种不同PCR产物在3种不同温度下杂交结果 见表3。
表3 UU、TB第一次PCR产物三种不同杂交温度D(λ)值(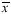 ±s)
±s)
, 百拇医药
Tab.3 D(? )values at 3 different hybridization temperatures
of the initial PCR products of UU and TB(Mean±SD)
Group
UU
TB
45 ℃
50 ℃
55 ℃
45 ℃
50 ℃
55 ℃
, 百拇医药
dTTP
0.540±0.102
0.537±0.097
0.535±0.104
0.535±0.099
0.538±0.109
0.543±0.108
dUTP/dTTP
0.538±0.098
0.541±0.105
0.539±0.098
, http://www.100md.com
0.540±0.097
0.536±0.102
0.539±0.102
dUTP
0.536±0.095
0.538±0.097
0.540±0.104
0.534±0.103
0.539±0.097
0.541±0.104
2.3 特异性杂交试验结果
, http://www.100md.com
3种特异性探针分别与其它两种3组扩增产物50℃杂交结果全部为阴性。
2.4 3种引物扩增特异性结果
HBV、UU、TB各自引物均不能扩增其它两种核酸模板。
3 讨论
dTTP组常规加dTTP,未加dUTP,抗污染组和非抗污染组均为阳性,扩增效率几乎相同,说明UNG不能降解含dTTP的PCR扩增的DNA,dUTP和UNG对PCR的扩增效率几乎没有影响。dTTP/dUTP、dUTP组均加了dUTP,抗污染组为阴性,非抗污染组为阳性,说明UNG能选择性地降解含dUTP的PCR产物。虽然dTTP/dUTP组中dUTP、dTTP各占一半,但只要每条PCR扩增的DNA链中有数个dUTP掺入,就能被UNG识别并降解。提示在抗污染PCR实际操作中,只需在常规dNTP(dATP、dGTP、dCTP、dTTP)混合物中加入适量dUTP就能达到抗污染的效果。dTTP组中抗污染组与非抗污染组皆为阳性,D(λ)值相近,进一步说明UNG对PCR扩增效率没有明显影响,与Ritzler[7]的结果一致。
, 百拇医药
本实验通过杂交温度高低的变化证实互补核酸链中U取代T对核酸杂交没有明显影响,而且对不同A/T含量的病原微生物,由U取代T后对核酸杂交的稳定性也无明显影响。
综上所述,本实验结果不支持以下两种推论:(1)在核酸链中掺入dUTP,可能影响核酸链的Tm值,进而影响PCR扩增的特异性。(2)扩增产物中A/T含量的高低会影响杂交的特异性。HBV C基因A/T含量大约为50%,解脲支原体脲素基因A/T含量为73%,而结核杆菌IS6110基因的A/T含量为38%。这3种微生物的A/T含量尽管差别较大,但在3组PCR产物杂交实验中均无非特异性杂交的结果。总之,本实验证明UNG结合dUTP能有效防止PCR产物的污染;对PCR扩增效率没有影响;含“U”的PCR产物对A/T含量差别较大的微生物核酸探针杂交的稳定性没有影响。因此,本方法不但能抗PCR产物污染,而且能对扩增产物进行杂交鉴定,为PCR微板核酸杂交ELISA技术在临床常规工作中的应用提供了理论依据。
作者简介:王省良(1961-),男,内蒙古包头人,1982年毕业于解放军农牧大学,硕士,副教授,电话:85148162
, 百拇医药
参考文献:
1,Cimion GD, Metchette KC, Tessmon JW, et al. Post-PCR sterilization a method to control carry-over contamination for the polymerase chain reaction[J]. Nucl Acids Res, 1990, 19(1):99-107.
2,Rys PN, Persing DH. Prevention false positives: quantitative evaluation of three protocols for inactivation of polymerase chain reaction amplification products[J]. J Clin Microbiol, 1993, 31(9):2356-60.
, http://www.100md.com 3,Uday K, Epstein JS, Hewlett IK. A novel method employing UNG to avoid carry-over contamination in RNA-PCR[J]. Nucl Acids Res, 1993, 21(16):3917-18.
4,King JA, Ball JK. Detection of HIV-1 by digoxigenin-labelled PCR and microtitre plate solution hybridisation assay and prevention of PCR carry-over by uracil-N-glycosylate[J]. J Virol Methods, 1993, 44(1): 67-76.
5,Longo MC, Berninger MS, Hartley JL. Use of uracil DNA glycosylase to control carry-over contamination in polymerase chain reactions[J]. Gene, 1990, 93(1):125-8.
, 百拇医药
6,Carmody Mw, Vary CP. Inhibition of DNA hybridization following partial dUTP substitution[J]. Biotechniques, 1993, 15(4): 692-9.
7,Ritzler M, Perschil I, Altwegg M. Infleuence of residual uracil-DNA glycosylase activity on the electrophorectic migration of dUTP-contaning PCR products[J]. J Microbiol Methods, 1999, 35(1):73-6.
收稿日期:1999-12-25, http://www.100md.com
单位:王省良(第一军医大学 生物医学诊断研究心, 广东 广州 510515);周东耀(珠江医院检验科,广东 广州 510282);王丽之(珠江医院检验科,广东 广州 510282);万成松(第一军医大学 生物医学诊断研究心, 广东 广州 510515);曾位森(第一军医大学 生物医学诊断研究心, 广东 广州 510515);彭华国(第一军医大学 生物医学诊断研究心, 广东 广州 510515);王虹(第一军医大学 生物医学诊断研究心, 广东 广州 510515)
关键词:尿嘧啶;脱氧核糖核酸酶类;糖苷水解酶类;聚合酶链反应;抗污染;核酸杂交
第一军医大学学报000405 摘要:目的 采用PCR微板核酸杂交ELISA技术分析尿嘧啶DNA糖苷酶(UNG/UDG)防止PCR产物污染及其对PCR扩增效率的影响,探讨在不同A/T含量的微生物中含尿嘧啶的PCR产物对核酸杂交的影响。方法 以3组dUTP含量不同的PCR产物作模板,抗污染组用UNG处理,直接进行再次扩增。用微板核酸杂交ELISA检测第二次PCR扩增的结果。 结果 抗污染组中以含dUTP的PCR产物作模板,结果为阴性;而以不含dUTP的PCR产物作模板,结果为阳性。非抗污染组全部为阳性。对3组PCR产物再进行核酸杂交无明显差别,且在一定温度内,3组具有同样的稳定性。 结论 UNG能有效降解含dUTP的PCR产物,使之不能作为模板再次扩增,可以有效地防止PCR产物的污染。含有尿嘧啶的PCR产物对寡核苷酸探针的杂交无影响。
, 百拇医药
中图分类号:R342.5; R349.1; R914.4 文献标识码:A 文章编号:1000-2588(2000)04-0319-03
Prevention of contamination in PCR products by using uracil-DNA-glycosylase before amplification and its influence on nucleic acid hybridization
WANG Sheng-liang,WAN Cheng-song, ZENG Wei-sen, PENG Hua-guo, WANG Hong
(Institute of Molecular Biological Diagnosis, Frist Military Medical University, Guangzhou 510515, China)
, 百拇医药
ZHOU Dong-yao, WANG Li-zhi
(Department of Clinical Laboratory, Zhujiang Hospital, Frist Military Medical University, Guangzhou 510282, China)Abstract: Objectve To investigate the efficacy of uracil-DNA-glycosylase(UNG) in preventing contamination in the PCR products before amplication procedure and explore its effect on the amplification efficiency. Methods HBV core-region DNA was amplified from HBV genomic plasmid using PCR with or without dUTP. The amplified products were used as the templates for secondary amplification. In anticontamination group, UNG was used to lyse the initially amplified products before secondary amplication in each reaction tube. In contrast, UNG was not used in not-antitamination group. The results of amplification were detected by sandwich micro-well hybridization ELISA technique. Results The templates containing dUTP were not amplified after UNG treatment(negative). In contrast, the templates without dUTP could be amplified(positive). All templates were amplified in not-antitamination group(positive). Conclusion UNG could prevent PCR products contamination effectively, and its effect on amplification efficiency is not visible.
, 百拇医药
Key words: uracil;deoxyribonucleases;glycoside hydrolases;PCR; anti-contamination; nucleic acid hybridization
有多种方法,如引物3’端黄嘌呤修饰法、补骨脂素结合法等[1、2],可防止PCR产物污染。这些方法都是在PCR反应后对产物进行处理,称为“后PCR法”。但补骨脂素结合法其PCR产物不能用于杂交引物,3'端黄嘌呤修饰法对引物的特异性有一定影响。尿嘧啶DNA糖苷酶(uracil-DNA-glycosylase, UNG/UDG)是近年来用于防止PCR污染的新试剂,称为“前PCR法”[3、4]。UNG通过打断核酸链上dUTP的糖苷键,使含dUTP的核酸不能作为模板被扩增。因此使用dUTP扩增DNA,UNG就能在PCR反应前降解污染的PCR产物。UNG和dUTP的加入是否会对PCR扩增效率产生影响,UNG抗污染的效率又如何,掺入尿嘧啶的PCR产物是否影响与核酸探针的杂交?相关报道[5、6]的结果并不一致。我们试图解决这些问题。
, 百拇医药
1 材料与方法
1.1 试剂和仪器
Taq酶、TMB、辣根过氧化物酶(HRP)标记的链亲和素购自宝灵曼公司。dUTP购自发玛西亚公司。HBV微板核酸杂交ELISA试剂盒由本中心自行研制。550型酶标仪和热循环仪均为Bio-Rad公司产品。
1.2 质粒与标本
乙型肝炎病毒(HBV)标准品系我中心自行克隆的HBV全基因,用微量分光光度计测定质粒DNA浓度为100 μg/ml,并采用极限稀释法将质粒稀释为1 pg/ml和10 fg/ml。10例乙型肝炎患者血清采自佛山市第一人民医院,并经普通PCR方法证实HBV DNA阳性。解脲支原体(UU)菌株及结核杆菌(TB)菌株由中国生物制品检定所提供,其菌液浓度为103/ml。
1.3 杂交液主要配方
, http://www.100md.com
20×SSC、硫酸葡聚糖、去离子甲酰胺、PEG6000、SDS等;洗液:1×SSC;封闭剂:1% Ficoll 400、1% PVP(聚乙烯吡咯烷酮)、1% BSA、HS-DNA、脱脂奶粉、甘氨酸。以上溶液均由本中心自制。
1.4 引物与探针
HBV引物设计位于C基因,解脲支原体位于脲素酶基因,结核杆菌位于IS6110基因。用Primer软件分别设计上述引物及探针,由上海生工公司合成。包被探针在5'磷酸化,并用碳酸盐缓冲液(pH9.6)在微孔板上包被14 h[1]。
1.5 核酸的提取
本中心自制的处理液50 μl(主要成分为十二烷基肌氨酸钠)置于0.5 ml离心管内,加待测血清50 μl或菌液、100 ℃煮沸15 min,12 000 r/min离心5 min,上清液作为扩增模板。
, 百拇医药
1.6 分组扩增HBV C基因、解脲支原体及结核杆菌基因序列
HBV标准品两个浓度及10例乙型肝炎病人的阳性血清共12份阳性模板,解脲支原体及结核杆菌分别为1份阳性模板,分3组进行基因扩增。dTTP组:加dATP、dGTP、dCTP、dTTP,不加dUTP;dUTP/dTTP组:加dATP、dGTP、dCTP、dTTP/dUTP各一半;dUTP组:加dATP、dGTP、dCTP、dUTP,不加dTTP。3组中除dNTP不同外,其他成分均相同。循环条件:94oC预变性2 min,94 ℃50 s、55 ℃50 s、72 ℃60 s,35个循环,72 ℃延伸3 min。扩增产物用微板核酸杂交方法检测。
1.7 UNG抗污染试验
上述每组扩增产物分抗污染组和非抗污染组进行。非抗污染组中每管加上述各组扩增产物1μl,其余为dUTP/dTTP组PCR反应液组分。抗污染组除具有非抗污染组所有组分外,每管另加UNG 0.5 U。同时设阴性对照,混匀,37 ℃水浴10 min后94 ℃6 min,然后按常规方法上机扩增,循环条件同前。
, 百拇医药
1.8 特异性杂交试验
将HBV包被探针及显色探针在50 ℃分别与解脲支原体、结核杆菌3组第1次PCR扩增产物杂交。解脲支原体包被探针与显色探针分别与HBV质粒扩增产物、结核杆菌3组扩增产物在50 ℃杂交。结核杆菌包被探针与显色探针分别与HBV质粒扩增产物、解脲支原体3组扩增产物在50 ℃杂交。
1.9 3种PCR引物扩增特异性试验
用HBV引物分别扩增UU及TB菌株,用UU引物扩增HBV质粒血清标本及TB菌株,用TB引物扩增HBV质粒血清标本及UU菌株。
1.10 3种杂交温度试验
从dTTP、dTTP/dUTP、dUTP3组扩增产物每份中取20 μl分别加入已包被捕捉探针的微孔板内,再加显色探针10 μl、杂交液100 μl,并选取45 ℃、50 ℃、55 ℃3种杂交温度杂交1 h。用杂交洗液洗去非特异性杂交,HRP标记的链亲和素酶联显色8 min,加2 mmol/L硫酸溶液2滴终止反应。
, 百拇医药
1.11结果判断
PCR扩增及杂交的结果在Bio-Rad 550型酶标仪上测定450 nm处的吸光度[D(λ)值]。P/N值≥2.1为DNA阳性,P/N值<2.1为DNA阴性(阴性对照A值<0.05,按0.05计算;P/N比值=标本A值/阴性对照A值)。
1.12 统计学分析
结果以均数±标准差(
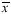 ±s)表示,并用卡方检验进行统计学分析。
±s)表示,并用卡方检验进行统计学分析。2 结果
2.1 UNG抗污染实验结果
第1次PCR扩增HBV质粒与血清、解脲支原体及结核杆菌菌株共14份3组全部为阳性,第2次PCR扩增结果见表1。
, http://www.100md.com
表1 HBV、UU、TB 3组产物第2次PCR扩增结果(n=14)
Tab.1 The secondary PCR results of HBV、UU、TB products
(n=14)
Group
Anticontamination(UNG+)
Not- Anticontamination(UNG-)
dTTP
14
14
, http://www.100md.com dUTP/dTTP
0
14
dUTP
0
14
2.2 HBV、UU、TB第1次PCR产物杂交实验结果
2.2.1 HBV 3种不同的PCR产物在三种不同温度条件下杂交结果 在同一温度,含T或含U的产物与寡核苷酸探针杂交的稳定性无明显差异。而在不同温度下由U部分或全部取代T则对寡核苷酸探针的杂交无显著影响(表2)。
表2 HBV第1次PCR产物3种不同杂交温度D(λ)值(
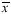 ±s)
±s), 百拇医药
Tab.2 D(? )values at 3 different hybridization temperatures of the
initial PCR products or HBV(Mean±SD)
Group
45 ℃
50 ℃
55 ℃
DTTP
0.548±0.097
0.552±0.110
0.553±0.106
, 百拇医药
dUTP/dTTP
0.530±0.099
0.537±0.096
0.539±0.098
dUTP
0.534±0.087
0.542±0.091
0.537±0.097
2.2.2 解脲支原体及结核杆菌3种不同PCR产物在3种不同温度下杂交结果 见表3。
表3 UU、TB第一次PCR产物三种不同杂交温度D(λ)值(
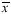 ±s)
±s), 百拇医药
Tab.3 D(? )values at 3 different hybridization temperatures
of the initial PCR products of UU and TB(Mean±SD)
Group
UU
TB
45 ℃
50 ℃
55 ℃
45 ℃
50 ℃
55 ℃
, 百拇医药
dTTP
0.540±0.102
0.537±0.097
0.535±0.104
0.535±0.099
0.538±0.109
0.543±0.108
dUTP/dTTP
0.538±0.098
0.541±0.105
0.539±0.098
, http://www.100md.com
0.540±0.097
0.536±0.102
0.539±0.102
dUTP
0.536±0.095
0.538±0.097
0.540±0.104
0.534±0.103
0.539±0.097
0.541±0.104
2.3 特异性杂交试验结果
, http://www.100md.com
3种特异性探针分别与其它两种3组扩增产物50℃杂交结果全部为阴性。
2.4 3种引物扩增特异性结果
HBV、UU、TB各自引物均不能扩增其它两种核酸模板。
3 讨论
dTTP组常规加dTTP,未加dUTP,抗污染组和非抗污染组均为阳性,扩增效率几乎相同,说明UNG不能降解含dTTP的PCR扩增的DNA,dUTP和UNG对PCR的扩增效率几乎没有影响。dTTP/dUTP、dUTP组均加了dUTP,抗污染组为阴性,非抗污染组为阳性,说明UNG能选择性地降解含dUTP的PCR产物。虽然dTTP/dUTP组中dUTP、dTTP各占一半,但只要每条PCR扩增的DNA链中有数个dUTP掺入,就能被UNG识别并降解。提示在抗污染PCR实际操作中,只需在常规dNTP(dATP、dGTP、dCTP、dTTP)混合物中加入适量dUTP就能达到抗污染的效果。dTTP组中抗污染组与非抗污染组皆为阳性,D(λ)值相近,进一步说明UNG对PCR扩增效率没有明显影响,与Ritzler[7]的结果一致。
, 百拇医药
本实验通过杂交温度高低的变化证实互补核酸链中U取代T对核酸杂交没有明显影响,而且对不同A/T含量的病原微生物,由U取代T后对核酸杂交的稳定性也无明显影响。
综上所述,本实验结果不支持以下两种推论:(1)在核酸链中掺入dUTP,可能影响核酸链的Tm值,进而影响PCR扩增的特异性。(2)扩增产物中A/T含量的高低会影响杂交的特异性。HBV C基因A/T含量大约为50%,解脲支原体脲素基因A/T含量为73%,而结核杆菌IS6110基因的A/T含量为38%。这3种微生物的A/T含量尽管差别较大,但在3组PCR产物杂交实验中均无非特异性杂交的结果。总之,本实验证明UNG结合dUTP能有效防止PCR产物的污染;对PCR扩增效率没有影响;含“U”的PCR产物对A/T含量差别较大的微生物核酸探针杂交的稳定性没有影响。因此,本方法不但能抗PCR产物污染,而且能对扩增产物进行杂交鉴定,为PCR微板核酸杂交ELISA技术在临床常规工作中的应用提供了理论依据。
作者简介:王省良(1961-),男,内蒙古包头人,1982年毕业于解放军农牧大学,硕士,副教授,电话:85148162
, 百拇医药
参考文献:
1,Cimion GD, Metchette KC, Tessmon JW, et al. Post-PCR sterilization a method to control carry-over contamination for the polymerase chain reaction[J]. Nucl Acids Res, 1990, 19(1):99-107.
2,Rys PN, Persing DH. Prevention false positives: quantitative evaluation of three protocols for inactivation of polymerase chain reaction amplification products[J]. J Clin Microbiol, 1993, 31(9):2356-60.
, http://www.100md.com 3,Uday K, Epstein JS, Hewlett IK. A novel method employing UNG to avoid carry-over contamination in RNA-PCR[J]. Nucl Acids Res, 1993, 21(16):3917-18.
4,King JA, Ball JK. Detection of HIV-1 by digoxigenin-labelled PCR and microtitre plate solution hybridisation assay and prevention of PCR carry-over by uracil-N-glycosylate[J]. J Virol Methods, 1993, 44(1): 67-76.
5,Longo MC, Berninger MS, Hartley JL. Use of uracil DNA glycosylase to control carry-over contamination in polymerase chain reactions[J]. Gene, 1990, 93(1):125-8.
, 百拇医药
6,Carmody Mw, Vary CP. Inhibition of DNA hybridization following partial dUTP substitution[J]. Biotechniques, 1993, 15(4): 692-9.
7,Ritzler M, Perschil I, Altwegg M. Infleuence of residual uracil-DNA glycosylase activity on the electrophorectic migration of dUTP-contaning PCR products[J]. J Microbiol Methods, 1999, 35(1):73-6.
收稿日期:1999-12-25, http://www.100md.com