格列吡嗪片剂对20名健康志愿者的人体相对生物利用度研究
作者:沈建平 朱延勤 郑马庆 丁虹彬 潘伟娜 邱俊 张银娣
单位:沈建平 丁虹彬 邱俊 潘伟娜 张银娣(南京医科大学临床药理研究所 南京 210029);朱延勤 郑马庆(江苏省药物研究所药理室 南京 210009)
关键词:格列吡嗪;药代动力学;生物利用度;高效液相色谱
中国临床药理学杂志000417摘要 目的:20名健康志愿者随机交叉给药先后一次口服格列吡嗪(受试和参比)片剂进行人体相对生物利用度研究。方法:采用HPLC-UV法和内标法定时检测其血药浓度,进行药代动力学分析。结果:经CAPP软件拟合所得的药时曲线均符合一室开放模型。格列吡嗪受试片与参比片的主要药动学参数分别为:T1/2K(h):2.68±0.46和2.71±0.46;Cmax(μg.L-1):622.53±136.96和620.95±117.36;Tmax(h):1.93±0.18和1.95±0.15;MRT(h):5.94±0.37和5.96±0.45;AUC0-16(μg.h.L-1):2848.24±553.24和2962.38±530.13;这些参数经方差分析证明无显著性差异(P<0.05)。受试片剂对参比片剂的相对生物利用度(F%)为:97.11±11.06。结论:两者的lnAUC、lnCmax、lnTmax经交叉试验下的方差分析法证明无显著性差异,经双单侧检验证明两种片剂具有生物等效性。
, 百拇医药
The Relative Bioavailabity of Glipzide Tablets in 20 Healthy Volunteers
SHEN Jian-Ping DING Hong-Bing QIU Jun ZHANG Yin-Di
(Institute of Clinical Pharmacology,Nanjing Medical University,Nanjing 210029)
ZHU Yan-Qin ZHENG Ma-Qing PAN Wei-Na
(The Institute of jiangsu province Materia Medica,Nanjing 210009)
Abstract OBJECTIVE:A single dose of 10 mg glipizide test tablet or its reference tablet was given to 20 healthy male volunteers in a randomized cross-over study.METHODS:The pharmacokinetics and bioavailability of test glipizide tablets were compared with reference glipizide tablets.Plasma levels of glipizide were detected by HPLC-UV method.RESULTS:It was found that the plasma concentration-time curves of the two preparations were fitted to a one compartment model.The parameters of the two formulations for glipizide:Cmax(μg.ml-1) were 622.53±139.96 and 620.95±117.36;Tmax (h)1.93±0.18and 1.95±0.15;respectively.MRT(h):5.74±0.37 and 5.96±0.45;AUC0-16(μg.h.L-1):2848.24±553.24 and 2962.38±530.13;The relative bioavailability (%) of test tablets was 97.11±11.06.CONCLUSION:There were no significant difference between pharmacokinetic parameters for test and reference tablets.It was demonstrated the two preparations were bioequivalent by one two-sided tests.
, 百拇医药
Key words glipizide;pharmacokinetics;bioavailability;HPLC
格列吡嗪(glipizide)为第二代磺酰脲口服降血糖药,其特点是口服吸收快速完全,无首过作用,能快速有效地降低血糖浓度,临床主要用于II型(非胰岛素依赖型)糖尿病。本-试验用HPLC-UV改进法,用20名健康志愿者,研究国产格列吡嗪片剂的药代动力学及相对生物利用度,为临床合理用药提供参考。
材料与方法
1.药品及试剂
受试制剂:格列吡嗪(glipizide)片剂,华裕(无锡)制药有限公司提供,批号:981112,规格:5mg /片。
参比制剂:格列吡嗪片剂,由海南金陵制药有限公司提供,批号:980710,规格:5mg/片。
, 百拇医药
格列吡嗪标准品:由华裕(无锡)制药有限公司提供,内标:格列齐特(gliclazide),由上海医工院亚东药业公司浦东药厂提供,试剂:乙腈,甲醇为色谱纯,水为双重蒸馏水,其余均为市售分析纯试剂.
2.血药浓度分析测定
2.1 仪器及分析条件
采用岛津LC-6A高效液相色谱仪,SCL-6A系统控制器,LC-6A溶剂泵,SPD-UV紫外检测器,C-R6A色谱数据处理机,色谱柱:ODS C18(250×4.6mm ø5μ)大连物化研究所生产,USA 7125型进样阀(定量管20μl),紫外检测波长230nm,流速1ml.min-1,柱温35℃,流动相:甲醇:0.01 mol.L-1磷酸缓冲液 (pH=3.5)55∶45,AUFS= 0.01。进样量20μL。
, 百拇医药
2.2 血浆样品测定
取0.5 ml血浆,加20μl(1mol.L-1)盐酸,加内标物10μl (108mg.L-1) 再加0.5 ml乙腈,混旋1min,离心(3500 r.min-1)10min,取上清液再高速离心(10000 r.min-1)1min后直接进样。
2.3 测定方法的评价
在上述HPLC实验条件下,色谱峰能与其血浆杂峰很好地分离,无干扰峰出现,信噪比≥3,最低检测限为25μg.L-1,见图1。血浆标准曲线范围为25,50,100,200,400,800,1600μg.L-1,按上述方法处理得标准曲线回归方程为:C = 22.91 + 867.53As/Ai,r=0.9998,故本法在25~1600μg.L-1范围内线性关系良好,见图2。 取标准品低、中、高三种浓度50,200,1600μg.L-1于一日内和一周内重复5个样品进样,其日内及日间变异系数(%)表明本法符合试验要求。见表1。
, http://www.100md.com
Table1.Precision of glipizide in human plasma (n=5) Concentration
(μg.L-1)
Within-day (n=5)
AS/AI
RSD
(%)
Between-day (n=5)
AS/AI
RSD
, 百拇医药
(%)
50
0.0326±0.0008
2.45
0.037±0.0025
6.68
200
0.1593±0.0044
2.76
0.189±0.0075
3.96
1600
, 百拇医药
1.6664±0.0430
2.28
1.751±0.1157
6.61
AS:glipizide peak area;AI :gliclazide peak area(mean±SD)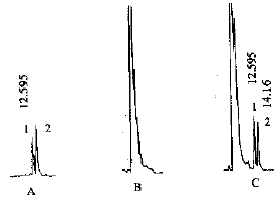
Fig1.chromatograms of glipizide from plasma.A.standard
(1 glipizide 2 gliclazide) B.blank plasma
, 百拇医药
C.plasma sample(1 glipizide 2 gliclazide)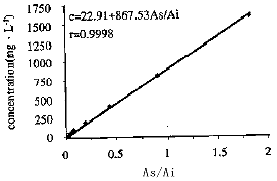
Fig2.standard curve for glipizide in plasma
Sample(gliclazide) 2.Internal standard (gliclazide)
3.试验方法
3.1受试者
20名健康男性,平均年龄为21.25±0.97岁,平均身高为172.8±5.06 cm,平均体重63.8±6.27 kg,试验前半个月停服一切药品,受试期间禁烟酒,志愿者无药物过敏史,经临床检查和生化检查血、尿常规、肝、-肾功能、血压和心电图检查,证明身体健康。均签署知情同意书,并经南京医科大学医学伦理委员会通过。
, http://www.100md.com
3.2 给药与取样
采用双交叉设计(two-period crossover design)试验方法进行,即受试者于受试前日晚住院观察,禁食12 h后于次日晨6:30空腹给药,随机分为两组,10名志愿者服用参比片,每人10 mg(5 mg×2),另10名志愿者服用受试片10 mg(5 mg×2),均用温开水150 ml吞服。服药后1.5 h内不进食,住院期间均统一用餐,避免剧烈运动,于服药后0.5,1,1.5,2,3,4,6,8,12,16h各取静脉血3 ml,血样置肝素抗凝管内,经离心后分离血浆,置-20℃保存备用,半个月后交叉重复上述试验。
4.数据处理
房室模-型参数估计:采用南京医科大学数学教研室罗建平等编写的CAPP软件包,由AST486sx180计算机据血浆药物浓度-时间曲线确定模型,并进行药代动力学参数计算。
, 百拇医药
非房室参数估计:采用南京医科大学生物数学研究室丁勇等编写的PHAUC软件,对以上所得参数采用交叉试验设计的方差分析(ANOVA)进行显著性检验。
据以下公式计算的相对生物利用度:
采用南京医科大学数学教研室丁勇等编写的BIO软件,对两种剂型的AUC、Cmax 、Tmax取自然对数后[5],分别作方差分析后,用双单侧检验和1-2α区间法[6]进行生物等效性分析。
试验结果
1.药代动力学模型及参数
两种格列吡嗪片剂口服后的血药浓度-时间曲线按CAPP 软件拟合为一室模型,按此模型进行计算出ka及k值,按非房室模型计算其它药代动力学参数,见表2。经交叉试验下的方差分析,P<0.05,两者无显著性差异。20名志愿者口服格列吡嗪片剂(T)及(C)后平均血药浓度-时间曲线见图3。受试制剂的相对生物利用度F%为97.11±11.06。
, 百拇医药
Table 2.Mean pharmacokinetic parameters of reference and
test glipizide tablet after a single dose 10 mg (n=20) Parameters
test
reference
T1/2ka(h)
0.41±0.08
0.41±0.08
2.68±0.46
, 百拇医药
2.71±0.46
Vd/F(L)
7.70±2.60
7.90±2.30
CL/F(L.h-1)
2.00±0.50
1.90±0.70
Tmax(h)
1.93±0.18
1.95±0.15
Cmax(μg.L-1)
, 百拇医药
622.53±136.96
620.95±117.36
AUC0-16(μg.h-1.L-1)
2848.24±553.24
2962.38±530.13
AUC0-∞(μg.h-1.L-1)
2985.73±578.25
3101.56±588.00
MRT(h)
, 百拇医药
5.94±0.37
5.96±0.45
mean±SD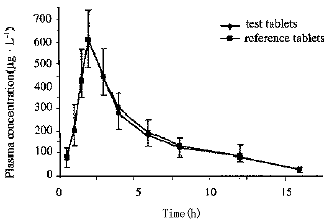
Fig3.a mean glipizide plasma concentration-time cruves
in 20 volunteers after oral administration of 10mg glipizide
2.生物等效性分析
受试制剂和参比制剂的药动学参数lnAUC0-16、lnCmax、lnTmax的方差分析结果表明制剂间变异、周期间变异、F值均小于F0.05,无显著性差异,除lnTmax外,lnAUC0-16、lnCmax间个体间有显著性差异。F值分别为8.64、9.32均大于F值2.21,p<0.05。双单侧检验当判断标准为±20%时两种制剂的双单侧检验分析结果lnAUC、lnCmax、lnTmax和lnMRT低侧高侧的t值均大于t0.05,t0.05(n=18)=1.734。lnAUC0-t的1-2α置信区间检验μt/μγ为 0.990/1.001,也符合上述要求。故可认为两种制剂具有生物等效性。
, http://www.100md.com
整个实验期间个别受试者有轻度头晕心悸反应,未出现明显低血糖反应。
讨论
本法采用HPLC-UV法,格列齐特为内标测定人体血浆中格列吡嗪的浓度,文献多采用二步法[1~4]。我们用乙腈一步抽取,检测波长采用文献2中的254mm,流动相改用甲醇和0.01 mol.L-1磷酸缓冲液以45 :55组成(pH 3.5)这样可避免杂峰干扰,样品稳定,可达到临床血样本测定要求。
本研究采用一次量10mg格列吡嗪口服,属临床应用剂量范围.经预试健康志愿者需在服药后1.5h即开始用标准餐,这样可避免其低血糖反应。由于服药量较大,测定时间较5mg长,所得药动学数据较为稳定可靠。
格列吡嗪试验片与参比片两者在体内药代动力学行为相似,试验片相对于参比片的生物利用度为(F%)97.11±11.06。lnAUC、lnCmax、及lnTmax三项参数经生物等效性分析两者生物效应相等。
, http://www.100md.com
参考文献
1,陈秋潮、杨春芹、赵彩虹,等.格列吡嗪胶囊的药代动力学及生物利用度研究.药学学报,1995;30:476~480.
2,徐榕青、邓思珊等.格列吡嗪在健康志愿者体内的的药代动力学及生物利用度.中国药学杂志,1995;30:353~355.
3,Emisson H.Hyperglycaemia and absorption of sulphonylurea drugs.J Chromatogr,1987;421:319.
4,Groop LC,Luzi L,Defronzo RA,et al.High performance liquid chromatographic determination of glipizide in human plasma and urine.Lancet,1989;15:129.
5,曾衍霖.对新药生物等效度申报材料写作的规范化建议.中国临床药理学杂志,1995;11:58~62.
6,黄圣凯等.生物等效性评价的几种统计方法.中国临床药理学杂志,1993;9:193~195.
收稿日期:2000-01-05
修回日期:2000-05-11, http://www.100md.com
单位:沈建平 丁虹彬 邱俊 潘伟娜 张银娣(南京医科大学临床药理研究所 南京 210029);朱延勤 郑马庆(江苏省药物研究所药理室 南京 210009)
关键词:格列吡嗪;药代动力学;生物利用度;高效液相色谱
中国临床药理学杂志000417摘要 目的:20名健康志愿者随机交叉给药先后一次口服格列吡嗪(受试和参比)片剂进行人体相对生物利用度研究。方法:采用HPLC-UV法和内标法定时检测其血药浓度,进行药代动力学分析。结果:经CAPP软件拟合所得的药时曲线均符合一室开放模型。格列吡嗪受试片与参比片的主要药动学参数分别为:T1/2K(h):2.68±0.46和2.71±0.46;Cmax(μg.L-1):622.53±136.96和620.95±117.36;Tmax(h):1.93±0.18和1.95±0.15;MRT(h):5.94±0.37和5.96±0.45;AUC0-16(μg.h.L-1):2848.24±553.24和2962.38±530.13;这些参数经方差分析证明无显著性差异(P<0.05)。受试片剂对参比片剂的相对生物利用度(F%)为:97.11±11.06。结论:两者的lnAUC、lnCmax、lnTmax经交叉试验下的方差分析法证明无显著性差异,经双单侧检验证明两种片剂具有生物等效性。
, 百拇医药
The Relative Bioavailabity of Glipzide Tablets in 20 Healthy Volunteers
SHEN Jian-Ping DING Hong-Bing QIU Jun ZHANG Yin-Di
(Institute of Clinical Pharmacology,Nanjing Medical University,Nanjing 210029)
ZHU Yan-Qin ZHENG Ma-Qing PAN Wei-Na
(The Institute of jiangsu province Materia Medica,Nanjing 210009)
Abstract OBJECTIVE:A single dose of 10 mg glipizide test tablet or its reference tablet was given to 20 healthy male volunteers in a randomized cross-over study.METHODS:The pharmacokinetics and bioavailability of test glipizide tablets were compared with reference glipizide tablets.Plasma levels of glipizide were detected by HPLC-UV method.RESULTS:It was found that the plasma concentration-time curves of the two preparations were fitted to a one compartment model.The parameters of the two formulations for glipizide:Cmax(μg.ml-1) were 622.53±139.96 and 620.95±117.36;Tmax (h)1.93±0.18and 1.95±0.15;respectively.MRT(h):5.74±0.37 and 5.96±0.45;AUC0-16(μg.h.L-1):2848.24±553.24 and 2962.38±530.13;The relative bioavailability (%) of test tablets was 97.11±11.06.CONCLUSION:There were no significant difference between pharmacokinetic parameters for test and reference tablets.It was demonstrated the two preparations were bioequivalent by one two-sided tests.
, 百拇医药
Key words glipizide;pharmacokinetics;bioavailability;HPLC
格列吡嗪(glipizide)为第二代磺酰脲口服降血糖药,其特点是口服吸收快速完全,无首过作用,能快速有效地降低血糖浓度,临床主要用于II型(非胰岛素依赖型)糖尿病。本-试验用HPLC-UV改进法,用20名健康志愿者,研究国产格列吡嗪片剂的药代动力学及相对生物利用度,为临床合理用药提供参考。
材料与方法
1.药品及试剂
受试制剂:格列吡嗪(glipizide)片剂,华裕(无锡)制药有限公司提供,批号:981112,规格:5mg /片。
参比制剂:格列吡嗪片剂,由海南金陵制药有限公司提供,批号:980710,规格:5mg/片。
, 百拇医药
格列吡嗪标准品:由华裕(无锡)制药有限公司提供,内标:格列齐特(gliclazide),由上海医工院亚东药业公司浦东药厂提供,试剂:乙腈,甲醇为色谱纯,水为双重蒸馏水,其余均为市售分析纯试剂.
2.血药浓度分析测定
2.1 仪器及分析条件
采用岛津LC-6A高效液相色谱仪,SCL-6A系统控制器,LC-6A溶剂泵,SPD-UV紫外检测器,C-R6A色谱数据处理机,色谱柱:ODS C18(250×4.6mm ø5μ)大连物化研究所生产,USA 7125型进样阀(定量管20μl),紫外检测波长230nm,流速1ml.min-1,柱温35℃,流动相:甲醇:0.01 mol.L-1磷酸缓冲液 (pH=3.5)55∶45,AUFS= 0.01。进样量20μL。
, 百拇医药
2.2 血浆样品测定
取0.5 ml血浆,加20μl(1mol.L-1)盐酸,加内标物10μl (108mg.L-1) 再加0.5 ml乙腈,混旋1min,离心(3500 r.min-1)10min,取上清液再高速离心(10000 r.min-1)1min后直接进样。
2.3 测定方法的评价
在上述HPLC实验条件下,色谱峰能与其血浆杂峰很好地分离,无干扰峰出现,信噪比≥3,最低检测限为25μg.L-1,见图1。血浆标准曲线范围为25,50,100,200,400,800,1600μg.L-1,按上述方法处理得标准曲线回归方程为:C = 22.91 + 867.53As/Ai,r=0.9998,故本法在25~1600μg.L-1范围内线性关系良好,见图2。 取标准品低、中、高三种浓度50,200,1600μg.L-1于一日内和一周内重复5个样品进样,其日内及日间变异系数(%)表明本法符合试验要求。见表1。
, http://www.100md.com
Table1.Precision of glipizide in human plasma (n=5) Concentration
(μg.L-1)
Within-day (n=5)
AS/AI
RSD
(%)
Between-day (n=5)
AS/AI
RSD
, 百拇医药
(%)
50
0.0326±0.0008
2.45
0.037±0.0025
6.68
200
0.1593±0.0044
2.76
0.189±0.0075
3.96
1600
, 百拇医药
1.6664±0.0430
2.28
1.751±0.1157
6.61
AS:glipizide peak area;AI :gliclazide peak area(mean±SD)

Fig1.chromatograms of glipizide from plasma.A.standard
(1 glipizide 2 gliclazide) B.blank plasma
, 百拇医药
C.plasma sample(1 glipizide 2 gliclazide)

Fig2.standard curve for glipizide in plasma
Sample(gliclazide) 2.Internal standard (gliclazide)
3.试验方法
3.1受试者
20名健康男性,平均年龄为21.25±0.97岁,平均身高为172.8±5.06 cm,平均体重63.8±6.27 kg,试验前半个月停服一切药品,受试期间禁烟酒,志愿者无药物过敏史,经临床检查和生化检查血、尿常规、肝、-肾功能、血压和心电图检查,证明身体健康。均签署知情同意书,并经南京医科大学医学伦理委员会通过。
, http://www.100md.com
3.2 给药与取样
采用双交叉设计(two-period crossover design)试验方法进行,即受试者于受试前日晚住院观察,禁食12 h后于次日晨6:30空腹给药,随机分为两组,10名志愿者服用参比片,每人10 mg(5 mg×2),另10名志愿者服用受试片10 mg(5 mg×2),均用温开水150 ml吞服。服药后1.5 h内不进食,住院期间均统一用餐,避免剧烈运动,于服药后0.5,1,1.5,2,3,4,6,8,12,16h各取静脉血3 ml,血样置肝素抗凝管内,经离心后分离血浆,置-20℃保存备用,半个月后交叉重复上述试验。
4.数据处理
房室模-型参数估计:采用南京医科大学数学教研室罗建平等编写的CAPP软件包,由AST486sx180计算机据血浆药物浓度-时间曲线确定模型,并进行药代动力学参数计算。
, 百拇医药
非房室参数估计:采用南京医科大学生物数学研究室丁勇等编写的PHAUC软件,对以上所得参数采用交叉试验设计的方差分析(ANOVA)进行显著性检验。
据以下公式计算的相对生物利用度:

采用南京医科大学数学教研室丁勇等编写的BIO软件,对两种剂型的AUC、Cmax 、Tmax取自然对数后[5],分别作方差分析后,用双单侧检验和1-2α区间法[6]进行生物等效性分析。
试验结果
1.药代动力学模型及参数
两种格列吡嗪片剂口服后的血药浓度-时间曲线按CAPP 软件拟合为一室模型,按此模型进行计算出ka及k值,按非房室模型计算其它药代动力学参数,见表2。经交叉试验下的方差分析,P<0.05,两者无显著性差异。20名志愿者口服格列吡嗪片剂(T)及(C)后平均血药浓度-时间曲线见图3。受试制剂的相对生物利用度F%为97.11±11.06。
, 百拇医药
Table 2.Mean pharmacokinetic parameters of reference and
test glipizide tablet after a single dose 10 mg (n=20) Parameters
test
reference
T1/2ka(h)
0.41±0.08
0.41±0.08

2.68±0.46
, 百拇医药
2.71±0.46
Vd/F(L)
7.70±2.60
7.90±2.30
CL/F(L.h-1)
2.00±0.50
1.90±0.70
Tmax(h)
1.93±0.18
1.95±0.15
Cmax(μg.L-1)
, 百拇医药
622.53±136.96
620.95±117.36
AUC0-16(μg.h-1.L-1)
2848.24±553.24
2962.38±530.13
AUC0-∞(μg.h-1.L-1)
2985.73±578.25
3101.56±588.00
MRT(h)
, 百拇医药
5.94±0.37
5.96±0.45
mean±SD

Fig3.a mean glipizide plasma concentration-time cruves
in 20 volunteers after oral administration of 10mg glipizide
2.生物等效性分析
受试制剂和参比制剂的药动学参数lnAUC0-16、lnCmax、lnTmax的方差分析结果表明制剂间变异、周期间变异、F值均小于F0.05,无显著性差异,除lnTmax外,lnAUC0-16、lnCmax间个体间有显著性差异。F值分别为8.64、9.32均大于F值2.21,p<0.05。双单侧检验当判断标准为±20%时两种制剂的双单侧检验分析结果lnAUC、lnCmax、lnTmax和lnMRT低侧高侧的t值均大于t0.05,t0.05(n=18)=1.734。lnAUC0-t的1-2α置信区间检验μt/μγ为 0.990/1.001,也符合上述要求。故可认为两种制剂具有生物等效性。
, http://www.100md.com
整个实验期间个别受试者有轻度头晕心悸反应,未出现明显低血糖反应。
讨论
本法采用HPLC-UV法,格列齐特为内标测定人体血浆中格列吡嗪的浓度,文献多采用二步法[1~4]。我们用乙腈一步抽取,检测波长采用文献2中的254mm,流动相改用甲醇和0.01 mol.L-1磷酸缓冲液以45 :55组成(pH 3.5)这样可避免杂峰干扰,样品稳定,可达到临床血样本测定要求。
本研究采用一次量10mg格列吡嗪口服,属临床应用剂量范围.经预试健康志愿者需在服药后1.5h即开始用标准餐,这样可避免其低血糖反应。由于服药量较大,测定时间较5mg长,所得药动学数据较为稳定可靠。
格列吡嗪试验片与参比片两者在体内药代动力学行为相似,试验片相对于参比片的生物利用度为(F%)97.11±11.06。lnAUC、lnCmax、及lnTmax三项参数经生物等效性分析两者生物效应相等。
, http://www.100md.com
参考文献
1,陈秋潮、杨春芹、赵彩虹,等.格列吡嗪胶囊的药代动力学及生物利用度研究.药学学报,1995;30:476~480.
2,徐榕青、邓思珊等.格列吡嗪在健康志愿者体内的的药代动力学及生物利用度.中国药学杂志,1995;30:353~355.
3,Emisson H.Hyperglycaemia and absorption of sulphonylurea drugs.J Chromatogr,1987;421:319.
4,Groop LC,Luzi L,Defronzo RA,et al.High performance liquid chromatographic determination of glipizide in human plasma and urine.Lancet,1989;15:129.
5,曾衍霖.对新药生物等效度申报材料写作的规范化建议.中国临床药理学杂志,1995;11:58~62.
6,黄圣凯等.生物等效性评价的几种统计方法.中国临床药理学杂志,1993;9:193~195.
收稿日期:2000-01-05
修回日期:2000-05-11, http://www.100md.com