降钙素对正常成年雄性大鼠骨重建过程的影响
作者:张凤山 党耕町 王志国 张惠珠
单位:张凤山(北京大学第三临床医学院骨科 100083);党耕町(北京大学第三临床医学院骨科 100083);王志国(北京大学第三临床医学院骨科 100083);张惠珠(北京大学第三临床医学院骨科 100083)
关键词:降钙素;骨重建过程;松质骨;骨组织形态计量学;偶联过程
中国骨质疏松杂志000403 摘要 目的 在体研究降钙素对成年雄性大鼠松质骨重建过程的影响,并分析其影响机制。方法 12只大鼠平均分成对照组和降钙素组,后者皮内注射鳗鱼降钙素1U/100 g/日,连续2日。7日后取第4、5腰椎,行不脱钙骨组织切片,骨组织形态计量学分析,方差分析比较两组结果。结果 骨吸收陷窝表面、活性吸收表面、破骨细胞平均细胞核数,降钙素组明显小于对照组。类骨质表面、类骨质相对体积、类骨质厚度,降钙素组明显小于对照组,成骨细胞形态两组之间有显著差异。骨小梁相对体积,两组之间无差异。结论 降钙素对正常成年雄性大鼠松质骨而言,可以明显抑制破骨吸收,这种作用可能是通过减少活性吸收表面数量和降低破骨细胞的吸收功能来完成的;可以抑制成骨细胞形成类骨质的活性,这种作用可能不是直接的,而是通过降钙素对骨吸收的抑制作用进而影响了骨吸收与骨形成的之间的偶联而完成的;短期应用降钙素骨量无变化。
, 百拇医药
Effect of calcitonin on bone remodeling of adult male Wistar rat
Zhang Fengshan,Dang Gengtin,Wang Zhiguo
(The Third Clinical Medical School of Beijing University,Beijing 100083,China)
Abstract Objective The effect of calcitonin on bone remodeling of adult male Wistar rat was observed and the mechanism was analyzed.Methods Twelve rats were distributed randomly to control and calcitonin groups.The rats in calcitonin group were administered elatonin(1U/100g/day,2days).The fourth and fifth lumbar vertebral bodies were undecalcified and analyzed by histomorphometry.T-test was used to analyze the differences between the two groups.Results The eroded surface,active resorptive surface,nuclear number of osteoclasts in calcitonin group were less than in control group.The osteoid surface,osteoid volume,osteoid thickness in calcitonin group were less than in control group.There was significant difference in osteoblast appearance between calcitonin and control groups.There is no difference of trabecular volume between calcitonin and control group. Conclusion For normal adult male rat,calcitonin depresses the osteoclastic resorption obviously through reducing the number of active resorptive surface and depressing osteoclastic activity;on the other hand,calcitonin depresses the osteoid producing activity of osteoblasts by indirectly affecting the coupling process between resorption and formation.Calcitonin administered in short did not affect the bone volume.
, 百拇医药
Key words Calcitonin Bone Remodeling process Trabecular bone Bone histomophormetry Coupling process
骨组织通过骨重建过程完成骨转换,与年龄相关的骨量丢失就是在这一过程中发生的。降钙素通过与破骨细胞上的降钙素受体结合,抑制骨重建过程中的破骨吸收[1],因而被广泛用来预防和治疗骨质疏松症,但大量的临床和实验室研究文献报告降钙素可以预防骨量的进一步丢失,却不能恢复骨量[2],其原因是什么?骨重建过程是骨吸收和骨形成过程的偶联,降钙素对骨吸收的抑制是否影响后续的骨形成过程,如果有影响,其影响机制是什么?国外文献对这些问题近年有一些散在的报告,但有争论,且研究不深入[3,4]。本文的目的除了进一步观察降钙素对骨吸收的抑制作用外,重点观察降钙素对正常的骨重建过程中骨形成过程的影响,并通过分析其影响结果,在细胞水平上探讨其影响机制,特别注意分析降钙素是否通过影响骨重建的偶联过程来影响骨形成。通过这一研究,为进一步正确、全面认识降钙素在骨质疏松症治疗中的地位提供参考。
, 百拇医药
1 材料和方法
1.1 动物分组及饲养
12只三级雄性Wistar-Lewis大鼠,体重360~440克(18周),标准饲料(钙、磷的含量分别为1.25%和0.7%)、自来水、垫料均经灭菌处理,大鼠自由摄取水和饲料,清洁喂养,人工12/12小时昼夜周期。12只动物平均分成2组:降钙素组和对照组。
1.2 用药
两组动物均饲养7日,其中对照组于实验第1、2天皮内注射生理盐水,降钙素组于第1、2天皮内注射鳗鱼降钙素(Elatonin),1U/100g/天。所有动物于用药开始后满7天于腹腔内注射3%戊巴比妥钠4 mg/100 g麻醉后取材,然后处死。合成降钙素衍生物益钙宁(Elcatonin)注射液由日本旭化成工业株式会社生产。1.3 组织标本取材制作
, 百拇医药 每只大鼠分别取相连的第4、第5腰椎,常规福尔马林溶液固定,乙醇上升梯度脱水,甲基丙烯酸甲酯包埋[5]。用Reucgart-Jung型切片机沿椎体矢状面作不连续不脱钙切片,选取5μm的中矢状面上切片3~5张,用1%甲苯胺蓝染色。
1.4 组织形态计量学分析
采用Opton ⅢRS多功能显微镜、Morphomat-10半自动图像分析系统(西德),测量参数如下[6]:BV/TV(%):骨小梁相对体积;Vos/TV(%)类骨质相对体积;OS/BS(%):类骨质表面;Ob.S/BS(%):骨小梁成骨细胞表面;Sfi(%):静止骨形成表面;ES/BS(%):吸收陷窝表面;Oc.S/BS(%):破骨细胞吸收表面;O.Th(μm):类骨质厚度;N.Ob/Ob.S(/mm):单位形成表面的成骨细胞数;N.Oc/Oc.S(/mm):单位活性吸收表面的破骨细胞数;N.Nc:破骨细胞核计数
, http://www.100md.com
所有的参数均测自腰椎小梁骨,测量范围为:远离皮质骨表面两个骨小梁厚度,远离终板1 mm。
1.5 统计学分析
各组大鼠所有参数均以均数±标准差表示( ±s)。组间差异采用方差分析,显著性t检验。P<0.05被认为有显著性差异,P<0.01被认为有极显著差异。
±s)。组间差异采用方差分析,显著性t检验。P<0.05被认为有显著性差异,P<0.01被认为有极显著差异。
2 结果
测量参数结果可见表1。
骨吸收参数:骨吸收陷窝表面、活性吸收表面(破骨细胞表面)、破骨细胞平均细胞核数,降钙素组明显小于对照组,如以破骨细胞表面占总吸收表面的比率计算,对照组是实验组的3.26倍;吸收表面单位长度上破骨细胞数对照组和降钙素组无明显差异(图1)。
, http://www.100md.com
骨形成参数:类骨质表面、类骨质相对体积、类骨质厚度,降钙素组均明显小于对照组,成骨细胞的形态两组之间有明显差异,对照组成骨表面上的成骨细胞多呈立方形、大园形,而降钙素组成骨表面上的成骨细胞多呈梭形、扁圆形或小圆形。成骨细胞骨形成表面、单位形成表面的成骨细胞数,降钙素组与对照组相比无显著性差异(图2)。
表1 对照组和降钙素组静态组织形态
计量学参数( ±s) 参数
±s) 参数
对照组
降钙素组
BV/TV(%)
30.56±4.30
, 百拇医药
27.77±3.48
Vos/TV(%)
0.24±0.06
0.13±0.07**
O.Th(μm)
2.12±0.44
1.85±0.34**
OS/BS(%)
5.24±1.96
3.39±1.08**
N.Ob/Ob.S(/mm)
, http://www.100md.com
30.80±1.60
30.00±4.00
Sfi(%)
36.69±11.07
43.33±16.60
ES/BS(%)
26.79±4.09
18.28±4.81**
OcS/BS(%)
1.36±0.58
0.61±0.44**
, 百拇医药
N.Oc(/mm)
7.00±1.26
5.94±1.70
N.Nc
2.41±0.54
1.76±0.44**
注:*两组间比较P<0.05,有显著性差异。**两组间比较P<0.01,有极显著差异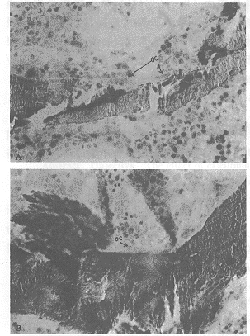
图1 对照组和降钙素组破骨吸收表面的比较。
A.对照组破骨吸收表面见较深的吸收陷窝,陷窝表面见两个功能旺盛的破骨细胞(OC),该断面上见这两个破骨细胞的核数分别为5和4。
, http://www.100md.com
B.降钙素组破骨吸收表面见较平的吸收陷窝,表面附着的破骨细胞(OC)功能不活跃,核数为2。
图2 对照组和降钙素组活性成骨表面的比较。
A.对照组成骨表面整齐排列的成骨细胞(OB)及其下分泌的类骨质(OS),成骨细胞呈圆形或方形,其下类骨质厚。
B.降钙素组被扁平细胞(LC)覆盖的成骨表面。
骨小梁相对体积:降钙素组与对照组无差异。
3 讨论
骨重建过程发生在骨重建单位,它是一个基本多细胞单位,分散在骨内膜、骨小梁、哈佛氏管及骨外膜表面上。一个完整的骨重建过程分四期:由破骨细胞的前体形成破骨细胞并附着在骨表面称为激活期,破骨细胞在骨表面吸收一定量的骨质,形成吸收陷窝即消失,为吸收期,在吸收陷窝上出现单核细胞,可能对吸收表面起修饰作用,此期为反转期,此后成骨细胞出现在吸收陷窝表面并制造新骨,当形成与吸收的骨量大致相当时,成骨细胞失去活性变为静止的衬细胞,此为形成期,此时骨重建过程结束,形成一个新骨结构单位。
, http://www.100md.com
对于某一特定的骨表面,一个骨重建过程结束时净剩的骨量取决于吸收期和形成期吸收和形成的骨量之差,在正常年轻成人,二者相等,处于平衡状态。当骨吸收大于骨形成时,为重建负平衡;反之为正平衡。在组织水平上,骨量的大小还受骨重建激活率的影响。在重建负平衡的状态下,激活率的增加将增加骨量丢失,而在重建正平衡的状态下,激活率的增加会提高骨量增加的速度。
下面就本研究中降钙素对骨重建过程中骨吸收和骨形成过程以及骨量的影响分别进行讨论。
3.1 对破骨吸收的影响
本研究使用降钙素,降钙素与破骨细胞上的降钙素受体结合,抑制骨吸收[1]。降钙素组使用降钙素的剂量为1U/100g/day,连续2日。降钙素组总的骨吸收表面、活性吸收表面明显小于对照组,如以破骨细胞表面占总吸收表面的比率计算,对照组是实验组的3.26倍。这显示了降钙素抑制骨吸收的明显效果,但即使如此大的剂量,也并不是完全抑制。分析降钙素对单位长度上破骨细胞数和细胞核数的影响发现,前者对照组和降钙素组无明显差异,而后者两组有极显著差异,降钙素组破骨细胞的平均核数明显低于对照组,这提示降钙素抑制破骨细胞的吸收功能是通过如下两个机制来实现的:一是减少活性吸收表面的数量,二是通过降低破骨细胞的功能(破骨细胞的核数反映其功能),而不是通过减少单位吸收长度上的破骨细胞数来实现的。Chambers[7]的体外实验观察到,降钙素可以使破骨细胞离开吸收表面,而未离开吸收表面的破骨细胞的刷状缘也消失,而刷状缘的存在是破骨细胞表现活性的重要电镜形态学标志,这与本实验的结果一致。
, 百拇医药
3.2 对骨形成的影响
降钙素对成骨细胞功能的影响目前尚不清楚,一些体外实验[8]和少数的体内试验提示它可以促进成骨细胞的功能[9],但David等最近的体内试验研究却发现降钙素抑制成骨细胞的活性,特别是使犬松质骨矿化延迟[3],类骨质表面和体积明显下降,并使胫骨和椎体的生物力学性能明显下降[4]。在骨重建过程中,分泌骨基质是活性成骨细胞的重要功能之一。本实验中在骨形成的静态参数方面:类骨质表面(OS/BS)、类骨质体积(Vos/TV)、类骨质厚度(O.Th),降钙素组均明显小于对照组,Delmas等研究联合应用二磷酸盐和hPTH(1-34)对老年羊骨组织的作用发现,单独应用低剂量PTH成骨活性明显增加,而联合应用二磷酸盐和hPTH(1-34),成骨活性明显受到抑制[10]。上述结果说明,降钙素不仅抑制了大鼠、羊和犬的破骨吸收,也抑制成骨细胞的骨形成能力。
, http://www.100md.com
那么降钙素是通过什么机制抑制成骨细胞的骨形成过程呢?虽然成骨细胞上存在降钙素受体[11],但尚未发现其对成骨细胞的直接作用。Harts的研究结果提示,二磷酸盐同时抑制骨吸收与骨形成,而对骨形成的作用是通过影响骨吸收与骨形成的偶联来完成的[12]。本实验中降钙素组成骨细胞骨形成表面(Sfa)与对照组相比无显著性差异,单位成骨细胞骨形成表面上的成骨细胞数量(N.Ob)也无差异,与David的结果相同[4],但成骨细胞的形态两组之间有明显差异,对照组成骨表面上的成骨细胞多呈立方形、大园形,而降钙素组成骨表面上的成骨细胞多呈梭形、扁圆形或小圆形。这说明降钙素可能并未影响成骨细胞的形成、增殖和向骨吸收表面的运动与附着,而可能主要影响其骨形成的活性。在骨重建过程中,骨吸收结束后,成骨细胞出现在吸收表面上,这一过程称为反转期,骨吸收与骨形成的偶联机制至今仍不清楚。体内外实验对其作了不少的研究,对激素、细胞因子在偶联中的作用、成骨细胞和破骨细胞的受体、骨吸收表面和反转表面的电镜形态学研究已经得到如下结论:激素、骨基质和骨髓环境中的细胞因子、骨吸收后骨祖细胞(Osteoprogenitor)周围的高钙环境、骨吸收后吸收陷窝中裸露的胶原纤维,都对偶联起一定作用。激素包括雌激素、PTH、降钙素、Vitmine D,细胞因子包括TGF-β、Activin、BMP、IGF-I、IGF-Ⅱ、前列腺素、IL-1、IL-4、IL-6、IL-11、TNF-α、PDGF、AChE[13-21]。
, 百拇医药
以TGF-β为例,骨吸收使骨基质释放TGF-β,刚释放出来的TGF-β无活性,在骨吸收过程中释放出来的另外两种蛋白质作用下,转变成活性TGF-β,可以直接刺激骨祖细胞向成骨细胞分化和向吸收表面的趋化。破骨细胞的活性与TGF-β在骨吸收表面上诱导成骨细胞的增殖相关。TGF-β可能在骨形成和骨吸收之间的偶联中起关键作用[13]。Amaguchi的体外研究发现,成骨细胞MC3T3-E1存在钙敏感受体[calcium-sensing receptor(CaR)]蛋白及其mRNA,CaR是一种G蛋白偶联的受体,最早发现位于甲状旁腺和肾组织,对细胞外钙离子的稳定起关键作用。位于成骨细胞上的CaR可能对刺激成骨细胞增殖和向吸收表面移动起关键作用。骨吸收后细胞外的高钙环境可能是通过这一机制来实现其调节偶联过程的[22]。但偶联过程是相当复杂的,它涉及到破骨细胞的凋亡、骨祖细胞向成骨细胞的分化、成骨细胞的增殖、成骨细胞向骨吸收表面的运动及附着、成骨细胞在骨吸收表面上行使功能,在空间上与骨吸收表面、骨髓内环境等相关,任何一个环节出现异常,都可能使这一过程暂时或永久性停止[23]。目前尚不清楚上述讨论的影响骨重建偶联过程的各种因素分别影响偶联过程的哪些环节以及相互之间的因果关系。结合上述这些研究结果,作者分析,本实验中观察到的降钙素对骨形成过程的抑制机制为:大剂量降钙素明显抑制破骨细胞骨吸收功能,因而导致骨髓或骨吸收表面上诱导偶联过程中无活性的成骨细胞向活性成骨细胞转化的某些因子减少(如TGFβ和Ca++)。
, 百拇医药
3.3 对松质骨骨量的影响
本实验中降钙素组松质骨骨量与对照组相比无差异,短期应用降钙素对松质骨骨量无影响是合理的。事实上,长期应用降钙素是否能增加骨量,目前也无一致结论,多数报告其不能增加松质骨骨量。
4 结论
4.1 降钙素可以明显抑制成年雄性大鼠的骨吸收。
4.2 降钙素抑制破骨细胞的吸收功能可能是通过如下两个机制来实现的:一是减少活性吸收表面的数量,二是通过降低破骨细胞的功能,而不是通过减少单位吸收长度上的破骨细胞数来实现的。
4.3 降钙素抑制成年雄性大鼠成骨细胞形成类骨质的活性,但不影响活性形成表面和单位活性形成表面上的成骨细胞数(N.Ob)。提示降钙素对骨形成过程的抑制机制为:大剂量降钙素明显抑制破骨细胞骨吸收功能,因而导致骨髓或骨吸收表面上诱导耦联过程中无活性的成骨细胞向活性成骨细胞转化的某些因子减少(如TGF-β和Ca++)。
, 百拇医药
4.4 成年雄性大鼠短期应用降钙素可使松质骨量无变化。
作者简介:张凤山,男,1964年出生,副主任医师。1990年毕业于原北京医科大学医学系,毕业后至今在北京大学第三临床医学院骨科工作,1996年至今在党耕町教授指导下攻读博士学位。主要从事脊柱外科、骨组织学的临床和基础研究。
参考文献
1,Massey HM,Flanagan AM.Human osteoclasts derive from CD14-positive monocytes.Br J Haematol,1999,106:167-70.
2,Mosekilde L,Danieslsen CC,Gasser J.The effect on vertebral bone mass and strength of long term treatment with antiresorptive agents(estrogen and calcitonin),human parathyroid hormone(1-38),and combination therapy,assessed in aged ovariectomized rats.Endocrinology,1994,134:2126-2134.
, http://www.100md.com
3,Monier-Faugere MC,Geng Z,Qi Q,et al.Calcitonin prevents bone loss,but decreases osteoblastic activity in ovariohysterectomized beagle dogs.J Bone Miner Res,1996,11:446-455.
4,David P,Thomas MD,Monier-Faugere MC,et al.Caltonin alters bone quality in beagle dogs.J Bone Miner Res,1997,12:1936-1943.
5,Liu CC.A simplified technique for temperature methymethacrylate embedding.Stain Technol.1987,62:155.
, 百拇医药
6,Parfitt AM,Drezner MK,Glorieux FH,et al.Bone histomorphometry:standardization of nomenclature,symbols,and units.Report of the ASBMR Histomorhometry Nomenclature Committee.J Bone Miner Res,1987,2:595-610.
7,Chambers TJ,Dunn CJ,Pharmacological control of osteoclastic mobility.Calcif Tissue Int,1983,35:566-579.
8,Farley JR,Wergedal JE,Hall SL,et al.Calcitonin has direct effects on 3[H]-thymidine incorporation and alkaline phosphatase activity in human osteoblast-like cells.Calcif Tissue Int,1991,48:297-301.
, 百拇医药
9,Wallach S,Farley JR,Baulink DJ,et al.Effects of calcitonin on bone quality and osteoblastic function.Calcif Tissue Int,1993,52:335-339.
10,Delmas P D,Vergnaud P.Arlot M E,et al.The anabolic effect of human PTH(1-34)on bone formation is blunted when bone resorption is inhibited by the bisphosphonate tiludronate——is activated resorption a prerequisite for the in vivo effect of PTH on formation in a remodeling system?Bone,1995,16(6):603-610.
, http://www.100md.com
11,Michelangeli VP,Frampton RJ.Transforming growth factor-beta modulates receptor binding of calciotropic hormones and G protein-mediated adenylate cyclase responses in osteoblast-like cells.Endocrinology,1992,131(3):1383-9.
12,Hart AB.Bisphosphonate effects on alveolar bone during rat molar drifting.J Dent Res,1988,67(11):1430-3.
13,Yoshikawa H,Takaoka K.Bone remodelling and its regulators.Nippon Rinsho,1994,52(9):2262-7.
, 百拇医药
14,Erlebacher A,Filvaroff EH,Ye JQ,et al.Osteoblastic responses to TGF-beta during bone remodeling.Mol Biol Cell,1998,9(7):1903-18.
15,Amaguchi T,Chattopadhyay N,Kifor O,et al.Mouse osteoblastic cell line(MC3T3-E1)expresses extracellular calcium(Ca2+o)-sensing receptor and its agonists stimulate chemotaxis and proliferation of MC3T3-E1 cells.J Bone Miner Res,1998,13(100:1530-8.
16,Gowen M,Wood DD,Russell RG,et al.Stimulation of the proliferation of human bone cells in vitro by human monocyte products with interleukin-1 activity.J Clin Invest,1985,75(4):1223-17.
, 百拇医药
17,Peck WA,Rifas L,Shen V.Macrophages release a peptide stimulator of osteoblast growth.Ann Biol Clin(Paris),1985,43(5):751-4.
18,Sakai R,Eto Y,Hirafuji M,et al.Activin release from bone coupled to bone resorption in organ culture of neonatal mouse calvaria.Bone,2000,26(3):235-40.
19,Tsukamoto T,Atsui T,Nakata H,et al.Interleukin-1 enhances the response of osteoblasts to platelet-derived growth factor through the alpha receptor-specific up-regulation.J Biol Chem,1991,266(16):10143-7.
, 百拇医药
20,Genever PG,Birch MA,Brown E,et al.Osteoblast-derived acetylcholinesterase:a novel mediator of cell-matrix interactions in bone?Bone,1999,24(4):297-303.
21,Tsukamoto T,Matsui T,Fukase M,et al.Platelet-derived growth factor B chain homodimer enhances chemotaxis and DNA synthesis in normal osteoblast-like cells(MC3T3-E1).Biochem Biophys Res Commun,1991,175(3):745-51.
22,Amaguchi T,Chattopadhyay N,Kifor O,et al.Mouse osteoblastic cell line(MC3T3-E1)expresses extracellular calcium(Ca2+o)-sensing receptor and its agonists stimulate chemotaxis and proliferation of MC3T3-E1 cells.J Bone Miner Res,1998,13(10):1530-8.
23,Croucher PI,Gilks WR,Compston JE.Evidence for interrupted bone resorption in human iliac cancellous bone.J Bone Miner Res,1995,10(10):1537-43., http://www.100md.com
单位:张凤山(北京大学第三临床医学院骨科 100083);党耕町(北京大学第三临床医学院骨科 100083);王志国(北京大学第三临床医学院骨科 100083);张惠珠(北京大学第三临床医学院骨科 100083)
关键词:降钙素;骨重建过程;松质骨;骨组织形态计量学;偶联过程
中国骨质疏松杂志000403 摘要 目的 在体研究降钙素对成年雄性大鼠松质骨重建过程的影响,并分析其影响机制。方法 12只大鼠平均分成对照组和降钙素组,后者皮内注射鳗鱼降钙素1U/100 g/日,连续2日。7日后取第4、5腰椎,行不脱钙骨组织切片,骨组织形态计量学分析,方差分析比较两组结果。结果 骨吸收陷窝表面、活性吸收表面、破骨细胞平均细胞核数,降钙素组明显小于对照组。类骨质表面、类骨质相对体积、类骨质厚度,降钙素组明显小于对照组,成骨细胞形态两组之间有显著差异。骨小梁相对体积,两组之间无差异。结论 降钙素对正常成年雄性大鼠松质骨而言,可以明显抑制破骨吸收,这种作用可能是通过减少活性吸收表面数量和降低破骨细胞的吸收功能来完成的;可以抑制成骨细胞形成类骨质的活性,这种作用可能不是直接的,而是通过降钙素对骨吸收的抑制作用进而影响了骨吸收与骨形成的之间的偶联而完成的;短期应用降钙素骨量无变化。
, 百拇医药
Effect of calcitonin on bone remodeling of adult male Wistar rat
Zhang Fengshan,Dang Gengtin,Wang Zhiguo
(The Third Clinical Medical School of Beijing University,Beijing 100083,China)
Abstract Objective The effect of calcitonin on bone remodeling of adult male Wistar rat was observed and the mechanism was analyzed.Methods Twelve rats were distributed randomly to control and calcitonin groups.The rats in calcitonin group were administered elatonin(1U/100g/day,2days).The fourth and fifth lumbar vertebral bodies were undecalcified and analyzed by histomorphometry.T-test was used to analyze the differences between the two groups.Results The eroded surface,active resorptive surface,nuclear number of osteoclasts in calcitonin group were less than in control group.The osteoid surface,osteoid volume,osteoid thickness in calcitonin group were less than in control group.There was significant difference in osteoblast appearance between calcitonin and control groups.There is no difference of trabecular volume between calcitonin and control group. Conclusion For normal adult male rat,calcitonin depresses the osteoclastic resorption obviously through reducing the number of active resorptive surface and depressing osteoclastic activity;on the other hand,calcitonin depresses the osteoid producing activity of osteoblasts by indirectly affecting the coupling process between resorption and formation.Calcitonin administered in short did not affect the bone volume.
, 百拇医药
Key words Calcitonin Bone Remodeling process Trabecular bone Bone histomophormetry Coupling process
骨组织通过骨重建过程完成骨转换,与年龄相关的骨量丢失就是在这一过程中发生的。降钙素通过与破骨细胞上的降钙素受体结合,抑制骨重建过程中的破骨吸收[1],因而被广泛用来预防和治疗骨质疏松症,但大量的临床和实验室研究文献报告降钙素可以预防骨量的进一步丢失,却不能恢复骨量[2],其原因是什么?骨重建过程是骨吸收和骨形成过程的偶联,降钙素对骨吸收的抑制是否影响后续的骨形成过程,如果有影响,其影响机制是什么?国外文献对这些问题近年有一些散在的报告,但有争论,且研究不深入[3,4]。本文的目的除了进一步观察降钙素对骨吸收的抑制作用外,重点观察降钙素对正常的骨重建过程中骨形成过程的影响,并通过分析其影响结果,在细胞水平上探讨其影响机制,特别注意分析降钙素是否通过影响骨重建的偶联过程来影响骨形成。通过这一研究,为进一步正确、全面认识降钙素在骨质疏松症治疗中的地位提供参考。
, 百拇医药
1 材料和方法
1.1 动物分组及饲养
12只三级雄性Wistar-Lewis大鼠,体重360~440克(18周),标准饲料(钙、磷的含量分别为1.25%和0.7%)、自来水、垫料均经灭菌处理,大鼠自由摄取水和饲料,清洁喂养,人工12/12小时昼夜周期。12只动物平均分成2组:降钙素组和对照组。
1.2 用药
两组动物均饲养7日,其中对照组于实验第1、2天皮内注射生理盐水,降钙素组于第1、2天皮内注射鳗鱼降钙素(Elatonin),1U/100g/天。所有动物于用药开始后满7天于腹腔内注射3%戊巴比妥钠4 mg/100 g麻醉后取材,然后处死。合成降钙素衍生物益钙宁(Elcatonin)注射液由日本旭化成工业株式会社生产。1.3 组织标本取材制作
, 百拇医药 每只大鼠分别取相连的第4、第5腰椎,常规福尔马林溶液固定,乙醇上升梯度脱水,甲基丙烯酸甲酯包埋[5]。用Reucgart-Jung型切片机沿椎体矢状面作不连续不脱钙切片,选取5μm的中矢状面上切片3~5张,用1%甲苯胺蓝染色。
1.4 组织形态计量学分析
采用Opton ⅢRS多功能显微镜、Morphomat-10半自动图像分析系统(西德),测量参数如下[6]:BV/TV(%):骨小梁相对体积;Vos/TV(%)类骨质相对体积;OS/BS(%):类骨质表面;Ob.S/BS(%):骨小梁成骨细胞表面;Sfi(%):静止骨形成表面;ES/BS(%):吸收陷窝表面;Oc.S/BS(%):破骨细胞吸收表面;O.Th(μm):类骨质厚度;N.Ob/Ob.S(/mm):单位形成表面的成骨细胞数;N.Oc/Oc.S(/mm):单位活性吸收表面的破骨细胞数;N.Nc:破骨细胞核计数
, http://www.100md.com
所有的参数均测自腰椎小梁骨,测量范围为:远离皮质骨表面两个骨小梁厚度,远离终板1 mm。
1.5 统计学分析
各组大鼠所有参数均以均数±标准差表示(
 ±s)。组间差异采用方差分析,显著性t检验。P<0.05被认为有显著性差异,P<0.01被认为有极显著差异。
±s)。组间差异采用方差分析,显著性t检验。P<0.05被认为有显著性差异,P<0.01被认为有极显著差异。2 结果
测量参数结果可见表1。
骨吸收参数:骨吸收陷窝表面、活性吸收表面(破骨细胞表面)、破骨细胞平均细胞核数,降钙素组明显小于对照组,如以破骨细胞表面占总吸收表面的比率计算,对照组是实验组的3.26倍;吸收表面单位长度上破骨细胞数对照组和降钙素组无明显差异(图1)。
, http://www.100md.com
骨形成参数:类骨质表面、类骨质相对体积、类骨质厚度,降钙素组均明显小于对照组,成骨细胞的形态两组之间有明显差异,对照组成骨表面上的成骨细胞多呈立方形、大园形,而降钙素组成骨表面上的成骨细胞多呈梭形、扁圆形或小圆形。成骨细胞骨形成表面、单位形成表面的成骨细胞数,降钙素组与对照组相比无显著性差异(图2)。
表1 对照组和降钙素组静态组织形态
计量学参数(
 ±s) 参数
±s) 参数对照组
降钙素组
BV/TV(%)
30.56±4.30
, 百拇医药
27.77±3.48
Vos/TV(%)
0.24±0.06
0.13±0.07**
O.Th(μm)
2.12±0.44
1.85±0.34**
OS/BS(%)
5.24±1.96
3.39±1.08**
N.Ob/Ob.S(/mm)
, http://www.100md.com
30.80±1.60
30.00±4.00
Sfi(%)
36.69±11.07
43.33±16.60
ES/BS(%)
26.79±4.09
18.28±4.81**
OcS/BS(%)
1.36±0.58
0.61±0.44**
, 百拇医药
N.Oc(/mm)
7.00±1.26
5.94±1.70
N.Nc
2.41±0.54
1.76±0.44**
注:*两组间比较P<0.05,有显著性差异。**两组间比较P<0.01,有极显著差异

图1 对照组和降钙素组破骨吸收表面的比较。
A.对照组破骨吸收表面见较深的吸收陷窝,陷窝表面见两个功能旺盛的破骨细胞(OC),该断面上见这两个破骨细胞的核数分别为5和4。
, http://www.100md.com
B.降钙素组破骨吸收表面见较平的吸收陷窝,表面附着的破骨细胞(OC)功能不活跃,核数为2。

图2 对照组和降钙素组活性成骨表面的比较。
A.对照组成骨表面整齐排列的成骨细胞(OB)及其下分泌的类骨质(OS),成骨细胞呈圆形或方形,其下类骨质厚。
B.降钙素组被扁平细胞(LC)覆盖的成骨表面。
骨小梁相对体积:降钙素组与对照组无差异。
3 讨论
骨重建过程发生在骨重建单位,它是一个基本多细胞单位,分散在骨内膜、骨小梁、哈佛氏管及骨外膜表面上。一个完整的骨重建过程分四期:由破骨细胞的前体形成破骨细胞并附着在骨表面称为激活期,破骨细胞在骨表面吸收一定量的骨质,形成吸收陷窝即消失,为吸收期,在吸收陷窝上出现单核细胞,可能对吸收表面起修饰作用,此期为反转期,此后成骨细胞出现在吸收陷窝表面并制造新骨,当形成与吸收的骨量大致相当时,成骨细胞失去活性变为静止的衬细胞,此为形成期,此时骨重建过程结束,形成一个新骨结构单位。
, http://www.100md.com
对于某一特定的骨表面,一个骨重建过程结束时净剩的骨量取决于吸收期和形成期吸收和形成的骨量之差,在正常年轻成人,二者相等,处于平衡状态。当骨吸收大于骨形成时,为重建负平衡;反之为正平衡。在组织水平上,骨量的大小还受骨重建激活率的影响。在重建负平衡的状态下,激活率的增加将增加骨量丢失,而在重建正平衡的状态下,激活率的增加会提高骨量增加的速度。
下面就本研究中降钙素对骨重建过程中骨吸收和骨形成过程以及骨量的影响分别进行讨论。
3.1 对破骨吸收的影响
本研究使用降钙素,降钙素与破骨细胞上的降钙素受体结合,抑制骨吸收[1]。降钙素组使用降钙素的剂量为1U/100g/day,连续2日。降钙素组总的骨吸收表面、活性吸收表面明显小于对照组,如以破骨细胞表面占总吸收表面的比率计算,对照组是实验组的3.26倍。这显示了降钙素抑制骨吸收的明显效果,但即使如此大的剂量,也并不是完全抑制。分析降钙素对单位长度上破骨细胞数和细胞核数的影响发现,前者对照组和降钙素组无明显差异,而后者两组有极显著差异,降钙素组破骨细胞的平均核数明显低于对照组,这提示降钙素抑制破骨细胞的吸收功能是通过如下两个机制来实现的:一是减少活性吸收表面的数量,二是通过降低破骨细胞的功能(破骨细胞的核数反映其功能),而不是通过减少单位吸收长度上的破骨细胞数来实现的。Chambers[7]的体外实验观察到,降钙素可以使破骨细胞离开吸收表面,而未离开吸收表面的破骨细胞的刷状缘也消失,而刷状缘的存在是破骨细胞表现活性的重要电镜形态学标志,这与本实验的结果一致。
, 百拇医药
3.2 对骨形成的影响
降钙素对成骨细胞功能的影响目前尚不清楚,一些体外实验[8]和少数的体内试验提示它可以促进成骨细胞的功能[9],但David等最近的体内试验研究却发现降钙素抑制成骨细胞的活性,特别是使犬松质骨矿化延迟[3],类骨质表面和体积明显下降,并使胫骨和椎体的生物力学性能明显下降[4]。在骨重建过程中,分泌骨基质是活性成骨细胞的重要功能之一。本实验中在骨形成的静态参数方面:类骨质表面(OS/BS)、类骨质体积(Vos/TV)、类骨质厚度(O.Th),降钙素组均明显小于对照组,Delmas等研究联合应用二磷酸盐和hPTH(1-34)对老年羊骨组织的作用发现,单独应用低剂量PTH成骨活性明显增加,而联合应用二磷酸盐和hPTH(1-34),成骨活性明显受到抑制[10]。上述结果说明,降钙素不仅抑制了大鼠、羊和犬的破骨吸收,也抑制成骨细胞的骨形成能力。
, http://www.100md.com
那么降钙素是通过什么机制抑制成骨细胞的骨形成过程呢?虽然成骨细胞上存在降钙素受体[11],但尚未发现其对成骨细胞的直接作用。Harts的研究结果提示,二磷酸盐同时抑制骨吸收与骨形成,而对骨形成的作用是通过影响骨吸收与骨形成的偶联来完成的[12]。本实验中降钙素组成骨细胞骨形成表面(Sfa)与对照组相比无显著性差异,单位成骨细胞骨形成表面上的成骨细胞数量(N.Ob)也无差异,与David的结果相同[4],但成骨细胞的形态两组之间有明显差异,对照组成骨表面上的成骨细胞多呈立方形、大园形,而降钙素组成骨表面上的成骨细胞多呈梭形、扁圆形或小圆形。这说明降钙素可能并未影响成骨细胞的形成、增殖和向骨吸收表面的运动与附着,而可能主要影响其骨形成的活性。在骨重建过程中,骨吸收结束后,成骨细胞出现在吸收表面上,这一过程称为反转期,骨吸收与骨形成的偶联机制至今仍不清楚。体内外实验对其作了不少的研究,对激素、细胞因子在偶联中的作用、成骨细胞和破骨细胞的受体、骨吸收表面和反转表面的电镜形态学研究已经得到如下结论:激素、骨基质和骨髓环境中的细胞因子、骨吸收后骨祖细胞(Osteoprogenitor)周围的高钙环境、骨吸收后吸收陷窝中裸露的胶原纤维,都对偶联起一定作用。激素包括雌激素、PTH、降钙素、Vitmine D,细胞因子包括TGF-β、Activin、BMP、IGF-I、IGF-Ⅱ、前列腺素、IL-1、IL-4、IL-6、IL-11、TNF-α、PDGF、AChE[13-21]。
, 百拇医药
以TGF-β为例,骨吸收使骨基质释放TGF-β,刚释放出来的TGF-β无活性,在骨吸收过程中释放出来的另外两种蛋白质作用下,转变成活性TGF-β,可以直接刺激骨祖细胞向成骨细胞分化和向吸收表面的趋化。破骨细胞的活性与TGF-β在骨吸收表面上诱导成骨细胞的增殖相关。TGF-β可能在骨形成和骨吸收之间的偶联中起关键作用[13]。Amaguchi的体外研究发现,成骨细胞MC3T3-E1存在钙敏感受体[calcium-sensing receptor(CaR)]蛋白及其mRNA,CaR是一种G蛋白偶联的受体,最早发现位于甲状旁腺和肾组织,对细胞外钙离子的稳定起关键作用。位于成骨细胞上的CaR可能对刺激成骨细胞增殖和向吸收表面移动起关键作用。骨吸收后细胞外的高钙环境可能是通过这一机制来实现其调节偶联过程的[22]。但偶联过程是相当复杂的,它涉及到破骨细胞的凋亡、骨祖细胞向成骨细胞的分化、成骨细胞的增殖、成骨细胞向骨吸收表面的运动及附着、成骨细胞在骨吸收表面上行使功能,在空间上与骨吸收表面、骨髓内环境等相关,任何一个环节出现异常,都可能使这一过程暂时或永久性停止[23]。目前尚不清楚上述讨论的影响骨重建偶联过程的各种因素分别影响偶联过程的哪些环节以及相互之间的因果关系。结合上述这些研究结果,作者分析,本实验中观察到的降钙素对骨形成过程的抑制机制为:大剂量降钙素明显抑制破骨细胞骨吸收功能,因而导致骨髓或骨吸收表面上诱导偶联过程中无活性的成骨细胞向活性成骨细胞转化的某些因子减少(如TGFβ和Ca++)。
, 百拇医药
3.3 对松质骨骨量的影响
本实验中降钙素组松质骨骨量与对照组相比无差异,短期应用降钙素对松质骨骨量无影响是合理的。事实上,长期应用降钙素是否能增加骨量,目前也无一致结论,多数报告其不能增加松质骨骨量。
4 结论
4.1 降钙素可以明显抑制成年雄性大鼠的骨吸收。
4.2 降钙素抑制破骨细胞的吸收功能可能是通过如下两个机制来实现的:一是减少活性吸收表面的数量,二是通过降低破骨细胞的功能,而不是通过减少单位吸收长度上的破骨细胞数来实现的。
4.3 降钙素抑制成年雄性大鼠成骨细胞形成类骨质的活性,但不影响活性形成表面和单位活性形成表面上的成骨细胞数(N.Ob)。提示降钙素对骨形成过程的抑制机制为:大剂量降钙素明显抑制破骨细胞骨吸收功能,因而导致骨髓或骨吸收表面上诱导耦联过程中无活性的成骨细胞向活性成骨细胞转化的某些因子减少(如TGF-β和Ca++)。
, 百拇医药
4.4 成年雄性大鼠短期应用降钙素可使松质骨量无变化。
作者简介:张凤山,男,1964年出生,副主任医师。1990年毕业于原北京医科大学医学系,毕业后至今在北京大学第三临床医学院骨科工作,1996年至今在党耕町教授指导下攻读博士学位。主要从事脊柱外科、骨组织学的临床和基础研究。
参考文献
1,Massey HM,Flanagan AM.Human osteoclasts derive from CD14-positive monocytes.Br J Haematol,1999,106:167-70.
2,Mosekilde L,Danieslsen CC,Gasser J.The effect on vertebral bone mass and strength of long term treatment with antiresorptive agents(estrogen and calcitonin),human parathyroid hormone(1-38),and combination therapy,assessed in aged ovariectomized rats.Endocrinology,1994,134:2126-2134.
, http://www.100md.com
3,Monier-Faugere MC,Geng Z,Qi Q,et al.Calcitonin prevents bone loss,but decreases osteoblastic activity in ovariohysterectomized beagle dogs.J Bone Miner Res,1996,11:446-455.
4,David P,Thomas MD,Monier-Faugere MC,et al.Caltonin alters bone quality in beagle dogs.J Bone Miner Res,1997,12:1936-1943.
5,Liu CC.A simplified technique for temperature methymethacrylate embedding.Stain Technol.1987,62:155.
, 百拇医药
6,Parfitt AM,Drezner MK,Glorieux FH,et al.Bone histomorphometry:standardization of nomenclature,symbols,and units.Report of the ASBMR Histomorhometry Nomenclature Committee.J Bone Miner Res,1987,2:595-610.
7,Chambers TJ,Dunn CJ,Pharmacological control of osteoclastic mobility.Calcif Tissue Int,1983,35:566-579.
8,Farley JR,Wergedal JE,Hall SL,et al.Calcitonin has direct effects on 3[H]-thymidine incorporation and alkaline phosphatase activity in human osteoblast-like cells.Calcif Tissue Int,1991,48:297-301.
, 百拇医药
9,Wallach S,Farley JR,Baulink DJ,et al.Effects of calcitonin on bone quality and osteoblastic function.Calcif Tissue Int,1993,52:335-339.
10,Delmas P D,Vergnaud P.Arlot M E,et al.The anabolic effect of human PTH(1-34)on bone formation is blunted when bone resorption is inhibited by the bisphosphonate tiludronate——is activated resorption a prerequisite for the in vivo effect of PTH on formation in a remodeling system?Bone,1995,16(6):603-610.
, http://www.100md.com
11,Michelangeli VP,Frampton RJ.Transforming growth factor-beta modulates receptor binding of calciotropic hormones and G protein-mediated adenylate cyclase responses in osteoblast-like cells.Endocrinology,1992,131(3):1383-9.
12,Hart AB.Bisphosphonate effects on alveolar bone during rat molar drifting.J Dent Res,1988,67(11):1430-3.
13,Yoshikawa H,Takaoka K.Bone remodelling and its regulators.Nippon Rinsho,1994,52(9):2262-7.
, 百拇医药
14,Erlebacher A,Filvaroff EH,Ye JQ,et al.Osteoblastic responses to TGF-beta during bone remodeling.Mol Biol Cell,1998,9(7):1903-18.
15,Amaguchi T,Chattopadhyay N,Kifor O,et al.Mouse osteoblastic cell line(MC3T3-E1)expresses extracellular calcium(Ca2+o)-sensing receptor and its agonists stimulate chemotaxis and proliferation of MC3T3-E1 cells.J Bone Miner Res,1998,13(100:1530-8.
16,Gowen M,Wood DD,Russell RG,et al.Stimulation of the proliferation of human bone cells in vitro by human monocyte products with interleukin-1 activity.J Clin Invest,1985,75(4):1223-17.
, 百拇医药
17,Peck WA,Rifas L,Shen V.Macrophages release a peptide stimulator of osteoblast growth.Ann Biol Clin(Paris),1985,43(5):751-4.
18,Sakai R,Eto Y,Hirafuji M,et al.Activin release from bone coupled to bone resorption in organ culture of neonatal mouse calvaria.Bone,2000,26(3):235-40.
19,Tsukamoto T,Atsui T,Nakata H,et al.Interleukin-1 enhances the response of osteoblasts to platelet-derived growth factor through the alpha receptor-specific up-regulation.J Biol Chem,1991,266(16):10143-7.
, 百拇医药
20,Genever PG,Birch MA,Brown E,et al.Osteoblast-derived acetylcholinesterase:a novel mediator of cell-matrix interactions in bone?Bone,1999,24(4):297-303.
21,Tsukamoto T,Matsui T,Fukase M,et al.Platelet-derived growth factor B chain homodimer enhances chemotaxis and DNA synthesis in normal osteoblast-like cells(MC3T3-E1).Biochem Biophys Res Commun,1991,175(3):745-51.
22,Amaguchi T,Chattopadhyay N,Kifor O,et al.Mouse osteoblastic cell line(MC3T3-E1)expresses extracellular calcium(Ca2+o)-sensing receptor and its agonists stimulate chemotaxis and proliferation of MC3T3-E1 cells.J Bone Miner Res,1998,13(10):1530-8.
23,Croucher PI,Gilks WR,Compston JE.Evidence for interrupted bone resorption in human iliac cancellous bone.J Bone Miner Res,1995,10(10):1537-43., http://www.100md.com