多聚体缓释系统局部给药治疗脑胶质瘤
作者:陈忠平
单位:中山医科大学肿瘤防治中心脑外科,广东 广州 510060
关键词:胶质瘤;局部化疗;多聚体
癌症000433
中图分类号:R739.41 文献标识码:A
文章编号:1000-467X(2000)04-0387-03
脑肿瘤的传统治疗为手术切除加放疗和化疗。对消灭残留肿瘤细胞,防止肿瘤复发,化疗起重要作用。由于神经系统的特殊性,许多药物(大分子)不易通过血脑屏障给脑瘤的化疗增加了困难。避开血脑屏障的局部给药,可以减少全身用药的毒副作用而大大提高肿瘤局部的药物浓度,可望是控制脑瘤局部复发的有效手段。近年来的研究提示,多聚体(polymer)药物缓释系统是理想的局部缓慢给药方式,在治疗脑肿瘤方面预示了明显的优越性[1]。本文将复习多聚体局部给药治疗脑胶质瘤的背景知识及其应用。
, http://www.100md.com
1 局部给药治疗脑瘤的基础
局部给药治疗脑瘤有以下几点理论基础:
(1)提高局部药物浓度而减少全身毒副作用。临床有效的抗癌药必须在肿瘤内达到足够的药物浓度而对身体其它系统无或仅是可以耐受的毒性作用。系统给药化疗使全身所有组织器官都暴露于抗癌药,特别是治疗脑肿瘤,由于血脑屏障的存在,往往需要加大剂量才能在中枢神经系统达到有效药物浓度。因此,使得治疗剂量接近甚至超过病人的最大耐受剂量,有些病人因严重全身毒副作用而无法接受化疗。局部给药可以用较小的剂量达到最大治疗浓度,而身体其它部位的抗癌药物浓度极低,可以明显减少全身毒副作用。
(2)避过血脑屏障。许多经典的对其它肿瘤有效的抗癌药,即使体外细胞药敏试验有效,但由于不能通过血脑屏障而不能采用全身给药用于脑肿瘤治疗。目前,临床上应用于脑肿瘤化疗的药物主要还是亚硝脲类如BCNU,CCNU等几种。向肿瘤部位直接给药,避开了血脑屏障,大大增加了脑瘤化疗药物选择范围。
, 百拇医药
(3)脑肿瘤几乎没有转移,向颅外的远方转移更是罕见。脑肿瘤局部复发,80%在原来肿瘤的2cm范围内[2],这就使得局部化疗能够达到理想的效果。
避开血脑屏障的局部给药有多种方式,临床上已经采用的方法有经预置的导管向瘤腔内直接注射(如采用Omaya),还有经皮下埋置药泵持续给药。这些给药系统无疑能明显提高局部药物浓度,但由于感染、机械的和导管堵塞等原因限制了临床应用效果。多聚体药物缓释系统是以多聚体为载体,将抗癌药物与其结合,结合在多聚体内的药物能在局部缓慢地释放,达到持续给药的目的。所以,这是理想的局部给药手段[1]。
2 多聚体技术
多聚体作为药物载体的研究始于70年代中期,美国波斯顿麻省总医院的Langer和Folkman首先将大分子物质(如蛋白)与多聚体结合,这些大分子物质能从多聚体内以弥散的方式逐步释放[3]。随后的研究又成功地将抗生素、生物因子、化疗药物等结合进入多聚体[4~6]。
, http://www.100md.com
最早的多聚体是采用醋酸乙烯(ethylene-vinylacetate,EVAc)。虽然在实验室证明它是良好的药物载体,但由于是非生物分解型多聚体,置入体内后,药物虽然能以弥散的方式逐步释出,但将留下载体异物。PCPP-SA{poly[bis-(p-carboxyphenoxy)propane]-sebacicacid}则是生物分解型多聚化合物,它的优点是:①由于它在体内是从周边向中心以稳定的速度被降解,所以药物释放稳定;②生物分解型多聚体能防止药物被水解破坏,保持原有活性;③多聚体的降解速度取决于PCPP和SA的比例搭配,通常药物释放可以持续数周、数月甚至超过一年[7];④由于多聚体本身被降解了,所以最终没有异物留下。脂肪酸二聚癸二酸(fattyaciddimer-sebacicacid,FAD-SA)被用于载带亲水性制剂,如顺铂[8]。采用poly(lactide-co-glycolide)多聚体与化疗药物或其它大分子结合,制成微球(microspheres)更可以用立体定向的方式注入脑内[9]。用作载体的多聚体还有聚乙烯乙二醇(polyethyleneglycol)、明胶(gelatin)等[10]。多聚体技术的研究包括二个方面,即各种不同载体的研究和被载物的应用研究。采用基因工程技术合成蛋白类多聚体是有别于化学合成多聚体的新技术[11],而采用多聚体缓释系统作为基因治疗的载体则是又一应用方面[12]。
, 百拇医药
实验证明,以多聚体作为载体局部给药,可明显延长局部脑组织与药物的接触时间。Grossman等将[3H]标记BCNU,比较不同给药方式局部脑组织与药物的接触情况。结果局部直接注入的BCNU很快被清除,24h后,只有15%的局部脑组织有BCNU,到72h时,仅剩极少的区域有可测得的[3H]-BCNU。而结合于多聚体内的药物,由于逐步释放,72h后40%的区域有[3H]-BCNU,500h后还有15%(图1)。Fung等观察了多聚体局部给药后BCNU的动态分布[13],一天后血液中的BCNU浓度只有脑内的20%,脑脊液(CSF)内为脑实质的56%。二周后血液中的BCNU为30%,脑脊液中降至20%(表1)。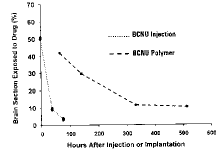
图1 多聚体局部给药与直接注射BCNU后脑组织切片内药物分布比较
, 百拇医药 表1 多聚体局部给药后BCNU的分布 部位
BCNU浓度(μmol/L)
6h
1d
7d
14d
血液
2.2
0.7
NP
0.3
CSF
8.1
, http://www.100md.com
1.8
NP
0.2
植入部位脑组织
NP
3.2
1.6
1.0
NP:未测定
多聚体作为载体局部给药,给神经外科病人的治疗开辟了一条新的途径。特别是对恶性胶质瘤病人,可以局部给予化疗药、肾上腺糖皮质激素、抗癫痫药、抗血管形成剂和许多其它大分子包括免疫毒素(表2)。
表2 已被研究的多聚体缓释药物 药物种类
, http://www.100md.com
实例
研究者
化疗药
BCNU
Brem,etal.[14]
Taxol
Walter,etal.[6]
Camptothecin
Weingart,etal.[15]
Carboplatin
Olivi,etal.[8]
, http://www.100md.com
修饰的化疗药
Methotrexate-dextran
Dang,etal.[16]
四羟过氧环磷酸酰胺
Judy,etal.[17]
激素
地塞米松
Tamargo,etal.[18]
抗血管形成剂
肝素和可的松
Tamargo,etal.[19]
, http://www.100md.com
Minocycline
Weingart,etal.[20]
抗癫痫药
二苯内酰脲
Tamargo,etal.[21]
生物制剂
免疫毒素
phillips,etal.[22]
反义核苷酸
Simons,etal.[23]
, http://www.100md.com
3 多聚体局部给药在治疗胶质瘤的应用
虽然有关多聚体局部给药的研究已有许多,但较为成熟的用于治疗脑胶质瘤的是以PCPP-SA为载体的BCNU。此制剂取名为Gliadel,已通过美国FDA鉴定,并推向市场。
3.1Gliadel
Gliadel是以PCPP-SA(20∶80)作为载体,加入3.8%BCNU,制成直径1.45cm厚1mm的圆碟片,每片含BCNU7.7mg。一系列的动物实验证明,PCPP-SA多聚体有很好的组织相溶性,与脑外科手术中常规用的明胶海绵比较它们的致炎症反应相当。在猴脑植入PCPP-SA对神经行为无影响,即使是含有BCNU的Gliadel也没有全身毒性作用发生。BCNU静脉注射很快被清除(t1/2<20min),而Gliadel释放有效药物(在兔脑)可持续3周。药物在脑内的弥散范围也很广,采用定量放射自显影和薄层层析技术,Gliadel植入一天后,弥散距离为4cm,一周是2cm,一个月后,在距手术部位1.3cm的区域还有可测得的药物浓度。采用多聚体局部给药在脑内的药物浓度可比静脉给药高出1200倍[14]。在动物实验,多聚体局部给药明显延长荷瘤鼠的生存时间,并且没有全身毒副作用。使用Gliadel后再加放疗,也没有明显的全身和神经毒性作用。
, 百拇医药
一组222例双盲对照的临床研究,复发脑胶质瘤病人在二次手术时瘤腔内植入Gliadel或不含BCNU的空白多聚体,病人中位生存时间Gliadel组为31周,而对照组病人仅23周(P=0.007)[24]。Gliadel在脑胶质瘤第一次手术时就用也同样有良好效果。Valtonen等报道了一组32例恶性胶质瘤病人(图2),随访2年,中位生存时间在首次手术时植入Gliadel的病人为58.1周,而对照组病人为39.9周(P=0.012)[25]。所以,Gliadel是临床上已经证明有效的,也是目前唯一已经商品化的用于治疗脑胶质瘤的缓释剂。
图2 恶性胶质瘤病人接受Gliadel植入与对照组的生存时间比较
临床应用Gliadel的注意事项[10]:(1)手术时应尽可能多的切除肿瘤组织,每个病人每次植入Gliadel最多不超过8片(BCNU总剂量61.6mg);(2)由于化疗药物在局部会引起脑水肿,所以手术后要加大肾上腺糖皮质激素的用量和延长使用时间;(3)使用Gliadel的病人,虽然感染发生率没有明显增加,但亦建议手术前后24h使用抗生素。(4)肿瘤腔与脑室有小的交通不影响应用Gliadel,但植入的Gliadel进入脑室系统,引起脑脊液循环障碍导致脑积水的话,则不能使用。(5)虽然总体来讲,使用Gliadel并没有增加癫痫的发生率,但病人手术后近期内癫痫的发生率增加,所以,在手术前就应使用抗癫痫药,以防术后短期内的癫痫,并在术后持续应用,特别是当病人接受大剂量激素时,更应监护血药浓度。
, 百拇医药
3.2其它多聚体缓释剂
除Gliadel外,正在进行研究的应用于治疗脑瘤的多聚体缓释剂还有许多,有些动物实验提示有很好的治疗效果。
3.2.1Taxoid类:Taxoid包括有Taxol和Taxotere,它们能与微管结合,使细胞阻止于G2期,继而通过细胞凋亡而使肿瘤细胞死亡[26]。临床试验证明Taxol对许多肿瘤有治疗作用,体外试验胶质瘤对其也很敏感,然而Taxol不易通过血脑屏障。Walter等将Taxol结合于PCPP-SA多聚体,治疗种植有9L胶质瘤的大鼠,生存时间延长3.1倍[6]。
3.2.2Camptothecin:Camptothecin是DNA复制酶topoisomeraseI的天然抑制剂,在临床前研究,Camptothecin对多种肿瘤有效。同样由于它对血脑屏障的通透性差,不适于以系统给药治疗颅内肿瘤。然而采用EVAc作为载体,局部给于Camptothecin,使荷瘤大鼠生存时间明显延长。治疗组59%的大鼠生存超过120天,而对照组都在32天内死亡[15]。
, http://www.100md.com
3.2.3Carboplatin:Carboplatin是第二代以铂为主体的抗癌药。载于FAD-SA多聚体内治疗大鼠颅内F98胶质瘤效果良好[27]。
3.2.4四羟过氧环磷酸酰胺(4-hydro-xyperoxycyclophosphamide,4-HC):4-HC是环磷酸酰胺的衍生物,它不需要经肝脏活化,因而适用于局部给药。在大鼠颅内接种F98胶质瘤5d后,局部给予4-HC/FAD-SA多聚体治疗,大鼠平均生存时间从对照组的14d增加到77d[17]。
4 多聚体局部给药应用前景
多聚体缓释系统除了可用于局部给予化疗药物外,还可用于载带其它制剂进入颅内。肾上腺糖皮质激素在脑外科病人,特别是脑肿瘤治疗中有肯定的作用,然而,全身给药具有许多副作用。Tamargo等将地塞米松载于EVAc多聚体内,治疗肿瘤引起的脑水肿,取得比系统给药更好的控制脑水肿的效果,而且保持血浆激素水平极低[18]。肿瘤血管形成是肿瘤生长的前提,实验证明使用血管形成抑制剂能抑制肿瘤生长,但由于它不能消灭肿瘤细胞而只能达到摵推焦泊,必须长期使用,多聚体缓释系统是一个理想的给药系统[20]。免疫毒素在动物实验证明有良好的治疗效果,但由于其分子量大难以通过血脑屏障,多聚体作为载体,局部植入可望能克服这一困难[22]。脑肿瘤的基因治疗,将目标基因传入颅腔内的肿瘤细胞,可用多聚体制成毫微体载带,以立体定向导入[28]。此外,多聚体缓释系统还可以同时载入多种治疗药物[20],使治疗效果更加显著。
, 百拇医药
通讯作者:陈忠平 Tel:86-20-87752547 Fax:86-20-87752547 E-mail:chenzhongping@hotmail.com
[参考文献]
[1]Thompson RC,Brem H. Treatment of gliomas using polymer- drug delivery [M]. The gliomas. Berger MS and Wilson CB (eds) W.B. Saunders Company,Toronto 1999: 555~ 563.
[2]Hochberg FH, Pruitt A. Assumptions in the radiotherapy of glioblastoma [J]. Neurology, 1980, 30:907~ 911.
, 百拇医药 [3]Langer R, Folkman J. Polymers for the sustained release of proteins and other macromolecules [J]. Nature, 1976, 263:797~ 800.
[4]Saltzman WM. Antibodies for treating and preventing disease: the potential role of polymeric controlled release [J]. Crit Rev Ther Drug Carrier Syst, 1993, 10:111~ 142.
[5]Murray JB, Brown L, Langer R, et al. A micro sustaind release system for epidermal growth factor [J]. In Vitro, 1983, 19:743~ 748.
, 百拇医药
[6]Walter KA, Cahan MA, Gur A, et al. Interstitial taxol delivered from a biodegradable polymer implant against experimental malignant glioma [J]. Cancer Res, 1994, 54:2207~ 2212.
[7]Langer R. New methods of drug delivery [J]. Science, 1990,249:1527~ 1533.
[8]Olivi A, Ewend MG, Utsuki T, et al. Interstitial delivery of carboplatin via biodegradable polymers is effective against experimental glioma in the rat [J]. Cancer Chemother Pharmacol, 1996,39:90~ 96.
, 百拇医药
[9]Menei P, Benoit JP, Boisdron- Celle M, et al. Drug targeting into the central nervous system by stereotactic implantation of biodegradable microspheres [J]. Neurosurgery, 1994, 34:1058~ 1064.
[10]Sampath P, Brem H. Implantable slow- release chemotherapeutic polymers for the treatment of malignant brain tumors [J].Cancer Control, 1998,5:130~ 137.
[11]Nagarsekar A, Ghandehari H.Genetically engineered polymers for drug delivery [J]. J Drug Target, 1999,7:11~ 32.
, http://www.100md.com
[12]Luo D,Woodrow- Mumford K,Belcheva N, et al. Controlled DNA delivery systems [J]. Pharm Res, 1999, 16:1300~ 1308.
[13]Fung LK, Ewend MG, Sills A, et al. Pharmacokinetics of interstitial delivery of carmustine,4- hydropero- xycyclophosphamide,and paclitaxel from biodegradable polymer implant in the monkey brain [J]. Cancer Res, 1998, 58:672~ 684.
[14]Brem H, Mahaley MJ Jr, Vick NA, et al. Interstitial chemotherapy with drug polymer implants for the treatment of recurrent gliomas [J]. J Neurosurg, 1991,74:441~ 446.
, 百拇医药
[15]Weingert JD, Thompson RC, Tyler B, et al. Local delivery of the topoisomerase I inhibitor camptothecin sodium prolongs survival in the rat intracranial 9L gliosarcoma model [J]. Int J Cancer, 1995, 62:605~ 609.
[16]Dang W, Colvin OM, Brem H, et al. Covalent coupling of methotrexate to dextran enhances the penetration of cytotoxicity into a tissue- like matrix [J]. Cancer Res, 1994, 54:1729~ 1735.
[17]Judy K, Olivi A, Buahin KG, et al. Effectiveness of controlled release of a cyclophosphamide derivative with polymers against rat gliomas [J]. J Neurosurg, 1995, 82:481~ 486.
, 百拇医药
[18]Tamargo RJ, Sills AK Jr, Reinhard CS, et al. Interstitial delivery of dexamethasone in the brain for the reduction of peritumoral edema [J]. J Neurosurg, 1991, 74:956~ 961.
[19]Tamargo RJ, Leong KW, Brem H. Growth inhibition of the 9L glioma using polymers to release heparin and cortisone acetae [J].J Neurooncol, 1990, 9:131~ 138.
[20]Weingart JD, Sipos EP, Brem H. The role of minocycline in the treatment of intracranial 9L glioma [J]. J Neurosurg, 1995,82:635~ 640.
, http://www.100md.com
[21]Tamargo RJ,Rossell LA,Tyler BM, et al. Interstitial delivery of diphenylhydantonin in the brain for the treatment of seizures in a rat model [J]. J Neurosurg,1994, 80:372.
[22]Phillips PC, Levow C,Catterall M,et al. Transforming growth factor- alpha- Pseudomonas exotoxin fusion protein(TGF- alpha- PE38) treatment of subcutaneous and intracranial human glioma and medulloblastoma xenografts in athymic mice [J]. Cancer Res,1994,54:1008~ 1015.
, 百拇医药
[23]Simons M, Edelman ER,DeKeyser JL, et al. Antisense c- myb oligonucleotides inhibit intimal arterial smooth muscle cell accumulation in vitro [J]. Nature,1992, 359:67~ 70.
[24]Brem H, Piantadosi S, Burger PC, et al. Placebo- controlled trial of safety and efficacy of intraoperative controlled delivery by biodegradable polymers of chemotherapy for recurrent gliomas. The Polymer- brain Tumor Treatment Group [J]. Lancet, 1995, 345:1008~ 1012.
, http://www.100md.com
[25]Valtonen S,Timonen U,Toivanen P,et al. Interstitial chemotherapy with carmustine- loaded polymers of high- grade gliomas: a randomized double- blind study [J]. Neurosurgery, 1997, 41:44~ 49.
[26]Lavelle F, Combeau C, Commercon A. Taxoids: structural and experimental properties [J]. Bull Cancer, 1995, 82:249~ 264.
[27]Brem H, Walter K, Tamargo, et al. Drug delivery to the brain [M]. In Domb AJ (ed): Polymer site- specific pharmacotherapy. New York, John Wiley & Sons. 1994, 117~ 139.
[28]Gref R,Minamitake Y,Peraccia MT,et al. Biodegradable long-circulating polymeric nanospheres [J]. Science, 1994, 263:1600~ 1603.
收稿日期:1999-05-26
修回日期:2000-01-07, http://www.100md.com
单位:中山医科大学肿瘤防治中心脑外科,广东 广州 510060
关键词:胶质瘤;局部化疗;多聚体
癌症000433
中图分类号:R739.41 文献标识码:A
文章编号:1000-467X(2000)04-0387-03
脑肿瘤的传统治疗为手术切除加放疗和化疗。对消灭残留肿瘤细胞,防止肿瘤复发,化疗起重要作用。由于神经系统的特殊性,许多药物(大分子)不易通过血脑屏障给脑瘤的化疗增加了困难。避开血脑屏障的局部给药,可以减少全身用药的毒副作用而大大提高肿瘤局部的药物浓度,可望是控制脑瘤局部复发的有效手段。近年来的研究提示,多聚体(polymer)药物缓释系统是理想的局部缓慢给药方式,在治疗脑肿瘤方面预示了明显的优越性[1]。本文将复习多聚体局部给药治疗脑胶质瘤的背景知识及其应用。
, http://www.100md.com
1 局部给药治疗脑瘤的基础
局部给药治疗脑瘤有以下几点理论基础:
(1)提高局部药物浓度而减少全身毒副作用。临床有效的抗癌药必须在肿瘤内达到足够的药物浓度而对身体其它系统无或仅是可以耐受的毒性作用。系统给药化疗使全身所有组织器官都暴露于抗癌药,特别是治疗脑肿瘤,由于血脑屏障的存在,往往需要加大剂量才能在中枢神经系统达到有效药物浓度。因此,使得治疗剂量接近甚至超过病人的最大耐受剂量,有些病人因严重全身毒副作用而无法接受化疗。局部给药可以用较小的剂量达到最大治疗浓度,而身体其它部位的抗癌药物浓度极低,可以明显减少全身毒副作用。
(2)避过血脑屏障。许多经典的对其它肿瘤有效的抗癌药,即使体外细胞药敏试验有效,但由于不能通过血脑屏障而不能采用全身给药用于脑肿瘤治疗。目前,临床上应用于脑肿瘤化疗的药物主要还是亚硝脲类如BCNU,CCNU等几种。向肿瘤部位直接给药,避开了血脑屏障,大大增加了脑瘤化疗药物选择范围。
, 百拇医药
(3)脑肿瘤几乎没有转移,向颅外的远方转移更是罕见。脑肿瘤局部复发,80%在原来肿瘤的2cm范围内[2],这就使得局部化疗能够达到理想的效果。
避开血脑屏障的局部给药有多种方式,临床上已经采用的方法有经预置的导管向瘤腔内直接注射(如采用Omaya),还有经皮下埋置药泵持续给药。这些给药系统无疑能明显提高局部药物浓度,但由于感染、机械的和导管堵塞等原因限制了临床应用效果。多聚体药物缓释系统是以多聚体为载体,将抗癌药物与其结合,结合在多聚体内的药物能在局部缓慢地释放,达到持续给药的目的。所以,这是理想的局部给药手段[1]。
2 多聚体技术
多聚体作为药物载体的研究始于70年代中期,美国波斯顿麻省总医院的Langer和Folkman首先将大分子物质(如蛋白)与多聚体结合,这些大分子物质能从多聚体内以弥散的方式逐步释放[3]。随后的研究又成功地将抗生素、生物因子、化疗药物等结合进入多聚体[4~6]。
, http://www.100md.com
最早的多聚体是采用醋酸乙烯(ethylene-vinylacetate,EVAc)。虽然在实验室证明它是良好的药物载体,但由于是非生物分解型多聚体,置入体内后,药物虽然能以弥散的方式逐步释出,但将留下载体异物。PCPP-SA{poly[bis-(p-carboxyphenoxy)propane]-sebacicacid}则是生物分解型多聚化合物,它的优点是:①由于它在体内是从周边向中心以稳定的速度被降解,所以药物释放稳定;②生物分解型多聚体能防止药物被水解破坏,保持原有活性;③多聚体的降解速度取决于PCPP和SA的比例搭配,通常药物释放可以持续数周、数月甚至超过一年[7];④由于多聚体本身被降解了,所以最终没有异物留下。脂肪酸二聚癸二酸(fattyaciddimer-sebacicacid,FAD-SA)被用于载带亲水性制剂,如顺铂[8]。采用poly(lactide-co-glycolide)多聚体与化疗药物或其它大分子结合,制成微球(microspheres)更可以用立体定向的方式注入脑内[9]。用作载体的多聚体还有聚乙烯乙二醇(polyethyleneglycol)、明胶(gelatin)等[10]。多聚体技术的研究包括二个方面,即各种不同载体的研究和被载物的应用研究。采用基因工程技术合成蛋白类多聚体是有别于化学合成多聚体的新技术[11],而采用多聚体缓释系统作为基因治疗的载体则是又一应用方面[12]。
, 百拇医药
实验证明,以多聚体作为载体局部给药,可明显延长局部脑组织与药物的接触时间。Grossman等将[3H]标记BCNU,比较不同给药方式局部脑组织与药物的接触情况。结果局部直接注入的BCNU很快被清除,24h后,只有15%的局部脑组织有BCNU,到72h时,仅剩极少的区域有可测得的[3H]-BCNU。而结合于多聚体内的药物,由于逐步释放,72h后40%的区域有[3H]-BCNU,500h后还有15%(图1)。Fung等观察了多聚体局部给药后BCNU的动态分布[13],一天后血液中的BCNU浓度只有脑内的20%,脑脊液(CSF)内为脑实质的56%。二周后血液中的BCNU为30%,脑脊液中降至20%(表1)。

图1 多聚体局部给药与直接注射BCNU后脑组织切片内药物分布比较
, 百拇医药 表1 多聚体局部给药后BCNU的分布 部位
BCNU浓度(μmol/L)
6h
1d
7d
14d
血液
2.2
0.7
NP
0.3
CSF
8.1
, http://www.100md.com
1.8
NP
0.2
植入部位脑组织
NP
3.2
1.6
1.0
NP:未测定
多聚体作为载体局部给药,给神经外科病人的治疗开辟了一条新的途径。特别是对恶性胶质瘤病人,可以局部给予化疗药、肾上腺糖皮质激素、抗癫痫药、抗血管形成剂和许多其它大分子包括免疫毒素(表2)。
表2 已被研究的多聚体缓释药物 药物种类
, http://www.100md.com
实例
研究者
化疗药
BCNU
Brem,etal.[14]
Taxol
Walter,etal.[6]
Camptothecin
Weingart,etal.[15]
Carboplatin
Olivi,etal.[8]
, http://www.100md.com
修饰的化疗药
Methotrexate-dextran
Dang,etal.[16]
四羟过氧环磷酸酰胺
Judy,etal.[17]
激素
地塞米松
Tamargo,etal.[18]
抗血管形成剂
肝素和可的松
Tamargo,etal.[19]
, http://www.100md.com
Minocycline
Weingart,etal.[20]
抗癫痫药
二苯内酰脲
Tamargo,etal.[21]
生物制剂
免疫毒素
phillips,etal.[22]
反义核苷酸
Simons,etal.[23]
, http://www.100md.com
3 多聚体局部给药在治疗胶质瘤的应用
虽然有关多聚体局部给药的研究已有许多,但较为成熟的用于治疗脑胶质瘤的是以PCPP-SA为载体的BCNU。此制剂取名为Gliadel,已通过美国FDA鉴定,并推向市场。
3.1Gliadel
Gliadel是以PCPP-SA(20∶80)作为载体,加入3.8%BCNU,制成直径1.45cm厚1mm的圆碟片,每片含BCNU7.7mg。一系列的动物实验证明,PCPP-SA多聚体有很好的组织相溶性,与脑外科手术中常规用的明胶海绵比较它们的致炎症反应相当。在猴脑植入PCPP-SA对神经行为无影响,即使是含有BCNU的Gliadel也没有全身毒性作用发生。BCNU静脉注射很快被清除(t1/2<20min),而Gliadel释放有效药物(在兔脑)可持续3周。药物在脑内的弥散范围也很广,采用定量放射自显影和薄层层析技术,Gliadel植入一天后,弥散距离为4cm,一周是2cm,一个月后,在距手术部位1.3cm的区域还有可测得的药物浓度。采用多聚体局部给药在脑内的药物浓度可比静脉给药高出1200倍[14]。在动物实验,多聚体局部给药明显延长荷瘤鼠的生存时间,并且没有全身毒副作用。使用Gliadel后再加放疗,也没有明显的全身和神经毒性作用。
, 百拇医药
一组222例双盲对照的临床研究,复发脑胶质瘤病人在二次手术时瘤腔内植入Gliadel或不含BCNU的空白多聚体,病人中位生存时间Gliadel组为31周,而对照组病人仅23周(P=0.007)[24]。Gliadel在脑胶质瘤第一次手术时就用也同样有良好效果。Valtonen等报道了一组32例恶性胶质瘤病人(图2),随访2年,中位生存时间在首次手术时植入Gliadel的病人为58.1周,而对照组病人为39.9周(P=0.012)[25]。所以,Gliadel是临床上已经证明有效的,也是目前唯一已经商品化的用于治疗脑胶质瘤的缓释剂。

图2 恶性胶质瘤病人接受Gliadel植入与对照组的生存时间比较
临床应用Gliadel的注意事项[10]:(1)手术时应尽可能多的切除肿瘤组织,每个病人每次植入Gliadel最多不超过8片(BCNU总剂量61.6mg);(2)由于化疗药物在局部会引起脑水肿,所以手术后要加大肾上腺糖皮质激素的用量和延长使用时间;(3)使用Gliadel的病人,虽然感染发生率没有明显增加,但亦建议手术前后24h使用抗生素。(4)肿瘤腔与脑室有小的交通不影响应用Gliadel,但植入的Gliadel进入脑室系统,引起脑脊液循环障碍导致脑积水的话,则不能使用。(5)虽然总体来讲,使用Gliadel并没有增加癫痫的发生率,但病人手术后近期内癫痫的发生率增加,所以,在手术前就应使用抗癫痫药,以防术后短期内的癫痫,并在术后持续应用,特别是当病人接受大剂量激素时,更应监护血药浓度。
, 百拇医药
3.2其它多聚体缓释剂
除Gliadel外,正在进行研究的应用于治疗脑瘤的多聚体缓释剂还有许多,有些动物实验提示有很好的治疗效果。
3.2.1Taxoid类:Taxoid包括有Taxol和Taxotere,它们能与微管结合,使细胞阻止于G2期,继而通过细胞凋亡而使肿瘤细胞死亡[26]。临床试验证明Taxol对许多肿瘤有治疗作用,体外试验胶质瘤对其也很敏感,然而Taxol不易通过血脑屏障。Walter等将Taxol结合于PCPP-SA多聚体,治疗种植有9L胶质瘤的大鼠,生存时间延长3.1倍[6]。
3.2.2Camptothecin:Camptothecin是DNA复制酶topoisomeraseI的天然抑制剂,在临床前研究,Camptothecin对多种肿瘤有效。同样由于它对血脑屏障的通透性差,不适于以系统给药治疗颅内肿瘤。然而采用EVAc作为载体,局部给于Camptothecin,使荷瘤大鼠生存时间明显延长。治疗组59%的大鼠生存超过120天,而对照组都在32天内死亡[15]。
, http://www.100md.com
3.2.3Carboplatin:Carboplatin是第二代以铂为主体的抗癌药。载于FAD-SA多聚体内治疗大鼠颅内F98胶质瘤效果良好[27]。
3.2.4四羟过氧环磷酸酰胺(4-hydro-xyperoxycyclophosphamide,4-HC):4-HC是环磷酸酰胺的衍生物,它不需要经肝脏活化,因而适用于局部给药。在大鼠颅内接种F98胶质瘤5d后,局部给予4-HC/FAD-SA多聚体治疗,大鼠平均生存时间从对照组的14d增加到77d[17]。
4 多聚体局部给药应用前景
多聚体缓释系统除了可用于局部给予化疗药物外,还可用于载带其它制剂进入颅内。肾上腺糖皮质激素在脑外科病人,特别是脑肿瘤治疗中有肯定的作用,然而,全身给药具有许多副作用。Tamargo等将地塞米松载于EVAc多聚体内,治疗肿瘤引起的脑水肿,取得比系统给药更好的控制脑水肿的效果,而且保持血浆激素水平极低[18]。肿瘤血管形成是肿瘤生长的前提,实验证明使用血管形成抑制剂能抑制肿瘤生长,但由于它不能消灭肿瘤细胞而只能达到摵推焦泊,必须长期使用,多聚体缓释系统是一个理想的给药系统[20]。免疫毒素在动物实验证明有良好的治疗效果,但由于其分子量大难以通过血脑屏障,多聚体作为载体,局部植入可望能克服这一困难[22]。脑肿瘤的基因治疗,将目标基因传入颅腔内的肿瘤细胞,可用多聚体制成毫微体载带,以立体定向导入[28]。此外,多聚体缓释系统还可以同时载入多种治疗药物[20],使治疗效果更加显著。
, 百拇医药
通讯作者:陈忠平 Tel:86-20-87752547 Fax:86-20-87752547 E-mail:chenzhongping@hotmail.com
[参考文献]
[1]Thompson RC,Brem H. Treatment of gliomas using polymer- drug delivery [M]. The gliomas. Berger MS and Wilson CB (eds) W.B. Saunders Company,Toronto 1999: 555~ 563.
[2]Hochberg FH, Pruitt A. Assumptions in the radiotherapy of glioblastoma [J]. Neurology, 1980, 30:907~ 911.
, 百拇医药 [3]Langer R, Folkman J. Polymers for the sustained release of proteins and other macromolecules [J]. Nature, 1976, 263:797~ 800.
[4]Saltzman WM. Antibodies for treating and preventing disease: the potential role of polymeric controlled release [J]. Crit Rev Ther Drug Carrier Syst, 1993, 10:111~ 142.
[5]Murray JB, Brown L, Langer R, et al. A micro sustaind release system for epidermal growth factor [J]. In Vitro, 1983, 19:743~ 748.
, 百拇医药
[6]Walter KA, Cahan MA, Gur A, et al. Interstitial taxol delivered from a biodegradable polymer implant against experimental malignant glioma [J]. Cancer Res, 1994, 54:2207~ 2212.
[7]Langer R. New methods of drug delivery [J]. Science, 1990,249:1527~ 1533.
[8]Olivi A, Ewend MG, Utsuki T, et al. Interstitial delivery of carboplatin via biodegradable polymers is effective against experimental glioma in the rat [J]. Cancer Chemother Pharmacol, 1996,39:90~ 96.
, 百拇医药
[9]Menei P, Benoit JP, Boisdron- Celle M, et al. Drug targeting into the central nervous system by stereotactic implantation of biodegradable microspheres [J]. Neurosurgery, 1994, 34:1058~ 1064.
[10]Sampath P, Brem H. Implantable slow- release chemotherapeutic polymers for the treatment of malignant brain tumors [J].Cancer Control, 1998,5:130~ 137.
[11]Nagarsekar A, Ghandehari H.Genetically engineered polymers for drug delivery [J]. J Drug Target, 1999,7:11~ 32.
, http://www.100md.com
[12]Luo D,Woodrow- Mumford K,Belcheva N, et al. Controlled DNA delivery systems [J]. Pharm Res, 1999, 16:1300~ 1308.
[13]Fung LK, Ewend MG, Sills A, et al. Pharmacokinetics of interstitial delivery of carmustine,4- hydropero- xycyclophosphamide,and paclitaxel from biodegradable polymer implant in the monkey brain [J]. Cancer Res, 1998, 58:672~ 684.
[14]Brem H, Mahaley MJ Jr, Vick NA, et al. Interstitial chemotherapy with drug polymer implants for the treatment of recurrent gliomas [J]. J Neurosurg, 1991,74:441~ 446.
, 百拇医药
[15]Weingert JD, Thompson RC, Tyler B, et al. Local delivery of the topoisomerase I inhibitor camptothecin sodium prolongs survival in the rat intracranial 9L gliosarcoma model [J]. Int J Cancer, 1995, 62:605~ 609.
[16]Dang W, Colvin OM, Brem H, et al. Covalent coupling of methotrexate to dextran enhances the penetration of cytotoxicity into a tissue- like matrix [J]. Cancer Res, 1994, 54:1729~ 1735.
[17]Judy K, Olivi A, Buahin KG, et al. Effectiveness of controlled release of a cyclophosphamide derivative with polymers against rat gliomas [J]. J Neurosurg, 1995, 82:481~ 486.
, 百拇医药
[18]Tamargo RJ, Sills AK Jr, Reinhard CS, et al. Interstitial delivery of dexamethasone in the brain for the reduction of peritumoral edema [J]. J Neurosurg, 1991, 74:956~ 961.
[19]Tamargo RJ, Leong KW, Brem H. Growth inhibition of the 9L glioma using polymers to release heparin and cortisone acetae [J].J Neurooncol, 1990, 9:131~ 138.
[20]Weingart JD, Sipos EP, Brem H. The role of minocycline in the treatment of intracranial 9L glioma [J]. J Neurosurg, 1995,82:635~ 640.
, http://www.100md.com
[21]Tamargo RJ,Rossell LA,Tyler BM, et al. Interstitial delivery of diphenylhydantonin in the brain for the treatment of seizures in a rat model [J]. J Neurosurg,1994, 80:372.
[22]Phillips PC, Levow C,Catterall M,et al. Transforming growth factor- alpha- Pseudomonas exotoxin fusion protein(TGF- alpha- PE38) treatment of subcutaneous and intracranial human glioma and medulloblastoma xenografts in athymic mice [J]. Cancer Res,1994,54:1008~ 1015.
, 百拇医药
[23]Simons M, Edelman ER,DeKeyser JL, et al. Antisense c- myb oligonucleotides inhibit intimal arterial smooth muscle cell accumulation in vitro [J]. Nature,1992, 359:67~ 70.
[24]Brem H, Piantadosi S, Burger PC, et al. Placebo- controlled trial of safety and efficacy of intraoperative controlled delivery by biodegradable polymers of chemotherapy for recurrent gliomas. The Polymer- brain Tumor Treatment Group [J]. Lancet, 1995, 345:1008~ 1012.
, http://www.100md.com
[25]Valtonen S,Timonen U,Toivanen P,et al. Interstitial chemotherapy with carmustine- loaded polymers of high- grade gliomas: a randomized double- blind study [J]. Neurosurgery, 1997, 41:44~ 49.
[26]Lavelle F, Combeau C, Commercon A. Taxoids: structural and experimental properties [J]. Bull Cancer, 1995, 82:249~ 264.
[27]Brem H, Walter K, Tamargo, et al. Drug delivery to the brain [M]. In Domb AJ (ed): Polymer site- specific pharmacotherapy. New York, John Wiley & Sons. 1994, 117~ 139.
[28]Gref R,Minamitake Y,Peraccia MT,et al. Biodegradable long-circulating polymeric nanospheres [J]. Science, 1994, 263:1600~ 1603.
收稿日期:1999-05-26
修回日期:2000-01-07, http://www.100md.com