部分人群TT病毒的分子流行病学研究
作者:马伟杭 范骏 俞云松 许毅 马亦林
单位:浙江大学医学院附属第一医院传染科 杭州 310003
关键词:
中华实验和临床病毒学杂志000427 继甲、乙、丙、丁、戊、庚型肝炎的相继发现后,仍有部分肝炎病人未能进行病原学的分型。日本学者Nishizawa等〔1〕报道了一种可能与输血后肝炎相关的病毒,暂称为输血传播病毒(TT virus),它可能是原因不明的非甲~庚型肝炎的病原。目前对TTV的研究尚处在起步阶段,其病毒特性、临床情况和流行病学状况均有待研究。我们对部分人群血清进行了TTV DNA的检测,并分析了部分片段的DNA序列。
1 材料和方法
1.1 化学试剂及工具酶 Taq DNA聚合酶、PCR仪来自PERKIN ELMER公司(美国),限制性内切酶EcoR Ⅰ、PGEM-T-Easy vector System由美国Promega公司生产,X-Gal、IPTG由美国GIBCO-BRL公司生产,ALF autocycle DNA sequence Kit由瑞典Pharmacia公司生产,菌种为大肠埃希菌DH-5α。
, 百拇医药
1.2 标本来源及处理 ①1997~1998年感染科住院病人共27例,男22例,女5例,平均年龄(41±6.2)岁,检测甲、乙、丙、丁、戊、庚肝炎全套系列,均为阴性。②1997~1999年肝炎科住院病人,共20例,均为重症肝炎。男15例、女5例,平均年龄(38±5.1)岁。上述两类患者均按照1995年5月北京第五次全国传染病寄生虫病学术会议讨论修订的病毒性肝炎防治方案收治。③健康助血员30例,男22例、女8例,平均年龄(27±3.6)岁。④尿毒症患者92例,男66例、女24例,平均年龄(44±7.2)岁,平均透析时间3个月±20.1 d。⑤ALT升高的婴幼儿20例,男11例、女9例,平均年龄3岁±8.1个月,ALT平均71±11 U/L(正常50 U/L)。⑥静脉药瘾者20例,男15例、女5例,平均年龄(25±5.0)岁,平均注射时间(3±2.1)个月。⑦性乱者21例,均为女性,平均年龄(24±5.2)岁。
上述标本共230例,取新鲜血清,-20℃冻存。取冻存血清35 μl,用裂解液(异硫氰胍)和氯仿抽提,离心取上清,用无水乙醇析出DNA。
, 百拇医药
1.3 聚合酶链反应(PCR) 根据已发表的TTV基因组序列〔2〕,选择扩增位于其N22克隆片段的引物,由中科院上海细胞所合成,外引物1:5′-GCAGCAGCA
TATGGATATGT-3′,外引物2:5′-TGACTGTGCTAAAGCCTCTA-3′,编码162-431基因组,扩增产物为270 bp;内引物1:5′-CATAC ACATGAATGCCAG
GC-3′,内引物2:5′-TACTTCTTGCTG
GTGAAAT-3′,编码215-410基因组,扩增产物为196 bp。PCR第1轮反应取外引物,94℃预变性3 min,再按94℃ 40 s,55℃ 45 s,72℃ 60 s顺序,依次循环35次,72℃延伸5 min;第2轮反应取内引物、3 μl第1轮扩增产物,实验过程同第一轮。取20 μl扩增产物在2%琼脂糖凝胶上电泳(5 V/cm)30 min,溴化乙锭染色,紫外灯下观察结果。
, http://www.100md.com
1.4 PCR片段的纯化、连接反应及转化 将扩增完成的阳性PCR产物50 μl加入含有50 μlddH2O的Eppendorf管中混匀,加入100 μl氯仿抽提1次,5 000 r/min×5 min,将上清100 μl转入另一新Eppendorf管中,重复用氯仿抽提1次后在上清液中加入10 μ 13 mol/L NaAc(pH5.8)及250 μl 100%乙醇,混匀后置-70℃冰箱2 h,12 000 r/min×10 min,弃上清,DNA沉淀室温干燥后用10 μl TE 溶解并置-20℃待用。取4 μl纯化DNA加入含1×ligation缓冲液,1 μlT-A载体及1 μl(12 U/μl)连接酶的Eppendorf管中并加ddH2O至总体积10 μl,4℃冰箱连接过夜;取5 μl连接完成的连接反应液转化大肠埃希菌DH-5α涂布于含氨苄青霉素的X-Gal、IPTG平板,置37℃培养箱培养过夜。白色菌落为重组子候选克隆,挑选白色菌落于LB液体培养基中,过夜培养,供抽提质粒所用。
, 百拇医药
1.5 DNA序列分析 按Pharmacia公司ALF DNA序列分析装置操作说明进行。所用引物为荧光标记的T7-Promoter Primer。
2 结果
2.1 TTV片段的PCR扩增 图1显示部分PCR的扩增结果。结果表明第1号血清为TTV阳性。其大小为196 bp,与预计PCR产物大小一致。总标本数量为230个待测血清标本。PCR扩增阳性为18例,总检出率7.83%(18/230)。其中非甲~庚型肝炎患者的检出率为7.41%(2/27)、重症肝炎患者的检出率为0(0/20)、助血员的检出率为20%(6/30)、血透病人的检出率为5.43%(5/92)、婴幼儿的检出率为10%(2/10)、静脉药瘾者的检出率为5%(1/20)、性乱者的检出率为9.52%(2/21)。
2.2 TTV阳性PCR片段的克隆 为确认阳性血清为TTV感染者,阳性标本重复PCR 1次后,PCR扩增亦为阳性。选择其中来源于非甲~庚型患者的1例阳性标本进行序列鉴定。经对阳性PCR产物纯化分离后,与TA载体pGEM-T-Easy vector进行连接反应,连接反应液转化大肠埃希菌DH-5α并涂布含Amp的X-Gal,IPTG平板。经过白色菌落扩增后,抽提质粒DNA并用限制性内切酶Ecor Ⅰ酶切分析。图2即为酶切电泳分析结果。表明TTV片段已被克隆至PGEM-T-Easy载体之中,此重组质粒命名为pGEM-TTV。
, 百拇医药
2.3 克隆片段TTV的DNA序列分析
图1 聚合酶链反应扩增TTV DNA片段
Fig.1 Results of PCR amplification of
TTV DNA fragment
M:100 bp Ladder DNA marker.
1-8:PCR amplified product
DNA序列分析在Pharmacia DNA序列分析仪上进行,利用通用引物T7 Promoter引物对TTV 片段的全序列进行分析。结果显示所扩增片段序列与Nishizawa等发表的N22克隆片段(215-410基因组)的序列同源性98.8%,图3为DNA序列分析结果。
, http://www.100md.com
3 讨论
TTV为单链DNA病毒,最初报道〔1〕是应用代表性分析法(DNA)从1例非甲~庚型病原不明输血后肝炎病人血清中发现一大小为500 bp的产物,经提取纯化、转化和克隆,获得DNA序列,该病毒克隆称N22,由于N22克隆来源于1例名为TT的病人,且与经输血传播病毒(Transfusion transmitted virus,TTV)巧合,所以暂称为TTV。我们从230例不同标本血清中检测到18例TTV DNA,证明了浙江省有TTV散发感染存在,阳性患者中也有无使用血制品史,说明TTV并不只是输血后肝炎的病原。
图2 TTV PCR产物的克隆分析
Fig.2 Agarose gel analysis of cloned
, http://www.100md.com
TTV PCR products
1:1 kb Ladder DNA marker. 2-3:EcoR Ⅰ
digested recombinant plasmid-pGEM-TTV.
4:PCR product of TTV fragment.
5:100 bp Ladder DNA marker
本文结果显示,TTV在不同人群中有着较高的感染,特别是助血员中达到20%,这与Simmonds P〔3,4〕的报道类似,提示我们迫切需要引起高度重视。但也有报道称正常人中的感染率如此高,可能预示着TTV的感染只是一过性而已,它的致病性值得怀疑〔5〕。我们也发现,除了重症肝炎患者的标本血清为阴性外,其余不同来源的标本阳性检出率之间差异无显著性(χ2>0.05),说明人群中的感染普遍较高。有报道称〔6〕:TTV在合并病毒性肝炎感染中的阳性率明显高于单一TTV的感染,而正常人与非甲~庚型肝炎患者中的感染率无差异。TTV感染后致病强度尚少见报道,据观察TTV的致病性较弱,而且愈后较好〔7〕,但TTV DNA的检出往往与ALT增高相关,本文阳性标本中的患者ALT最高为167 U/L,这是否与TTV的感染、复制有关,还需进一步研究。我们认为在TTV的结构、形态还没有彻底清楚以前,仍然需要保持高度的警惕,特别是对于有输血史或者ALT升高的患者。
, http://www.100md.com
对TTV PCR产物的核酸序列分析表明,本文中阳性病例TTV部分序列与Nishizawa报道〔1〕的毒株(N22)相同部分序列一致性达到98.8%,说明浙江省TTV毒株可能与日本毒株属同型或亚型,其感染、致病性尚待进一步研究。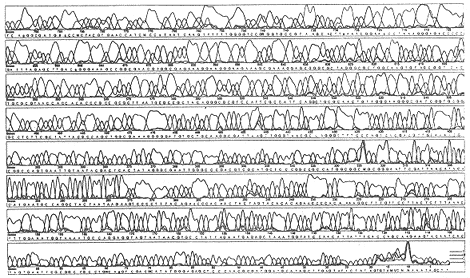
图3 克隆的TTV片段的DNA序列分析
Fig.3 Sequence analysis of cloned TTV fragment
参 考 文 献
1,Nishizawa T,Okamoto H,Konishi K,et al.A novel DNA virus (TTV) associated with elevated transaminas levels in posttransfusion hepatitis of unknown etiology.Biochem Biophys Res Commun,1997,24:92-97.
, 百拇医药
2,Okamoto H,Takahashi M,Nishizawa T, et al. Marked genomic heterogeneity and frequent mixed infection of TT virus demonstrated by PCR with primers from coding and noncoding regions. Virology,1999,259:428-436.
3,Desai SM,Muerhoff AS,Leary TP,et al.Prevalence of TT virus infection in US blood donors and populations at risk for acquiring parenterally transmitted viruses.J Infect Dis,1999,179:1242-1244.
4,Simmonds P,Davidson F,Lycett C,et al.Detection of a novel DNA virus (TTV) in blood donors and blood products. Lancet,1998,352:191-195.
, 百拇医药
5,Fukuda Y,Nakano I,Kumada T,et al.TT virus (TTV) is not associated with acute sporadic hepatitis. Infection,1999,27:125-127.
6,张军,罗文新,杨海杰,等.TT病毒与肝炎关系的临床流行病学研究.中华微生物和免疫学杂志,2000,20:19-22.
7,Miyasakd A,Suzuki K,Abe K,et al.High prevalence of TT virus (TTV) in patients with nonA to nonG fulminant hepatitis:differences of clinical features and prognosis between TTV positive and negative patients.Nippon Rinsho,1999,57:1339-1344.
(收稿日期:2000-03-21)
, 百拇医药
单位:浙江大学医学院附属第一医院传染科 杭州 310003
关键词:
中华实验和临床病毒学杂志000427 继甲、乙、丙、丁、戊、庚型肝炎的相继发现后,仍有部分肝炎病人未能进行病原学的分型。日本学者Nishizawa等〔1〕报道了一种可能与输血后肝炎相关的病毒,暂称为输血传播病毒(TT virus),它可能是原因不明的非甲~庚型肝炎的病原。目前对TTV的研究尚处在起步阶段,其病毒特性、临床情况和流行病学状况均有待研究。我们对部分人群血清进行了TTV DNA的检测,并分析了部分片段的DNA序列。
1 材料和方法
1.1 化学试剂及工具酶 Taq DNA聚合酶、PCR仪来自PERKIN ELMER公司(美国),限制性内切酶EcoR Ⅰ、PGEM-T-Easy vector System由美国Promega公司生产,X-Gal、IPTG由美国GIBCO-BRL公司生产,ALF autocycle DNA sequence Kit由瑞典Pharmacia公司生产,菌种为大肠埃希菌DH-5α。
, 百拇医药
1.2 标本来源及处理 ①1997~1998年感染科住院病人共27例,男22例,女5例,平均年龄(41±6.2)岁,检测甲、乙、丙、丁、戊、庚肝炎全套系列,均为阴性。②1997~1999年肝炎科住院病人,共20例,均为重症肝炎。男15例、女5例,平均年龄(38±5.1)岁。上述两类患者均按照1995年5月北京第五次全国传染病寄生虫病学术会议讨论修订的病毒性肝炎防治方案收治。③健康助血员30例,男22例、女8例,平均年龄(27±3.6)岁。④尿毒症患者92例,男66例、女24例,平均年龄(44±7.2)岁,平均透析时间3个月±20.1 d。⑤ALT升高的婴幼儿20例,男11例、女9例,平均年龄3岁±8.1个月,ALT平均71±11 U/L(正常50 U/L)。⑥静脉药瘾者20例,男15例、女5例,平均年龄(25±5.0)岁,平均注射时间(3±2.1)个月。⑦性乱者21例,均为女性,平均年龄(24±5.2)岁。
上述标本共230例,取新鲜血清,-20℃冻存。取冻存血清35 μl,用裂解液(异硫氰胍)和氯仿抽提,离心取上清,用无水乙醇析出DNA。
, 百拇医药
1.3 聚合酶链反应(PCR) 根据已发表的TTV基因组序列〔2〕,选择扩增位于其N22克隆片段的引物,由中科院上海细胞所合成,外引物1:5′-GCAGCAGCA
TATGGATATGT-3′,外引物2:5′-TGACTGTGCTAAAGCCTCTA-3′,编码162-431基因组,扩增产物为270 bp;内引物1:5′-CATAC ACATGAATGCCAG
GC-3′,内引物2:5′-TACTTCTTGCTG
GTGAAAT-3′,编码215-410基因组,扩增产物为196 bp。PCR第1轮反应取外引物,94℃预变性3 min,再按94℃ 40 s,55℃ 45 s,72℃ 60 s顺序,依次循环35次,72℃延伸5 min;第2轮反应取内引物、3 μl第1轮扩增产物,实验过程同第一轮。取20 μl扩增产物在2%琼脂糖凝胶上电泳(5 V/cm)30 min,溴化乙锭染色,紫外灯下观察结果。
, http://www.100md.com
1.4 PCR片段的纯化、连接反应及转化 将扩增完成的阳性PCR产物50 μl加入含有50 μlddH2O的Eppendorf管中混匀,加入100 μl氯仿抽提1次,5 000 r/min×5 min,将上清100 μl转入另一新Eppendorf管中,重复用氯仿抽提1次后在上清液中加入10 μ 13 mol/L NaAc(pH5.8)及250 μl 100%乙醇,混匀后置-70℃冰箱2 h,12 000 r/min×10 min,弃上清,DNA沉淀室温干燥后用10 μl TE 溶解并置-20℃待用。取4 μl纯化DNA加入含1×ligation缓冲液,1 μlT-A载体及1 μl(12 U/μl)连接酶的Eppendorf管中并加ddH2O至总体积10 μl,4℃冰箱连接过夜;取5 μl连接完成的连接反应液转化大肠埃希菌DH-5α涂布于含氨苄青霉素的X-Gal、IPTG平板,置37℃培养箱培养过夜。白色菌落为重组子候选克隆,挑选白色菌落于LB液体培养基中,过夜培养,供抽提质粒所用。
, 百拇医药
1.5 DNA序列分析 按Pharmacia公司ALF DNA序列分析装置操作说明进行。所用引物为荧光标记的T7-Promoter Primer。
2 结果
2.1 TTV片段的PCR扩增 图1显示部分PCR的扩增结果。结果表明第1号血清为TTV阳性。其大小为196 bp,与预计PCR产物大小一致。总标本数量为230个待测血清标本。PCR扩增阳性为18例,总检出率7.83%(18/230)。其中非甲~庚型肝炎患者的检出率为7.41%(2/27)、重症肝炎患者的检出率为0(0/20)、助血员的检出率为20%(6/30)、血透病人的检出率为5.43%(5/92)、婴幼儿的检出率为10%(2/10)、静脉药瘾者的检出率为5%(1/20)、性乱者的检出率为9.52%(2/21)。
2.2 TTV阳性PCR片段的克隆 为确认阳性血清为TTV感染者,阳性标本重复PCR 1次后,PCR扩增亦为阳性。选择其中来源于非甲~庚型患者的1例阳性标本进行序列鉴定。经对阳性PCR产物纯化分离后,与TA载体pGEM-T-Easy vector进行连接反应,连接反应液转化大肠埃希菌DH-5α并涂布含Amp的X-Gal,IPTG平板。经过白色菌落扩增后,抽提质粒DNA并用限制性内切酶Ecor Ⅰ酶切分析。图2即为酶切电泳分析结果。表明TTV片段已被克隆至PGEM-T-Easy载体之中,此重组质粒命名为pGEM-TTV。
, 百拇医药
2.3 克隆片段TTV的DNA序列分析

图1 聚合酶链反应扩增TTV DNA片段
Fig.1 Results of PCR amplification of
TTV DNA fragment
M:100 bp Ladder DNA marker.
1-8:PCR amplified product
DNA序列分析在Pharmacia DNA序列分析仪上进行,利用通用引物T7 Promoter引物对TTV 片段的全序列进行分析。结果显示所扩增片段序列与Nishizawa等发表的N22克隆片段(215-410基因组)的序列同源性98.8%,图3为DNA序列分析结果。
, http://www.100md.com
3 讨论
TTV为单链DNA病毒,最初报道〔1〕是应用代表性分析法(DNA)从1例非甲~庚型病原不明输血后肝炎病人血清中发现一大小为500 bp的产物,经提取纯化、转化和克隆,获得DNA序列,该病毒克隆称N22,由于N22克隆来源于1例名为TT的病人,且与经输血传播病毒(Transfusion transmitted virus,TTV)巧合,所以暂称为TTV。我们从230例不同标本血清中检测到18例TTV DNA,证明了浙江省有TTV散发感染存在,阳性患者中也有无使用血制品史,说明TTV并不只是输血后肝炎的病原。

图2 TTV PCR产物的克隆分析
Fig.2 Agarose gel analysis of cloned
, http://www.100md.com
TTV PCR products
1:1 kb Ladder DNA marker. 2-3:EcoR Ⅰ
digested recombinant plasmid-pGEM-TTV.
4:PCR product of TTV fragment.
5:100 bp Ladder DNA marker
本文结果显示,TTV在不同人群中有着较高的感染,特别是助血员中达到20%,这与Simmonds P〔3,4〕的报道类似,提示我们迫切需要引起高度重视。但也有报道称正常人中的感染率如此高,可能预示着TTV的感染只是一过性而已,它的致病性值得怀疑〔5〕。我们也发现,除了重症肝炎患者的标本血清为阴性外,其余不同来源的标本阳性检出率之间差异无显著性(χ2>0.05),说明人群中的感染普遍较高。有报道称〔6〕:TTV在合并病毒性肝炎感染中的阳性率明显高于单一TTV的感染,而正常人与非甲~庚型肝炎患者中的感染率无差异。TTV感染后致病强度尚少见报道,据观察TTV的致病性较弱,而且愈后较好〔7〕,但TTV DNA的检出往往与ALT增高相关,本文阳性标本中的患者ALT最高为167 U/L,这是否与TTV的感染、复制有关,还需进一步研究。我们认为在TTV的结构、形态还没有彻底清楚以前,仍然需要保持高度的警惕,特别是对于有输血史或者ALT升高的患者。
, http://www.100md.com
对TTV PCR产物的核酸序列分析表明,本文中阳性病例TTV部分序列与Nishizawa报道〔1〕的毒株(N22)相同部分序列一致性达到98.8%,说明浙江省TTV毒株可能与日本毒株属同型或亚型,其感染、致病性尚待进一步研究。

图3 克隆的TTV片段的DNA序列分析
Fig.3 Sequence analysis of cloned TTV fragment
参 考 文 献
1,Nishizawa T,Okamoto H,Konishi K,et al.A novel DNA virus (TTV) associated with elevated transaminas levels in posttransfusion hepatitis of unknown etiology.Biochem Biophys Res Commun,1997,24:92-97.
, 百拇医药
2,Okamoto H,Takahashi M,Nishizawa T, et al. Marked genomic heterogeneity and frequent mixed infection of TT virus demonstrated by PCR with primers from coding and noncoding regions. Virology,1999,259:428-436.
3,Desai SM,Muerhoff AS,Leary TP,et al.Prevalence of TT virus infection in US blood donors and populations at risk for acquiring parenterally transmitted viruses.J Infect Dis,1999,179:1242-1244.
4,Simmonds P,Davidson F,Lycett C,et al.Detection of a novel DNA virus (TTV) in blood donors and blood products. Lancet,1998,352:191-195.
, 百拇医药
5,Fukuda Y,Nakano I,Kumada T,et al.TT virus (TTV) is not associated with acute sporadic hepatitis. Infection,1999,27:125-127.
6,张军,罗文新,杨海杰,等.TT病毒与肝炎关系的临床流行病学研究.中华微生物和免疫学杂志,2000,20:19-22.
7,Miyasakd A,Suzuki K,Abe K,et al.High prevalence of TT virus (TTV) in patients with nonA to nonG fulminant hepatitis:differences of clinical features and prognosis between TTV positive and negative patients.Nippon Rinsho,1999,57:1339-1344.
(收稿日期:2000-03-21)
, 百拇医药