乳腺癌细胞可溶性FasL分泌及其对淋巴细胞凋亡的诱导
作者:苏逢锡 贾渭娟 陈积圣 宋尔卫
单位:苏逢锡 贾渭娟 陈积圣 宋尔卫(中山医科大学孙逸仙纪念医院乳腺外科 广州 510120)
关键词:乳腺肿瘤;可溶性Fas配基;细胞凋亡;免疫抑制
肿瘤000427 中图分类号:R737.9 文献标识码:A 文章编号:1000-7431(2000)04-0310-03
乳腺癌组织有较高的Fas配基(FasL)表达[1],这种表达是否可诱导机体Fas阳性的免疫效应细胞凋亡,从而主动抑制机体的免疫功能,目前尚不清楚。作者通过检测乳腺癌细胞株MCF-7 Fas mRNA和蛋白的表达,以及其对可溶性FasL(sFasL)的分泌,观察该细胞株对Fas表达阳性的J和T细胞凋亡的诱导作用,从而探讨乳腺癌抑制机体免疫功能的机制。
, 百拇医药
材料与方法
一、材料
效应细胞和靶细胞系 效应细胞为乳腺癌MCF-7细胞系,靶细胞为Jurkat白血病T淋巴细胞 ,由美国新泽西洲大学任国媚博士提供;均在含10 %小牛血清的PRMI 1640培养液中传代培养。
二、方法
1.膜型FasL(mFasL)和sFasL的Western免疫印迹法检测 分别提取乳腺癌MCF-7细胞培养上清液和经裂解后细胞溶解液的蛋白质,并分别取50 ug样品与等体积加样缓冲液混和,煮沸5 min,12 % SDS-PAGE电泳,然后电转移至NC膜上,用兔抗人抗FasL多克隆抗体(Santa公司)作Ⅰ抗体,HRP标记的羊抗兔IgG(Santa 公司)作Ⅱ抗体,ECL (Santa 公司)荧光显色。
2.FasL mRNA的RT-PCR检测 MCF-7细胞总RNA提取采用异硫氰酸胍、酚、氯仿抽提“一步法”。RT-PCR采用Promega公司反转录试剂盒,按要求操作。取逆转录产物20 μl加入30 μl PCR 体系(PCR试剂盒,华美公司),引物浓度为200 ng/μl(mg/L)。反应条件及引物如下,FasL特异引物序列:5’-GGATTGGGCCTGGGGATGTTTCA-3’(上游),5’-TTGTGGCTCAGGGGCAGGTTGTTG-3’(下游)。β-肌动蛋白(β-actin)特异引物序列:5’-GTGGGGCGCCCCAGGCACCA-3’(上游);5’-CTCCTTAATGTCACGCACGATTTC-3’(下游)。按下述条件扩增:94 ℃,40 s;55 ℃,60 s;72 ℃,60 s。阳性对照采用表达FasL的人结肠癌细胞株SW620;阴性对照用不表达FasL的人结肠癌细胞株LoVo,均由美国新泽西洲大学任国媚博士提供。
, 百拇医药
3.混合细胞培养DNA片段化检测(JAM 试验) 按文献方法[2]用3.7×108 Bq/Ld(10mCi/Ld)[3H]TdR(Amersham)标记靶细胞Jurkat细胞核DNA,PBS洗2次。按5×106/L把效应MCF-7乳腺癌细胞加入到平底96孔板中,根据不同的E/T(E:效应细胞;T:靶细胞)比率加入标记好的靶细胞。37 ℃ CO2培养箱中培育5 h,收集细胞行放射性计数,推算靶细胞中片段化DNA百分含量,代表其凋亡的含量。计算公式为:片段化DNA(%)=100%×(不加入效应细胞的完整靶细胞核DNA放射计数-加入效应细胞的完整靶细胞核DNA放射计数)/不加入效应细胞的完整靶细胞核DNA放射计数。
4.效应细胞培养上清液对靶细胞凋亡的诱导 分别按0∶1、1∶2、1∶1和2∶1的比例在Jurkat细胞培养液中加入MCF-7细胞培养上清液,4 ℃下培育Jurkat细胞过夜。收集细胞,PBS洗后离心5 min,加入70 %乙醇,4 ℃下培育30 min,PBS洗后加入50 μl碘化丙碇(PI)染液50 mg/L PI,0.1 % Triton X-100,0.1 mmol/L EDTA(Na)2,50 mg/L RNase A(50 U/mg),室温下培育30 min,流式细胞仪检测DNA含量分布。每次计数104个细胞。所有资料经LYSIS Ⅱ软件(Becton Dickinson)进行定量检测。
, 百拇医药
5.统计学分析 每项试验重复5孔,数值以平均值±标准差表示。均数组间比较采用t检验。
结果
1.mFasL和sFasL的 Western免疫印迹检测结果 乳腺癌MCF-7细胞溶解液经应用抗FasL抗体 Western免疫印迹法检测在40 kDa位置上显示清晰的蛋白带(图1,Lane A),其细胞培养上清液经同样检测后在26 kDa位置上显示蛋白带(见图1,Lane B),分别与文献报道的 mFasL和分泌型 sFasL蛋白带的位置相符[3]。而阴性对照中则未见相应位置的蛋白带显示(见图1,Lane C)。
图1 乳腺癌MCF-7细胞裂解液和培养上清液的抗FasL多抗Western印迹检测。
(M:Size Marker;Lane A:MCF-7细胞裂解液,见mFasL阳性;Lane
, http://www.100md.com
B:MCF-7培养上清液,见sFasL阳性;Lane C:阴性对照)
2.FasL mRNA 的RT-PCR检测结果 分别采用已知FasL mRNA阳性和阴性的人结肠癌细胞株作为对照系统,RT-PCR法检测结果显示乳腺癌MCF-7细胞呈FasL mRNA表达阳性,为344 bp大小的DNA片段(图2)。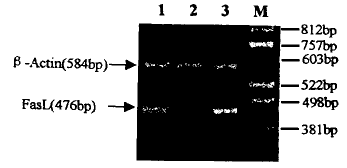
图2 乳腺癌MCF-7细胞FasL mRNA的RT-PCR检测结果。
(M:Size Marker;1:阳性对照;2:阴性对照;3:MCF-7细胞)
3.混合培养的靶细胞片段化的DNA含量 观察在不同效应细胞(MCF-7)与靶细胞(Jurkat)比例(E/T)时,Jurkat细胞片段化DNA含量的百分率变化。结果表明E/T=1时,DNA片段化含量为(9.6±1.2) %;E/T=2,为(19.0±3.8) %;E/T=4,为(30.2±7.4 %;E/T=8,为(57.3±9.8) %。因此,随着效靶细胞比例升高,靶细胞(Jurkat)片段化DNA含量也上升(P<0.01)。
, 百拇医药
4.MCF-7细胞上清液对Jurkat细胞凋亡的诱导 不同浓度的MCF-7细胞培养上清液处理Jurkat细胞,通过PI对DNA染色并应用流式细胞仪检测细胞DNA含量分布,其中,DNA含量低于G1期的亚二倍体细胞(sub-G1细胞)出现是细胞凋亡的重要特征。结果显示,不加入MCF-7上清液时(0∶1),Jurkat细胞AI为(1.2±0.4)%;上清液与PRMI 1640培养液比例为1∶2时,AI为(8.6±2.7)%;比例为1∶1时,AI为(19.4±2.5)%;2∶1时,AI为(34.7±4.6)%。可见,随着MCF-7上清液浓度的增加,Jurkat细胞中凋亡细胞的比例也增高(P<0.01)。
讨论
Fas配基(FasL)是一种Ⅱ型跨膜蛋白,分子量为40 kD,属于肿瘤坏死因子超家族成员。FasL能与受体Fas蛋白(CD95)结合,导致表达该蛋白的细胞发生凋亡。由于机体免疫活性细胞如淋巴细胞、NK细胞等均表达Fas蛋白并对FasL介导的凋亡敏感,故肿瘤细胞表达FasL被认为是其抑制机体免疫功能的因素之一[4]。体外和体内的研究均证明乳腺癌细胞可表达FasL[1],乳腺癌组织的免疫组化研究发现FasL阳性的乳腺癌旁浸润淋巴细胞发生较大量的凋亡,故认为Fas-FasL系统参与乳腺癌免疫逃避的机制[5]。
, 百拇医药
白血病细胞的跨膜型FasL可被间质金属蛋白酶切割,其膜外段脱落形成sFasL,分子量为26kD,被释放至细胞周围环境中[6]。但目前在实体肿瘤中有关sFasL分泌的研究尚少。作者采用抗FasL抗体Western免疫印迹法在MCF-7细胞培养上清液中检测出可溶性的FasL,由于在MCF-7细胞裂解液中可检测到跨膜型的FasL蛋白存在,RT-PCR也证实该细胞中含有过量表达的FasL mRNA,因此作者认为,细胞培养上清液中的sFasL来源于MCF-7细胞,是其跨膜型FasL蛋白的膜外段脱落产物。其它恶性肿瘤如前列腺癌细胞在体外培养时也分泌大量的sFasL[7]。
作者发现MCF-7细胞与对FasL敏感的Jurkat细胞共同培养时,随着MCF-7细胞比例的增加,Jurkat细胞发生凋亡的数量也增加,说明MCF-7细胞可通过胞膜表面的FasL或分泌的sFasL作用于Jurkat细胞的Fas蛋白,诱导其凋亡的发生。进一步用含有sFasL的MCF-7培养上清液处理Jurkat细胞,随着其浓度增加,Jurkat细胞凋亡数量也增加,可见sFasL不仅能与Fas结合,也同样具备跨膜型FasL的生物学活性,诱导Fas阳性的淋巴细胞凋亡。Martinez等[3]也证实激活的淋巴细胞分泌的可溶性FasL可诱导Jurkat细胞凋亡。因此作者认为乳腺癌细胞可能通过sFasL的分泌,诱导机体淋巴细胞凋亡,从而主动抑制机体的抗肿瘤免疫功能。
, 百拇医药
作者简介:苏逢锡,大学本科,副主任医师。
参考文献
[1]O’Connell J,Bennett MW,O'Sulivan GC,et al.Expression of Fas(CD95/APO-1)ligand by human breast cancers:significance for tumor immune privilege〔J〕.Clin Diagn Lab Immunol,1999,6:457
[2]Matzinger P.The JAM test:a simple assay for DNA fragmentation and cell death〔J〕.J Immunol Methods,1991,145:185
[3]Martinez-Lorenzo MJ,Alava MA,Anel A,et al.Release of preformed Fas ligand in soluble form is the major factor for activation-induced death of Jurkat T cells〔J〕.Immunology,1996,89:511~517
, 百拇医药
[4]Bennett MW,O'Connell J,O'Sullivan GC,et al.Expression of fas ligand by human gastric adenocarcinomas:a potential mechanism of immune escape in stomach cancer〔J〕.Gut,1999,44:156
[5]Gutierrez LS,Eliza M,Niven-Fairchild T,et al.The Fas/Fas-ligand system:a mechanism for immune evasion in human breast carcinomas〔J〕.Breast Cancer Res Treat,1999,54:245
[6]Tanaka M,Suda T,Haze K,et al.Fas ligand in human serum〔J〕.Nat Med,1996,2:317
[7]Liu QY,Rubin MA,Omene C,et al.Fas ligand is constitutively secreted by prostate cancer cells in vitro〔J〕.Clin Cancer Res,1998,4:1803
(收稿日期:2000-03-06), http://www.100md.com
单位:苏逢锡 贾渭娟 陈积圣 宋尔卫(中山医科大学孙逸仙纪念医院乳腺外科 广州 510120)
关键词:乳腺肿瘤;可溶性Fas配基;细胞凋亡;免疫抑制
肿瘤000427 中图分类号:R737.9 文献标识码:A 文章编号:1000-7431(2000)04-0310-03
乳腺癌组织有较高的Fas配基(FasL)表达[1],这种表达是否可诱导机体Fas阳性的免疫效应细胞凋亡,从而主动抑制机体的免疫功能,目前尚不清楚。作者通过检测乳腺癌细胞株MCF-7 Fas mRNA和蛋白的表达,以及其对可溶性FasL(sFasL)的分泌,观察该细胞株对Fas表达阳性的J和T细胞凋亡的诱导作用,从而探讨乳腺癌抑制机体免疫功能的机制。
, 百拇医药
材料与方法
一、材料
效应细胞和靶细胞系 效应细胞为乳腺癌MCF-7细胞系,靶细胞为Jurkat白血病T淋巴细胞 ,由美国新泽西洲大学任国媚博士提供;均在含10 %小牛血清的PRMI 1640培养液中传代培养。
二、方法
1.膜型FasL(mFasL)和sFasL的Western免疫印迹法检测 分别提取乳腺癌MCF-7细胞培养上清液和经裂解后细胞溶解液的蛋白质,并分别取50 ug样品与等体积加样缓冲液混和,煮沸5 min,12 % SDS-PAGE电泳,然后电转移至NC膜上,用兔抗人抗FasL多克隆抗体(Santa公司)作Ⅰ抗体,HRP标记的羊抗兔IgG(Santa 公司)作Ⅱ抗体,ECL (Santa 公司)荧光显色。
2.FasL mRNA的RT-PCR检测 MCF-7细胞总RNA提取采用异硫氰酸胍、酚、氯仿抽提“一步法”。RT-PCR采用Promega公司反转录试剂盒,按要求操作。取逆转录产物20 μl加入30 μl PCR 体系(PCR试剂盒,华美公司),引物浓度为200 ng/μl(mg/L)。反应条件及引物如下,FasL特异引物序列:5’-GGATTGGGCCTGGGGATGTTTCA-3’(上游),5’-TTGTGGCTCAGGGGCAGGTTGTTG-3’(下游)。β-肌动蛋白(β-actin)特异引物序列:5’-GTGGGGCGCCCCAGGCACCA-3’(上游);5’-CTCCTTAATGTCACGCACGATTTC-3’(下游)。按下述条件扩增:94 ℃,40 s;55 ℃,60 s;72 ℃,60 s。阳性对照采用表达FasL的人结肠癌细胞株SW620;阴性对照用不表达FasL的人结肠癌细胞株LoVo,均由美国新泽西洲大学任国媚博士提供。
, 百拇医药
3.混合细胞培养DNA片段化检测(JAM 试验) 按文献方法[2]用3.7×108 Bq/Ld(10mCi/Ld)[3H]TdR(Amersham)标记靶细胞Jurkat细胞核DNA,PBS洗2次。按5×106/L把效应MCF-7乳腺癌细胞加入到平底96孔板中,根据不同的E/T(E:效应细胞;T:靶细胞)比率加入标记好的靶细胞。37 ℃ CO2培养箱中培育5 h,收集细胞行放射性计数,推算靶细胞中片段化DNA百分含量,代表其凋亡的含量。计算公式为:片段化DNA(%)=100%×(不加入效应细胞的完整靶细胞核DNA放射计数-加入效应细胞的完整靶细胞核DNA放射计数)/不加入效应细胞的完整靶细胞核DNA放射计数。
4.效应细胞培养上清液对靶细胞凋亡的诱导 分别按0∶1、1∶2、1∶1和2∶1的比例在Jurkat细胞培养液中加入MCF-7细胞培养上清液,4 ℃下培育Jurkat细胞过夜。收集细胞,PBS洗后离心5 min,加入70 %乙醇,4 ℃下培育30 min,PBS洗后加入50 μl碘化丙碇(PI)染液50 mg/L PI,0.1 % Triton X-100,0.1 mmol/L EDTA(Na)2,50 mg/L RNase A(50 U/mg),室温下培育30 min,流式细胞仪检测DNA含量分布。每次计数104个细胞。所有资料经LYSIS Ⅱ软件(Becton Dickinson)进行定量检测。
, 百拇医药
5.统计学分析 每项试验重复5孔,数值以平均值±标准差表示。均数组间比较采用t检验。
结果
1.mFasL和sFasL的 Western免疫印迹检测结果 乳腺癌MCF-7细胞溶解液经应用抗FasL抗体 Western免疫印迹法检测在40 kDa位置上显示清晰的蛋白带(图1,Lane A),其细胞培养上清液经同样检测后在26 kDa位置上显示蛋白带(见图1,Lane B),分别与文献报道的 mFasL和分泌型 sFasL蛋白带的位置相符[3]。而阴性对照中则未见相应位置的蛋白带显示(见图1,Lane C)。

图1 乳腺癌MCF-7细胞裂解液和培养上清液的抗FasL多抗Western印迹检测。
(M:Size Marker;Lane A:MCF-7细胞裂解液,见mFasL阳性;Lane
, http://www.100md.com
B:MCF-7培养上清液,见sFasL阳性;Lane C:阴性对照)
2.FasL mRNA 的RT-PCR检测结果 分别采用已知FasL mRNA阳性和阴性的人结肠癌细胞株作为对照系统,RT-PCR法检测结果显示乳腺癌MCF-7细胞呈FasL mRNA表达阳性,为344 bp大小的DNA片段(图2)。

图2 乳腺癌MCF-7细胞FasL mRNA的RT-PCR检测结果。
(M:Size Marker;1:阳性对照;2:阴性对照;3:MCF-7细胞)
3.混合培养的靶细胞片段化的DNA含量 观察在不同效应细胞(MCF-7)与靶细胞(Jurkat)比例(E/T)时,Jurkat细胞片段化DNA含量的百分率变化。结果表明E/T=1时,DNA片段化含量为(9.6±1.2) %;E/T=2,为(19.0±3.8) %;E/T=4,为(30.2±7.4 %;E/T=8,为(57.3±9.8) %。因此,随着效靶细胞比例升高,靶细胞(Jurkat)片段化DNA含量也上升(P<0.01)。
, 百拇医药
4.MCF-7细胞上清液对Jurkat细胞凋亡的诱导 不同浓度的MCF-7细胞培养上清液处理Jurkat细胞,通过PI对DNA染色并应用流式细胞仪检测细胞DNA含量分布,其中,DNA含量低于G1期的亚二倍体细胞(sub-G1细胞)出现是细胞凋亡的重要特征。结果显示,不加入MCF-7上清液时(0∶1),Jurkat细胞AI为(1.2±0.4)%;上清液与PRMI 1640培养液比例为1∶2时,AI为(8.6±2.7)%;比例为1∶1时,AI为(19.4±2.5)%;2∶1时,AI为(34.7±4.6)%。可见,随着MCF-7上清液浓度的增加,Jurkat细胞中凋亡细胞的比例也增高(P<0.01)。
讨论
Fas配基(FasL)是一种Ⅱ型跨膜蛋白,分子量为40 kD,属于肿瘤坏死因子超家族成员。FasL能与受体Fas蛋白(CD95)结合,导致表达该蛋白的细胞发生凋亡。由于机体免疫活性细胞如淋巴细胞、NK细胞等均表达Fas蛋白并对FasL介导的凋亡敏感,故肿瘤细胞表达FasL被认为是其抑制机体免疫功能的因素之一[4]。体外和体内的研究均证明乳腺癌细胞可表达FasL[1],乳腺癌组织的免疫组化研究发现FasL阳性的乳腺癌旁浸润淋巴细胞发生较大量的凋亡,故认为Fas-FasL系统参与乳腺癌免疫逃避的机制[5]。
, 百拇医药
白血病细胞的跨膜型FasL可被间质金属蛋白酶切割,其膜外段脱落形成sFasL,分子量为26kD,被释放至细胞周围环境中[6]。但目前在实体肿瘤中有关sFasL分泌的研究尚少。作者采用抗FasL抗体Western免疫印迹法在MCF-7细胞培养上清液中检测出可溶性的FasL,由于在MCF-7细胞裂解液中可检测到跨膜型的FasL蛋白存在,RT-PCR也证实该细胞中含有过量表达的FasL mRNA,因此作者认为,细胞培养上清液中的sFasL来源于MCF-7细胞,是其跨膜型FasL蛋白的膜外段脱落产物。其它恶性肿瘤如前列腺癌细胞在体外培养时也分泌大量的sFasL[7]。
作者发现MCF-7细胞与对FasL敏感的Jurkat细胞共同培养时,随着MCF-7细胞比例的增加,Jurkat细胞发生凋亡的数量也增加,说明MCF-7细胞可通过胞膜表面的FasL或分泌的sFasL作用于Jurkat细胞的Fas蛋白,诱导其凋亡的发生。进一步用含有sFasL的MCF-7培养上清液处理Jurkat细胞,随着其浓度增加,Jurkat细胞凋亡数量也增加,可见sFasL不仅能与Fas结合,也同样具备跨膜型FasL的生物学活性,诱导Fas阳性的淋巴细胞凋亡。Martinez等[3]也证实激活的淋巴细胞分泌的可溶性FasL可诱导Jurkat细胞凋亡。因此作者认为乳腺癌细胞可能通过sFasL的分泌,诱导机体淋巴细胞凋亡,从而主动抑制机体的抗肿瘤免疫功能。
, 百拇医药
作者简介:苏逢锡,大学本科,副主任医师。
参考文献
[1]O’Connell J,Bennett MW,O'Sulivan GC,et al.Expression of Fas(CD95/APO-1)ligand by human breast cancers:significance for tumor immune privilege〔J〕.Clin Diagn Lab Immunol,1999,6:457
[2]Matzinger P.The JAM test:a simple assay for DNA fragmentation and cell death〔J〕.J Immunol Methods,1991,145:185
[3]Martinez-Lorenzo MJ,Alava MA,Anel A,et al.Release of preformed Fas ligand in soluble form is the major factor for activation-induced death of Jurkat T cells〔J〕.Immunology,1996,89:511~517
, 百拇医药
[4]Bennett MW,O'Connell J,O'Sullivan GC,et al.Expression of fas ligand by human gastric adenocarcinomas:a potential mechanism of immune escape in stomach cancer〔J〕.Gut,1999,44:156
[5]Gutierrez LS,Eliza M,Niven-Fairchild T,et al.The Fas/Fas-ligand system:a mechanism for immune evasion in human breast carcinomas〔J〕.Breast Cancer Res Treat,1999,54:245
[6]Tanaka M,Suda T,Haze K,et al.Fas ligand in human serum〔J〕.Nat Med,1996,2:317
[7]Liu QY,Rubin MA,Omene C,et al.Fas ligand is constitutively secreted by prostate cancer cells in vitro〔J〕.Clin Cancer Res,1998,4:1803
(收稿日期:2000-03-06), http://www.100md.com