恶性造血细胞表面Flt3受体的表达及其对Flt3配体的反应性研究
作者:许志祥 徐颖 施勤 李颖 胡华成 黄伟达 张学光
单位:许志祥 徐颖 施勤 李颖 张学光(苏州医学院生物技术研究所免疫研究室,江苏 苏州 215007);许志祥 胡华成(苏州医学院附二院,江苏 苏州 215004);黄伟达(上海复旦大学生化系,上海 200433)
关键词:Flt3受体;重组人Flt3配体(rhFL);恶性造血细胞;增殖;地塞米松
癌症000505
【摘要】目的:研究恶性造血细胞表面Flt3受体的表达,TNFα和地塞米松(DXM)对Flt3受体表达的作用及重组人Flt3配体(rhFL)对恶性造血细胞增殖的影响。方法:用流式细胞仪测定18株体外培养的恶性造血细胞株细胞表面Flt3受体,用MTT法测定rhFL对恶性造血细胞增殖的影响。结果:5株细胞表面存在Flt3受体。B淋巴瘤细胞株Raji、Daudi及多发性骨髓瘤细胞株8266表达高水平Flt3受体;髓系白血病细胞株HL-60和多发性骨髓瘤细胞株XG-6表达低水平的Flt3受体。用10-6mol/LDXM培养24h后,上述细胞Flt3受体表达降低;用20ng/mlTNFα培养24h后,Raji和8266细胞Flt3受体表达降低,HL-60和XG-6细胞Flt3受体表达增高,Daudi细胞Flt3受体表达不受影响。rhFL在10~100ng/ml浓度时,刺激Raji和HL-60细胞的增殖(P<0.05),但对绝大多数的恶性造血细胞体外无刺激作用。结论:多数恶性造血细胞不表达Flt3受体;rhFL也不引起此类细胞的增殖。地塞米松降低Flt3受体的表达,有可能用于防止或降低FL对部分恶性造血细胞的刺激作用,使FL的应用更为安全。
, http://www.100md.com
中图分类号:R733文献标识码:A文章编号:1000-467X(2000)05-0412-04
Flt3 receptor expression on the surface of malignant hematopoietic cells and responses to Flt3 ligand stimulation
XU Zhi-xiang,XU Ying,ZHANG Xue-guang,et al.
(Department of Immunology, Biotechnology Research Institute,Suzhou Medical College, Suzhou 215007, P.R.China)
XU Zhi-xiang
, 百拇医药
(The Second Affiliated Hospital, Suzhou Medical College, Suzhou 215004, P.R.China)
【Abstract】 Objectives: To investigate the Flt3 receptor expression on the surface of malignant hematopoietic cells, the effect of TNFα and dexamethasone (DXM) on its expression and the responses of those cells to recombinant human Flt3 ligand (rhFL). Methods: Eighteen malignant hematopoietic cell lines were determined for the Flt3 receptor expression by flow cytometric analysis. The effect of rhFL on the proliferation of malignant hematopoietic cells in vitro was examined using MTT assay. Results: The expressions of Flt3 receptor on the surface of Raji, Daudi, HL-60, 8266, and XG-6 cells were detected by flow cytometric analysis. Following incubation with 20 ng/ml TNFα for 24 h, the number of Flt3 receptor positive cells were decreased in Raji and 8266, increased in HL-60 and XG-6, and no difference in Daudi cells. After incubation with 10- 6 mol/L DXM for 24 h, the number of Flt3 receptor positive cells decreased in all the 5 Flt3 receptor positive cell lines. rhFL stimulated the proliferation of HL-60 and Raji cells. Conclusions: For most of the malignant hematopoietic cells, there was neither the expression of Flt3 receptor nor the response to rhFL. DXM may be useful to reduce the effect of FL on the proliferation of some Flt3 receptor positive malignant hematopoietic cells in vitro and in vivo.
, http://www.100md.com
Key words: Flt3 receptor; Recombinant human Flt3 ligand(rhFL); Malignant hematopoietic cell lines; Proliferation; Dexamethasone(DXM)
机体的造血过程复杂,受多种正负调控因子的调控。这些造血生长因子或细胞因子的调控失衡,可导致某一细胞系的过度增殖,甚至出现白血病改变。在这些细胞因子中,细胞表面酪氨酸激酶受体Ⅲ(classⅢreceptor-typetyrosinekinases,RTK-Ⅲ)及其配体在造血过程,尤其是早期造血过程中起重要作用[1]。Flt3受体(fms-liketyrosinekinasereceptorⅢ,FR)是Lyman等于1993年发现的一种RTK-Ⅲ[2]。Flt3在成人骨髓、胸腺及胎儿胸腺、肝脏中高表达。Flt3配体(Flt3ligand,FL)是一种具有促进早期造血功能的细胞因子,FL与FR结合,可刺激早期造血干细胞/祖细胞增殖,促进造血。FL尚可刺激树突状细胞(dendriticcell,DC)和自然杀伤细胞(naturalkillercell)的生长和分化,诱导它们的成熟,从而产生抗肿瘤作用[3~5]。
, 百拇医药
另一方面,FL在生理情况下对造血前体细胞具有刺激增殖作用,而造血系统多种恶性肿瘤起源于造血前体细胞,FL对其有无刺激作用,此关系到FL能否用于该类患者造血功能严重衰竭时的治疗,亦关系到FL能否用于此类患者的抗肿瘤生物治疗。本研究旨在探讨FR在人造血系统多种恶性肿瘤细胞株细胞表面的表达,TNFα及地塞米松对此群细胞表达FR的影响,以及重组人FL(rhFL)在体外对此群细胞的刺激作用,以期为FL在临床中的应用提供基础研究资料。
1材料和方法
1.1细胞因子及细胞株
rhFL由我室在毕氏酵母中表达、生产并分离、纯化。人重组SCF、IL-3、IL-4、GM-CSF、M-CSF、TNFα购自Immunogen公司。Daudi、Raji、Jurkat、HL-60、U937、KG1-α、U266、TF1、Baf、8266及Wehi细胞系购自ATCC(美国);B9细胞系由L.Arden博士赠送(Amsterdam);B9-11,XG-1、XG-6和XG-7细胞系由B.Klein博士赠送(Montpellier);HSB2,JJhanandSupT1细胞系由南京医科大学姚教授赠送。所有细胞均经支原体检测,无支原体污染,并按常规保存。
, http://www.100md.com
1.2细胞培养
用含有10%胎牛血清的RPMI1640培养基,常规培养细胞(37℃,5%CO2)。Baf细胞培养时,还加入1.5%的Wehi上清,作为该细胞生长所需IL-3的来源。TF-1、XG-1(XG-6、XG-7)和B9(B9-11)细胞培养时还分别加入10ng/mlGM-CSF、1ng/mlIL-6和0.5ng/mlIL-11。为研究TNFα和地塞米松对细胞表达FR的影响,在测定FR表达前24h,培养基中加入20ng/mlTNFα或10-6mol/L地塞米松(DXM)。
1.3造血系统恶性肿瘤细胞株细胞表面Flt3受体的流式细胞仪分析
收集处于对数生长期的培养细胞,用PBS洗脱3遍,并计数。取5×105细胞置于96孔板中,加入抗Flt3特异性的IgG1单抗SF1.340(购自Immunotech公司),4℃孵育30min,用PBS洗脱未结合的单抗。加入FITC荧光标记的羊抗鼠IgG,4℃置于暗处30min。洗脱3遍后用EPICS流式细胞仪(CoulterElectronic)检测Flt3表达。
, http://www.100md.com
1.4rhFL对造血系统恶性肿瘤细胞株细胞的增殖作用研究
按本室建立的常规方法进行,简述如下:取对数生长期的检测细胞,经洗涤3次后,置于96孔板中,每孔5000细胞,置于含有10%胎牛血清RPMI1640培养基中,加入不同浓度(0~100ng/ml)的rhFL。Baf细胞培养时还加入1.5%Wehi上清,作为该细胞生长所需IL-3的来源。TF1、XG-1(XG-7)、B9-11(B9)细胞培养时还分别加入10ng/mlGM-CSF、1ng/mlIL-6和0.5ng/mlIL-11。培养72h后,采用MTT法测定细胞的增殖活性[6]。
2实验结果
2.1造血系统恶性肿瘤细胞株细胞表面Flt3受体的表达
共检测了18株白血病、淋巴瘤及多发性骨髓瘤细胞系细胞表面表达Flt3受体的情况。其中5株检出Flt3受体的表达。在5株Flt3受体表达阳性的细胞株中,Flt3受体的表达水平不一致。Raji、Daudi和8266表达阳性率较高,而HL-60及XG-6表达Flt3受体阳性率较低(表1、图1)。
, 百拇医药
2.2TNFα和地塞米松对造血系统恶性肿瘤细胞株细胞Flt3受体表达的影响
用20ng/mlTNFα培养24h后,Raji和8266细胞表达Flt3受体的阳性细胞数降低,而HL-60和XG-6细胞中Flt3受体阳性细胞数增高,Daudi细胞表达Flt3受体不受影响。用10-6mol/LDXM培养24h后,细胞表达Flt3受体降低(表1、图1).
2.3rhFL对造血系统恶性肿瘤细胞株细胞的作用
rhFL在10~100ng/ml浓度时,刺激Raji和HL-60细胞的增殖(P<0.05) , 对 Jurkat、KG-1α、8266、U266、U937、Daudi、Baf、B9、B9-11、TF1、XG-1、XG-6、XG-7、HSB2,JJhan及SupT1等多种白血病细胞系、淋巴瘤细胞系及多发性骨髓瘤细胞系细胞无刺激增殖或抑制作用(图2)。
, 百拇医药
表1造血系统恶性肿瘤细胞株细胞表面Flt3
受体的表达 细胞系
细胞类型(原始疾病类型)
表达Flt3的细胞(阴性对照)(%)
表达Flt3的细胞(%)
TNFα刺激后,表达Flt3的细胞(%)
DXM作用后表达Flt3的细胞(%)
Raji
lymphoid(Btype)
2.1
36.2
, 百拇医药
30.8
14.7
Daudi
lymphoblastoid(Btype)
2.7
13.4
12.6
6.7
SUP-T1
lymphoid(Ttype)
0.7
0.4
, 百拇医药
0.9
0.58
JJhan
lymphoid(Ttype)
1.4
1.3
1.8
1.2
HSB2
lymphoid(Ttype)
0.8
1.2
1.7
, 百拇医药
1.2
Jurkat
lymphoid(ALLT)
0.8
0.7
0.5
1.2
HL-60
myeloid(AMLM2)
1.1
4.1
10.5
4.9
, 百拇医药
KG-1α
myeloid(AML)
1.6
1.8
1.5
1.2
TF-1
Erythroid(AMLM6)
1.8
2.5
3.0
2.8
U937
, http://www.100md.com
monocytic(Histiocyticlymph)
1.7
3.8
1.9
1.9
8266
myeloma
0.7
45.5
34.2
22.8
U-266
, 百拇医药 myeloma
2.0
3.8
6.6
2.2
XG-1
myeloma
1.8
1.7
1.5
1.5
XG-6
myeloma
, 百拇医药
2.5
6.3
12.6
4.3
XG-7
myeloma
1.9
3.0
4.1
4.0
B9
Murinelymphoid(Btype)
1.8
, 百拇医药
1.4
1.9
1.2
B9-11
Murinelymphoid(Btype)
2.2
1.9
2.0
2.0
Baf
MurineProB-cell
1.1
, http://www.100md.com 1.2
1.3
1.2
3讨论
造血生成受多种正性和负性调控因子的调节,以维持机体的造血过程在一个相对平衡的状态。若造血生长因子或细胞因子调控失衡,可导致某一细胞系的过度增殖,甚至出现白血病改变。FL是一种重要的正性调控因子,与造血干/祖细胞表面的Flt3受体结合,促进造血干/祖细胞增殖和生长,具有显著的促进造血作用。FL可刺激树突状细胞(dendriticcell,DC)和自然杀伤细胞(naturalkillercell)的生长和分化,诱导它们的成熟,从而具有抗肿瘤作用[4,5,7]。因此,FL具有重要的研究和潜在的临床应用价值。
然而,造血系统多种恶性肿瘤起源于造血前体细胞,这些细胞表面有无Flt3受体表达,FL对其有无刺激作用,这关系到FL能否用于该类患者造血功能严重衰竭时的治疗,亦关系到FL能否用于此类患者的抗肿瘤生物治疗。本研究发现,B淋巴瘤细胞株Raji、Daudi及多发性骨髓瘤细胞株8266表达高水平Flt3受体;髓系白血病细胞株HL-60和多发性骨髓瘤细胞株XG-6表达低水平的Flt3受体。rhFL对Raji和HL-60细胞有刺激增殖作用,但对绝大多数的造血系统恶性细胞株如Jurkat、KG-1α、8266、U266、U937、Daudi、Baf、B9、B9-11、TF1、XG-1、XG-6、XG-7、HSB2、JJhan及SupT1等细胞无明显增殖或抑制作用,说明rhFL可用于绝大多数的造血系统肿瘤患者,而不至于引起恶性造血细胞的增殖。但对B淋巴瘤患者和急性髓系白血病患者,使用时必须监测患者恶性细胞表面Flt3受体的表达。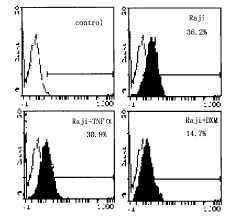
, 百拇医药
图1Raji细胞表面Flt3受体的流式细胞仪分析
细胞用特异性的抗flt3受体单抗SF1.340染色标记(图中曲线下黑体部分),阴性对照用具有相同独特型的无关抗体进行标记(图中曲线下中空部分)。
图2rhFL对Flt3受体阳性恶性造血细胞系细胞体外作用
但我们的实验亦发现,地塞米松可抑制细胞表面Flt3受体的表达,而TNFα对各种细胞系细胞表达Flt3受体的作用不尽一致。该结果提示,恶性细胞Flt3受体阳性的血液病患者必须使用FL改善造血或行FL抗肿瘤生物治疗时;加用地塞米松,有可能防止或降低FL对自身恶性细胞的刺激作用,使FL的应用更为安全。但必须指出,我们所用的细胞均为细胞系细胞,要完整了解FL对造血系统恶性肿瘤的影响,尚需进一步研究rhFL对新鲜肿瘤细胞的体外效应以及探讨rhFL在体内对恶性肿瘤细胞的作用。
, 百拇医药
基金项目:本课题为国防科工委资助项目(Y5573162)和国际原子能机构(IAEA)资助项目(CRP/9/025)
[参考文献]
[1] Ullrich A, Schlessinger J. Signal transduction by receptors with tyrosine kinase activity [J]. Cell, 1990, 61: 203~ 212.
[2] Rosnet O, Schiff C, Pebusque MJ, et al. Human FLT3/FLK2 gene: cDNA cloning and expression in hematopoietic cells [J]. Blood, 1993, 82(4): 1110~ 1119.
[3] Lyman SD, James L, Johnson L, et al. Cloning of the human homologue of the murine Flt3 ligand: a growth factor for early hematopoietic progenitor cells [J]. Blood, 1994, 83(10): 2795~ 2801.
, http://www.100md.com
[4] Lynch DH, Andreasen A, Maraskovsky E, et al. Flt3 ligand induces tumor regression and antitumor immune responses in vivo [J]. Nat Med, 1997, 3(2): 625~ 631.
[5] Peron JM, Esche C, Subbotin VM, et al. FLT3-ligand administration inhibits liver metastases: role of NK cells [J]. J Immunol, 1998, 161(11): 6164~ 6170.
[6] Carmichael J, DeGraff WG, Gazdar AF, et al. Evaluation of a tetrazolium-based semiautomated colorimetric assay: Assessment of chemosensitivity testing [J]. Cancer Res, 1987, 47(4): 936~ 943.
[7] Sakabe H, Kimura T, Zeng Z, et al. Haematopoietic action of Flt3 ligand on cord blood-derived CD34-positive cells expressing different levels of Flt3 or c-kit tyrosine kinase receptor: comparison with stem cell factor [J]. Eur J Haematol, 1998, 60(5): 297~ 306.
收稿日期:1999-11-11;修回日期:1999-12-13, 百拇医药
单位:许志祥 徐颖 施勤 李颖 张学光(苏州医学院生物技术研究所免疫研究室,江苏 苏州 215007);许志祥 胡华成(苏州医学院附二院,江苏 苏州 215004);黄伟达(上海复旦大学生化系,上海 200433)
关键词:Flt3受体;重组人Flt3配体(rhFL);恶性造血细胞;增殖;地塞米松
癌症000505
【摘要】目的:研究恶性造血细胞表面Flt3受体的表达,TNFα和地塞米松(DXM)对Flt3受体表达的作用及重组人Flt3配体(rhFL)对恶性造血细胞增殖的影响。方法:用流式细胞仪测定18株体外培养的恶性造血细胞株细胞表面Flt3受体,用MTT法测定rhFL对恶性造血细胞增殖的影响。结果:5株细胞表面存在Flt3受体。B淋巴瘤细胞株Raji、Daudi及多发性骨髓瘤细胞株8266表达高水平Flt3受体;髓系白血病细胞株HL-60和多发性骨髓瘤细胞株XG-6表达低水平的Flt3受体。用10-6mol/LDXM培养24h后,上述细胞Flt3受体表达降低;用20ng/mlTNFα培养24h后,Raji和8266细胞Flt3受体表达降低,HL-60和XG-6细胞Flt3受体表达增高,Daudi细胞Flt3受体表达不受影响。rhFL在10~100ng/ml浓度时,刺激Raji和HL-60细胞的增殖(P<0.05),但对绝大多数的恶性造血细胞体外无刺激作用。结论:多数恶性造血细胞不表达Flt3受体;rhFL也不引起此类细胞的增殖。地塞米松降低Flt3受体的表达,有可能用于防止或降低FL对部分恶性造血细胞的刺激作用,使FL的应用更为安全。
, http://www.100md.com
中图分类号:R733文献标识码:A文章编号:1000-467X(2000)05-0412-04
Flt3 receptor expression on the surface of malignant hematopoietic cells and responses to Flt3 ligand stimulation
XU Zhi-xiang,XU Ying,ZHANG Xue-guang,et al.
(Department of Immunology, Biotechnology Research Institute,Suzhou Medical College, Suzhou 215007, P.R.China)
XU Zhi-xiang
, 百拇医药
(The Second Affiliated Hospital, Suzhou Medical College, Suzhou 215004, P.R.China)
【Abstract】 Objectives: To investigate the Flt3 receptor expression on the surface of malignant hematopoietic cells, the effect of TNFα and dexamethasone (DXM) on its expression and the responses of those cells to recombinant human Flt3 ligand (rhFL). Methods: Eighteen malignant hematopoietic cell lines were determined for the Flt3 receptor expression by flow cytometric analysis. The effect of rhFL on the proliferation of malignant hematopoietic cells in vitro was examined using MTT assay. Results: The expressions of Flt3 receptor on the surface of Raji, Daudi, HL-60, 8266, and XG-6 cells were detected by flow cytometric analysis. Following incubation with 20 ng/ml TNFα for 24 h, the number of Flt3 receptor positive cells were decreased in Raji and 8266, increased in HL-60 and XG-6, and no difference in Daudi cells. After incubation with 10- 6 mol/L DXM for 24 h, the number of Flt3 receptor positive cells decreased in all the 5 Flt3 receptor positive cell lines. rhFL stimulated the proliferation of HL-60 and Raji cells. Conclusions: For most of the malignant hematopoietic cells, there was neither the expression of Flt3 receptor nor the response to rhFL. DXM may be useful to reduce the effect of FL on the proliferation of some Flt3 receptor positive malignant hematopoietic cells in vitro and in vivo.
, http://www.100md.com
Key words: Flt3 receptor; Recombinant human Flt3 ligand(rhFL); Malignant hematopoietic cell lines; Proliferation; Dexamethasone(DXM)
机体的造血过程复杂,受多种正负调控因子的调控。这些造血生长因子或细胞因子的调控失衡,可导致某一细胞系的过度增殖,甚至出现白血病改变。在这些细胞因子中,细胞表面酪氨酸激酶受体Ⅲ(classⅢreceptor-typetyrosinekinases,RTK-Ⅲ)及其配体在造血过程,尤其是早期造血过程中起重要作用[1]。Flt3受体(fms-liketyrosinekinasereceptorⅢ,FR)是Lyman等于1993年发现的一种RTK-Ⅲ[2]。Flt3在成人骨髓、胸腺及胎儿胸腺、肝脏中高表达。Flt3配体(Flt3ligand,FL)是一种具有促进早期造血功能的细胞因子,FL与FR结合,可刺激早期造血干细胞/祖细胞增殖,促进造血。FL尚可刺激树突状细胞(dendriticcell,DC)和自然杀伤细胞(naturalkillercell)的生长和分化,诱导它们的成熟,从而产生抗肿瘤作用[3~5]。
, 百拇医药
另一方面,FL在生理情况下对造血前体细胞具有刺激增殖作用,而造血系统多种恶性肿瘤起源于造血前体细胞,FL对其有无刺激作用,此关系到FL能否用于该类患者造血功能严重衰竭时的治疗,亦关系到FL能否用于此类患者的抗肿瘤生物治疗。本研究旨在探讨FR在人造血系统多种恶性肿瘤细胞株细胞表面的表达,TNFα及地塞米松对此群细胞表达FR的影响,以及重组人FL(rhFL)在体外对此群细胞的刺激作用,以期为FL在临床中的应用提供基础研究资料。
1材料和方法
1.1细胞因子及细胞株
rhFL由我室在毕氏酵母中表达、生产并分离、纯化。人重组SCF、IL-3、IL-4、GM-CSF、M-CSF、TNFα购自Immunogen公司。Daudi、Raji、Jurkat、HL-60、U937、KG1-α、U266、TF1、Baf、8266及Wehi细胞系购自ATCC(美国);B9细胞系由L.Arden博士赠送(Amsterdam);B9-11,XG-1、XG-6和XG-7细胞系由B.Klein博士赠送(Montpellier);HSB2,JJhanandSupT1细胞系由南京医科大学姚教授赠送。所有细胞均经支原体检测,无支原体污染,并按常规保存。
, http://www.100md.com
1.2细胞培养
用含有10%胎牛血清的RPMI1640培养基,常规培养细胞(37℃,5%CO2)。Baf细胞培养时,还加入1.5%的Wehi上清,作为该细胞生长所需IL-3的来源。TF-1、XG-1(XG-6、XG-7)和B9(B9-11)细胞培养时还分别加入10ng/mlGM-CSF、1ng/mlIL-6和0.5ng/mlIL-11。为研究TNFα和地塞米松对细胞表达FR的影响,在测定FR表达前24h,培养基中加入20ng/mlTNFα或10-6mol/L地塞米松(DXM)。
1.3造血系统恶性肿瘤细胞株细胞表面Flt3受体的流式细胞仪分析
收集处于对数生长期的培养细胞,用PBS洗脱3遍,并计数。取5×105细胞置于96孔板中,加入抗Flt3特异性的IgG1单抗SF1.340(购自Immunotech公司),4℃孵育30min,用PBS洗脱未结合的单抗。加入FITC荧光标记的羊抗鼠IgG,4℃置于暗处30min。洗脱3遍后用EPICS流式细胞仪(CoulterElectronic)检测Flt3表达。
, http://www.100md.com
1.4rhFL对造血系统恶性肿瘤细胞株细胞的增殖作用研究
按本室建立的常规方法进行,简述如下:取对数生长期的检测细胞,经洗涤3次后,置于96孔板中,每孔5000细胞,置于含有10%胎牛血清RPMI1640培养基中,加入不同浓度(0~100ng/ml)的rhFL。Baf细胞培养时还加入1.5%Wehi上清,作为该细胞生长所需IL-3的来源。TF1、XG-1(XG-7)、B9-11(B9)细胞培养时还分别加入10ng/mlGM-CSF、1ng/mlIL-6和0.5ng/mlIL-11。培养72h后,采用MTT法测定细胞的增殖活性[6]。
2实验结果
2.1造血系统恶性肿瘤细胞株细胞表面Flt3受体的表达
共检测了18株白血病、淋巴瘤及多发性骨髓瘤细胞系细胞表面表达Flt3受体的情况。其中5株检出Flt3受体的表达。在5株Flt3受体表达阳性的细胞株中,Flt3受体的表达水平不一致。Raji、Daudi和8266表达阳性率较高,而HL-60及XG-6表达Flt3受体阳性率较低(表1、图1)。
, 百拇医药
2.2TNFα和地塞米松对造血系统恶性肿瘤细胞株细胞Flt3受体表达的影响
用20ng/mlTNFα培养24h后,Raji和8266细胞表达Flt3受体的阳性细胞数降低,而HL-60和XG-6细胞中Flt3受体阳性细胞数增高,Daudi细胞表达Flt3受体不受影响。用10-6mol/LDXM培养24h后,细胞表达Flt3受体降低(表1、图1).
2.3rhFL对造血系统恶性肿瘤细胞株细胞的作用
rhFL在10~100ng/ml浓度时,刺激Raji和HL-60细胞的增殖(P<0.05) , 对 Jurkat、KG-1α、8266、U266、U937、Daudi、Baf、B9、B9-11、TF1、XG-1、XG-6、XG-7、HSB2,JJhan及SupT1等多种白血病细胞系、淋巴瘤细胞系及多发性骨髓瘤细胞系细胞无刺激增殖或抑制作用(图2)。
, 百拇医药
表1造血系统恶性肿瘤细胞株细胞表面Flt3
受体的表达 细胞系
细胞类型(原始疾病类型)
表达Flt3的细胞(阴性对照)(%)
表达Flt3的细胞(%)
TNFα刺激后,表达Flt3的细胞(%)
DXM作用后表达Flt3的细胞(%)
Raji
lymphoid(Btype)
2.1
36.2
, 百拇医药
30.8
14.7
Daudi
lymphoblastoid(Btype)
2.7
13.4
12.6
6.7
SUP-T1
lymphoid(Ttype)
0.7
0.4
, 百拇医药
0.9
0.58
JJhan
lymphoid(Ttype)
1.4
1.3
1.8
1.2
HSB2
lymphoid(Ttype)
0.8
1.2
1.7
, 百拇医药
1.2
Jurkat
lymphoid(ALLT)
0.8
0.7
0.5
1.2
HL-60
myeloid(AMLM2)
1.1
4.1
10.5
4.9
, 百拇医药
KG-1α
myeloid(AML)
1.6
1.8
1.5
1.2
TF-1
Erythroid(AMLM6)
1.8
2.5
3.0
2.8
U937
, http://www.100md.com
monocytic(Histiocyticlymph)
1.7
3.8
1.9
1.9
8266
myeloma
0.7
45.5
34.2
22.8
U-266
, 百拇医药 myeloma
2.0
3.8
6.6
2.2
XG-1
myeloma
1.8
1.7
1.5
1.5
XG-6
myeloma
, 百拇医药
2.5
6.3
12.6
4.3
XG-7
myeloma
1.9
3.0
4.1
4.0
B9
Murinelymphoid(Btype)
1.8
, 百拇医药
1.4
1.9
1.2
B9-11
Murinelymphoid(Btype)
2.2
1.9
2.0
2.0
Baf
MurineProB-cell
1.1
, http://www.100md.com 1.2
1.3
1.2
3讨论
造血生成受多种正性和负性调控因子的调节,以维持机体的造血过程在一个相对平衡的状态。若造血生长因子或细胞因子调控失衡,可导致某一细胞系的过度增殖,甚至出现白血病改变。FL是一种重要的正性调控因子,与造血干/祖细胞表面的Flt3受体结合,促进造血干/祖细胞增殖和生长,具有显著的促进造血作用。FL可刺激树突状细胞(dendriticcell,DC)和自然杀伤细胞(naturalkillercell)的生长和分化,诱导它们的成熟,从而具有抗肿瘤作用[4,5,7]。因此,FL具有重要的研究和潜在的临床应用价值。
然而,造血系统多种恶性肿瘤起源于造血前体细胞,这些细胞表面有无Flt3受体表达,FL对其有无刺激作用,这关系到FL能否用于该类患者造血功能严重衰竭时的治疗,亦关系到FL能否用于此类患者的抗肿瘤生物治疗。本研究发现,B淋巴瘤细胞株Raji、Daudi及多发性骨髓瘤细胞株8266表达高水平Flt3受体;髓系白血病细胞株HL-60和多发性骨髓瘤细胞株XG-6表达低水平的Flt3受体。rhFL对Raji和HL-60细胞有刺激增殖作用,但对绝大多数的造血系统恶性细胞株如Jurkat、KG-1α、8266、U266、U937、Daudi、Baf、B9、B9-11、TF1、XG-1、XG-6、XG-7、HSB2、JJhan及SupT1等细胞无明显增殖或抑制作用,说明rhFL可用于绝大多数的造血系统肿瘤患者,而不至于引起恶性造血细胞的增殖。但对B淋巴瘤患者和急性髓系白血病患者,使用时必须监测患者恶性细胞表面Flt3受体的表达。

, 百拇医药
图1Raji细胞表面Flt3受体的流式细胞仪分析
细胞用特异性的抗flt3受体单抗SF1.340染色标记(图中曲线下黑体部分),阴性对照用具有相同独特型的无关抗体进行标记(图中曲线下中空部分)。

图2rhFL对Flt3受体阳性恶性造血细胞系细胞体外作用
但我们的实验亦发现,地塞米松可抑制细胞表面Flt3受体的表达,而TNFα对各种细胞系细胞表达Flt3受体的作用不尽一致。该结果提示,恶性细胞Flt3受体阳性的血液病患者必须使用FL改善造血或行FL抗肿瘤生物治疗时;加用地塞米松,有可能防止或降低FL对自身恶性细胞的刺激作用,使FL的应用更为安全。但必须指出,我们所用的细胞均为细胞系细胞,要完整了解FL对造血系统恶性肿瘤的影响,尚需进一步研究rhFL对新鲜肿瘤细胞的体外效应以及探讨rhFL在体内对恶性肿瘤细胞的作用。
, 百拇医药
基金项目:本课题为国防科工委资助项目(Y5573162)和国际原子能机构(IAEA)资助项目(CRP/9/025)
[参考文献]
[1] Ullrich A, Schlessinger J. Signal transduction by receptors with tyrosine kinase activity [J]. Cell, 1990, 61: 203~ 212.
[2] Rosnet O, Schiff C, Pebusque MJ, et al. Human FLT3/FLK2 gene: cDNA cloning and expression in hematopoietic cells [J]. Blood, 1993, 82(4): 1110~ 1119.
[3] Lyman SD, James L, Johnson L, et al. Cloning of the human homologue of the murine Flt3 ligand: a growth factor for early hematopoietic progenitor cells [J]. Blood, 1994, 83(10): 2795~ 2801.
, http://www.100md.com
[4] Lynch DH, Andreasen A, Maraskovsky E, et al. Flt3 ligand induces tumor regression and antitumor immune responses in vivo [J]. Nat Med, 1997, 3(2): 625~ 631.
[5] Peron JM, Esche C, Subbotin VM, et al. FLT3-ligand administration inhibits liver metastases: role of NK cells [J]. J Immunol, 1998, 161(11): 6164~ 6170.
[6] Carmichael J, DeGraff WG, Gazdar AF, et al. Evaluation of a tetrazolium-based semiautomated colorimetric assay: Assessment of chemosensitivity testing [J]. Cancer Res, 1987, 47(4): 936~ 943.
[7] Sakabe H, Kimura T, Zeng Z, et al. Haematopoietic action of Flt3 ligand on cord blood-derived CD34-positive cells expressing different levels of Flt3 or c-kit tyrosine kinase receptor: comparison with stem cell factor [J]. Eur J Haematol, 1998, 60(5): 297~ 306.
收稿日期:1999-11-11;修回日期:1999-12-13, 百拇医药