血小板衍生生长因子-BB对破骨细胞功能影响的实验研究
作者:金大地 张忠民 陈建庭
单位:510515广州,第一军医大学南方医院骨科;国家骨质疏松症诊疗研究中心
关键词:血小板源生长因子;受体,血小板源生长因子;破骨细胞;酸性磷酸酶;酒石酸盐类
中华骨科杂志000512
【摘要】目的探讨血小板衍生生长因子-BB(platelet-derivedgrowthfactor-BB,PDGF-BB)对破骨细胞生物学功能的影响。方法(1)利用酶消化法分离培养成人破骨细胞;(2)应用透射电子显微镜方法观察破骨细胞对PDGF-β受体的表达;(3)在经过纯化的破骨细胞上清液中施加重组人基因PDGF-BB,利用酶动力学方法测定培养上清液中的酸性磷酸酶(ACP)和抗酒石酸酸性磷酸酶(TRAP)的活性;(4)通过Leica图像分析仪观察在PDGF-BB作用下,破骨细胞所形成骨吸收陷窝的数目与面积。结果(1)破骨细胞膜上有胶体金颗粒沉着;(2)破骨细胞培养上清液中的ACP和TRAP活性随着PDGF-BB浓度的升高而增加,分别从(1.85±0.13)u/L和(1.73±0.15)u/L(对照组)增加至(2.86±0.15)u/L和(2.75±0.24)u/L(40μg/L组,P<0.01);(3)在PDGF-BB的作用下,破骨细胞所形成的骨吸收陷窝的面积从(435.08±237.50)μm2(对照组)增高至(630.26±240.64)μm2(40μg/L组,P<0.01),每个骨片上骨吸收陷窝的数目亦从14.00±1.41增加为26.00±2.00(P<0.05或P<0.01)。结论PDGF-BB通过与PDGF-β受体结合,可直接促进破骨细胞的骨吸收功能。
, http://www.100md.com
The effects of platelet- derived growth factor- BB on the osteoclastic bone resorption
JIN Dadi, ZHANG Zhongmin, CHEN Jianting
Department of Orthopaedics and Spinal Surgery, Nanfang Hospital, The First Military Medical University, The National Research Center on Osteoporosis, Guangzhou 510515, China
【 Abstract】 Objective To study the effect of platelet- derived growth factor- BB( PDGF- BB) on the biological functions of human osteoclasts. Methods 1)Adult osteoclasts were isolated from human spongy bone with collagenase Ⅱ . 2)PDGF receptor- β was detected on the osteoclasts with transmission electron microscope. 3)The PDGF- BB was exerted on the osteoclasts that adhered to the bone slice at the concentration of 0,10,20,30 and 40 μ g/L. The acid phosphatase (ACP) and the tartrate- resistant acid phosphatase ( TRAP) activities in the culture medium were measured with kinetic method. 4)The number and area of lacunae formed by osteoclasts absorption under the action of PDGF- BB were analysed with Leica image analysis apparatus. Results 1)The colloidal gold deposited on the cellular membrane. 2)The ACP and TRAP activities rose with the dose of PDGF- BB, increasing respectively from (1.85± 0.13) u/L and (1.73± 0.15)u/L (control) to (2.86± 0.15)u/L and (2.75± 0.24)u/L when PDGF- BB was at 40 μ g/L (P< 0.01). 3)The volume of Howship's lacunae augmented from (435.08± 237.50) μ m2 (control) to (630.26± 240.64) μ m2 (P< 0.01), and the number of the resorption lacuna increased also from 14.00± 1.41 to 26.00± 2.00 (P< 0.01). Conclusion The human osteoclast has PDGF receptor- β on its membrane and PDGF- BB could stimulate osteoclastic bone resorption directly after binding to the receptor- β .
, 百拇医药
【 Key words】 Platelet- derived growth factor; Receptors,platelet- derived growth factor; Osteoclasts; Acid phosphatase; Tartrates
现已阐明,血小板衍生生长因子(platelet-derived growth factor,PDGF)是由A、B两条多肽链通过二硫键连接而成的三种二聚体,即PDGF-AA、PDGF-AB和PDGF-BB。PDGF分别有α和β两种受体,α受体可与A链和B链结合,而β受体仅与B链结合[1,2]。已知PDGF有促成骨细胞分裂、分化之作用,但对其与破骨细胞的关系尚知之甚少。一般认为PDGF-BB的生物学功能最强,为了解两者之间的关系,我们利用免疫电镜等方法观察PDGF对破骨细胞生物学功能的影响。
材料与方法
一、材料
, http://www.100md.com
主要试剂有无酚红1640培养基(GibcoBRL公司);抗PDGF-β受体单克隆抗体(鼠抗人,Oncogene公司);甲苯胺蓝(Sigma公司);重组人PDGF-BB(Oncogene公司);Ⅱ型胶原酶(Sigma公司),胶体金(直径10nm)标记羊抗小鼠IgG(北京中山生物公司);酸性磷酸酶试剂盒(bioMérieux公司)。
二、方法
(一)骨片制作:取新鲜健康成人股骨标本(交通意外伤后截肢),以体积分数为2.5%戊二醛和体积分数为10%甲醛固定,乙醇逐级脱水,冷水降温,用低速骨锯将皮质骨锯开,并在油石上磨成厚约20μm的骨片。超声波清洗机洗涤,环氧乙烷灭菌,置于4℃保存、备用。
(二)破骨细胞的分离与培养:经征得需植骨患者的同意,取其髂骨松质骨,以磷酸缓冲液(PBS,pH7.4)冲洗,剪碎(约1mm×1mm×1mm大小),Ⅱ型胶原酶消化[3],PBS洗涤,用无酚红1640培养基制成细胞悬液,接种于培养皿内。孵育40min后,用PBS洗掉吸附能力较弱或未贴壁细胞,重新收集贴附的细胞,调节其密度约为104/ml,继续孵育[4]。酚红具有微弱的雌性激素作用[5],并可干扰酶学检查结果,因而未被用作酸碱指示剂。
, 百拇医药
(三)PDGF-β受体的测定:将培养3d的细胞转移至离心管内(104/ml),加入PDGF-β受体单克隆抗体,孵育10min,PBS充分洗涤,加入胶体金标记第二抗体,孵育10min,PBS充分洗涤,然后将细胞悬液转入琼脂模型管内,2500r/min离心10min。以体积分数为2.5%戊二醛前固定3h,锇酸后固定30min,丙酮脱水,树脂包埋,超薄切片(1μm),透射电子显微镜观察。
(四)酸性磷酸酶(ACP)与抗酒石酸酸性磷酸酶(TRAP)活性的测定:将破骨细胞接种于24孔的培养板内,按照PDGF-BB终浓度(10、20、30和40μg/L)分为四个实验组,每组5孔,另设空白对照组4孔。48h后,将培养上清液2000r/min离心5min,加入α-napthyl phosphate(底物)缓冲液(pH5.4),孵育10min,其产物与FastRedTR反应,终产物行偶氮染色,测定ACP活性。在孵育液中加入酒石酸(终浓度为75mmol/L),即可测得TRAP活性。
, http://www.100md.com
(五)骨吸收陷窝的测定:将细胞悬液接种于24孔培养板内,每孔含5片骨片。按照PDGF-BB的终浓度(10、20、30和40μg/L)分为4个实验组,另设空白对照组4孔。72h后,取出骨片,以体积分数为2.5%戊二醛固定30min,以质量分数为0.1%甲苯胺蓝硼酸盐溶液染色2min。然后分别置入0.25mol/L的氨水中,超声振荡2min以上,用上述染液复染5min[6],丙酮脱水。Leica Quantimet500图像分析仪检测骨吸收陷窝面积和记录骨吸收陷窝数目。
(六)统计学处理:利用SPSS7.5(r)对全部数据进行one-way ANOVA分析,结果以均数±标准差表示(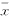 ±s)。
±s)。
结果
一、免疫电镜观察结果
, http://www.100md.com
由图1可见,破骨细胞具有多个细胞核,伪足较多而不规则。图2清晰可见破骨细胞的细胞膜上有胶体金颗粒沉着,表明人类破骨细胞可以表达PDGF-β受体。
图1 破骨细胞具有多个细胞核(N),伪足形状不规则免疫电镜×4000
图2 破骨细胞膜上可见胶体金颗粒沉积(↑)免疫电镜×6000
二、ACP与TRAP活性测定结果
表1显示,实验组ACP和TRAP的活性随着PDGF-BB浓度的增加而上升,当PDGF浓度升至40μg/L时,其活性分别达到(2.86±0.15)u/L(P=0.014)和(2.75±0.24)u/L(P=0.008)。培养上清液中,TRAP的活性占总ACP活性的93.5%。
, 百拇医药
表1 培养上清液中ACP与TRAP测定结果(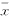 ±s,u/L) 组别
±s,u/L) 组别
样本数
总ACP活性
TRAP活性
对照组
4
1.85±0.13
1.73±0.15
实验1组
5
2.15±0.17
, 百拇医药
2.05±0.25
t值
2.64
2.15
实验2组
5
2.58±0.40
2.40±0.24
t值
3.99
3.65
实验3组
5
, 百拇医药
2.80±0.78
2.68±0.80
t值
4.53*
4.42*
实验4组
5
2.86±0.15
2.75±0.24
t值
5.02**
4.89**
, 百拇医药
注:与对照组相比,*P<0.05,**P<0.01。表2同
三、骨吸收陷窝的测量结果
破骨细胞以及其吸收骨质后所形成的骨吸收陷窝经甲苯胺蓝染色后呈深蓝色,在光学显微镜下清晰可辨:破骨细胞具有数个细胞核,伪足与骨片紧密结合在一起,洗脱破骨细胞后,骨吸收陷窝被深染,形状欠规则(图3,4)。而常规HE染色则不能清晰地分辨破骨细胞所形成的骨吸收陷窝(图5)。由表2可见,骨片上骨吸收陷窝的数目和面积随着PDGF-BB浓度的增高而显著增加,与对照组相比差异有显著性意义(P<0.05或P<0.01)。
表2 PDGF-BB对骨吸收陷窝的影响(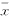 ±s) 组别
±s) 组别
样本数(n1)
, 百拇医药
骨吸收陷窝面积(μm2)
样本数(n2)
骨吸收陷窝数目
对照组
60
435.08±237.50
4
14.00±1.41
实验1组
95
560.09±228.26
5
, 百拇医药
19.00±2.00
t值
3.86*
4.27
实验2组
119
590.32±285.57
5
23.75±2.50
t值
4.14*
7.56*
, http://www.100md.com
实验3组
125
616.94±241.73
5
24.75±0.95
t值
4.89**
9.18**
实验4组
130
630.26±240.64
5
, 百拇医药
26.00±2.00
t值
5.27**
10.25**
图3 骨吸收陷窝深染(↑),与此对应为哈佛管(▲),骨板染色较浅甲苯胺蓝染色×400
图4 可见破骨细胞被染成蓝色(↑),细胞核清晰可见,细胞未附着部分未被深染甲苯胺蓝染色×400
图5 可见骨吸收陷窝以及骨片被红染,不能清晰分辨骨吸收陷窝HE×400
, http://www.100md.com
讨论
近年的研究表明,破骨细胞起源于造血组织的前体破骨细胞。髂骨是人体骨组织中造血比较旺盛的骨骼之一,因此,其破骨细胞含量明显高于其它部位,而且在经胶原酶消化后的混合细胞悬液中,破骨细胞的贴壁速度比其它细胞快。我们利用破骨细胞这一特点,对破骨细胞进行纯化。
PDGF-β受体含有1067个氨基酸碱基,有两个分离的酪氨酸激酶区为其典型特征。当PDGF-BB与之结合后,诱导受体聚合,激活其内在的酪氨酸激酶,使受体和其它蛋白质磷酸化,从而发生多种生物化学反应,引起DNA复制与细胞分裂[7]。本实验中破骨细胞合成与分泌ACP与TRAP增加即为生长因子-受体诱导所致。
ACP是骨吸收过程中必不可少的因素之一,Zaidi等[8]的研究结果表明,当ACP的活性被抗人类TRAP血清抑制后,破骨细胞的骨吸收活动则消失。TRAP为ACP的同功酶之一,被认为是破骨细胞的标志性酶,从本文实验结果可以看出,在破骨细胞分泌的总的ACP中,TRAP的活性超过90%,与文献报道的,人血清中TRAP主要来自于破骨细胞的研究结果相吻合[9,10]。有些人,诸如儿童、绝经后妇女、甲状腺功能亢进以及甲状旁腺功能亢进的患者,其血清TRAP的活性显著升高,表明其骨代谢异常活跃。因此,临床上可以TRAP活性的变化作为判断骨组织代谢的敏感且特异性指标[11,12]。
, 百拇医药
由表2结果显示,吸附在骨片上的破骨细胞所形成的骨吸收陷窝数目随着PDGF浓度的升高而增加。现已证明单核细胞可以融合成为多核的破骨细胞[13,14],但单核的前体破骨细胞在融合成多核细胞的过程中受体液因素调节和影响。离开体液环境,单核破骨细胞融合成多核细胞的速度则非常缓慢甚至可能不发生融合。PDGF-BB即为一种强效细胞因子,具有刺激多种组织细胞增殖与分化的作用。因此,笔者认为,骨吸收陷窝数目的增加,可能为PDGF-BB刺激前体破骨细胞向破骨细胞转化的结果。其他研究发现,PDGF-BB与其受体结合后,可改变细胞结构并调节细胞的运动功能[7],从而促进破骨细胞与骨片的结合。
Boyde等[15]首先建立了测量体外培养的破骨细胞所形成骨吸收陷窝(howshipslacunae)面积的经典方法:即将破骨细胞从骨片洗脱,在扫描电镜下观察并通过三维重建计算骨吸收陷窝的体积。但该方法设备复杂,技术要求高,不容易掌握。在前人研究的基础上,Arnett等[6]发现骨吸收陷窝可被甲苯胺蓝深染,骨吸收陷窝的面积与其体积存在正相关关系,可间接地反映破骨细胞对骨质的吸收程度。显然,破骨细胞自身体积的大小与其生物学功能有着很大关系。细胞体积越大,与骨质接触面积越广,并且分泌TRAP等酶与酸性物质也越多,最终可导致单个破骨细胞形成较大的骨吸收陷窝。
, http://www.100md.com
研究表明,成骨细胞参与调节破骨细胞的生物学功能,在PDGF的刺激下,成骨细胞可通过产生前列腺素而促进破骨细胞的骨吸收功能[16]。但是,对于高度纯化的破骨细胞与PDGF的关系尚少有报道。本组实验结果提示:PDGF-BB通过与破骨细胞PDGF-β受体结合,直接促进破骨细胞的骨吸收功能。由此可推测,成骨细胞功能低下的患者,在PDGF-BB的作用下,破骨细胞功能异常活跃,导致骨质疏松症。由于PDGF具有促进成骨细胞分裂与分化作用,故PDGF-BB可能在骨组织代谢,尤其在骨的修复与重建过程中具有重要作用。
参 考 文 献
1,Rao CD, Igaraghi H, Chiu IM, et al. Structure and sequence of the human c- sis/platelet- derived growth factor 2 ( SIS /PDGF 2 ) transcriptional unit. Proc Natl Acad Sci USA, 1986, 83: 2392- 2396.
, 百拇医药
2,Betsholtz C, Johnsson A, Heldin CH, et al. cDNA sequence and chromosomal localization of human platelet- derived growth factor A- chain and its expression in tumor cell lines. Nature, 1986, 320: 695- 699.
3,Lambrecht JT, Marks SC Jr. Human osteoclast- like cells in primary culture. Clin Anat, 1996, 9: 41- 45.
4,Gay CV, Kief NL, Bekker PJ. Effect of estrogen on acidification in osteoclasts. Biochem Biophys Res Commun, 1993, 192: 1251- 1259.
, 百拇医药
5,Berthois Y, Katzenellenbogen JA, Katzenellenbogen BS. Phenol red in tissue culture media is a weak estrogen: implications concerning the study of estrogen- responsive cells in culture. Proc Natl Acad Sci USA, 1986, 83: 2496- 2500.
6,Arnett TR, Dempster DW. A comparative study of disaggregated chick and rat osteoclasts in vitro: effects of calcitonin and prostaglandins. Endocrinology, 1987, 120: 602- 608.
7,Claesson- Welsh L. Platelet- derived growth factor receptor signals. J Biol Chem, 1994, 269: 32023- 32026.
, 百拇医药
8,Zaidi M, Moonga B, Moss DW, et al. Inhibition of osteoclastic acid phosphatase abolishes bone resorption. Biochem Biophys Res Commun, 1989, 159: 68- 71.
9,Rico H, Villa LF. Serum tartrate- resistant acid phosphatase(TRAP) as a biochemical marker of bone remodeling. Calcif Tissue Int, 1993, 52: 149- 150.
10,Eggert FM. Stable acid phosphatase: Ⅱ . effects of pH and inhibitors. Histochemistry, 1980, 66: 319- 329.
, http://www.100md.com
11,Cheung CK, Panesar NS, Haines C, et al. Immunoassay of a tartrate- resistant acid phosphatase in serum. Clin Chem, 1995, 41: 679- 686.
12,Nakanishi M, Yoh K, Uchida K, et al. Improved method for measuring tartrate- resistant acid phosphatase activity in serum. Clin Chem, 1998, 44: 221- 225.
13,Rodman GD. Advances in bone biology: the osteoclast. Endocr Rev, 1996, 17: 308- 322.
14,Athanasou NA. Celluar biology of bone- resorbing cells. J Bone Joint Surg (Am), 1996,78:1096- 1112.
, http://www.100md.com
15,Boyde A, Ali NN, Jones SJ. Resorption of dentine by isolated osteoclasts in vitro. Br Dent J, 1984, 156: 216- 220.
16,Tashjian AH Jr, Hohmann EL, Antoniades HN, et al. Platelet- derived growth factor stimulates bone resorption via a prostaglandin- mediated mechanism. Endocrinology, 1982, 111: 118- 124.
(收稿日期:1999-02-02), 百拇医药
单位:510515广州,第一军医大学南方医院骨科;国家骨质疏松症诊疗研究中心
关键词:血小板源生长因子;受体,血小板源生长因子;破骨细胞;酸性磷酸酶;酒石酸盐类
中华骨科杂志000512
【摘要】目的探讨血小板衍生生长因子-BB(platelet-derivedgrowthfactor-BB,PDGF-BB)对破骨细胞生物学功能的影响。方法(1)利用酶消化法分离培养成人破骨细胞;(2)应用透射电子显微镜方法观察破骨细胞对PDGF-β受体的表达;(3)在经过纯化的破骨细胞上清液中施加重组人基因PDGF-BB,利用酶动力学方法测定培养上清液中的酸性磷酸酶(ACP)和抗酒石酸酸性磷酸酶(TRAP)的活性;(4)通过Leica图像分析仪观察在PDGF-BB作用下,破骨细胞所形成骨吸收陷窝的数目与面积。结果(1)破骨细胞膜上有胶体金颗粒沉着;(2)破骨细胞培养上清液中的ACP和TRAP活性随着PDGF-BB浓度的升高而增加,分别从(1.85±0.13)u/L和(1.73±0.15)u/L(对照组)增加至(2.86±0.15)u/L和(2.75±0.24)u/L(40μg/L组,P<0.01);(3)在PDGF-BB的作用下,破骨细胞所形成的骨吸收陷窝的面积从(435.08±237.50)μm2(对照组)增高至(630.26±240.64)μm2(40μg/L组,P<0.01),每个骨片上骨吸收陷窝的数目亦从14.00±1.41增加为26.00±2.00(P<0.05或P<0.01)。结论PDGF-BB通过与PDGF-β受体结合,可直接促进破骨细胞的骨吸收功能。
, http://www.100md.com
The effects of platelet- derived growth factor- BB on the osteoclastic bone resorption
JIN Dadi, ZHANG Zhongmin, CHEN Jianting
Department of Orthopaedics and Spinal Surgery, Nanfang Hospital, The First Military Medical University, The National Research Center on Osteoporosis, Guangzhou 510515, China
【 Abstract】 Objective To study the effect of platelet- derived growth factor- BB( PDGF- BB) on the biological functions of human osteoclasts. Methods 1)Adult osteoclasts were isolated from human spongy bone with collagenase Ⅱ . 2)PDGF receptor- β was detected on the osteoclasts with transmission electron microscope. 3)The PDGF- BB was exerted on the osteoclasts that adhered to the bone slice at the concentration of 0,10,20,30 and 40 μ g/L. The acid phosphatase (ACP) and the tartrate- resistant acid phosphatase ( TRAP) activities in the culture medium were measured with kinetic method. 4)The number and area of lacunae formed by osteoclasts absorption under the action of PDGF- BB were analysed with Leica image analysis apparatus. Results 1)The colloidal gold deposited on the cellular membrane. 2)The ACP and TRAP activities rose with the dose of PDGF- BB, increasing respectively from (1.85± 0.13) u/L and (1.73± 0.15)u/L (control) to (2.86± 0.15)u/L and (2.75± 0.24)u/L when PDGF- BB was at 40 μ g/L (P< 0.01). 3)The volume of Howship's lacunae augmented from (435.08± 237.50) μ m2 (control) to (630.26± 240.64) μ m2 (P< 0.01), and the number of the resorption lacuna increased also from 14.00± 1.41 to 26.00± 2.00 (P< 0.01). Conclusion The human osteoclast has PDGF receptor- β on its membrane and PDGF- BB could stimulate osteoclastic bone resorption directly after binding to the receptor- β .
, 百拇医药
【 Key words】 Platelet- derived growth factor; Receptors,platelet- derived growth factor; Osteoclasts; Acid phosphatase; Tartrates
现已阐明,血小板衍生生长因子(platelet-derived growth factor,PDGF)是由A、B两条多肽链通过二硫键连接而成的三种二聚体,即PDGF-AA、PDGF-AB和PDGF-BB。PDGF分别有α和β两种受体,α受体可与A链和B链结合,而β受体仅与B链结合[1,2]。已知PDGF有促成骨细胞分裂、分化之作用,但对其与破骨细胞的关系尚知之甚少。一般认为PDGF-BB的生物学功能最强,为了解两者之间的关系,我们利用免疫电镜等方法观察PDGF对破骨细胞生物学功能的影响。
材料与方法
一、材料
, http://www.100md.com
主要试剂有无酚红1640培养基(GibcoBRL公司);抗PDGF-β受体单克隆抗体(鼠抗人,Oncogene公司);甲苯胺蓝(Sigma公司);重组人PDGF-BB(Oncogene公司);Ⅱ型胶原酶(Sigma公司),胶体金(直径10nm)标记羊抗小鼠IgG(北京中山生物公司);酸性磷酸酶试剂盒(bioMérieux公司)。
二、方法
(一)骨片制作:取新鲜健康成人股骨标本(交通意外伤后截肢),以体积分数为2.5%戊二醛和体积分数为10%甲醛固定,乙醇逐级脱水,冷水降温,用低速骨锯将皮质骨锯开,并在油石上磨成厚约20μm的骨片。超声波清洗机洗涤,环氧乙烷灭菌,置于4℃保存、备用。
(二)破骨细胞的分离与培养:经征得需植骨患者的同意,取其髂骨松质骨,以磷酸缓冲液(PBS,pH7.4)冲洗,剪碎(约1mm×1mm×1mm大小),Ⅱ型胶原酶消化[3],PBS洗涤,用无酚红1640培养基制成细胞悬液,接种于培养皿内。孵育40min后,用PBS洗掉吸附能力较弱或未贴壁细胞,重新收集贴附的细胞,调节其密度约为104/ml,继续孵育[4]。酚红具有微弱的雌性激素作用[5],并可干扰酶学检查结果,因而未被用作酸碱指示剂。
, 百拇医药
(三)PDGF-β受体的测定:将培养3d的细胞转移至离心管内(104/ml),加入PDGF-β受体单克隆抗体,孵育10min,PBS充分洗涤,加入胶体金标记第二抗体,孵育10min,PBS充分洗涤,然后将细胞悬液转入琼脂模型管内,2500r/min离心10min。以体积分数为2.5%戊二醛前固定3h,锇酸后固定30min,丙酮脱水,树脂包埋,超薄切片(1μm),透射电子显微镜观察。
(四)酸性磷酸酶(ACP)与抗酒石酸酸性磷酸酶(TRAP)活性的测定:将破骨细胞接种于24孔的培养板内,按照PDGF-BB终浓度(10、20、30和40μg/L)分为四个实验组,每组5孔,另设空白对照组4孔。48h后,将培养上清液2000r/min离心5min,加入α-napthyl phosphate(底物)缓冲液(pH5.4),孵育10min,其产物与FastRedTR反应,终产物行偶氮染色,测定ACP活性。在孵育液中加入酒石酸(终浓度为75mmol/L),即可测得TRAP活性。
, http://www.100md.com
(五)骨吸收陷窝的测定:将细胞悬液接种于24孔培养板内,每孔含5片骨片。按照PDGF-BB的终浓度(10、20、30和40μg/L)分为4个实验组,另设空白对照组4孔。72h后,取出骨片,以体积分数为2.5%戊二醛固定30min,以质量分数为0.1%甲苯胺蓝硼酸盐溶液染色2min。然后分别置入0.25mol/L的氨水中,超声振荡2min以上,用上述染液复染5min[6],丙酮脱水。Leica Quantimet500图像分析仪检测骨吸收陷窝面积和记录骨吸收陷窝数目。
(六)统计学处理:利用SPSS7.5(r)对全部数据进行one-way ANOVA分析,结果以均数±标准差表示(
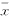 ±s)。
±s)。结果
一、免疫电镜观察结果
, http://www.100md.com
由图1可见,破骨细胞具有多个细胞核,伪足较多而不规则。图2清晰可见破骨细胞的细胞膜上有胶体金颗粒沉着,表明人类破骨细胞可以表达PDGF-β受体。

图1 破骨细胞具有多个细胞核(N),伪足形状不规则免疫电镜×4000

图2 破骨细胞膜上可见胶体金颗粒沉积(↑)免疫电镜×6000
二、ACP与TRAP活性测定结果
表1显示,实验组ACP和TRAP的活性随着PDGF-BB浓度的增加而上升,当PDGF浓度升至40μg/L时,其活性分别达到(2.86±0.15)u/L(P=0.014)和(2.75±0.24)u/L(P=0.008)。培养上清液中,TRAP的活性占总ACP活性的93.5%。
, 百拇医药
表1 培养上清液中ACP与TRAP测定结果(
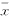 ±s,u/L) 组别
±s,u/L) 组别样本数
总ACP活性
TRAP活性
对照组
4
1.85±0.13
1.73±0.15
实验1组
5
2.15±0.17
, 百拇医药
2.05±0.25
t值
2.64
2.15
实验2组
5
2.58±0.40
2.40±0.24
t值
3.99
3.65
实验3组
5
, 百拇医药
2.80±0.78
2.68±0.80
t值
4.53*
4.42*
实验4组
5
2.86±0.15
2.75±0.24
t值
5.02**
4.89**
, 百拇医药
注:与对照组相比,*P<0.05,**P<0.01。表2同
三、骨吸收陷窝的测量结果
破骨细胞以及其吸收骨质后所形成的骨吸收陷窝经甲苯胺蓝染色后呈深蓝色,在光学显微镜下清晰可辨:破骨细胞具有数个细胞核,伪足与骨片紧密结合在一起,洗脱破骨细胞后,骨吸收陷窝被深染,形状欠规则(图3,4)。而常规HE染色则不能清晰地分辨破骨细胞所形成的骨吸收陷窝(图5)。由表2可见,骨片上骨吸收陷窝的数目和面积随着PDGF-BB浓度的增高而显著增加,与对照组相比差异有显著性意义(P<0.05或P<0.01)。
表2 PDGF-BB对骨吸收陷窝的影响(
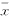 ±s) 组别
±s) 组别样本数(n1)
, 百拇医药
骨吸收陷窝面积(μm2)
样本数(n2)
骨吸收陷窝数目
对照组
60
435.08±237.50
4
14.00±1.41
实验1组
95
560.09±228.26
5
, 百拇医药
19.00±2.00
t值
3.86*
4.27
实验2组
119
590.32±285.57
5
23.75±2.50
t值
4.14*
7.56*
, http://www.100md.com
实验3组
125
616.94±241.73
5
24.75±0.95
t值
4.89**
9.18**
实验4组
130
630.26±240.64
5
, 百拇医药
26.00±2.00
t值
5.27**
10.25**

图3 骨吸收陷窝深染(↑),与此对应为哈佛管(▲),骨板染色较浅甲苯胺蓝染色×400

图4 可见破骨细胞被染成蓝色(↑),细胞核清晰可见,细胞未附着部分未被深染甲苯胺蓝染色×400

图5 可见骨吸收陷窝以及骨片被红染,不能清晰分辨骨吸收陷窝HE×400
, http://www.100md.com
讨论
近年的研究表明,破骨细胞起源于造血组织的前体破骨细胞。髂骨是人体骨组织中造血比较旺盛的骨骼之一,因此,其破骨细胞含量明显高于其它部位,而且在经胶原酶消化后的混合细胞悬液中,破骨细胞的贴壁速度比其它细胞快。我们利用破骨细胞这一特点,对破骨细胞进行纯化。
PDGF-β受体含有1067个氨基酸碱基,有两个分离的酪氨酸激酶区为其典型特征。当PDGF-BB与之结合后,诱导受体聚合,激活其内在的酪氨酸激酶,使受体和其它蛋白质磷酸化,从而发生多种生物化学反应,引起DNA复制与细胞分裂[7]。本实验中破骨细胞合成与分泌ACP与TRAP增加即为生长因子-受体诱导所致。
ACP是骨吸收过程中必不可少的因素之一,Zaidi等[8]的研究结果表明,当ACP的活性被抗人类TRAP血清抑制后,破骨细胞的骨吸收活动则消失。TRAP为ACP的同功酶之一,被认为是破骨细胞的标志性酶,从本文实验结果可以看出,在破骨细胞分泌的总的ACP中,TRAP的活性超过90%,与文献报道的,人血清中TRAP主要来自于破骨细胞的研究结果相吻合[9,10]。有些人,诸如儿童、绝经后妇女、甲状腺功能亢进以及甲状旁腺功能亢进的患者,其血清TRAP的活性显著升高,表明其骨代谢异常活跃。因此,临床上可以TRAP活性的变化作为判断骨组织代谢的敏感且特异性指标[11,12]。
, 百拇医药
由表2结果显示,吸附在骨片上的破骨细胞所形成的骨吸收陷窝数目随着PDGF浓度的升高而增加。现已证明单核细胞可以融合成为多核的破骨细胞[13,14],但单核的前体破骨细胞在融合成多核细胞的过程中受体液因素调节和影响。离开体液环境,单核破骨细胞融合成多核细胞的速度则非常缓慢甚至可能不发生融合。PDGF-BB即为一种强效细胞因子,具有刺激多种组织细胞增殖与分化的作用。因此,笔者认为,骨吸收陷窝数目的增加,可能为PDGF-BB刺激前体破骨细胞向破骨细胞转化的结果。其他研究发现,PDGF-BB与其受体结合后,可改变细胞结构并调节细胞的运动功能[7],从而促进破骨细胞与骨片的结合。
Boyde等[15]首先建立了测量体外培养的破骨细胞所形成骨吸收陷窝(howshipslacunae)面积的经典方法:即将破骨细胞从骨片洗脱,在扫描电镜下观察并通过三维重建计算骨吸收陷窝的体积。但该方法设备复杂,技术要求高,不容易掌握。在前人研究的基础上,Arnett等[6]发现骨吸收陷窝可被甲苯胺蓝深染,骨吸收陷窝的面积与其体积存在正相关关系,可间接地反映破骨细胞对骨质的吸收程度。显然,破骨细胞自身体积的大小与其生物学功能有着很大关系。细胞体积越大,与骨质接触面积越广,并且分泌TRAP等酶与酸性物质也越多,最终可导致单个破骨细胞形成较大的骨吸收陷窝。
, http://www.100md.com
研究表明,成骨细胞参与调节破骨细胞的生物学功能,在PDGF的刺激下,成骨细胞可通过产生前列腺素而促进破骨细胞的骨吸收功能[16]。但是,对于高度纯化的破骨细胞与PDGF的关系尚少有报道。本组实验结果提示:PDGF-BB通过与破骨细胞PDGF-β受体结合,直接促进破骨细胞的骨吸收功能。由此可推测,成骨细胞功能低下的患者,在PDGF-BB的作用下,破骨细胞功能异常活跃,导致骨质疏松症。由于PDGF具有促进成骨细胞分裂与分化作用,故PDGF-BB可能在骨组织代谢,尤其在骨的修复与重建过程中具有重要作用。
参 考 文 献
1,Rao CD, Igaraghi H, Chiu IM, et al. Structure and sequence of the human c- sis/platelet- derived growth factor 2 ( SIS /PDGF 2 ) transcriptional unit. Proc Natl Acad Sci USA, 1986, 83: 2392- 2396.
, 百拇医药
2,Betsholtz C, Johnsson A, Heldin CH, et al. cDNA sequence and chromosomal localization of human platelet- derived growth factor A- chain and its expression in tumor cell lines. Nature, 1986, 320: 695- 699.
3,Lambrecht JT, Marks SC Jr. Human osteoclast- like cells in primary culture. Clin Anat, 1996, 9: 41- 45.
4,Gay CV, Kief NL, Bekker PJ. Effect of estrogen on acidification in osteoclasts. Biochem Biophys Res Commun, 1993, 192: 1251- 1259.
, 百拇医药
5,Berthois Y, Katzenellenbogen JA, Katzenellenbogen BS. Phenol red in tissue culture media is a weak estrogen: implications concerning the study of estrogen- responsive cells in culture. Proc Natl Acad Sci USA, 1986, 83: 2496- 2500.
6,Arnett TR, Dempster DW. A comparative study of disaggregated chick and rat osteoclasts in vitro: effects of calcitonin and prostaglandins. Endocrinology, 1987, 120: 602- 608.
7,Claesson- Welsh L. Platelet- derived growth factor receptor signals. J Biol Chem, 1994, 269: 32023- 32026.
, 百拇医药
8,Zaidi M, Moonga B, Moss DW, et al. Inhibition of osteoclastic acid phosphatase abolishes bone resorption. Biochem Biophys Res Commun, 1989, 159: 68- 71.
9,Rico H, Villa LF. Serum tartrate- resistant acid phosphatase(TRAP) as a biochemical marker of bone remodeling. Calcif Tissue Int, 1993, 52: 149- 150.
10,Eggert FM. Stable acid phosphatase: Ⅱ . effects of pH and inhibitors. Histochemistry, 1980, 66: 319- 329.
, http://www.100md.com
11,Cheung CK, Panesar NS, Haines C, et al. Immunoassay of a tartrate- resistant acid phosphatase in serum. Clin Chem, 1995, 41: 679- 686.
12,Nakanishi M, Yoh K, Uchida K, et al. Improved method for measuring tartrate- resistant acid phosphatase activity in serum. Clin Chem, 1998, 44: 221- 225.
13,Rodman GD. Advances in bone biology: the osteoclast. Endocr Rev, 1996, 17: 308- 322.
14,Athanasou NA. Celluar biology of bone- resorbing cells. J Bone Joint Surg (Am), 1996,78:1096- 1112.
, http://www.100md.com
15,Boyde A, Ali NN, Jones SJ. Resorption of dentine by isolated osteoclasts in vitro. Br Dent J, 1984, 156: 216- 220.
16,Tashjian AH Jr, Hohmann EL, Antoniades HN, et al. Platelet- derived growth factor stimulates bone resorption via a prostaglandin- mediated mechanism. Endocrinology, 1982, 111: 118- 124.
(收稿日期:1999-02-02), 百拇医药