低氧诱导法培养大鼠肺微血管内皮细胞
作者:马子敏 杨曦明 洪欣 孙兴斌 谢印芝
单位:军事医学科学院卫生学环境医学研究所,天津 300050
关键词:缺氧;生长因子;微循环;内皮;肺;大鼠
航天医学与医学工程000512摘要: 目的 探讨大鼠肺微血管内皮细胞培养方法,并期望发展一种简便、实用的体外培养方法。 方法 用7% O2(4 h/d,3 d)诱导培养猪肺动脉内皮细胞,然后收集该低氧诱导的培养基后加入大鼠肺边缘组织块,再培养微血管内皮细胞。 结果 加入低氧诱导培养基后48 h,即有明显细胞增生;原代培养1 wk后,细胞呈典型的鹅卵石状连片生长,继续可以传代3~4次。与对照方法相比,采用低氧诱导培养基法培养大鼠肺微血管内皮细胞,贴块后细胞增生反应较早出现、繁殖较快,细胞老化延迟,传代后细胞生长良好,3代以内细胞形态无明显退变。 结论 本文探讨的低氧诱导培养基方法,具有简便、实用的特点,可用于建立大鼠肺微血管内皮细胞的细胞模型,用于高原医学研究。
, http://www.100md.com
中图分类号:R852.22 文献标识码:A 文章编号:1002-0837(2000)05-0365-03
Culture of Rat Lung Tissue Capillary Endothelial Cells with Hypoxia Induced Medium
MA Zi-min,YANG Xi-ming,HONG Xin,SUN Xin-bin,XIE Yin-zhi
(Space Medicine & Medical Engineering)
Abstract: Objective To study the culturing of rat lung tissue capillary endothelial cells(RLCEC)in vitro,with the aim of developing a simple and practical method. Methods Swine lung arterial endothelial cells were cultured in a medium induced by 7% O2 for 4 h,the hypoxia induced medium(HIM)was then used to culture the capillary tissue of rat's lung to enhance the growing of RLCEC. Result 48 h after the adding of the HIM,evident generation appeared,1 wk later,the RLCEC showed characteristic morphology of cobble like figure under microscope,the cells showed normal shape within 3~4th generations.Compared with the culturing condition without HIM,the RLCEC cultured with this method proliferated earlier and better ,and the aging of the cultured cells was delayed. Conclusion The HIM provided a practical and simple method for the culturing of RLCEC,it could be used for building the in vitro model for hypoxia related study.
, 百拇医药
Key words:hypoxia;growth factors;microcirculation;endothelium;lung;rats
平原人急进高原时,易发急性高原性肺水肿,其主要发病机制与肺微血管内皮细胞的调控有关。在离体研究模型中,肺微血管内皮细胞是关键材料。但是体外培养肺微血管内皮细胞一直比较困难,更不能长期培养[1]。1979年Jundan等[2]成功培养了牛肺微血管内皮细胞,大鼠、人等动物微血管内皮细胞还不能培养;1994年Magee等[3]使用纯化的血管内皮生长因子(vascular endothelial growth factor,VEGF) 等其它繁杂的方法培养成功了大鼠肺微血管内皮细胞(rat lung tissue capillary endothelial cell,RLCEC)。但该方法不易推广。Sandner等[4]报道多种组织、细胞在中等程度低氧时可以上调VEGF等生长因子的表达,本文利用此原理,使用猪肺动脉内皮细胞的低氧诱导培养基(hypoxia induced medium,HIM)来尝试培养大鼠肺微血管内皮细胞。
, 百拇医药
方 法
实验动物 采用健康Wistar 大鼠,体重在180 g左右(本院动物中心提供)。
实验器材及材料 小牛血清(CS)和RPMI medium1640培养基(Gibico公司);VIII因子相关抗原及抗血清(上海东风生物制品公司);其它试剂为国产分析纯。
低氧诱导培养基的制备(HIM) 将本室已培养的猪肺动脉内皮细胞在25 ml 培养瓶中培养,每瓶加入4 ml RPMI medium 1640培养基(含10%CS),每日在7% O2下低氧培养4 h,3 d后收集低氧诱导培养基。
RLCEC的原代培养 参考贴块法[5],将实验动物乙醚麻醉、消毒后,开胸、取肺; 用50 ml,0.01 mol/L PBS冲洗3次,取肺脏边缘部分,在无菌平皿内切至1 mm3大小的组织块,贴入25 ml培养瓶壁;置37℃培养箱内孵育60 min后分别加入4 ml RPMI medium 1640培养基1(含15%CS,50%HIM)或RPMI medium 1640培养基2(含15%CS),在37℃,5%CO2条件下常氧培养,每48 h换液一次。
, http://www.100md.com
RLCEC的传代培养 将2瓶不同培养液培养的单层细胞,用0.08%胰酶消化5 min,待贴壁细胞变得疏松后,加入含10%CS的RPMI medium 1640 培养基2ml 终止消化,1000 rpm 离心5 min,去上清液,再用10 ml、0.01 mol/L PBS 洗涤3次,加入6 ml RPMI medium 1640培养基(含10%CS,50%HIM),各传入2只25 ml培养瓶。在37℃,5%CO2条件下继续常氧培养,每48 h换液一次。
RLCEC的鉴定 用50 ml、0.01 mol/L PBS洗涤贴壁生长的RLCEC培养瓶,接着加入冷乙醇2 ml固定30 min、PBS洗涤3次,待干燥后,用FITC荧光标记的羊抗鼠VIII相关抗原抗血清0.5 ml孵育30 min,最后再用PBS液洗涤3次,将RLCEC培养瓶封口,在荧光显微镜下照相。
结 果
, http://www.100md.com RLCEC 的生长情况 在RPMI medium 1640培养基1中培养48 h后,在光镜下可见有多角形细胞在组织块边缘、周围出现,视野内有一定量的血细胞混杂(图1b);72 h后,呈几乎单一的不规则多角形细胞大量出现,细胞胞浆丰富,核清晰可见。(图2b)。培养4~5 d后,细胞呈典型的鹅卵石状连片生长(图3)。几乎铺满培养瓶壁 , 传代后细胞生长良好,3代以内细胞形态无明显改变 。
在RPMI 1640培养基2中培养3 d后,在光镜下可见有少量多角形细胞在组织块边缘(图1 a),继续培养后第4~5天,多角形细胞大量出现。细胞胞浆丰富,核清晰可见,呈不规则多角形;继续培养后,在光镜下可见有少量圆形的细胞出现,细胞胞浆中有大量的空泡,颗粒状物质(图2 a)。培养第7~10天以内,圆细胞逐渐增多,多角形细胞伪足变短,细胞数量开始减少,逐渐衰老死亡,不能再培养。
RLCEC 的性质 用FITC荧光标记的VIII相关抗原IgG染色RLCEC,细胞发出黄绿色荧光(图4),表现为VIII相关抗原阳性。和文献报道一致。
, 百拇医药
讨 论
用RPMI 1640培养基1(低氧诱导培养基)和RPMI 1640培养基2分别培养RLCEC,细胞生长情况、可传代的能力及后期细胞形态明显不同,表明低氧诱导培养基(HIM)适合用来培养RLCEC细胞。可能主要通过诱导肺动脉内皮细胞表达、释放了促进RLCEC生长的VEGF、PDGF等生长因子,因此有利于原代大鼠肺微血管内皮细胞的生长。对于微血管内皮细胞,低氧培养3 h培养基中即可检测到有VEGF的释放(这方面的结果已另文发表)。在其他组织,结果也比较相似[6]。中等程度的低氧,如7%~9% 的氧浓度引起的低氧反应不同于急性严重低氧(1%~5% O2) 时的低氧应激反应。主要可能是通过HIF-1 调控的非病理生理通路[7]启动低氧反应。所以低氧诱导法成功用于培养大鼠肺微血管内皮细胞,为今后高原医学研究及肺微血管研究提供一种简便实用的实验细胞膜型。
, 百拇医药
图1a 在RPMI medium 1640培养基2中培养3 d的RLCEC细胞光镜形态(×100)
Fig.1a RLCEC cultured in RPMI1640 medium 2 for 3 d(light microscope ×100)
图1b 在RPMI medium 1640培养基1中培养48 h RLCEC细胞光镜形态(×100)
Fig.1b RLCEC cultured in RPMI1640 medium 1 for 48 h(light microscope ×100)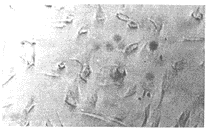
图2a 在RPMI medium 1640培养基2中培养第4~5天的RLCEC细胞光镜形态(×100)
, 百拇医药
Fig.2a RLCEC cultured in RMPI 1640 medium 2 for 4~5 d(light microscope ×100)
图2b 在RPMI medium 1640培养基1中培养72 h后的RLCEC细胞光镜形态(×100)
Fig.2b RLCEC cultured in RPMI1640 medium 1 for 72 h(light microscope ×100)
图3 RLCEC 2代细胞在RPMI medium 1640培养基1中培养3~4 d后,细胞呈典型的鹅卵石状生长(×100)
, 百拇医药
Fig.3 Second generation RLCEC cultured in RPMI1640 medium 1 for 3~4 d,showing typical cobble like growth of the cell(light microscope ×100)
图4 FITC荧光标记的VIII相关抗原IgG染色的RLCEC发出黄绿色荧光,表现为VIII相关抗原阳性
Fig.4 RLCEC stained with florescence labeled VIII related antigen IgG,showing yellowish green florescence which represents VIII related antigen positive
, 百拇医药 [参考文献]
[1] Del Vecchio.PJ,Ryan JW.Isolation of capillary segments from rat adrenal gland[J].J Cell Biol,75(Suppl):CU041(abstract)
[2] Jundan F,Christian CH,Bruce RZ.Long term culture of capillary endothelial cells[J].PNAS,1979,76(10):5217~5221
[3] Magee JC,Ann ES,Keith TO.Isolation,culture,and characterization of rat lung microvascular endothelial cells[J].American Physiology,1994,267(4):C433~C441
, http://www.100md.com
[4] Sandner P,Wolf K,Bergmaier U et al.Induction of VEGF and VEGFR gene expression by hypoxia: Divergent regulation in vivo and in vitro[J].Kindney Int,1997,51(2):448~452
[5] XIE S,YANG XJ,QIAN GS.Culture and characterization of rat lung microvascular endothelial cells[J].Chinese J Applied Physiolgys,1997,13(2):189~190
谢菘,杨晓静,钱桂生.大鼠肺微血管内皮细胞培养及鉴定[J].中国应用生理学杂志,1997,13(2):189~190
[6] Minchenko A,Baucer T,Salceda S et al.Hypoxic stimulation of VEGF expression in vitro and in vivo[J].Lab Invest,1994,71(3):374~379
[7] Bunn HF,Poyton PO.Oxygen sensing and molecular adaptation to hypoxia[J].Physiol Rev,1996,76(3):839~885
收稿日期:2000-01-31, 百拇医药
单位:军事医学科学院卫生学环境医学研究所,天津 300050
关键词:缺氧;生长因子;微循环;内皮;肺;大鼠
航天医学与医学工程000512摘要: 目的 探讨大鼠肺微血管内皮细胞培养方法,并期望发展一种简便、实用的体外培养方法。 方法 用7% O2(4 h/d,3 d)诱导培养猪肺动脉内皮细胞,然后收集该低氧诱导的培养基后加入大鼠肺边缘组织块,再培养微血管内皮细胞。 结果 加入低氧诱导培养基后48 h,即有明显细胞增生;原代培养1 wk后,细胞呈典型的鹅卵石状连片生长,继续可以传代3~4次。与对照方法相比,采用低氧诱导培养基法培养大鼠肺微血管内皮细胞,贴块后细胞增生反应较早出现、繁殖较快,细胞老化延迟,传代后细胞生长良好,3代以内细胞形态无明显退变。 结论 本文探讨的低氧诱导培养基方法,具有简便、实用的特点,可用于建立大鼠肺微血管内皮细胞的细胞模型,用于高原医学研究。
, http://www.100md.com
中图分类号:R852.22 文献标识码:A 文章编号:1002-0837(2000)05-0365-03
Culture of Rat Lung Tissue Capillary Endothelial Cells with Hypoxia Induced Medium
MA Zi-min,YANG Xi-ming,HONG Xin,SUN Xin-bin,XIE Yin-zhi
(Space Medicine & Medical Engineering)
Abstract: Objective To study the culturing of rat lung tissue capillary endothelial cells(RLCEC)in vitro,with the aim of developing a simple and practical method. Methods Swine lung arterial endothelial cells were cultured in a medium induced by 7% O2 for 4 h,the hypoxia induced medium(HIM)was then used to culture the capillary tissue of rat's lung to enhance the growing of RLCEC. Result 48 h after the adding of the HIM,evident generation appeared,1 wk later,the RLCEC showed characteristic morphology of cobble like figure under microscope,the cells showed normal shape within 3~4th generations.Compared with the culturing condition without HIM,the RLCEC cultured with this method proliferated earlier and better ,and the aging of the cultured cells was delayed. Conclusion The HIM provided a practical and simple method for the culturing of RLCEC,it could be used for building the in vitro model for hypoxia related study.
, 百拇医药
Key words:hypoxia;growth factors;microcirculation;endothelium;lung;rats
平原人急进高原时,易发急性高原性肺水肿,其主要发病机制与肺微血管内皮细胞的调控有关。在离体研究模型中,肺微血管内皮细胞是关键材料。但是体外培养肺微血管内皮细胞一直比较困难,更不能长期培养[1]。1979年Jundan等[2]成功培养了牛肺微血管内皮细胞,大鼠、人等动物微血管内皮细胞还不能培养;1994年Magee等[3]使用纯化的血管内皮生长因子(vascular endothelial growth factor,VEGF) 等其它繁杂的方法培养成功了大鼠肺微血管内皮细胞(rat lung tissue capillary endothelial cell,RLCEC)。但该方法不易推广。Sandner等[4]报道多种组织、细胞在中等程度低氧时可以上调VEGF等生长因子的表达,本文利用此原理,使用猪肺动脉内皮细胞的低氧诱导培养基(hypoxia induced medium,HIM)来尝试培养大鼠肺微血管内皮细胞。
, 百拇医药
方 法
实验动物 采用健康Wistar 大鼠,体重在180 g左右(本院动物中心提供)。
实验器材及材料 小牛血清(CS)和RPMI medium1640培养基(Gibico公司);VIII因子相关抗原及抗血清(上海东风生物制品公司);其它试剂为国产分析纯。
低氧诱导培养基的制备(HIM) 将本室已培养的猪肺动脉内皮细胞在25 ml 培养瓶中培养,每瓶加入4 ml RPMI medium 1640培养基(含10%CS),每日在7% O2下低氧培养4 h,3 d后收集低氧诱导培养基。
RLCEC的原代培养 参考贴块法[5],将实验动物乙醚麻醉、消毒后,开胸、取肺; 用50 ml,0.01 mol/L PBS冲洗3次,取肺脏边缘部分,在无菌平皿内切至1 mm3大小的组织块,贴入25 ml培养瓶壁;置37℃培养箱内孵育60 min后分别加入4 ml RPMI medium 1640培养基1(含15%CS,50%HIM)或RPMI medium 1640培养基2(含15%CS),在37℃,5%CO2条件下常氧培养,每48 h换液一次。
, http://www.100md.com
RLCEC的传代培养 将2瓶不同培养液培养的单层细胞,用0.08%胰酶消化5 min,待贴壁细胞变得疏松后,加入含10%CS的RPMI medium 1640 培养基2ml 终止消化,1000 rpm 离心5 min,去上清液,再用10 ml、0.01 mol/L PBS 洗涤3次,加入6 ml RPMI medium 1640培养基(含10%CS,50%HIM),各传入2只25 ml培养瓶。在37℃,5%CO2条件下继续常氧培养,每48 h换液一次。
RLCEC的鉴定 用50 ml、0.01 mol/L PBS洗涤贴壁生长的RLCEC培养瓶,接着加入冷乙醇2 ml固定30 min、PBS洗涤3次,待干燥后,用FITC荧光标记的羊抗鼠VIII相关抗原抗血清0.5 ml孵育30 min,最后再用PBS液洗涤3次,将RLCEC培养瓶封口,在荧光显微镜下照相。
结 果
, http://www.100md.com RLCEC 的生长情况 在RPMI medium 1640培养基1中培养48 h后,在光镜下可见有多角形细胞在组织块边缘、周围出现,视野内有一定量的血细胞混杂(图1b);72 h后,呈几乎单一的不规则多角形细胞大量出现,细胞胞浆丰富,核清晰可见。(图2b)。培养4~5 d后,细胞呈典型的鹅卵石状连片生长(图3)。几乎铺满培养瓶壁 , 传代后细胞生长良好,3代以内细胞形态无明显改变 。
在RPMI 1640培养基2中培养3 d后,在光镜下可见有少量多角形细胞在组织块边缘(图1 a),继续培养后第4~5天,多角形细胞大量出现。细胞胞浆丰富,核清晰可见,呈不规则多角形;继续培养后,在光镜下可见有少量圆形的细胞出现,细胞胞浆中有大量的空泡,颗粒状物质(图2 a)。培养第7~10天以内,圆细胞逐渐增多,多角形细胞伪足变短,细胞数量开始减少,逐渐衰老死亡,不能再培养。
RLCEC 的性质 用FITC荧光标记的VIII相关抗原IgG染色RLCEC,细胞发出黄绿色荧光(图4),表现为VIII相关抗原阳性。和文献报道一致。
, 百拇医药
讨 论
用RPMI 1640培养基1(低氧诱导培养基)和RPMI 1640培养基2分别培养RLCEC,细胞生长情况、可传代的能力及后期细胞形态明显不同,表明低氧诱导培养基(HIM)适合用来培养RLCEC细胞。可能主要通过诱导肺动脉内皮细胞表达、释放了促进RLCEC生长的VEGF、PDGF等生长因子,因此有利于原代大鼠肺微血管内皮细胞的生长。对于微血管内皮细胞,低氧培养3 h培养基中即可检测到有VEGF的释放(这方面的结果已另文发表)。在其他组织,结果也比较相似[6]。中等程度的低氧,如7%~9% 的氧浓度引起的低氧反应不同于急性严重低氧(1%~5% O2) 时的低氧应激反应。主要可能是通过HIF-1 调控的非病理生理通路[7]启动低氧反应。所以低氧诱导法成功用于培养大鼠肺微血管内皮细胞,为今后高原医学研究及肺微血管研究提供一种简便实用的实验细胞膜型。

, 百拇医药
图1a 在RPMI medium 1640培养基2中培养3 d的RLCEC细胞光镜形态(×100)
Fig.1a RLCEC cultured in RPMI1640 medium 2 for 3 d(light microscope ×100)

图1b 在RPMI medium 1640培养基1中培养48 h RLCEC细胞光镜形态(×100)
Fig.1b RLCEC cultured in RPMI1640 medium 1 for 48 h(light microscope ×100)

图2a 在RPMI medium 1640培养基2中培养第4~5天的RLCEC细胞光镜形态(×100)
, 百拇医药
Fig.2a RLCEC cultured in RMPI 1640 medium 2 for 4~5 d(light microscope ×100)

图2b 在RPMI medium 1640培养基1中培养72 h后的RLCEC细胞光镜形态(×100)
Fig.2b RLCEC cultured in RPMI1640 medium 1 for 72 h(light microscope ×100)

图3 RLCEC 2代细胞在RPMI medium 1640培养基1中培养3~4 d后,细胞呈典型的鹅卵石状生长(×100)
, 百拇医药
Fig.3 Second generation RLCEC cultured in RPMI1640 medium 1 for 3~4 d,showing typical cobble like growth of the cell(light microscope ×100)

图4 FITC荧光标记的VIII相关抗原IgG染色的RLCEC发出黄绿色荧光,表现为VIII相关抗原阳性
Fig.4 RLCEC stained with florescence labeled VIII related antigen IgG,showing yellowish green florescence which represents VIII related antigen positive
, 百拇医药 [参考文献]
[1] Del Vecchio.PJ,Ryan JW.Isolation of capillary segments from rat adrenal gland[J].J Cell Biol,75(Suppl):CU041(abstract)
[2] Jundan F,Christian CH,Bruce RZ.Long term culture of capillary endothelial cells[J].PNAS,1979,76(10):5217~5221
[3] Magee JC,Ann ES,Keith TO.Isolation,culture,and characterization of rat lung microvascular endothelial cells[J].American Physiology,1994,267(4):C433~C441
, http://www.100md.com
[4] Sandner P,Wolf K,Bergmaier U et al.Induction of VEGF and VEGFR gene expression by hypoxia: Divergent regulation in vivo and in vitro[J].Kindney Int,1997,51(2):448~452
[5] XIE S,YANG XJ,QIAN GS.Culture and characterization of rat lung microvascular endothelial cells[J].Chinese J Applied Physiolgys,1997,13(2):189~190
谢菘,杨晓静,钱桂生.大鼠肺微血管内皮细胞培养及鉴定[J].中国应用生理学杂志,1997,13(2):189~190
[6] Minchenko A,Baucer T,Salceda S et al.Hypoxic stimulation of VEGF expression in vitro and in vivo[J].Lab Invest,1994,71(3):374~379
[7] Bunn HF,Poyton PO.Oxygen sensing and molecular adaptation to hypoxia[J].Physiol Rev,1996,76(3):839~885
收稿日期:2000-01-31, 百拇医药