重组PcDNA3-hBMP3转染兔关节软骨细胞和对其增殖的影响
作者:韩一生 胡蕴玉 金格勒 戴先文 李松建
单位:710032西安,第四军医大学西京医院骨科研究所
关键词:转染;软骨细胞;关节
中华骨科杂志000613
【摘要】目的研究将人骨形成蛋白3(BMP3)的cDNA构建于真核,表达载体PcDNA3,形成重组DNAPcDNA3-hBMP3,转染兔关节软骨细胞,以探讨基因转染对关节软骨细胞增殖的影响。方法利用重组DNA和基因克隆技术构建重组DNA;用细胞培养和基因转染技术体外转染兔关节软骨细胞;用核酸杂交和蛋白电泳检测细胞BMP3的表达,最后通过FCM、DNA和葡糖醛酸含量检测以及Ⅱ型胶原探针原位杂交分析其对增殖的影响。结果软骨细胞6次传代后,Ⅱ型胶原原位杂交的灰度值降低,同样条件下转染的软骨细胞仍保持较高水平Ⅱ型胶原的表达;转染的软骨细胞经流式细胞仪的分析,软骨细胞S期细胞比例增多,说明细胞DNA的合成增加;经DNA和葡糖醛酸含量测定,转染的软骨细胞DNA和葡糖醛酸含量较转染前有明显提高。结论hBMP3对维持软骨细胞的表型具有十分重要的作用,在脂质体的介导下,DNAPcDNA3-hBMP3转染兔关节软骨细胞获得成功。
, http://www.100md.com
Effect of recombined PcDNA3-hBMP3 transfection on rabbit articular chondrocytes proliferation
HAN Yisheng,HU Yunyu,JIN Gele,et al.
(Department of Orthopaedics, Xijing Hospital, Xi' an 710032,China)
【Abstract】 Objective The recombined DNA PcDNA3-hBMP3 was transfected into rabbits articular condrocytes in vitro under liposome to study the instantaneous and steady mRNA or its protein expression of hBMP3 in rabbit's articular chondrocytes, and make further study on the effects of transfection on proliferation of these cells. Methods In order to learn whether there is expression of hBMP protein in these cells after transfection, the protein electrophoresis has been applied. In situ hybridization by type Ⅱ collagen cDNA probe was used to make sure that whether the cell still has its phenotype after transfection.The measurements of the FCM, DNA and GAG have been used to explore the changes in all these fields in the cells. Results Through many generations, chondrocytes after transfection still remain type Ⅱ collagen expression. This shows the important role of the transfection of hBMP3 to maintain the phenotype of chondrocytes. Cellular proportion in S period increased, which indicates the increase of synthesis and propagation of cell DNA. DNA and PG contents of chondrocytes increase remarkably after transfection. Conclusion hBMP3 plays a great role in maintaining the phenotype of chondrocytes. With the help of lipofectamine, the transfection of PcDNA3-hBMP3 to chondrocyte was carried out successfully.
, http://www.100md.com
【Key words】 Transfection; Chondrocytes; Joints
骨形成蛋白3(BMP3)体内外实验均证实可明显地促进多种来源软骨细胞的增殖,并且有利于软骨细胞表型的保持[1-7]。本研究应用重组DNA技术构建DNAPcDNA3-hBMP3,在脂质体介导下,体外转染兔关节软骨细胞,通过核酸杂交和蛋白电泳检测转染后细胞hBMP3的表达情况,分析hBMP3基因转染对软骨细胞增殖的影响。
材料与方法
一、实验材料
(一)hBMP3全长cDNA质粒:1.48kb,用EcoRⅠ(5酶切位点)和XbalⅠ(3酶切位点)可将其从质粒上切下。PcDNA3质粒5.4kb,非功能区含EcoRⅠ和XbalⅠ酶切位点,带有抗新霉素(NeoR)和氨苄青霉素(AmpR)的标记基因。
, 百拇医药
(二)DNA构建试剂:限制性内切酶和T4DNA连接酶;溴化乙锭(EB);低溶点琼脂糖和普通琼脂糖;LB液体培养基、选择性固体培养基、TE缓冲液(pH8.0)和TAE电泳缓冲液。
(三)软骨消化酶和细胞培养液:0.05%睾丸透明质酸酶、0.2%冻干胰蛋白酶和0.2%Ⅱ型梭状芽孢杆菌胶原酶,用前配制并滤菌,细胞培养液为10%胎牛血清DMEM(均为质量分数)。
(四)脂质体(lipofectamine)和基因转染筛选试剂,前者为1ml装,后者为G418(新霉素),1g装。
(五)仪器:CO2孵箱,低温冷冻高速离心机,水浴恒温摇床,真空干燥仪,紫外线检测仪,手提长波紫外线灯,水平电泳仪,恒温烤箱,电子分析天平。
二、实验方法
(一)重组真核表达载体PcDNA3-hBMP3的构建、纯度测定和鉴定:大肠杆菌DH5a感受态细胞的制备(Cohen法)[8]→hBMP3质粒DNA细菌转化→hBMP3质粒小量提取和酶切hBMP3片段回收(冻融法)[9]→DNA含量及纯度测定(分光光度法)→hBMP3定向克隆至PcDNA3中(粘-粘连接法)[10]→PcDNA3-hBMP3重组质粒大量制备(碱裂解法)[11]→重组质粒纯化(Sepharose2B柱层析法)[12]→重组质粒含量纯度测定。PcDNA3-hBMP3的酶切鉴定:用EcoRⅠ和XbaⅠ双酶切,切下片段,电泳鉴定。
, http://www.100md.com
(二)软骨细胞分离、培养和冻存:取28d新西兰兔,无菌条件下取软骨,利刀削成薄片移入培养皿,Hank液冲洗。将软骨切成1mm×1mm×1mm组织块移入内室(消化小室分内、外室,内室放软骨,下端用45μm尼龙网套住;外室放酶溶液和消化下的软骨细胞),于外室加质量分数为0.2%胰蛋白酶5ml,磁力振荡器120r/min,37℃,30min,用注射器从外室吸取溶液弃去,Hank液冲洗。外室加入质量分数为0.2%胶原酶5ml,磁力振荡120r/min,37℃,60min,用注射器吸取分离的软骨细胞,注入无菌离心管内。再加入胶原酶5ml于外室消化60min,离心后弃去上清液,用记数板计数。细胞一部分做原代培养,另一部分以106/ml混合二甲基亚砜液氮中冻存,用时复苏[13,14]。
(三)脂质体介导下PcDNA3-hBMP3基因转染关节软骨细胞:细胞培养密度为1×105/ml,培养液为DMEM4ml,在CO2孵箱放置2d,在其对数生长期做转染。具体方法[15-17]:配A液:0.5ml消毒试管中加无血清DMEM100μl和DNA质粒5μg,混匀。B液:无血清培养液100μl+10μl脂质体,混匀。DNA-脂质体复合物(DNA-lipofectaminecomplexes)形成:混合A、B液,室温下15~45min,后于混合液中加入0.79ml无血清培养液,轻轻混匀。将DNA-脂质体复合物加入培养瓶内,培养液终体积为4ml。37℃、CO2孵箱孵化12h,加0.5ml血清,继续培养12h。24h后,换含G418400μg/ml正常培养液进行筛选。2d后收集细胞,测其RNA瞬时表达(transientexpression);另一组细胞继续用G418筛选4周,检测细胞RNA的稳定表达(stableexpression)。
, 百拇医药
(四)转染后软骨细胞hBMP3蛋白表达的检测(蛋白电泳):蛋白电泳阳性和阴性对照的设立。阳性对照用兔骨折后3d骨痂组织,阴性对照用正常肌肉。步骤1:用胰蛋白酶消化收集对数生长期细胞,加入50μlTE缓冲液混匀,取10μl混合液,加入2X样品缓冲液10μl混匀,煮沸5min,离心5min,上清液用作质量分数为12%SDS-聚丙烯酰胺凝胶电泳(12%SDS-PAGE)。步骤2SDS-PAGE:配制质量分数为12%分离胶和质量分数为6%浓缩胶,将处理样品上样,电泳在恒压条件下进行,浓缩胶中为120V,分离胶中为160V。电泳结束后取下凝胶,用考马斯蓝染色,用脱色液脱色至背景透明为止[18,19]。
(五)转染后细胞爬片Ⅱ型胶原cDNA探针原位杂交:取非转染的第2代和第6代的软骨细胞,待细胞爬满玻片后与Ⅱ型胶原cDNA做原位杂交。取转染的第6代和第7代软骨细胞,待细胞爬满玻片后与Ⅱ型胶原cDNA做原位杂交。收集爬片,加入固定剂2ml预固定,逐级脱水后,用玻片封面。Dig-11-dUTP标记探针。细胞爬片原位杂交。常规脱水,透明,封片。
, 百拇医药
(六)软骨细胞流式细胞仪的检测方法:收转染2d的细胞和用G418筛选至4周的细胞,在离心机上离心(1000r/min)后用PBS液500μg/l制成单细胞悬液,要求细胞浓度为106/ml,后加入体积分数为99%乙醇1ml,轻微振荡,膜封口,冰箱保存,即可上机检测。
(七)软骨细胞DNA含量测定:分别取转染前、后的软骨细胞做DNA分析,方法如下:2ml1mol/LHCl加入含有细胞的离心管,吹打均匀后放入70℃水溶15min,冷却后800r/min离心3min,取上清液测定。制作标准曲线:样品液1ml加入二苯胺工作液2ml混合后25℃放置18h,600nm波长比色。计算:DNA(μg/ml)=ODu/ODs×标准液(μg/ml)。
(八)软骨细胞葡糖醛酸含量测定:收集细胞的培养液,用咔唑硫酸法测基质中葡糖醛酸含量。标准曲线的制作方法与DNA含量标准曲线的制作相同,但标准工作液为四硼酸钠硫酸液,加5ml。三者混合后煮沸10min,流水冷却,再加咔唑剂各0.2ml,混合后煮沸15min,流水冷却,530nm比色,制标准曲线。样品测定:分别加标准应用液1.0ml,样品液1.0ml,水1.0ml,按以上步骤制定标准曲线。计算:己糖醛酸含量(mg/100ml)=Du/Ds×20。
, 百拇医药
图1 软骨细胞爬片后显示其形态为多角形 番红花染色×200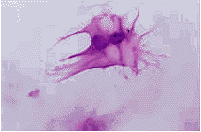
图2 软骨细胞分裂前HE染色×200
图3 软骨细胞多次传代后,其形态和排列均发生变化 ×100
(九)计算机图像分析和统计方法:Ⅱ型胶原原位杂交切片经显微照相后,用MicrotekE6扫描仪扫描,图像采集输入计算机,再用PhotoshopV5.0图像处理软件分析,提取对照组中表达信号的灰度阈值,后根据不同组杂交结果的灰度值,计算平均灰度值。最后用Base统计软件进行统计学处理,团体t检验比较不同组的转染效能。
结果
, 百拇医药
一、兔关节软骨细胞的一般生物学特性
在一定条件下,兔关节软骨细胞生长稳定,增殖速度快,接种成活率高,可适用于体外细胞基因转染研究。软骨细胞属贴壁生长,形态呈多角形(图1),细胞1代时间(cellgenerationtime)为6d;对数生长期为接种后3~5d;接种后第1d就可见细胞分裂相,数量很少,第3d时达到最高峰,此后逐渐下降,到第8d几乎没有细胞的分裂(图2);细胞接种后12h细胞贴壁率(attachmentefficiency)为95%;软骨细胞7代以后其形态有所变化,生长曲线滞后,细胞倍增时间延长,成纤维细胞样细胞增多,排列呈漩涡状(图3);细胞对种植密度呈现明显的依赖性,当<1×104/ml时,软骨细胞生长缓慢或不生长。
二、PcDNA3-hBMP3基因转染关节软骨细胞及其蛋白表达
转染24h后,换含量G418(400μg/ml)的DMEM进行筛选,一周内80%~90%的细胞被杀死(图4),而转染成功的零星细胞则形成新的细胞克隆,继续用G418筛选至4周,未死亡新的克隆细胞为转染成功的阳性细胞(图5),消化收集阳性软骨细胞,提取蛋白做BMP3蛋白电泳,结果表明为阳性,说明细胞经4周筛选后仍有外源基因的表达。
, http://www.100md.com
三、软骨细胞爬片Ⅱ型胶原探针原位杂交结果
结果见表1。
表1 软骨细胞爬片Ⅱ型胶原探针原位杂交灰度值
传代
转染后2d
转染后4周
第2代(非)
42.67±3.98**
41.89±2.21*
第6代(非)
28.60±2.33
, http://www.100md.com
22.23±3.53
第6代(转)
72.42±3.40**
45.75±2.37*
第9代(转)
48.74±4.20**
33.24±1.19*
注:**P<0.01,*0.01
从表1中可看出非转染的软骨细胞经多次传代后,软骨细胞爬片Ⅱ型胶原原位杂交灰度值有所降低,而转染后的软骨细胞仍有较高水平的Ⅱ型胶原表达(图6,7)。
, http://www.100md.com
软骨细胞DNA和葡糖醛酸含量测定结果见表2。
软骨细胞流式细胞仪测定结果见表3。
表2 转染前后软骨细胞DNA和葡糖醛酸含量(μg/瓶)
转染
DNA含量
葡糖醛酸含量
转染前
40.56±3.16
148.45±3.92
转染后
75.25±2.09**
, 百拇医药
280.50±3.97**
注:**P<0.01表3软骨细胞的细胞周期分布
转染
G1期
S期
G2期
转染前
89.2%*
2.5%
8.3%
转染后
, 百拇医药
62.4%
32.9%*
4.2%
注:*0.01
从表3中可看出转染后软骨细胞S期细胞比例增加,G1和G2期细胞减少,说明细胞DNA的合成以及细胞的增殖活动加强。
讨论
软骨细胞有丝分裂活动极低,其修复能力差。体外培养软骨细胞的有限性增殖、对接种密度的依赖以及难以保持软骨细胞表型是软骨组织工程和软骨细胞库建立必须解决的难题[20]。本研究旨在利用基因重组技术,在脂质体介导下转染软骨细胞,使软骨细胞内源性hBMP3获得稳定表达。用转基因的方法提高软骨细胞内源性细胞因子的表达,形成内源性促进生长机制,体现了提高软骨细胞Ⅱ型胶原和PG的合成、解决软骨细胞体外培养困难、细胞表型易变的新思维,也为体外软骨组织工程和关节软骨病的基因治疗提供了直接的实验依据。
, 百拇医药
PcDNA3和hBMP3基因所在的质粒均含有EcoRⅠ和XbaⅠ两个酶切位点,两者用双酶切后的DNA两端为非同源互补的粘性末端,两末端完全匹配,在T4DNA连接酶作用下,即可将hBMP3片段定向地插入到PcDNA3载体中,形成能在真核中表达的重组真核表达载体PcDNA3-hBMP3。外源性基因与宿主细胞基因组的整合是细胞稳定表达的基础,而染色体外状态则多表现为瞬时表达[21-24]。从时间上讲,细胞转染后4周以上或用G418筛选至4周细胞仍有表达,即可认为细胞存在稳定表达。从本实验结果来看,PcDNA3-hBMP3导入软骨细胞后形成了稳定的表达。
本研究开展有几个基本前提:(1)BMP3对软骨细胞具有促进其生长和保持软骨细胞表型的作用,这是本研究的实验基础。(2)转染以前需了解软骨细胞本身BMP3的基础表达水平。(3)靶细胞选择:建系细胞对外源DNA无限制作用,生长相对稳定且存活周期长,应首选建系细胞。兔关节软骨细胞在体外存活时间足够长(>4周),在一定条件下生长稳定也可适宜做细胞转染。(4)要有开展此项研究的物质条件,应具备hBMP3全长DNA基因和用于真核细胞的表达性载体(expresionvector)PcDNA3。
, http://www.100md.com
基因在大肠杆菌表达通常以质粒为载体,在体细胞表达多需病毒做载体(真核载体),但它又需要在大肠杆菌中扩增,因此也带有原核序列[25,26]。载体是基因转染的关键,作为载体应具备以下条件[27]:
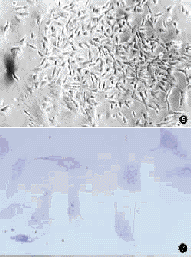
图4 G418筛选后,多数细胞出现死亡×100 图5 G418筛选后获得的阳性细胞克隆×100 图6 正常软骨细胞爬片(Ⅱ型胶原探针原位杂交阳性)×400 图7 软骨细胞转染后经9次传代,Ⅱ型胶原仍有较高水平表达(Ⅱ型胶原探针原位杂交阳性)×400
(1)表达型载体具有自主复制的信号,并配备有与宿主细胞相适应的起动子、增强子或加尾信号等,个别载体能够整合到宿主细胞的染色体上与基因组一同复制。(2)载体相对分子质量要小,3~10×103为宜,便于DNA体外操作和导入宿主细胞。(3)有一段对于它们在宿主细胞增殖非必须的DNA区域,其中含有内切酶位点,便于外源性DNA的插入。(4)载体上应有筛选标记,如抗药性基因等(LacZ和neo),一个检测是否插入了目的基因,另一个可检测是否导入细胞内。
, http://www.100md.com
流式细胞仪(flowcytemeter,FCM)在细胞生物学和临床肿瘤学以及临床血液学诸多领域都有广泛应用。细胞周期分析是其基本分析内容之一,而实施的技术是通过测定细胞周期各时相的DNA含量来达到的。FCM的参量包括:(1)结构参量:如DNA以及RNA的含量;(2)功能参量:主要是描述细胞整体生物特性,如细胞周期动力学。众所周知,细胞周期即一个母细胞分裂结束后形成的细胞至其下一次再分裂结束形成两个子细胞的这段时期,可分为间期(G1期、S期、G2期)和M期(分裂期)两个阶段。细胞群中多数细胞处于间期,少数细胞处于M期,后者主要完成细胞的分裂,持续时间很短,约1~2h。在间期中,细胞又分为G1期(DNA合成前期)、S期(DNA合成期)和G2期(DNA合成后期),这一过程主要完成DNA的合成。本研究转染后的软骨细胞经流式细胞仪的分析,软骨细胞S期细胞比例增加,G1和G2期的细胞减少,说明细胞DNA的合成以及细胞的增殖活动加强。
本研究选用有限细胞系(非建系细胞)作基因转染研究。结果表明:细胞转染后用G418筛选至4周,仍有新的细胞克隆形成,提取克隆细胞的mRNA与hBMP3基因片段做斑点杂交,证实转染的软骨细胞稳定表达为阳性;经蛋白电泳证实转染的软骨细胞有BMP3蛋白的表达,相对分子质量为20.0×103。细胞经6次传代后,细胞Ⅱ型胶原原位杂交的灰度值明显降低,而同样条件下转染后的软骨细胞仍保持有Ⅱ型胶原较高水平的表达,说明hBMP3对维持软骨细胞的表型具有十分重要的作用。转染后的软骨细胞经DNA和葡糖醛酸含量测定,软骨细胞DNA和葡糖醛酸含量较转染前均有明显提高。以上结果说明hBMP3基因转入软骨细胞后,不仅促进了细胞DNA的合成,而且也促进了软骨细胞表型的保持。
, 百拇医药
综上所述,本研究可得出如下结论:(1)经G4184周筛选获得阳性细胞克隆,经斑点杂交和蛋白电泳证实PcDNA3-hBMP3体外转染软骨细胞获得成功。(2)转染后的软骨细胞经流式细胞仪的分析,与转染前比较软骨细胞S期的细胞比例增加。(3)软骨细胞经6次传代后,细胞Ⅱ型胶原原位杂交的灰度值明显降低,而同样条件下转染后的软骨细胞仍保持有Ⅱ型胶原较高水平的表达,说明hBMP3对维持软骨细胞的表型具有十分重要的作用。(4)转染后的软骨细胞经DNA和葡糖醛酸含量测定,软骨细胞DNA和葡糖醛酸含量较转染前均明显提高。
参考文献
1,Watt FM. Effect of seeding density on stability of the differentiated phenotype of pig articular chondrocytes in culture. J Cell Sci, 1988, 89 : 373-378.
, 百拇医药
2,Bohme K, Conscience-Egli M, Tschan T, et al. Induction of proliferation or hypertrophy of chondrocytes in serum-free culture:the role of insulin-like growth factor-Ⅰ ,insulin, or thyroxine. J Cell Biol, 1992, 116:1035-1042.
3,Farquharson C, Whitehead CC. Differentiation and mineralization in chick chondrocytes maintained in a high cell density culture: a model for endochondral ossification. In Vitro Cell Dev Biol Anim, 1995,31:288-294.
, http://www.100md.com
4,Mallein-Gerin F, Ruggiero F, Garrone R. Proteoglycan core protein and type Ⅱ collagen gene expressions are not correlated with cell shape changes during low density chondrocyte cultures. Differentiation, 1990, 43: 204-211.
5,Mallein GF, Garrone R, van der Rest M. Proteoglycan and collagen synthesis are correlated with actin organization in dedifferentiating chondrocytes. Eur J Cell Biol, 1991, 56: 364-373.
6,Loty S, Forest N, Boulekbache H, et al. Cytochalasin D induces changes in cell shape and promotes in vitro chondrogenesis: a morphological study. Biol Cell, 1995, 83: 149-161.
, 百拇医药
7,Freyria AM, Ronziere MC, Boutillon MM, et al.Two-dimensional electrophoresis of intracellular and secreted protein synthesized by fetal bovine chondrocytes in high-density culture. Electrophoresis, 1995, 16: 1268-1272.
8,Jahng JS, Lee JW, Han CD, et al. Transforming growth factor-beta 1 responsiveness of human articular chondrocytes in vitro: normal versus osteoarthritis. Yonsei Med J, 1997, 38: 40-51.
9,Galera P, Redini F, Vivien D, et al. Effect of transforming growth factor-beta 1(TGF-beta 1) on matrix synthesis by monolayer cultures of rabbit articular chondrocytes during the dedifferentiation process. Exp Cell Res, 1992, 200: 379-392.
, 百拇医药
10,Blanco FJ, Geng Y, Lotz M. Differentiation-dependent effects of IL-1 and TGF-beta on human articular chondrocyte proliferation are related to inducible nitric oxide synthase expression. J Immunol, 1995, 154: 4018-4026.
11,Kolettas E, Buluwela L, Bayliss MT, et al. Expression of cartilage-specific molecules is retained on long-term culture of human articular chondrocytes. J Cell Sci, 1995, 108: 1991-1999.
12,Benya PD, Padilla SR. Dihydrocytochalasin B enhances transforming growth factor-beta-induced reexpression of the differentiated chondrocyte phenotype without stimulation of collagen synthesis. Exp Cell Res, 1993, 204: 268-277.
, 百拇医药
13,Aulthouse AL, Beck M, Griffey E, et al. Expression of the human chondrocyte phenotype in vitro. In Vitro Cell Dev Biol, 1989, 25: 659-668.
14,Brown PD, Benya PD. Alterations in chondrocyte cytoskeletal architecture during phenotypic modulation by retinoic acid and dihydrocytochalasin B-induced reexpression.J Cell Biol,1988, 106:171-179.
15,Choudary PV, Barranger JA, Tsuji S, et al. Retrovirus-mediated transfer of the human glucocere brosidase gene to Gaucher fibroblasts. Mol Biol Med, 1986, 3:293-299.
, 百拇医药
16,Curiel DT, Agarwal S,Wagner E, et al. Adenovirus enhancement of transferrin-polylysine-mediated gene delivery. Proc Nat Acad Sci(USA), 1991, 88:8850-8854.
17,Kotin RM. Prospects for the use of adeno-associated virus as a vector for huamn gene therapy. Hum Gene Ther, 1994, 5:793-801.
18,Glorioso JC, Deluca NA, Goins WF. Development of herpes simplex virus vectors for gene transfer to the central nervous system. Gene therapeutics,1994. 281-302.
, 百拇医药
19,Tomita N.Annals of the New York Academy of Sciences: Special Is sue on DNA Vaccines. Ann N Y Acad Sci, 1995, 772.
20,Tomita T, Hashimoto H, Tomita N. In vivo direct genetransfer into articular cartilage by intraarticular injection mediated by HVJ and liposomes. Arthritis Rheum, 1997, 40:901-906.
21,Wolff JA, Malone RW, Williams P, et al. Direct gene transfer into mouse muscle in vivo. Science, 1990, 247:1465-1468.
, 百拇医药
22,Tang DC, DeVit M, Johnston SA. Genetic immunization is a simple method for eliciting an immune response. Nature, 1992, 356:152-154.
23,Wolff AD.Gene expression in cultured chondrocytes. Vaccine, 1994, 13:131-132.
24,Tang DC,Lai WC,Johnston SA, et al. Protection against mycoplasma infection using expression-library immunization. Nature, 1995, 377:632-635.
25,Davis HL . DNA-based immunization. In:Dickson G,Ed. Molecular and Cell Biology of Human Gene Therapeutics. London:Chapman and Hall,1992.310-317.
, 百拇医药
26,Montgomery DL, Shiver JW, Leander KR, et al. Heterologous and homologous protection against influenza A by DNA vaccination: optimization of DNA vectors. DNA Cell Biol, 1993, 12:777-783.
27,Michael WC , Webster RG, Fuller, et al. DNA vaccines: protective immunizations by parenteral, mucosal and gene-gun inoculations. Proc Natl Sci USA, 1993, 90:11478-11482.
(收稿日期:1999-07-19), http://www.100md.com
单位:710032西安,第四军医大学西京医院骨科研究所
关键词:转染;软骨细胞;关节
中华骨科杂志000613
【摘要】目的研究将人骨形成蛋白3(BMP3)的cDNA构建于真核,表达载体PcDNA3,形成重组DNAPcDNA3-hBMP3,转染兔关节软骨细胞,以探讨基因转染对关节软骨细胞增殖的影响。方法利用重组DNA和基因克隆技术构建重组DNA;用细胞培养和基因转染技术体外转染兔关节软骨细胞;用核酸杂交和蛋白电泳检测细胞BMP3的表达,最后通过FCM、DNA和葡糖醛酸含量检测以及Ⅱ型胶原探针原位杂交分析其对增殖的影响。结果软骨细胞6次传代后,Ⅱ型胶原原位杂交的灰度值降低,同样条件下转染的软骨细胞仍保持较高水平Ⅱ型胶原的表达;转染的软骨细胞经流式细胞仪的分析,软骨细胞S期细胞比例增多,说明细胞DNA的合成增加;经DNA和葡糖醛酸含量测定,转染的软骨细胞DNA和葡糖醛酸含量较转染前有明显提高。结论hBMP3对维持软骨细胞的表型具有十分重要的作用,在脂质体的介导下,DNAPcDNA3-hBMP3转染兔关节软骨细胞获得成功。
, http://www.100md.com
Effect of recombined PcDNA3-hBMP3 transfection on rabbit articular chondrocytes proliferation
HAN Yisheng,HU Yunyu,JIN Gele,et al.
(Department of Orthopaedics, Xijing Hospital, Xi' an 710032,China)
【Abstract】 Objective The recombined DNA PcDNA3-hBMP3 was transfected into rabbits articular condrocytes in vitro under liposome to study the instantaneous and steady mRNA or its protein expression of hBMP3 in rabbit's articular chondrocytes, and make further study on the effects of transfection on proliferation of these cells. Methods In order to learn whether there is expression of hBMP protein in these cells after transfection, the protein electrophoresis has been applied. In situ hybridization by type Ⅱ collagen cDNA probe was used to make sure that whether the cell still has its phenotype after transfection.The measurements of the FCM, DNA and GAG have been used to explore the changes in all these fields in the cells. Results Through many generations, chondrocytes after transfection still remain type Ⅱ collagen expression. This shows the important role of the transfection of hBMP3 to maintain the phenotype of chondrocytes. Cellular proportion in S period increased, which indicates the increase of synthesis and propagation of cell DNA. DNA and PG contents of chondrocytes increase remarkably after transfection. Conclusion hBMP3 plays a great role in maintaining the phenotype of chondrocytes. With the help of lipofectamine, the transfection of PcDNA3-hBMP3 to chondrocyte was carried out successfully.
, http://www.100md.com
【Key words】 Transfection; Chondrocytes; Joints
骨形成蛋白3(BMP3)体内外实验均证实可明显地促进多种来源软骨细胞的增殖,并且有利于软骨细胞表型的保持[1-7]。本研究应用重组DNA技术构建DNAPcDNA3-hBMP3,在脂质体介导下,体外转染兔关节软骨细胞,通过核酸杂交和蛋白电泳检测转染后细胞hBMP3的表达情况,分析hBMP3基因转染对软骨细胞增殖的影响。
材料与方法
一、实验材料
(一)hBMP3全长cDNA质粒:1.48kb,用EcoRⅠ(5酶切位点)和XbalⅠ(3酶切位点)可将其从质粒上切下。PcDNA3质粒5.4kb,非功能区含EcoRⅠ和XbalⅠ酶切位点,带有抗新霉素(NeoR)和氨苄青霉素(AmpR)的标记基因。
, 百拇医药
(二)DNA构建试剂:限制性内切酶和T4DNA连接酶;溴化乙锭(EB);低溶点琼脂糖和普通琼脂糖;LB液体培养基、选择性固体培养基、TE缓冲液(pH8.0)和TAE电泳缓冲液。
(三)软骨消化酶和细胞培养液:0.05%睾丸透明质酸酶、0.2%冻干胰蛋白酶和0.2%Ⅱ型梭状芽孢杆菌胶原酶,用前配制并滤菌,细胞培养液为10%胎牛血清DMEM(均为质量分数)。
(四)脂质体(lipofectamine)和基因转染筛选试剂,前者为1ml装,后者为G418(新霉素),1g装。
(五)仪器:CO2孵箱,低温冷冻高速离心机,水浴恒温摇床,真空干燥仪,紫外线检测仪,手提长波紫外线灯,水平电泳仪,恒温烤箱,电子分析天平。
二、实验方法
(一)重组真核表达载体PcDNA3-hBMP3的构建、纯度测定和鉴定:大肠杆菌DH5a感受态细胞的制备(Cohen法)[8]→hBMP3质粒DNA细菌转化→hBMP3质粒小量提取和酶切hBMP3片段回收(冻融法)[9]→DNA含量及纯度测定(分光光度法)→hBMP3定向克隆至PcDNA3中(粘-粘连接法)[10]→PcDNA3-hBMP3重组质粒大量制备(碱裂解法)[11]→重组质粒纯化(Sepharose2B柱层析法)[12]→重组质粒含量纯度测定。PcDNA3-hBMP3的酶切鉴定:用EcoRⅠ和XbaⅠ双酶切,切下片段,电泳鉴定。
, http://www.100md.com
(二)软骨细胞分离、培养和冻存:取28d新西兰兔,无菌条件下取软骨,利刀削成薄片移入培养皿,Hank液冲洗。将软骨切成1mm×1mm×1mm组织块移入内室(消化小室分内、外室,内室放软骨,下端用45μm尼龙网套住;外室放酶溶液和消化下的软骨细胞),于外室加质量分数为0.2%胰蛋白酶5ml,磁力振荡器120r/min,37℃,30min,用注射器从外室吸取溶液弃去,Hank液冲洗。外室加入质量分数为0.2%胶原酶5ml,磁力振荡120r/min,37℃,60min,用注射器吸取分离的软骨细胞,注入无菌离心管内。再加入胶原酶5ml于外室消化60min,离心后弃去上清液,用记数板计数。细胞一部分做原代培养,另一部分以106/ml混合二甲基亚砜液氮中冻存,用时复苏[13,14]。
(三)脂质体介导下PcDNA3-hBMP3基因转染关节软骨细胞:细胞培养密度为1×105/ml,培养液为DMEM4ml,在CO2孵箱放置2d,在其对数生长期做转染。具体方法[15-17]:配A液:0.5ml消毒试管中加无血清DMEM100μl和DNA质粒5μg,混匀。B液:无血清培养液100μl+10μl脂质体,混匀。DNA-脂质体复合物(DNA-lipofectaminecomplexes)形成:混合A、B液,室温下15~45min,后于混合液中加入0.79ml无血清培养液,轻轻混匀。将DNA-脂质体复合物加入培养瓶内,培养液终体积为4ml。37℃、CO2孵箱孵化12h,加0.5ml血清,继续培养12h。24h后,换含G418400μg/ml正常培养液进行筛选。2d后收集细胞,测其RNA瞬时表达(transientexpression);另一组细胞继续用G418筛选4周,检测细胞RNA的稳定表达(stableexpression)。
, 百拇医药
(四)转染后软骨细胞hBMP3蛋白表达的检测(蛋白电泳):蛋白电泳阳性和阴性对照的设立。阳性对照用兔骨折后3d骨痂组织,阴性对照用正常肌肉。步骤1:用胰蛋白酶消化收集对数生长期细胞,加入50μlTE缓冲液混匀,取10μl混合液,加入2X样品缓冲液10μl混匀,煮沸5min,离心5min,上清液用作质量分数为12%SDS-聚丙烯酰胺凝胶电泳(12%SDS-PAGE)。步骤2SDS-PAGE:配制质量分数为12%分离胶和质量分数为6%浓缩胶,将处理样品上样,电泳在恒压条件下进行,浓缩胶中为120V,分离胶中为160V。电泳结束后取下凝胶,用考马斯蓝染色,用脱色液脱色至背景透明为止[18,19]。
(五)转染后细胞爬片Ⅱ型胶原cDNA探针原位杂交:取非转染的第2代和第6代的软骨细胞,待细胞爬满玻片后与Ⅱ型胶原cDNA做原位杂交。取转染的第6代和第7代软骨细胞,待细胞爬满玻片后与Ⅱ型胶原cDNA做原位杂交。收集爬片,加入固定剂2ml预固定,逐级脱水后,用玻片封面。Dig-11-dUTP标记探针。细胞爬片原位杂交。常规脱水,透明,封片。
, 百拇医药
(六)软骨细胞流式细胞仪的检测方法:收转染2d的细胞和用G418筛选至4周的细胞,在离心机上离心(1000r/min)后用PBS液500μg/l制成单细胞悬液,要求细胞浓度为106/ml,后加入体积分数为99%乙醇1ml,轻微振荡,膜封口,冰箱保存,即可上机检测。
(七)软骨细胞DNA含量测定:分别取转染前、后的软骨细胞做DNA分析,方法如下:2ml1mol/LHCl加入含有细胞的离心管,吹打均匀后放入70℃水溶15min,冷却后800r/min离心3min,取上清液测定。制作标准曲线:样品液1ml加入二苯胺工作液2ml混合后25℃放置18h,600nm波长比色。计算:DNA(μg/ml)=ODu/ODs×标准液(μg/ml)。
(八)软骨细胞葡糖醛酸含量测定:收集细胞的培养液,用咔唑硫酸法测基质中葡糖醛酸含量。标准曲线的制作方法与DNA含量标准曲线的制作相同,但标准工作液为四硼酸钠硫酸液,加5ml。三者混合后煮沸10min,流水冷却,再加咔唑剂各0.2ml,混合后煮沸15min,流水冷却,530nm比色,制标准曲线。样品测定:分别加标准应用液1.0ml,样品液1.0ml,水1.0ml,按以上步骤制定标准曲线。计算:己糖醛酸含量(mg/100ml)=Du/Ds×20。

, 百拇医药
图1 软骨细胞爬片后显示其形态为多角形 番红花染色×200

图2 软骨细胞分裂前HE染色×200

图3 软骨细胞多次传代后,其形态和排列均发生变化 ×100
(九)计算机图像分析和统计方法:Ⅱ型胶原原位杂交切片经显微照相后,用MicrotekE6扫描仪扫描,图像采集输入计算机,再用PhotoshopV5.0图像处理软件分析,提取对照组中表达信号的灰度阈值,后根据不同组杂交结果的灰度值,计算平均灰度值。最后用Base统计软件进行统计学处理,团体t检验比较不同组的转染效能。
结果
, 百拇医药
一、兔关节软骨细胞的一般生物学特性
在一定条件下,兔关节软骨细胞生长稳定,增殖速度快,接种成活率高,可适用于体外细胞基因转染研究。软骨细胞属贴壁生长,形态呈多角形(图1),细胞1代时间(cellgenerationtime)为6d;对数生长期为接种后3~5d;接种后第1d就可见细胞分裂相,数量很少,第3d时达到最高峰,此后逐渐下降,到第8d几乎没有细胞的分裂(图2);细胞接种后12h细胞贴壁率(attachmentefficiency)为95%;软骨细胞7代以后其形态有所变化,生长曲线滞后,细胞倍增时间延长,成纤维细胞样细胞增多,排列呈漩涡状(图3);细胞对种植密度呈现明显的依赖性,当<1×104/ml时,软骨细胞生长缓慢或不生长。
二、PcDNA3-hBMP3基因转染关节软骨细胞及其蛋白表达
转染24h后,换含量G418(400μg/ml)的DMEM进行筛选,一周内80%~90%的细胞被杀死(图4),而转染成功的零星细胞则形成新的细胞克隆,继续用G418筛选至4周,未死亡新的克隆细胞为转染成功的阳性细胞(图5),消化收集阳性软骨细胞,提取蛋白做BMP3蛋白电泳,结果表明为阳性,说明细胞经4周筛选后仍有外源基因的表达。
, http://www.100md.com
三、软骨细胞爬片Ⅱ型胶原探针原位杂交结果
结果见表1。
表1 软骨细胞爬片Ⅱ型胶原探针原位杂交灰度值
传代
转染后2d
转染后4周
第2代(非)
42.67±3.98**
41.89±2.21*
第6代(非)
28.60±2.33
, http://www.100md.com
22.23±3.53
第6代(转)
72.42±3.40**
45.75±2.37*
第9代(转)
48.74±4.20**
33.24±1.19*
注:**P<0.01,*0.01
从表1中可看出非转染的软骨细胞经多次传代后,软骨细胞爬片Ⅱ型胶原原位杂交灰度值有所降低,而转染后的软骨细胞仍有较高水平的Ⅱ型胶原表达(图6,7)。
, http://www.100md.com
软骨细胞DNA和葡糖醛酸含量测定结果见表2。
软骨细胞流式细胞仪测定结果见表3。
表2 转染前后软骨细胞DNA和葡糖醛酸含量(μg/瓶)
转染
DNA含量
葡糖醛酸含量
转染前
40.56±3.16
148.45±3.92
转染后
75.25±2.09**
, 百拇医药
280.50±3.97**
注:**P<0.01表3软骨细胞的细胞周期分布
转染
G1期
S期
G2期
转染前
89.2%*
2.5%
8.3%
转染后
, 百拇医药
62.4%
32.9%*
4.2%
注:*0.01
从表3中可看出转染后软骨细胞S期细胞比例增加,G1和G2期细胞减少,说明细胞DNA的合成以及细胞的增殖活动加强。
讨论
软骨细胞有丝分裂活动极低,其修复能力差。体外培养软骨细胞的有限性增殖、对接种密度的依赖以及难以保持软骨细胞表型是软骨组织工程和软骨细胞库建立必须解决的难题[20]。本研究旨在利用基因重组技术,在脂质体介导下转染软骨细胞,使软骨细胞内源性hBMP3获得稳定表达。用转基因的方法提高软骨细胞内源性细胞因子的表达,形成内源性促进生长机制,体现了提高软骨细胞Ⅱ型胶原和PG的合成、解决软骨细胞体外培养困难、细胞表型易变的新思维,也为体外软骨组织工程和关节软骨病的基因治疗提供了直接的实验依据。
, 百拇医药
PcDNA3和hBMP3基因所在的质粒均含有EcoRⅠ和XbaⅠ两个酶切位点,两者用双酶切后的DNA两端为非同源互补的粘性末端,两末端完全匹配,在T4DNA连接酶作用下,即可将hBMP3片段定向地插入到PcDNA3载体中,形成能在真核中表达的重组真核表达载体PcDNA3-hBMP3。外源性基因与宿主细胞基因组的整合是细胞稳定表达的基础,而染色体外状态则多表现为瞬时表达[21-24]。从时间上讲,细胞转染后4周以上或用G418筛选至4周细胞仍有表达,即可认为细胞存在稳定表达。从本实验结果来看,PcDNA3-hBMP3导入软骨细胞后形成了稳定的表达。
本研究开展有几个基本前提:(1)BMP3对软骨细胞具有促进其生长和保持软骨细胞表型的作用,这是本研究的实验基础。(2)转染以前需了解软骨细胞本身BMP3的基础表达水平。(3)靶细胞选择:建系细胞对外源DNA无限制作用,生长相对稳定且存活周期长,应首选建系细胞。兔关节软骨细胞在体外存活时间足够长(>4周),在一定条件下生长稳定也可适宜做细胞转染。(4)要有开展此项研究的物质条件,应具备hBMP3全长DNA基因和用于真核细胞的表达性载体(expresionvector)PcDNA3。
, http://www.100md.com
基因在大肠杆菌表达通常以质粒为载体,在体细胞表达多需病毒做载体(真核载体),但它又需要在大肠杆菌中扩增,因此也带有原核序列[25,26]。载体是基因转染的关键,作为载体应具备以下条件[27]:


图4 G418筛选后,多数细胞出现死亡×100 图5 G418筛选后获得的阳性细胞克隆×100 图6 正常软骨细胞爬片(Ⅱ型胶原探针原位杂交阳性)×400 图7 软骨细胞转染后经9次传代,Ⅱ型胶原仍有较高水平表达(Ⅱ型胶原探针原位杂交阳性)×400
(1)表达型载体具有自主复制的信号,并配备有与宿主细胞相适应的起动子、增强子或加尾信号等,个别载体能够整合到宿主细胞的染色体上与基因组一同复制。(2)载体相对分子质量要小,3~10×103为宜,便于DNA体外操作和导入宿主细胞。(3)有一段对于它们在宿主细胞增殖非必须的DNA区域,其中含有内切酶位点,便于外源性DNA的插入。(4)载体上应有筛选标记,如抗药性基因等(LacZ和neo),一个检测是否插入了目的基因,另一个可检测是否导入细胞内。
, http://www.100md.com
流式细胞仪(flowcytemeter,FCM)在细胞生物学和临床肿瘤学以及临床血液学诸多领域都有广泛应用。细胞周期分析是其基本分析内容之一,而实施的技术是通过测定细胞周期各时相的DNA含量来达到的。FCM的参量包括:(1)结构参量:如DNA以及RNA的含量;(2)功能参量:主要是描述细胞整体生物特性,如细胞周期动力学。众所周知,细胞周期即一个母细胞分裂结束后形成的细胞至其下一次再分裂结束形成两个子细胞的这段时期,可分为间期(G1期、S期、G2期)和M期(分裂期)两个阶段。细胞群中多数细胞处于间期,少数细胞处于M期,后者主要完成细胞的分裂,持续时间很短,约1~2h。在间期中,细胞又分为G1期(DNA合成前期)、S期(DNA合成期)和G2期(DNA合成后期),这一过程主要完成DNA的合成。本研究转染后的软骨细胞经流式细胞仪的分析,软骨细胞S期细胞比例增加,G1和G2期的细胞减少,说明细胞DNA的合成以及细胞的增殖活动加强。
本研究选用有限细胞系(非建系细胞)作基因转染研究。结果表明:细胞转染后用G418筛选至4周,仍有新的细胞克隆形成,提取克隆细胞的mRNA与hBMP3基因片段做斑点杂交,证实转染的软骨细胞稳定表达为阳性;经蛋白电泳证实转染的软骨细胞有BMP3蛋白的表达,相对分子质量为20.0×103。细胞经6次传代后,细胞Ⅱ型胶原原位杂交的灰度值明显降低,而同样条件下转染后的软骨细胞仍保持有Ⅱ型胶原较高水平的表达,说明hBMP3对维持软骨细胞的表型具有十分重要的作用。转染后的软骨细胞经DNA和葡糖醛酸含量测定,软骨细胞DNA和葡糖醛酸含量较转染前均有明显提高。以上结果说明hBMP3基因转入软骨细胞后,不仅促进了细胞DNA的合成,而且也促进了软骨细胞表型的保持。
, 百拇医药
综上所述,本研究可得出如下结论:(1)经G4184周筛选获得阳性细胞克隆,经斑点杂交和蛋白电泳证实PcDNA3-hBMP3体外转染软骨细胞获得成功。(2)转染后的软骨细胞经流式细胞仪的分析,与转染前比较软骨细胞S期的细胞比例增加。(3)软骨细胞经6次传代后,细胞Ⅱ型胶原原位杂交的灰度值明显降低,而同样条件下转染后的软骨细胞仍保持有Ⅱ型胶原较高水平的表达,说明hBMP3对维持软骨细胞的表型具有十分重要的作用。(4)转染后的软骨细胞经DNA和葡糖醛酸含量测定,软骨细胞DNA和葡糖醛酸含量较转染前均明显提高。
参考文献
1,Watt FM. Effect of seeding density on stability of the differentiated phenotype of pig articular chondrocytes in culture. J Cell Sci, 1988, 89 : 373-378.
, 百拇医药
2,Bohme K, Conscience-Egli M, Tschan T, et al. Induction of proliferation or hypertrophy of chondrocytes in serum-free culture:the role of insulin-like growth factor-Ⅰ ,insulin, or thyroxine. J Cell Biol, 1992, 116:1035-1042.
3,Farquharson C, Whitehead CC. Differentiation and mineralization in chick chondrocytes maintained in a high cell density culture: a model for endochondral ossification. In Vitro Cell Dev Biol Anim, 1995,31:288-294.
, http://www.100md.com
4,Mallein-Gerin F, Ruggiero F, Garrone R. Proteoglycan core protein and type Ⅱ collagen gene expressions are not correlated with cell shape changes during low density chondrocyte cultures. Differentiation, 1990, 43: 204-211.
5,Mallein GF, Garrone R, van der Rest M. Proteoglycan and collagen synthesis are correlated with actin organization in dedifferentiating chondrocytes. Eur J Cell Biol, 1991, 56: 364-373.
6,Loty S, Forest N, Boulekbache H, et al. Cytochalasin D induces changes in cell shape and promotes in vitro chondrogenesis: a morphological study. Biol Cell, 1995, 83: 149-161.
, 百拇医药
7,Freyria AM, Ronziere MC, Boutillon MM, et al.Two-dimensional electrophoresis of intracellular and secreted protein synthesized by fetal bovine chondrocytes in high-density culture. Electrophoresis, 1995, 16: 1268-1272.
8,Jahng JS, Lee JW, Han CD, et al. Transforming growth factor-beta 1 responsiveness of human articular chondrocytes in vitro: normal versus osteoarthritis. Yonsei Med J, 1997, 38: 40-51.
9,Galera P, Redini F, Vivien D, et al. Effect of transforming growth factor-beta 1(TGF-beta 1) on matrix synthesis by monolayer cultures of rabbit articular chondrocytes during the dedifferentiation process. Exp Cell Res, 1992, 200: 379-392.
, 百拇医药
10,Blanco FJ, Geng Y, Lotz M. Differentiation-dependent effects of IL-1 and TGF-beta on human articular chondrocyte proliferation are related to inducible nitric oxide synthase expression. J Immunol, 1995, 154: 4018-4026.
11,Kolettas E, Buluwela L, Bayliss MT, et al. Expression of cartilage-specific molecules is retained on long-term culture of human articular chondrocytes. J Cell Sci, 1995, 108: 1991-1999.
12,Benya PD, Padilla SR. Dihydrocytochalasin B enhances transforming growth factor-beta-induced reexpression of the differentiated chondrocyte phenotype without stimulation of collagen synthesis. Exp Cell Res, 1993, 204: 268-277.
, 百拇医药
13,Aulthouse AL, Beck M, Griffey E, et al. Expression of the human chondrocyte phenotype in vitro. In Vitro Cell Dev Biol, 1989, 25: 659-668.
14,Brown PD, Benya PD. Alterations in chondrocyte cytoskeletal architecture during phenotypic modulation by retinoic acid and dihydrocytochalasin B-induced reexpression.J Cell Biol,1988, 106:171-179.
15,Choudary PV, Barranger JA, Tsuji S, et al. Retrovirus-mediated transfer of the human glucocere brosidase gene to Gaucher fibroblasts. Mol Biol Med, 1986, 3:293-299.
, 百拇医药
16,Curiel DT, Agarwal S,Wagner E, et al. Adenovirus enhancement of transferrin-polylysine-mediated gene delivery. Proc Nat Acad Sci(USA), 1991, 88:8850-8854.
17,Kotin RM. Prospects for the use of adeno-associated virus as a vector for huamn gene therapy. Hum Gene Ther, 1994, 5:793-801.
18,Glorioso JC, Deluca NA, Goins WF. Development of herpes simplex virus vectors for gene transfer to the central nervous system. Gene therapeutics,1994. 281-302.
, 百拇医药
19,Tomita N.Annals of the New York Academy of Sciences: Special Is sue on DNA Vaccines. Ann N Y Acad Sci, 1995, 772.
20,Tomita T, Hashimoto H, Tomita N. In vivo direct genetransfer into articular cartilage by intraarticular injection mediated by HVJ and liposomes. Arthritis Rheum, 1997, 40:901-906.
21,Wolff JA, Malone RW, Williams P, et al. Direct gene transfer into mouse muscle in vivo. Science, 1990, 247:1465-1468.
, 百拇医药
22,Tang DC, DeVit M, Johnston SA. Genetic immunization is a simple method for eliciting an immune response. Nature, 1992, 356:152-154.
23,Wolff AD.Gene expression in cultured chondrocytes. Vaccine, 1994, 13:131-132.
24,Tang DC,Lai WC,Johnston SA, et al. Protection against mycoplasma infection using expression-library immunization. Nature, 1995, 377:632-635.
25,Davis HL . DNA-based immunization. In:Dickson G,Ed. Molecular and Cell Biology of Human Gene Therapeutics. London:Chapman and Hall,1992.310-317.
, 百拇医药
26,Montgomery DL, Shiver JW, Leander KR, et al. Heterologous and homologous protection against influenza A by DNA vaccination: optimization of DNA vectors. DNA Cell Biol, 1993, 12:777-783.
27,Michael WC , Webster RG, Fuller, et al. DNA vaccines: protective immunizations by parenteral, mucosal and gene-gun inoculations. Proc Natl Sci USA, 1993, 90:11478-11482.
(收稿日期:1999-07-19), http://www.100md.com