紫杉醇诱导Jurkat细胞凋亡及其机制探讨
作者:周晓燕 许良中 何开玲 张太明 朱伟萍 李小妹 金爱萍
单位:周晓燕 许良中 张太明 朱伟萍 李小妹 金爱萍(200032 上海医科大学肿瘤医院分子病理研究室);何开玲(上海医科大学生物化学教研室)
关键词:紫杉醇;细胞凋亡;bcl-2基因家族;细胞株,Jurkat
中华血液学杂志000605 【摘要】 目的 观察抗微管药物紫杉醇对T细胞淋巴瘤细胞株Jurkat是否具有凋亡诱导作用,并进一步研究bcl-2基因家族在此过程中的作用。方法 将不同浓度的紫杉醇作用于Jurkat细胞,观察其作用的时间效应及剂量效应;在光镜和电镜下观察其形态变化;用流式细胞术分析细胞DNA含量的改变并作DNA片段分析;用免疫组织化学及半定量逆转录-聚合酶链反应(RT-PCR)法观察在紫杉醇作用过程中凋亡调节基因bcl-2家族的mRNA和蛋白表达的变化。结果 紫杉醇能抑制Jurkat细胞生长,在一定剂量和时间范围内,主要引起细胞凋亡,并显示剂量和时间效应,在这个过程中bax转录及蛋白表达增加,并出现bcl-xs的转录。结论 紫杉醇能特异地诱导Jurkat细胞凋亡,这为紫杉醇应用于T细胞淋巴瘤的治疗提供了依据,并为研究淋巴瘤细胞凋亡的基因调控提供了极好的模型,bax和bcl-xs参与了紫杉醇诱导Jurkat细胞凋亡的基因调控。
, 百拇医药
Taxol-induced apoptosis in Jurkat T cell lymphoma cell line and its molecular mechanisms
ZHOU Xiaoyan, XU Liangzhong, HE Kailing, et al.
(Laboratory of Molecular Pathology, Cancer Hospital, Shanghai Medical University, Shanghai 200032,China)
【Abstract】 Objective To observe whether antimicrotubular drug taxol can induce apoptosis in Jurkat T cell lymphoma cell line and the role of bcl-2 gene family in this process. Methods Different concentrations of taxol were used to treat Jurkat cells. Cell morphology was observed under light and electron microscope. Flow cytometry and electrophoresis were used to analyze DNA contents and DNA fragments.Bcl-2 gene family proteins and mRNAs were studied by immunohistochemistry and semi-quantitative RT-PCR technique. Results Taxol could inhibit Jurkat cell growth. Within a certain range of treating time and dose, cells were induced apoptosis with a time and dose related manner. The expressions of bax protein and mRNA were increased and bcl-xs mRNA became detectable after taxol treatment. Conclusion Taxol can specifically induce Jurkat cells apoptosis. It might provide a theoretical basis for clinical treatment and a good model for studying apoptotic gene modulation. Bax and bcl-xs participate in the taxol induced apoptosis of Jurkat cells.
, 百拇医药
【Key words】 Jurkat; Taxol; Apoptosis; bcl-2 gene family
紫杉醇(paclitaxel,商品名Taxol)是从紫杉树皮中提取的一种新的抗微管药物[1],1993年美国FDA批准该药用于治疗对常规化疗无效的卵巢癌和乳腺癌,其作用是与微管结合使微管稳定性增强,抑制微管解聚,使细胞阻滞于分裂期,并促进细胞凋亡[2]。国外临床研究表明部分淋巴瘤患者对紫杉醇敏感[3],但对紫杉醇作用机制的研究较少,淋巴瘤类型复杂,我们选用T淋巴瘤细胞株Jurkat 在体外观察紫杉醇对其是否具有凋亡诱导作用,并进一步研究其凋亡调控机制。
材料和方法
1 细胞培养及药物 人T淋巴瘤细胞株Jurkat由上海第二医科大学瑞金医院上海血液学研究所提供,在常规条件下培养。
, 百拇医药
2 药物抑制的时间效应与剂量效应 将对数生长期的Jurkat细胞以3×105/ml接种于24孔板,培养12h后加入紫杉醇,使其终浓度为100ng/ml,在不同时间观察并计数细胞;或加入不同浓度的药物培养12h后观察,每组设3个复孔。
3 细胞形态观察 在倒置显微镜、光镜(HE染色)及透射电镜下分别观察细胞的形态特征,同时作台盼蓝染色。
4 流式细胞术(FCM)分析 2×106细胞用体积分数为70%的酒精固定,体积分数为1%的triton X-100 10ml处理10min,0.001g/L RNA酶1ml处理20min,2.5g/L碘化丙锭(PI)染色20min。流式细胞仪(Facscalibur)为Becton-Dickinson公司产品,激发波长为488nm,每样品随机分析105细胞,分析软件为Modfit。
, 百拇医药 5 DNA片段分析 106细胞用PBS洗涤,离心后再加30μl PBS重悬细胞,加等体积2×缓冲液(50mmol/L Tris,40mmol/L EDTA,1.6g/L Sarcoyl) 充分混匀,加RNA酶 0.1g/L, 50℃孵育30min,再用蛋白酶K 1g/L孵育4~24h,70℃加热10min,取30μl电泳(40V,4h)。
6 免疫组织化学及逆转录-聚合酶链反应(RT-PCR) 对紫杉醇处理的细胞用bcl-2单抗、bax和bcl-x多抗作免疫组化分析,并用TrizolTM Reagent(GIBOL产品)提取总RNA,经AMV(Promega产品)逆转录为cDNA。3种基因的cDNA引物序列分别是:bcl-2, 5′-TTCGCCGAGATGTCCAGGC-3′, 5′-TCACTTGTGGCCCAGATAGG-3′,产物为386bp; bax, 5′-GATGCGTCCACCAAGAAG-3′, 5′-GATCAGTTCCGGCACCTT-3′,产物为243bp; bcl-x, 5′-AGACCCCCAGTGCCATCAAT-3′, 5′-ACAGTCATGCCCGTCAGGAA-3′,该对引物设计在bcl-xs缺失区的两侧,能同时扩增出523bp的bcl-xl和354bp的bcl-xs。 单独用bcl-x引物或分别用bcl-2或bax与β-actin cDNA引物同时扩增。产物在20g/L琼脂糖凝胶电泳后用IS-1000 Digital Imaging系统对所产生的条带作半定量分析。
, 百拇医药
结果
1 紫杉醇对Jurkat细胞的抑制效应 100ng/ml紫杉醇与Jurkat细胞一起孵育3,6,12,24,30h,细胞的生长抑制率分别为14.3%,27.6%,55.5%,72.8%,88.5%;不同浓度紫杉醇(1,10,50,100,200ng/ml)分别与Jurkat细胞孵育24h,细胞生长抑制率分别为38.5%,45.7%,58.5%,69.5%,84.7%,生长抑制率显示时间和浓度效应。
2 紫杉醇作用后Jurkat细胞形态学改变 倒置显微镜下可见Jurkat细胞在1ng/ml紫杉醇作用3h后即可见部分细胞变长,膜鼓起并逐渐脱离细胞形成小体。光镜及电镜下可见细胞核固缩、靠边呈新月形,细胞膜包裹裂解的细胞核及细胞浆形成的凋亡小体,即为倒置显微镜下见到的小体;电镜下尚可见线粒体膜完整,不肿胀(图1)。台盼蓝试验阴性,表明细胞膜完整,通透性正常。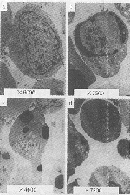
, 百拇医药
图1 未处理(a)及紫杉醇处理后(b,c,d)Jurkat细胞的电镜观察
3 FCM分析 紫杉醇作用后早期可见S期和G2/M期细胞增多,同时在G1峰前出现亚二倍体峰,即凋亡小峰(Ap峰,图2),表明细胞DNA降解、渗漏导致DNA染色能力下降。AP峰随紫杉醇剂量的加大、作用时间的延长而增高。
DNA含量(相对荧光强度)
a:对照,G0/G1 37.36%、G2/M 9.80%、S 52.84%、凋亡率0.58%;b:10ng/ml紫杉醇,G0/G1 60.79%、G2/M 21.71%、S 17.50%,凋亡率21.87%;c:50ng/ml紫杉醇,G0/G1 62.35%、G2/M 1.36%、S 36.28%、凋亡率32.14%;d:100ng/ml紫杉醇,G0/G1 62.49%、G2/M 8.58%、S 28.93%、凋亡率38.72%
, http://www.100md.com
图2 用不同浓度紫杉醇处理后FCM检测结果
4 DNA片段分析 Jurkat细胞在紫杉醇作用后出现典型的DNA梯形带,证明紫杉醇作用后细胞内内源性核酸酶活性增高,将核小体之间DNA切割形成180~200bp的多聚体。
5 紫杉醇作用后bcl-2基因家族的mRNA及蛋白的变化 未处理的Jurkat细胞均有bcl-2、bax和bcl-x的转录和蛋白表达,bcl-x主要以bcl-xl的形式存在;经紫杉醇作用后,bax mRNA和蛋白表达增加,并出现bcl-xs的转录(图3,4),bcl-x蛋白表达略有增高但不能区分bcl-x的形式,bcl-2的mRNA和蛋白表达无明显变化。
M为pBR322/MSPⅠ分子量标志;1为未处理组;2~5分别为100ng/ml紫杉醇处理6,12,24,30h
, 百拇医药
图3 Jurkat细胞在紫杉醇处理后bax mRNA的变化
1为未处理组;2~5 分别为100ng/ml紫杉醇处理6,12,24,30h;M为pBR322/MSPⅠ分子量标志
图4 Jurkat细胞在紫杉醇处理后bcl-x mRNA的变化
讨论
紫杉醇作为抗癌新药,它在乳腺癌、卵巢癌、前列腺癌等治疗中已有应用,它可导致G2/M期阻滞,并促进细胞凋亡。我们的研究结果显示紫杉醇对T淋巴瘤细胞株Jurkat具有显著的凋亡诱导作用,而G2/M期阻滞仅在早期短时间内发生。小鼠体内研究表明有丝分裂阻滞与肿瘤生长的抑制无关,而细胞凋亡与生长抑制明显相关,诱导细胞凋亡的能力是药物疗效的有用指标[4]。由此可见紫杉醇将是淋巴瘤,特别是T细胞淋巴瘤治疗中有价值的药物,本研究结果为该药的临床使用提供了理论依据,同时亦为进一步研究淋巴瘤细胞凋亡的基因调控提供了极好的模型。
, http://www.100md.com
由于bcl-2可抑制许多因子诱导的细胞凋亡,是细胞凋亡调节中共同终末通道的关键基因之一,而多数bcl-2家族成员之间可形成同源或异源二聚体,构成基因网络,它们之间的相对比例决定细胞的命运。bax为凋亡促进基因,bcl-x通过不同的剪切机制产生两种形式的mRNA,即bcl-xl和bcl-xs。bcl-xl的作用与bcl-2相似,可抑制细胞凋亡,bcl-xs mRNA比bcl-xl mRNA少189bp,产生的蛋白能抑制bcl-2的功能从而促进细胞凋亡。我们选择上述三个基因观察它们在紫杉醇介导的Jurkat 细胞凋亡中的变化。在未处理的Jurkat细胞中三种基因均有转录和蛋白表达,其中bcl-x以bcl-xl的形式存在,细胞可持续生长而不发生凋亡,表明多种凋亡调节基因处于相对平衡状态。在紫杉醇作用后,bcl-2基因在转录和蛋白表达上基本不变,但bax的mRNA和蛋白均增高,这使bcl-2与bax的比值下调, bax.bax同二聚体和bax.bcl-2的异二聚体增多,而bcl-2.bcl-2下降,从而促进细胞凋亡的发生。同时出现了bcl-xs,它可使bcl-xl.bcl-xs增加,也可促进细胞凋亡。 有文献报道紫杉醇可促进前列腺癌细胞bcl-2的磷酸化,使bcl-2的抑制细胞凋亡的能力消失,从而促进细胞凋亡[2],在Jurkat 细胞中是否有类似现象,有必要作进一步的研究。总之,bcl-2基因家族在紫杉醇诱导Jurkat细胞凋亡过程中起着重要的调控作用。
, http://www.100md.com
基金项目:上海市领先医学资助项目(Ⅲ-002)
参考文献
1,Long HJ. Paclitaxel (Taxol): a novel anticancer chemotherapeutic drug. Mayo Clin Proc, 1994,69:341-345.
2,Haldar S, Chintaplli J, Croce CM. Taxol induces bcl-2 phosphorylation and death of prostate cancer cells. Cancer Res,1996,56:1253-1255.
3,Younes A, Sarris A, Melnyk A, et al. Three-hour paclitaxel infusion in patients with refractory and relapsed non-Hodgkin's lymphoma. J Clin Oncol, 1995,13:583-587.
4,Donaldson KL, Goolsby G, Kiener PA, et al. Activation of pcdc2 coincident with taxol-induced apoptosis. Cell Growth Differ, 1994,5:1041-1051.
(收稿日期:1999-07-05), http://www.100md.com
单位:周晓燕 许良中 张太明 朱伟萍 李小妹 金爱萍(200032 上海医科大学肿瘤医院分子病理研究室);何开玲(上海医科大学生物化学教研室)
关键词:紫杉醇;细胞凋亡;bcl-2基因家族;细胞株,Jurkat
中华血液学杂志000605 【摘要】 目的 观察抗微管药物紫杉醇对T细胞淋巴瘤细胞株Jurkat是否具有凋亡诱导作用,并进一步研究bcl-2基因家族在此过程中的作用。方法 将不同浓度的紫杉醇作用于Jurkat细胞,观察其作用的时间效应及剂量效应;在光镜和电镜下观察其形态变化;用流式细胞术分析细胞DNA含量的改变并作DNA片段分析;用免疫组织化学及半定量逆转录-聚合酶链反应(RT-PCR)法观察在紫杉醇作用过程中凋亡调节基因bcl-2家族的mRNA和蛋白表达的变化。结果 紫杉醇能抑制Jurkat细胞生长,在一定剂量和时间范围内,主要引起细胞凋亡,并显示剂量和时间效应,在这个过程中bax转录及蛋白表达增加,并出现bcl-xs的转录。结论 紫杉醇能特异地诱导Jurkat细胞凋亡,这为紫杉醇应用于T细胞淋巴瘤的治疗提供了依据,并为研究淋巴瘤细胞凋亡的基因调控提供了极好的模型,bax和bcl-xs参与了紫杉醇诱导Jurkat细胞凋亡的基因调控。
, 百拇医药
Taxol-induced apoptosis in Jurkat T cell lymphoma cell line and its molecular mechanisms
ZHOU Xiaoyan, XU Liangzhong, HE Kailing, et al.
(Laboratory of Molecular Pathology, Cancer Hospital, Shanghai Medical University, Shanghai 200032,China)
【Abstract】 Objective To observe whether antimicrotubular drug taxol can induce apoptosis in Jurkat T cell lymphoma cell line and the role of bcl-2 gene family in this process. Methods Different concentrations of taxol were used to treat Jurkat cells. Cell morphology was observed under light and electron microscope. Flow cytometry and electrophoresis were used to analyze DNA contents and DNA fragments.Bcl-2 gene family proteins and mRNAs were studied by immunohistochemistry and semi-quantitative RT-PCR technique. Results Taxol could inhibit Jurkat cell growth. Within a certain range of treating time and dose, cells were induced apoptosis with a time and dose related manner. The expressions of bax protein and mRNA were increased and bcl-xs mRNA became detectable after taxol treatment. Conclusion Taxol can specifically induce Jurkat cells apoptosis. It might provide a theoretical basis for clinical treatment and a good model for studying apoptotic gene modulation. Bax and bcl-xs participate in the taxol induced apoptosis of Jurkat cells.
, 百拇医药
【Key words】 Jurkat; Taxol; Apoptosis; bcl-2 gene family
紫杉醇(paclitaxel,商品名Taxol)是从紫杉树皮中提取的一种新的抗微管药物[1],1993年美国FDA批准该药用于治疗对常规化疗无效的卵巢癌和乳腺癌,其作用是与微管结合使微管稳定性增强,抑制微管解聚,使细胞阻滞于分裂期,并促进细胞凋亡[2]。国外临床研究表明部分淋巴瘤患者对紫杉醇敏感[3],但对紫杉醇作用机制的研究较少,淋巴瘤类型复杂,我们选用T淋巴瘤细胞株Jurkat 在体外观察紫杉醇对其是否具有凋亡诱导作用,并进一步研究其凋亡调控机制。
材料和方法
1 细胞培养及药物 人T淋巴瘤细胞株Jurkat由上海第二医科大学瑞金医院上海血液学研究所提供,在常规条件下培养。
, 百拇医药
2 药物抑制的时间效应与剂量效应 将对数生长期的Jurkat细胞以3×105/ml接种于24孔板,培养12h后加入紫杉醇,使其终浓度为100ng/ml,在不同时间观察并计数细胞;或加入不同浓度的药物培养12h后观察,每组设3个复孔。
3 细胞形态观察 在倒置显微镜、光镜(HE染色)及透射电镜下分别观察细胞的形态特征,同时作台盼蓝染色。
4 流式细胞术(FCM)分析 2×106细胞用体积分数为70%的酒精固定,体积分数为1%的triton X-100 10ml处理10min,0.001g/L RNA酶1ml处理20min,2.5g/L碘化丙锭(PI)染色20min。流式细胞仪(Facscalibur)为Becton-Dickinson公司产品,激发波长为488nm,每样品随机分析105细胞,分析软件为Modfit。
, 百拇医药 5 DNA片段分析 106细胞用PBS洗涤,离心后再加30μl PBS重悬细胞,加等体积2×缓冲液(50mmol/L Tris,40mmol/L EDTA,1.6g/L Sarcoyl) 充分混匀,加RNA酶 0.1g/L, 50℃孵育30min,再用蛋白酶K 1g/L孵育4~24h,70℃加热10min,取30μl电泳(40V,4h)。
6 免疫组织化学及逆转录-聚合酶链反应(RT-PCR) 对紫杉醇处理的细胞用bcl-2单抗、bax和bcl-x多抗作免疫组化分析,并用TrizolTM Reagent(GIBOL产品)提取总RNA,经AMV(Promega产品)逆转录为cDNA。3种基因的cDNA引物序列分别是:bcl-2, 5′-TTCGCCGAGATGTCCAGGC-3′, 5′-TCACTTGTGGCCCAGATAGG-3′,产物为386bp; bax, 5′-GATGCGTCCACCAAGAAG-3′, 5′-GATCAGTTCCGGCACCTT-3′,产物为243bp; bcl-x, 5′-AGACCCCCAGTGCCATCAAT-3′, 5′-ACAGTCATGCCCGTCAGGAA-3′,该对引物设计在bcl-xs缺失区的两侧,能同时扩增出523bp的bcl-xl和354bp的bcl-xs。 单独用bcl-x引物或分别用bcl-2或bax与β-actin cDNA引物同时扩增。产物在20g/L琼脂糖凝胶电泳后用IS-1000 Digital Imaging系统对所产生的条带作半定量分析。
, 百拇医药
结果
1 紫杉醇对Jurkat细胞的抑制效应 100ng/ml紫杉醇与Jurkat细胞一起孵育3,6,12,24,30h,细胞的生长抑制率分别为14.3%,27.6%,55.5%,72.8%,88.5%;不同浓度紫杉醇(1,10,50,100,200ng/ml)分别与Jurkat细胞孵育24h,细胞生长抑制率分别为38.5%,45.7%,58.5%,69.5%,84.7%,生长抑制率显示时间和浓度效应。
2 紫杉醇作用后Jurkat细胞形态学改变 倒置显微镜下可见Jurkat细胞在1ng/ml紫杉醇作用3h后即可见部分细胞变长,膜鼓起并逐渐脱离细胞形成小体。光镜及电镜下可见细胞核固缩、靠边呈新月形,细胞膜包裹裂解的细胞核及细胞浆形成的凋亡小体,即为倒置显微镜下见到的小体;电镜下尚可见线粒体膜完整,不肿胀(图1)。台盼蓝试验阴性,表明细胞膜完整,通透性正常。

, 百拇医药
图1 未处理(a)及紫杉醇处理后(b,c,d)Jurkat细胞的电镜观察
3 FCM分析 紫杉醇作用后早期可见S期和G2/M期细胞增多,同时在G1峰前出现亚二倍体峰,即凋亡小峰(Ap峰,图2),表明细胞DNA降解、渗漏导致DNA染色能力下降。AP峰随紫杉醇剂量的加大、作用时间的延长而增高。

DNA含量(相对荧光强度)
a:对照,G0/G1 37.36%、G2/M 9.80%、S 52.84%、凋亡率0.58%;b:10ng/ml紫杉醇,G0/G1 60.79%、G2/M 21.71%、S 17.50%,凋亡率21.87%;c:50ng/ml紫杉醇,G0/G1 62.35%、G2/M 1.36%、S 36.28%、凋亡率32.14%;d:100ng/ml紫杉醇,G0/G1 62.49%、G2/M 8.58%、S 28.93%、凋亡率38.72%
, http://www.100md.com
图2 用不同浓度紫杉醇处理后FCM检测结果
4 DNA片段分析 Jurkat细胞在紫杉醇作用后出现典型的DNA梯形带,证明紫杉醇作用后细胞内内源性核酸酶活性增高,将核小体之间DNA切割形成180~200bp的多聚体。
5 紫杉醇作用后bcl-2基因家族的mRNA及蛋白的变化 未处理的Jurkat细胞均有bcl-2、bax和bcl-x的转录和蛋白表达,bcl-x主要以bcl-xl的形式存在;经紫杉醇作用后,bax mRNA和蛋白表达增加,并出现bcl-xs的转录(图3,4),bcl-x蛋白表达略有增高但不能区分bcl-x的形式,bcl-2的mRNA和蛋白表达无明显变化。

M为pBR322/MSPⅠ分子量标志;1为未处理组;2~5分别为100ng/ml紫杉醇处理6,12,24,30h
, 百拇医药
图3 Jurkat细胞在紫杉醇处理后bax mRNA的变化

1为未处理组;2~5 分别为100ng/ml紫杉醇处理6,12,24,30h;M为pBR322/MSPⅠ分子量标志
图4 Jurkat细胞在紫杉醇处理后bcl-x mRNA的变化
讨论
紫杉醇作为抗癌新药,它在乳腺癌、卵巢癌、前列腺癌等治疗中已有应用,它可导致G2/M期阻滞,并促进细胞凋亡。我们的研究结果显示紫杉醇对T淋巴瘤细胞株Jurkat具有显著的凋亡诱导作用,而G2/M期阻滞仅在早期短时间内发生。小鼠体内研究表明有丝分裂阻滞与肿瘤生长的抑制无关,而细胞凋亡与生长抑制明显相关,诱导细胞凋亡的能力是药物疗效的有用指标[4]。由此可见紫杉醇将是淋巴瘤,特别是T细胞淋巴瘤治疗中有价值的药物,本研究结果为该药的临床使用提供了理论依据,同时亦为进一步研究淋巴瘤细胞凋亡的基因调控提供了极好的模型。
, http://www.100md.com
由于bcl-2可抑制许多因子诱导的细胞凋亡,是细胞凋亡调节中共同终末通道的关键基因之一,而多数bcl-2家族成员之间可形成同源或异源二聚体,构成基因网络,它们之间的相对比例决定细胞的命运。bax为凋亡促进基因,bcl-x通过不同的剪切机制产生两种形式的mRNA,即bcl-xl和bcl-xs。bcl-xl的作用与bcl-2相似,可抑制细胞凋亡,bcl-xs mRNA比bcl-xl mRNA少189bp,产生的蛋白能抑制bcl-2的功能从而促进细胞凋亡。我们选择上述三个基因观察它们在紫杉醇介导的Jurkat 细胞凋亡中的变化。在未处理的Jurkat细胞中三种基因均有转录和蛋白表达,其中bcl-x以bcl-xl的形式存在,细胞可持续生长而不发生凋亡,表明多种凋亡调节基因处于相对平衡状态。在紫杉醇作用后,bcl-2基因在转录和蛋白表达上基本不变,但bax的mRNA和蛋白均增高,这使bcl-2与bax的比值下调, bax.bax同二聚体和bax.bcl-2的异二聚体增多,而bcl-2.bcl-2下降,从而促进细胞凋亡的发生。同时出现了bcl-xs,它可使bcl-xl.bcl-xs增加,也可促进细胞凋亡。 有文献报道紫杉醇可促进前列腺癌细胞bcl-2的磷酸化,使bcl-2的抑制细胞凋亡的能力消失,从而促进细胞凋亡[2],在Jurkat 细胞中是否有类似现象,有必要作进一步的研究。总之,bcl-2基因家族在紫杉醇诱导Jurkat细胞凋亡过程中起着重要的调控作用。
, http://www.100md.com
基金项目:上海市领先医学资助项目(Ⅲ-002)
参考文献
1,Long HJ. Paclitaxel (Taxol): a novel anticancer chemotherapeutic drug. Mayo Clin Proc, 1994,69:341-345.
2,Haldar S, Chintaplli J, Croce CM. Taxol induces bcl-2 phosphorylation and death of prostate cancer cells. Cancer Res,1996,56:1253-1255.
3,Younes A, Sarris A, Melnyk A, et al. Three-hour paclitaxel infusion in patients with refractory and relapsed non-Hodgkin's lymphoma. J Clin Oncol, 1995,13:583-587.
4,Donaldson KL, Goolsby G, Kiener PA, et al. Activation of pcdc2 coincident with taxol-induced apoptosis. Cell Growth Differ, 1994,5:1041-1051.
(收稿日期:1999-07-05), http://www.100md.com