大鼠舌癌变过程中端粒酶活性变化的研究
作者:刘兴坤 何荣根 周曾同 陈万涛 周晓健
单位:周晓健 何荣根 周曾同 陈万涛(200011 上海第二医科大学口腔医学院口腔颌面外科);刘兴坤(现在江苏苏州市口腔医院口腔颌面外科 215005)
关键词:大鼠;癌;酶类
中华口腔医学杂志000608 【摘要】 目的 研究大鼠舌癌及癌前病变组织中的端粒酶活性,探讨其在口腔癌诊断与防治方面的应用前景。方法 采用PCR-TRAP银染与ELISA技术分别对69例4NQO诱发大鼠舌癌变过程中端粒酶活性变化进行定性和定量检测。结果 两种方法检测端粒酶活性有很好的一致性。随口腔癌变进展,端粒酶阳性率递增,正常粘膜、单纯性增生、轻中度异常增生、重度异常增生、原位癌、鳞癌的阳性率分别为0.0%、12.5%、25.0%、66.7%、72.7%和93.8%。结论 端粒酶激活是口腔癌形成的重要环节,检测癌前病变组织中端粒酶活性可预测癌变潜能。端粒酶为口腔癌防治研究提供了理想靶点。
, http://www.100md.com
Telomerase activity in rat tongue carcinogenesis
LIU Xingkun, HE Ronggen, ZHOU Zengtong, et al.
(Department of Oral and Maxillofacial Surgery, Suzhou Stomatological Hospital, Suzhou, Jiangshu 215005,China)
【Abstract】 Objective To detect the telomerase activity in rat tongue cancer and precancerous lesions and to investigate the possibility of telomerase as oral cancer biological marker. Methods A total of 69 rat tongue carcinogenesis specimens induced by 4-nitroquinoline-1-oxide (4NQO) were examined for telomerase activity by PCR-telomeric repeat amplification protocol (TRAP) silver staining and ELISA. Results Sequential increase in telomerase activity in tongue carcinogenesis was found. The positive rate of telomerase in normal, HP, mmDP, sDP, ISC and SCC was 0.0%, 12.5%, 25.0%, 66.7%, 72.7% and 93.8%. Conclusions Telomerase may be a tumor specific gene marker, and may play an important role in early diagnosis and treatment of oral cancer.
, 百拇医药
【Key words】 Rats; Carcinoma; Enzymes
无限增殖和分化障碍是癌细胞的重要生物学特性,也是肿瘤难以治愈的根本原因。最新的研究发现,端粒酶与细胞分裂及寿命控制有密切关系。一般认为,在细胞癌变过程中因端粒酶的活性增强,端粒的长度得以维持,染色体形态得到稳定,从而逃脱了因端粒缩短而引起的细胞死亡,使细胞达不到终末分化,获得永生化[1]。在人体多数肿瘤组织中已检出。目前,对口腔癌变过程中端粒酶激活阶段的认识不一[2,3]。我们采用PCR-端粒重复序列扩增(telomeric repeat amplification protocol, TRAP)银染技术和ELISA技术分别对大鼠口腔癌变过程中端粒酶活性变化进行定性和定量检测,旨在探索端粒酶在口腔癌变过程中的规律性变化及其在口腔癌诊断与防治方面的应用前景。
材料和方法
, http://www.100md.com 1.标本来源: 69例0.002%4NQO饮水(0~32周)诱发SD大鼠舌癌变组织液氮冻存块,全部标本均经双盲法病理证实。
2.端粒酶活性检测:
(1) PCR-TRAP:操作按照宝灵曼公司的端粒酶PCR-TRAP试剂盒说明进行。3 mm ×3 mm ×3 mm组织裂解,端粒酶延伸、PCR扩增:首先25 ℃30 min、94 ℃5 min,再经94 ℃30 s、50 ℃30 s、 72 ℃90 s,循环30个周期,最后72 ℃10 min。
(2)聚丙烯酰胺凝胶电泳银染: PCR产物浓缩纯化,12%聚丙烯酰胺凝胶电泳,硝酸银染色,以出现扩增条带相差6 bp的数个TTAGGG的DNA梯度(DNA ladder)片段为端粒酶阳性。
(3) ELISA:PCR产物经包被、变性、杂交、酶联抗体、底物反应、显色等步骤后,测定450 nm和690 nm的吸光度(A)值,根据A=A450-A690计算结果。判定标准为:阳性对照A值应>1.5;阴性对照A值应<0.25;经检标本A值-阴性对照A值>0.2者视为端粒酶阳性。
, 百拇医药
3.统计学处理:SPSS(7.5)统计软件进行统计学处理,结果采用计数资料的结构相对数(%)表示,ELISA结果采用多个独立样本的秩和检验(kruskal-walls test),两两比较采用mann-whithey检验。
结果
端粒酶活性在口腔癌发生发展过程中的变化(表1)。
表1 大鼠舌癌变组织端粒酶活性检测结果(例) 组织学
n
端粒酶阳性
凝胶电泳银染(%)
ELISA(%)
正常*
, 百拇医药
8
0(0)
0(0)
单纯性增生**
8
1(12.5)
1(12.5)
轻中度异常增生***
8
2(25.0)
2(25.0)
重度异常增生****
, http://www.100md.com
18
11(61.1)
12(66.7)
原位癌*****
11
8(72.7)
8(72.7)
鳞癌******
16
15(93.8)
15(93.8)
注:(ELISA)H=24.17 P<0.01; ****** 、*****、****、 ** :*,******:** P<0.01;***:*,******:***、**** P<0.05 端粒酶阳性率随口腔癌变进展而递增(图1~4)。正常粘膜、单纯性增生、轻中度异常增生、重度异常增生、原位癌、鳞癌的端粒酶阳性率分别为0.0%、12.5%、25.0%、66.7%、72.7%和93.8%。与鳞癌阳性率相比,原位癌以前各组差异均有显著性(P<0.05)。
, http://www.100md.com
PCR-TRAP凝胶电泳银染法与ELISA法结果基本一致,仅重度异常增生组1例凝胶电泳显示条带模糊,为可疑阳性,经ELISA检测A值为0.77。ELISA定量检测较凝胶电泳银染更准确。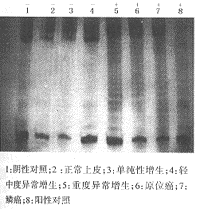
图1 大鼠舌粘膜上皮各种典型病变的端粒酶活性
图2 正常大鼠舌粘膜上皮端粒酶呈阴性
图3 4NQO作用13周大鼠舌粘膜上皮端粒酶活性
图4 4NQO作用13周后停药继续观察至32周大鼠舌粘膜上皮端粒酶活性
, http://www.100md.com
讨论
端粒为真核细胞线性染色体末端的一种特异序列,由重复排列的六核苷酸5'-TTAGGG-3'组成[1-3]。端粒长度被认为是细胞的“有丝分裂钟”,正常体细胞由于末端复制问题,端粒随着细胞分裂而进行性缩短,以致不能维持染色体的稳定使细胞衰老死亡。端粒长度的维持需要端粒酶的激活,而该酶在正常组织中,只在生长速度很快的胚胎、骨髓和生殖等细胞中才能检测到,而在大多数功能特化了的体细胞中检测不到。正常体细胞分裂一定数目后逐渐老化,肿瘤细胞由于端粒酶激活维持了端粒的长度使细胞获得永生。国外学者的研究表明,绝大部分的肿瘤呈端粒酶阳性。Shay和Gazdar[4]总结了大样本的正常组织(196例)、原位癌(410例)、恶性肿瘤(2 031例)和癌旁组织(690例)中端粒酶阳性率分别为0.5%、30.0%、85.0%和11.0%。本实验检测到的大鼠舌鳞癌和原位癌的端粒酶阳性率分别为93.8%和72.7%。另外,细胞内除端粒酶外,还存在其他的调节端粒长度的因子,如端粒结合蛋白、端粒结构等。端粒酶本身的激活受一些因子的调控,端粒酶RNA(hTR)基因的激活和端粒酶抑制基因的失活等,在一些生物细胞及人的肿瘤细胞中也发现了非端粒酶依赖性端粒维持方式。这可以解释为什么不是所有的肿瘤组织中都有端粒酶的活性。
, http://www.100md.com
端粒酶的激活发生在癌变过程的哪个阶段是否能作为诊断肿瘤的指标?这是人们普遍感兴趣的问题。Bednarek等[5]通过对DMBA+TPA诱导小鼠乳头状上皮瘤发生发展过程的研究发现,端粒酶阳性率随肿瘤发展过程而提高。临床上,Yashima等[6]也发现肺多步骤癌变过程中支气管上皮端粒酶阳性率呈进行性增加:正常26%、过度增生71%、化生80%、异常增生82%、原位癌100%;正常、癌前、原位癌支气管上皮端粒酶相对水平较低,约0.2~0.6 U/μg蛋白,而发展成侵袭性癌时端粒酶水平则显著提高,达34.0 U/μg蛋白。与此相反,Mao等[2]则在对头颈鳞癌端粒酶活性检测中发现,正常和过度角化组织无端粒酶活性表达,过度增生和异常增生组织端粒酶100%呈阳性,侵袭性癌时只有90%为阳性,提示端粒酶的激活可能发生在肿瘤形成的早期。本研究观察到的大鼠舌癌变组织端粒酶活性变化:正常粘膜(0.0%);单纯性增生(12.5%);轻中度异常增生(25.0%);重度异常增生(66.7%);原位癌(72.7%);鳞癌(93.8%),呈逐步增加趋势。与Mutirangura等[3]报道的87.5%(14/16)头颈鳞癌和38.5%(10/26)口腔白斑呈端粒酶阳性结果相似。综合各家报道,端粒酶在肿瘤发生及发展过程中的激活阶段不一致可能与肿瘤类型、部位、生物学特性不同有关。有学者收集口腔冲洗液中的脱落细胞测定端粒酶活性,将其作为无创诊断的指标取得了一定进展。我们相信,随着端粒酶研究的深入,人们对端粒酶是否作为肿瘤确诊的指标会有更正确的认识。
, http://www.100md.com
本研究发现,在大鼠舌粘膜上皮单纯性增生、异常增生病变中有一些组织端粒酶阳性。这意味着在组织病理学上认为是非癌的组织中存在着一定数量的具有癌变潜能的“永生化”细胞,这可以解释本研究中4NQO作用13周,致大鼠舌粘膜上皮单纯性增生、异常增生后停药而继续观察至32周时相继出现癌变。所以,对这群组织学上看不到的“永生化”细胞,应引起足够的重视。端粒酶活性检测为预测癌前病变的癌变潜能和指导临床治疗提供了较可靠的方法。
在方法学上,Kim等[1]于1994年首先应用PCR-TRAP法检测端粒酶活性,大幅度提高了灵敏度,可检测到104个细胞中的1个不死性细胞,但存在同位素污染的弊端。如果用溴化乙锭(EB)染色,则其灵敏度已不够。因此本研究将银染方法用于PCR-TRAP的标记染色,既解决了同位素的放射性污染问题,又比EB的灵敏度高,另外,硝酸银染色仅在可见光下可观察,实验结果还可经凝胶干燥后长期保存,但该法仅能定性。因此,笔者又尝试了PCR-TRAP ELISA定量方法,与银染法相比,结果证实其特异、敏感、简便、快速,本组中有1例重度异常增生组织PCR-TRAP银染显示扩增的相差6 bp的梯度条带模糊,不能确定是否为阳性,经ELISA法检测其A值为0.77,确为阳性。另外,ELISA法可在96孔板中同时进行,便于大量检测。
, 百拇医药
既然端粒酶特异性地表达于各种肿瘤细胞,又是肿瘤细胞无限增殖能力所必需,而且目前认为端粒酶活性增高可能是细胞通向癌变最后的、唯一的旁路。各种端粒酶抑制剂反义核苷酸、反义肽苷酸,硫代反义肽苷酸、核酶、核苷类似物、分化诱导剂等应运而生,但所有这些尚无突破性进展。相信随着端粒酶组份的成功分离、对端粒酶的动力学和调控机制认识的进一步加深,端粒酶有望成为恶性肿瘤治疗的理想的新靶点。
基金项目:国家自然科学基金资助项目(39670787)
参考文献
1.Kim NW, Piatyszek MA, Prowse KR, et al. Specific association of human telomerase activity with immortal cells and cancer. Science, 1994, 266:2 011-2 014.
, 百拇医药
2.Mao L, El-Naggar AK, Fan YK, et al. Telomerase activity in head and neck squamous cell carcinoma and adjacent tissues. Cancer Res, 1996,56:5 600-5 605.
3.Mutirangura A, Supiyaphun P, Trirekapan S, et al. Telomerase activity in oral leukoplakia and head and neck squamous cell carcinoma. Cancer Res, 1996,56:3 530- 3 533.
4.Shay JW, Gazdar AF. Telomerase in the early detection of cancer. J Clin Pathol, 1997,50: 106-109.
, http://www.100md.com
5.Bednarek A, Budunova I, Slaga TJ, et al. Increased telomerase activity in mouse skin premalignant progression. Cancer Res, 1995,55:4 566-4 569.
6.Yashima K, Litzky LA, Kaiser L, et al. Telomerase expression in respiratory epithelium during the multistage pathogenesis of lung carcinomas. Cancer Res, 1997,57:2 373-2 377.
(收稿日期:1999-11-11), 百拇医药
单位:周晓健 何荣根 周曾同 陈万涛(200011 上海第二医科大学口腔医学院口腔颌面外科);刘兴坤(现在江苏苏州市口腔医院口腔颌面外科 215005)
关键词:大鼠;癌;酶类
中华口腔医学杂志000608 【摘要】 目的 研究大鼠舌癌及癌前病变组织中的端粒酶活性,探讨其在口腔癌诊断与防治方面的应用前景。方法 采用PCR-TRAP银染与ELISA技术分别对69例4NQO诱发大鼠舌癌变过程中端粒酶活性变化进行定性和定量检测。结果 两种方法检测端粒酶活性有很好的一致性。随口腔癌变进展,端粒酶阳性率递增,正常粘膜、单纯性增生、轻中度异常增生、重度异常增生、原位癌、鳞癌的阳性率分别为0.0%、12.5%、25.0%、66.7%、72.7%和93.8%。结论 端粒酶激活是口腔癌形成的重要环节,检测癌前病变组织中端粒酶活性可预测癌变潜能。端粒酶为口腔癌防治研究提供了理想靶点。
, http://www.100md.com
Telomerase activity in rat tongue carcinogenesis
LIU Xingkun, HE Ronggen, ZHOU Zengtong, et al.
(Department of Oral and Maxillofacial Surgery, Suzhou Stomatological Hospital, Suzhou, Jiangshu 215005,China)
【Abstract】 Objective To detect the telomerase activity in rat tongue cancer and precancerous lesions and to investigate the possibility of telomerase as oral cancer biological marker. Methods A total of 69 rat tongue carcinogenesis specimens induced by 4-nitroquinoline-1-oxide (4NQO) were examined for telomerase activity by PCR-telomeric repeat amplification protocol (TRAP) silver staining and ELISA. Results Sequential increase in telomerase activity in tongue carcinogenesis was found. The positive rate of telomerase in normal, HP, mmDP, sDP, ISC and SCC was 0.0%, 12.5%, 25.0%, 66.7%, 72.7% and 93.8%. Conclusions Telomerase may be a tumor specific gene marker, and may play an important role in early diagnosis and treatment of oral cancer.
, 百拇医药
【Key words】 Rats; Carcinoma; Enzymes
无限增殖和分化障碍是癌细胞的重要生物学特性,也是肿瘤难以治愈的根本原因。最新的研究发现,端粒酶与细胞分裂及寿命控制有密切关系。一般认为,在细胞癌变过程中因端粒酶的活性增强,端粒的长度得以维持,染色体形态得到稳定,从而逃脱了因端粒缩短而引起的细胞死亡,使细胞达不到终末分化,获得永生化[1]。在人体多数肿瘤组织中已检出。目前,对口腔癌变过程中端粒酶激活阶段的认识不一[2,3]。我们采用PCR-端粒重复序列扩增(telomeric repeat amplification protocol, TRAP)银染技术和ELISA技术分别对大鼠口腔癌变过程中端粒酶活性变化进行定性和定量检测,旨在探索端粒酶在口腔癌变过程中的规律性变化及其在口腔癌诊断与防治方面的应用前景。
材料和方法
, http://www.100md.com 1.标本来源: 69例0.002%4NQO饮水(0~32周)诱发SD大鼠舌癌变组织液氮冻存块,全部标本均经双盲法病理证实。
2.端粒酶活性检测:
(1) PCR-TRAP:操作按照宝灵曼公司的端粒酶PCR-TRAP试剂盒说明进行。3 mm ×3 mm ×3 mm组织裂解,端粒酶延伸、PCR扩增:首先25 ℃30 min、94 ℃5 min,再经94 ℃30 s、50 ℃30 s、 72 ℃90 s,循环30个周期,最后72 ℃10 min。
(2)聚丙烯酰胺凝胶电泳银染: PCR产物浓缩纯化,12%聚丙烯酰胺凝胶电泳,硝酸银染色,以出现扩增条带相差6 bp的数个TTAGGG的DNA梯度(DNA ladder)片段为端粒酶阳性。
(3) ELISA:PCR产物经包被、变性、杂交、酶联抗体、底物反应、显色等步骤后,测定450 nm和690 nm的吸光度(A)值,根据A=A450-A690计算结果。判定标准为:阳性对照A值应>1.5;阴性对照A值应<0.25;经检标本A值-阴性对照A值>0.2者视为端粒酶阳性。
, 百拇医药
3.统计学处理:SPSS(7.5)统计软件进行统计学处理,结果采用计数资料的结构相对数(%)表示,ELISA结果采用多个独立样本的秩和检验(kruskal-walls test),两两比较采用mann-whithey检验。
结果
端粒酶活性在口腔癌发生发展过程中的变化(表1)。
表1 大鼠舌癌变组织端粒酶活性检测结果(例) 组织学
n
端粒酶阳性
凝胶电泳银染(%)
ELISA(%)
正常*
, 百拇医药
8
0(0)
0(0)
单纯性增生**
8
1(12.5)
1(12.5)
轻中度异常增生***
8
2(25.0)
2(25.0)
重度异常增生****
, http://www.100md.com
18
11(61.1)
12(66.7)
原位癌*****
11
8(72.7)
8(72.7)
鳞癌******
16
15(93.8)
15(93.8)
注:(ELISA)H=24.17 P<0.01; ****** 、*****、****、 ** :*,******:** P<0.01;***:*,******:***、**** P<0.05 端粒酶阳性率随口腔癌变进展而递增(图1~4)。正常粘膜、单纯性增生、轻中度异常增生、重度异常增生、原位癌、鳞癌的端粒酶阳性率分别为0.0%、12.5%、25.0%、66.7%、72.7%和93.8%。与鳞癌阳性率相比,原位癌以前各组差异均有显著性(P<0.05)。
, http://www.100md.com
PCR-TRAP凝胶电泳银染法与ELISA法结果基本一致,仅重度异常增生组1例凝胶电泳显示条带模糊,为可疑阳性,经ELISA检测A值为0.77。ELISA定量检测较凝胶电泳银染更准确。

图1 大鼠舌粘膜上皮各种典型病变的端粒酶活性

图2 正常大鼠舌粘膜上皮端粒酶呈阴性

图3 4NQO作用13周大鼠舌粘膜上皮端粒酶活性

图4 4NQO作用13周后停药继续观察至32周大鼠舌粘膜上皮端粒酶活性
, http://www.100md.com
讨论
端粒为真核细胞线性染色体末端的一种特异序列,由重复排列的六核苷酸5'-TTAGGG-3'组成[1-3]。端粒长度被认为是细胞的“有丝分裂钟”,正常体细胞由于末端复制问题,端粒随着细胞分裂而进行性缩短,以致不能维持染色体的稳定使细胞衰老死亡。端粒长度的维持需要端粒酶的激活,而该酶在正常组织中,只在生长速度很快的胚胎、骨髓和生殖等细胞中才能检测到,而在大多数功能特化了的体细胞中检测不到。正常体细胞分裂一定数目后逐渐老化,肿瘤细胞由于端粒酶激活维持了端粒的长度使细胞获得永生。国外学者的研究表明,绝大部分的肿瘤呈端粒酶阳性。Shay和Gazdar[4]总结了大样本的正常组织(196例)、原位癌(410例)、恶性肿瘤(2 031例)和癌旁组织(690例)中端粒酶阳性率分别为0.5%、30.0%、85.0%和11.0%。本实验检测到的大鼠舌鳞癌和原位癌的端粒酶阳性率分别为93.8%和72.7%。另外,细胞内除端粒酶外,还存在其他的调节端粒长度的因子,如端粒结合蛋白、端粒结构等。端粒酶本身的激活受一些因子的调控,端粒酶RNA(hTR)基因的激活和端粒酶抑制基因的失活等,在一些生物细胞及人的肿瘤细胞中也发现了非端粒酶依赖性端粒维持方式。这可以解释为什么不是所有的肿瘤组织中都有端粒酶的活性。
, http://www.100md.com
端粒酶的激活发生在癌变过程的哪个阶段是否能作为诊断肿瘤的指标?这是人们普遍感兴趣的问题。Bednarek等[5]通过对DMBA+TPA诱导小鼠乳头状上皮瘤发生发展过程的研究发现,端粒酶阳性率随肿瘤发展过程而提高。临床上,Yashima等[6]也发现肺多步骤癌变过程中支气管上皮端粒酶阳性率呈进行性增加:正常26%、过度增生71%、化生80%、异常增生82%、原位癌100%;正常、癌前、原位癌支气管上皮端粒酶相对水平较低,约0.2~0.6 U/μg蛋白,而发展成侵袭性癌时端粒酶水平则显著提高,达34.0 U/μg蛋白。与此相反,Mao等[2]则在对头颈鳞癌端粒酶活性检测中发现,正常和过度角化组织无端粒酶活性表达,过度增生和异常增生组织端粒酶100%呈阳性,侵袭性癌时只有90%为阳性,提示端粒酶的激活可能发生在肿瘤形成的早期。本研究观察到的大鼠舌癌变组织端粒酶活性变化:正常粘膜(0.0%);单纯性增生(12.5%);轻中度异常增生(25.0%);重度异常增生(66.7%);原位癌(72.7%);鳞癌(93.8%),呈逐步增加趋势。与Mutirangura等[3]报道的87.5%(14/16)头颈鳞癌和38.5%(10/26)口腔白斑呈端粒酶阳性结果相似。综合各家报道,端粒酶在肿瘤发生及发展过程中的激活阶段不一致可能与肿瘤类型、部位、生物学特性不同有关。有学者收集口腔冲洗液中的脱落细胞测定端粒酶活性,将其作为无创诊断的指标取得了一定进展。我们相信,随着端粒酶研究的深入,人们对端粒酶是否作为肿瘤确诊的指标会有更正确的认识。
, http://www.100md.com
本研究发现,在大鼠舌粘膜上皮单纯性增生、异常增生病变中有一些组织端粒酶阳性。这意味着在组织病理学上认为是非癌的组织中存在着一定数量的具有癌变潜能的“永生化”细胞,这可以解释本研究中4NQO作用13周,致大鼠舌粘膜上皮单纯性增生、异常增生后停药而继续观察至32周时相继出现癌变。所以,对这群组织学上看不到的“永生化”细胞,应引起足够的重视。端粒酶活性检测为预测癌前病变的癌变潜能和指导临床治疗提供了较可靠的方法。
在方法学上,Kim等[1]于1994年首先应用PCR-TRAP法检测端粒酶活性,大幅度提高了灵敏度,可检测到104个细胞中的1个不死性细胞,但存在同位素污染的弊端。如果用溴化乙锭(EB)染色,则其灵敏度已不够。因此本研究将银染方法用于PCR-TRAP的标记染色,既解决了同位素的放射性污染问题,又比EB的灵敏度高,另外,硝酸银染色仅在可见光下可观察,实验结果还可经凝胶干燥后长期保存,但该法仅能定性。因此,笔者又尝试了PCR-TRAP ELISA定量方法,与银染法相比,结果证实其特异、敏感、简便、快速,本组中有1例重度异常增生组织PCR-TRAP银染显示扩增的相差6 bp的梯度条带模糊,不能确定是否为阳性,经ELISA法检测其A值为0.77,确为阳性。另外,ELISA法可在96孔板中同时进行,便于大量检测。
, 百拇医药
既然端粒酶特异性地表达于各种肿瘤细胞,又是肿瘤细胞无限增殖能力所必需,而且目前认为端粒酶活性增高可能是细胞通向癌变最后的、唯一的旁路。各种端粒酶抑制剂反义核苷酸、反义肽苷酸,硫代反义肽苷酸、核酶、核苷类似物、分化诱导剂等应运而生,但所有这些尚无突破性进展。相信随着端粒酶组份的成功分离、对端粒酶的动力学和调控机制认识的进一步加深,端粒酶有望成为恶性肿瘤治疗的理想的新靶点。
基金项目:国家自然科学基金资助项目(39670787)
参考文献
1.Kim NW, Piatyszek MA, Prowse KR, et al. Specific association of human telomerase activity with immortal cells and cancer. Science, 1994, 266:2 011-2 014.
, 百拇医药
2.Mao L, El-Naggar AK, Fan YK, et al. Telomerase activity in head and neck squamous cell carcinoma and adjacent tissues. Cancer Res, 1996,56:5 600-5 605.
3.Mutirangura A, Supiyaphun P, Trirekapan S, et al. Telomerase activity in oral leukoplakia and head and neck squamous cell carcinoma. Cancer Res, 1996,56:3 530- 3 533.
4.Shay JW, Gazdar AF. Telomerase in the early detection of cancer. J Clin Pathol, 1997,50: 106-109.
, http://www.100md.com
5.Bednarek A, Budunova I, Slaga TJ, et al. Increased telomerase activity in mouse skin premalignant progression. Cancer Res, 1995,55:4 566-4 569.
6.Yashima K, Litzky LA, Kaiser L, et al. Telomerase expression in respiratory epithelium during the multistage pathogenesis of lung carcinomas. Cancer Res, 1997,57:2 373-2 377.
(收稿日期:1999-11-11), 百拇医药