急性心肌梗死患者脂蛋白(a)和凝血纤溶活性的关系以及尿激酶溶栓治疗对其影响
急性心肌梗死患者脂蛋白(a)和凝血纤溶活性的关系以及尿激酶溶栓治疗对其影响
迟东升 吾柏铭 洪小苏 余荣水 靳风霞
摘 要 目的:观察急性心肌梗死(AMI)患者脂蛋白的(a)[LP(a)]与凝血和纤溶功能的关系以及尿激酶溶栓治疗对其影响。方法:采用酶联免疫吸附双抗体夹心法(ELISA)检测20例AMI、30例稳定型心绞痛(SAP)、8例不稳定型心绞痛(UAP)患者和20例健康人以及AMI溶栓后的血清LP(a)、血浆D-二聚体(DD)、纤维蛋白单体(FM)和组织型纤溶酶原激活剂(t-PA)浓度。结果:AMI、UAP和SAP患者的LP(a)、DD和FM较对照组明显增高,而t-PA明显降低(P<0.01);AMI合并心衰、心源性休克和严重心律失常以及梗死面积较大者的LP(a)、DD和FM均显著增高,t-PA下降。AMI溶栓后梗死相关动脉(IRA)再通者的FM和LP(a)明显下降,DD和t-PA在早期明显升高。未溶栓组的LP(a)与DD呈正相关(r=0.47,P<0.01),与t-PA呈负相关(r=0.52,P<0.01)。溶栓未通组的LP(a)与DD呈正相关(r=0.38,P<0.01)。溶栓再通组的LP(a)与t-PA呈正相关(r=0.37,P<0.05)。结论:冠心病患者,特别是急性心肌缺血患者体内存在凝血活性增强,纤溶活性下降,与升高的LP(a)一起可加重其病理生理过程。尿激酶(UK)溶栓治疗对AMI患者可产生有利的影响,能在一定程度上纠正凝血和纤溶功能紊乱;AMI溶栓后早期出现DD和t-PA浓度明显升高可能提示IRA再通。
, 百拇医药
关键词:急性心肌梗死 冠心病 脂蛋白(a) D-二聚体 纤维蛋白单体 组织型纤溶酶原激活剂
近年来,凝血和纤溶系统的功能失调在冠心病(CHD)中的作用日益得到重视,并认为动脉粥样硬化(AS)斑块的产生和发展是由血栓形成或纤溶功能缺陷所导致的。脂蛋白(a)[LP(a)]具有致AS和血栓形成的双重作用,近年来已成为人们研究的热点,本文的目的旨在观察急性心肌梗死(AMI)患者的LP(a)含量和凝血、纤溶活性变化的临床意义以及尿激酶(UK)溶栓治疗对其影响。
1 材料与方法
1.1 对象
1.1.1 AMI组 1995年9月~1996年12月期间收入住院的病人20例,其中男16例,女4例,年龄54~82岁,平均67.2±7.0岁。均符合1979年WHO制定的AMI诊断标准。从胸痛出现至住院的时间分别为≤6 h者7例,7~12 h者2例,13~24 h者7例,>24 h者4例。其中前壁、前壁伴下壁、前间壁伴下壁、前间壁伴右室、高侧壁和正后壁MI各1例,下壁伴右室MI 2例,前间壁、心内膜下MI各3例,下壁伴正后壁MI 6例。
, 百拇医药
1.1.2 不稳定型心绞痛(UAP)组 同期入院的符合WHO诊断标准的UAP患者8例,男7例,女1例,年龄51~72岁,平均66.1±5.6岁。其中初发或恶化劳累型AP 5例,MI后AP 1例,混合性AP 2例。
1.1.3 稳定型心绞痛(SAP)组 同期入院的符合WHO诊断标准的30例SAP病人,男18例,女12例,年龄42~85岁,平均65.2±11.6岁。
1.1.4 健康对照组(Normal Controls) 为门诊健康体检者,经全面体检、ECG、X-胸片、UCG以及血液生化检查未发现异常者20例,其中男16例,女4例,年龄49~68岁,平均63.4±6.2岁。近2周内未服用影响血液凝血和纤溶功能的药物。
1.2 治疗方法和判断标准
1.2.1 给药方法 自出现胸痛到入院时间小于24 h,无溶栓禁忌症,入院时仍有胸痛和心电图ST段抬高的AMI患者,给予UK(南京大学生物制药厂生产)50万U加入生理盐水20 ml中稀释后缓慢静注,随即50万U加入生理盐水100 ml中静滴,30分钟内滴完。AMI溶栓治疗开始后的一周内未用抗凝药物和抗血小板聚集药物治疗。
, http://www.100md.com
1.2.2 梗死相关动脉(IRA)再通判断标准 根据《中华心血管病杂志》编委会制定的“急性心肌梗死溶栓疗法参考方案”中的冠状动脉再通间接指征判定[1]。
1.3 实验方法
AMI组入院后未给溶栓药物前采即血标本,UK溶栓后1、3、6、12、24 h,第3、5、7天各采血一次。UAP、SAP组和健康对照组晨起空腹取血一次。采用塑料注射器一次取外周静脉血6 ml,分别取1.8 ml注入备有5.58%EDTA-Na2和6-氨基己酸各0.1 ml的塑料试管中,以3 000 r/min离心15 min,分别取上层血浆和血清,用于血浆纤维蛋白单体(FM)、D-二聚体(DD)和组织型纤溶酶原激活剂(t-PA),以及血清LP(a)浓度测定。标本置-30℃冰箱中保存备用。均采用酶联免疫吸附双抗体夹心法(ELISA)测定。试剂盒购自福建太阳生物技术公司,严格按其说明书介绍的实验方法操作。
, 百拇医药
1.4 统计处理方法
应用SPSS/PC+统计软件包进行统计处理,数据以均数±标准差(x±s)表示,组间资料比较用t检验、方差分析和相关分析。
2 结果
2.1 AMI、UAP、SAP患者的LP(a)含量和凝血、纤溶指标的比较
结果显示入院时AMI患者的DD、FM、LP(a)浓度最高,其次为UAP、SAP,与对照组比较有显著差异。t-PA含量与上述指标相反,见表1。血清LP(a)浓度≥25 mg/d1者,AMI组为60%(12/20),UAP组为37.5%(3/8),SAP组为16.7%(5/30),对照组均小于此值。
表1 AMI、UAP、SAP患者的LP(a)、DD、FM、t-PA含量比较(x±s)
, 百拇医药
n
LP(a)(mg/d1)
DD(mg/d1)
FM(ng/μl)
t-PA(ng/ml)
AMI
20
33.5±11.3*#++
29.2±10.5*#++
8.5±1.1*#+
, http://www.100md.com
0.58±0.10*#++
UAP
8
23.4±2.5*#
16.9±5.2*#
7.4±1.7*#
0.93±0.16*#
SAP
30
15.9±5.2*
, 百拇医药
5.7±2.6
5.6±1.6*
1.25±0.07*
Control
20
4.8±1.5
2.6±1.0
1.3±0.5
1.86±0.23
*P<0.01 vs Control,#P<0.01 vs SAP,+P<0.05,++P<0.01 vs UAP
, 百拇医药 2.2 AMI经UK溶栓治疗后,IRA再通组、未通组与未溶栓组之间的LP(a)含量和凝血、纤溶指标的比较
本组有12例AMI患者给予UK溶栓治疗,判定再通者7例,未通者5例,未溶栓者8例。再通者溶栓距发病平均为5.1±3.9 h,>6 h者2例(8.5 h和12 h);未通者距发病平均为12.2±7.6 h,有3例>6 h(12 h、14 h和24 h)。结果显示:IRA再通组和未通组溶栓前的LP(a)和FM水平分别为15.6±3.2 mg/d1 vs 21.2±3.6 mg/d1和7.6±0.6 ng/μl vs 8.7±0.7 ng/μl,有显著差异;再通组的LP(a)较未通组和未溶栓组显著下降,但6 h后再次升高,直到第三天后才开始下降。溶栓组的FM显著下降,但再通组更为明显,12 h后3组均开始再次升高,并持续在较高水平。再通组溶栓后3 h,DD浓度达峰值,是溶栓前的10 倍,24 h后恢复到溶栓前水平,未通组有类似的变化,但幅度较小,未溶栓组的DD发病12 h后开始升高,与溶栓组比较差异显著。溶栓后再通组的t-PA浓度明显升高,6 h达峰值,是溶栓前的近2倍,此后开始下降,24 h后再次升高,较未通组和未溶栓组持续显著增高;未通组溶栓后的t-PA呈持续性下降,未溶栓组t-PA变化较小。结果见图1~4。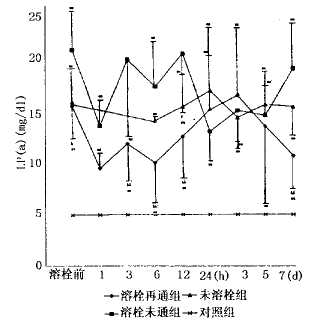
, http://www.100md.com
图1 AMI溶栓后IRA再通组、未通组和未溶栓组血清LP(a)动态变化比较
*P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs未溶栓组;&P<0.05,&&P<0.01 vs溶栓未通组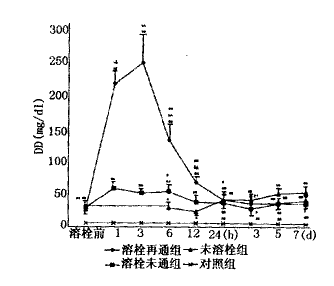
图2 AMI溶栓后IRA再通组、未通组和未溶栓组血浆DD动态变化比较
*P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs未溶栓组;&P<0.05,&&P<0.01 vs溶栓未通组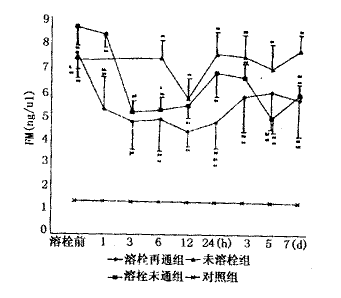
, 百拇医药
图3 AMI溶栓后IRA再通组、未通组和未溶栓组血浆FM动态变化比较
*P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs未溶栓组;&P<0.05,&&P<0.01 vs溶栓未通组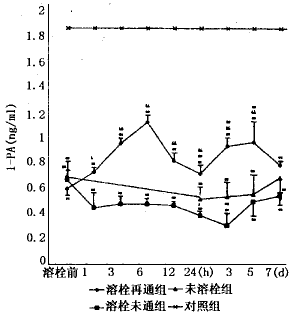
图4 AMI溶栓后IRA再通组、未通组和未溶栓组血浆t-PA动态变化比较*P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs未溶栓组;&P<0.05,&&P<0.01 vs溶栓未通组
2.3 AMI患者LP(a)与凝血、纤溶指标之间的关系
未溶栓组的LP(a)与DD呈正相关(r=0.47,P<0.01),与t-PA呈负相关(r=-0.52,P<0.01)。溶栓未通组的LP(a)与DD呈正相关(r=0.38,P<0.01)。溶栓再通组的LP(a)与t-PA呈正相关(r=0.37,P<0.05)。
, http://www.100md.com
2.4 LP(a)、凝血和纤溶指标的峰值浓度与AMI梗死面积的关系
本组一处梗死者6例(Ⅰ组),两处梗死者14例(含心内膜下MI,Ⅱ组)。显示除LP(a)外,其它测值的峰值两者间均有显著差异,见表2。
表2 LP(a)、DD、FM、t-PA的峰值浓度与AMI梗死面积的关系(x±s)
n
LP(a)(mg/d1)
DD(mg/d1)
FM(ng/μl)
t-PA(ng/ml)
Ⅰ组
, 百拇医药
6
40.6±19.9
77.5±27.3*
5.3±1.6*
3.7±1.2*
Ⅱ组
14
39.3±16.5
306.4±91.6
8.8±1.4
1.2±0.4
, 百拇医药 *P<0.001 vs Ⅱ组
2.5 LP(a)、凝血和纤溶指标的峰值浓度与AMI并发症的关系
本组20例AMI中,出现心源性休克或严重心衰(Killip心功能Ⅲ级以上)7例,死亡3例(死因均为心源性休克),严重心律失常(包括Ⅲ°AVB,短阵室速)8例,无上述并发症者7例。结果显示LP(a)、DD、FM的浓度峰值有并发症者较无并发症者明显升高,t-PA峰值明显下降,结果见表3。
表3 LP(a)、DD、FM、t-PA的峰值浓度与AMI并发症的关系(x±s)
n
LP(a)(mg/dl)
DD(mg/dl)
, 百拇医药
FM(ng/μl)
t-PA(ng/ml)
心衰、休克
7
43.9±16.3*
345.0±83.8**
7.8±1.7**
1.0±0.3**
死亡
3
51.4±11.7*
, 百拇医药
219.0±69.1**
8.7±2.7**
0.7±0.1**
心律失常
8
46.7±11.3*
406.4±42.8**
10.5±1.8**
1.2±0.3**
无并发症
, 百拇医药
7
30.3±9.1
96.5±28.0
4.6±1.5
2.7±0.4
*P<0.05 **P<0.01 vs无并发症组
3 讨论
LP(a)是一种由低密度脂蛋白(LDL)、载脂蛋白(a)[apo(a)]和载脂蛋白B-100(apoB-100)组成的特殊脂蛋白,具有致AS和血栓形成的双重作用,其中的apo(a)与纤溶酶原(Plg)有部分同源性。
本组结果显示LP(a)浓度随CHD的严重程度增加而显著升高,AMI组最高,其次为UAP、SAP,均较对照组显著升高;LP(a)≥25 mg/dl者,AMI组为60%,UAP组为37.5%,SAP组为16.7%。与Terres等[2]的结果近似,表明LP(a)参与了冠状动脉(CA)AS的发生和发展。LP(a)致AS的机制为:①apo(a)可减少或阻滞β转移生长因子(TGF-β)和纤溶酶(Plm)的生成,从而刺激平滑肌细胞分裂和增生[3];②LP(a)可选择性地在病变组织的动脉壁中聚集,沉积在AS斑块中的LP(a)颗粒,部分退变为LDL样颗粒和自由的apo(a);③LP(a)通过与纤维蛋白(Fb)结合,将胆固醇(TC)运送至受损血管处,透过动脉内皮积聚在内膜下,以原颗粒apoB-100和apo(a)复合物或自由apo(a)的形式积聚在细胞基质,然后与氨基葡聚糖、蛋白多糖或纤维素形成复合物或通过氧化发生结构变化,这些经过修饰的LP(a)就更易被巨噬细胞吞噬而形成泡沫细胞,最终导致AS形成;④LP(a)与Fb结合后还可刺激粥样斑块的生长[4]。
, http://www.100md.com
CHD的发病与凝血和纤溶系统的功能失调密切相关。血栓形成是由内、外源性凝血系统的激活或纤溶系统的功能缺陷所导致的。凝血反应的最后阶段是纤维蛋白原(Fg)在凝血酶(Tb)的作用下形成Fb;Fb是血栓的主要结构成份,也是构成血栓的其它细胞和血液成分的网架;Fg经Tb作用后,释放出纤维蛋白肽A(FPA)和肽B(FPB)之后,形成的FM可以自然聚合,并在因子XⅢa作用下,形成交联纤维蛋白(CLFb)。t-PA是纤溶的主要生理激活剂,能激活Fb血凝块上的Plg,生成Plm,Plm可使CLFb降解而产生DD[5]。由此可见,FM升高是体内Tb形成的标志,表明凝血活性增强;DD升高一方面表明体内凝血活动增强,同时也反映了继发性的纤溶活动增强,而t-PA和UK可激活Plg生成Plm,促进血栓的溶解。
本研究的结果显示,CHD患者血浆FM、DD浓度较对照组显著升高,而t-PA浓度明显降低,且与疾病的严重程度有密切联系,高LP(a)和FM血症的AMI患者溶栓后的再通率明显减低;AMI合并心源性休克,心衰和严重心律失常者,以及梗死面积较大者的LP(a)、FM和DD浓度明显升高,t-PA浓度明显降低。Vaziri等[6]的研究与本文结果一致。可见,CHD患者,特别是急性心肌缺血患者体内存在凝血活性增强,原发性纤溶活性减低,与升高的LP(a)一起导致CA内血栓形成,继而造成心肌缺血,诱发心律失常和心源性休克,加重心衰,并可使AMI的梗死面积扩展。因此,降低LP(a)浓度、抗凝和增加体内纤溶活性的治疗措施在急性心肌缺血中有着非常重要的价值。
, http://www.100md.com
此外,本组AMI未溶栓组和溶栓未通组的LP(a)与DD正相关,溶栓未通组的LP(a)与t-PA呈负相关,提示LP(a)可能促进血栓形成并抑制纤溶活性。其机制可能为:①直接减少血管内皮细胞(EC)分泌t-PA,抑制t-PA、UK、链激酶介导的纤溶作用[7];②干扰Plg转变为Plm,使Plm生成减少,减弱血凝块的溶解;③抑制或与Plg竞争同Fg、Fb及其降解产物、血小板、EC、巨噬细胞上的Plg受体的结合,产生高凝状态和血栓形成前状态;④增强α2—抗纤溶酶对纤溶酶的抑制;⑤参与调节EC合成1型纤溶酶原激活剂抑制物(PAI-1)[4,8]。
AMI后尽早恢复心肌血供是治疗的关键。因此早期溶栓治疗显得特别重要。本实验结果显示溶栓后IRA再通组的LP(a)和FM浓度较未通组和溶栓组有显著的下降,DD和t-PA浓度均于溶栓后迅速升高,分别是溶栓前的10倍和近2倍。溶栓未通组上述指标较未溶栓组也有一定程度的改善。本文结果说明,AMI溶栓治疗,即使对IRA未通的病人,也可对机体产生有利的影响,而IRA再通者的凝血活性明显下降,纤溶活性明显升高。AMI溶栓后早期如有DD和t-PA浓度的显著升高,可能提示IRA再通。本组AMI溶栓早期LP(a)和FM浓度开始升高,并持续在较高水平,IRA再通组的LP(a)与t-PA正相关,提示在t-PA升高的同时,伴有LP(a)的升高,Goto等[9]的研究也证实了上述结果。表明UK溶栓后早期即有继发性凝血活性和抗纤溶物质的增加,因此溶栓后早期辅以抗凝治疗就显得特别重要。
, 百拇医药
本文结果表明,CHD患者,特别是急性心肌缺血患者体内的LP(a)浓度显著升高,并伴有凝血和纤溶功能失调。AMI伴并发症者的LP(a)浓度和凝血活性显著增高,纤溶活性显著下降。LP(a)与凝血活性正相关,与纤溶活性负相关。LP(a)和FM浓度升高可明显降低IRA再通率。AMI溶栓后早期出现DD和t-PA浓度明显升高可能提示IRA再通。
作者单位:迟东升(山东泰安解放军88医院心内科,271000)
吾柏铭(苏州医学院第二附属医院心内科)
洪小苏(苏州医学院第二附属医院心内科)
余荣水(苏州医学院第二附属医院心内科)
靳风霞(山东省泰山慢性病医院)
参考文献
, 百拇医药
[1]中华心血管杂志编委会.急性心肌梗死溶栓疗法参考方案[J].中华心血管病杂志,1991,19:137-138.
[2]Terres W,Tatsis E,Pfalzer B,et al.Rapid angiographic progression of coronary artery disease in patients with elevated lipoprotein(a)[J].Circulation,1995,91(4):948-950.
[3]Harpel PC,Hermann A,Zhang X,et al.Lipoprotein(a),plasmin modulation,and atherogenesis[J].Thromb Haemost,1995,74(1):382-386.
[4]Scanu AM.Lipoprotein(a).a genetic risk factor for premture coronary heart disease[J].JAMA,1992,267:3326-3329.
, 百拇医药
[5]迟东升,吾柏铭.D-二聚体在心血管疾病中的应用价值[J].心血管病学进展,1998,19(1):18-20.
[6]Vaziri ND,Kennedy SC,Kennnedy D,et al.Coagulation,fibrinolytic,and inhibitory proteins in acute myocardial infarction and angina pectoris[J].Am J Med,1992,93(6):651-657.
[7]Hajjar KA,Gavish D,Breslow JL,et al.Lipoprotein(a) modulation of endothelial cell surface fibrinolysis and its potential role in atherosclerosis[J].Nature,1989,339:303-305.
, http://www.100md.com
[8]Etingin OR,Najjar DP,Hajjar KA,et al.Lipoprotein(a) regulates plasminogen activator inhibitor-1 expression in endothelial cells.A potential mechanism in thrombogenesis[J].J Biol Chem,1991,266(4):2459-2465.
[9]Goto S,Kawai Y,Handa S,et al.Prolonged activation of fibrinolytic system induced fibrin nonselective thrombolytic agent can contribute to preventing early reocclusion after coronary thrombolytic therapy[J].Cardiology,1993,82(4):274-279., 百拇医药
迟东升 吾柏铭 洪小苏 余荣水 靳风霞
摘 要 目的:观察急性心肌梗死(AMI)患者脂蛋白的(a)[LP(a)]与凝血和纤溶功能的关系以及尿激酶溶栓治疗对其影响。方法:采用酶联免疫吸附双抗体夹心法(ELISA)检测20例AMI、30例稳定型心绞痛(SAP)、8例不稳定型心绞痛(UAP)患者和20例健康人以及AMI溶栓后的血清LP(a)、血浆D-二聚体(DD)、纤维蛋白单体(FM)和组织型纤溶酶原激活剂(t-PA)浓度。结果:AMI、UAP和SAP患者的LP(a)、DD和FM较对照组明显增高,而t-PA明显降低(P<0.01);AMI合并心衰、心源性休克和严重心律失常以及梗死面积较大者的LP(a)、DD和FM均显著增高,t-PA下降。AMI溶栓后梗死相关动脉(IRA)再通者的FM和LP(a)明显下降,DD和t-PA在早期明显升高。未溶栓组的LP(a)与DD呈正相关(r=0.47,P<0.01),与t-PA呈负相关(r=0.52,P<0.01)。溶栓未通组的LP(a)与DD呈正相关(r=0.38,P<0.01)。溶栓再通组的LP(a)与t-PA呈正相关(r=0.37,P<0.05)。结论:冠心病患者,特别是急性心肌缺血患者体内存在凝血活性增强,纤溶活性下降,与升高的LP(a)一起可加重其病理生理过程。尿激酶(UK)溶栓治疗对AMI患者可产生有利的影响,能在一定程度上纠正凝血和纤溶功能紊乱;AMI溶栓后早期出现DD和t-PA浓度明显升高可能提示IRA再通。
, 百拇医药
关键词:急性心肌梗死 冠心病 脂蛋白(a) D-二聚体 纤维蛋白单体 组织型纤溶酶原激活剂
近年来,凝血和纤溶系统的功能失调在冠心病(CHD)中的作用日益得到重视,并认为动脉粥样硬化(AS)斑块的产生和发展是由血栓形成或纤溶功能缺陷所导致的。脂蛋白(a)[LP(a)]具有致AS和血栓形成的双重作用,近年来已成为人们研究的热点,本文的目的旨在观察急性心肌梗死(AMI)患者的LP(a)含量和凝血、纤溶活性变化的临床意义以及尿激酶(UK)溶栓治疗对其影响。
1 材料与方法
1.1 对象
1.1.1 AMI组 1995年9月~1996年12月期间收入住院的病人20例,其中男16例,女4例,年龄54~82岁,平均67.2±7.0岁。均符合1979年WHO制定的AMI诊断标准。从胸痛出现至住院的时间分别为≤6 h者7例,7~12 h者2例,13~24 h者7例,>24 h者4例。其中前壁、前壁伴下壁、前间壁伴下壁、前间壁伴右室、高侧壁和正后壁MI各1例,下壁伴右室MI 2例,前间壁、心内膜下MI各3例,下壁伴正后壁MI 6例。
, 百拇医药
1.1.2 不稳定型心绞痛(UAP)组 同期入院的符合WHO诊断标准的UAP患者8例,男7例,女1例,年龄51~72岁,平均66.1±5.6岁。其中初发或恶化劳累型AP 5例,MI后AP 1例,混合性AP 2例。
1.1.3 稳定型心绞痛(SAP)组 同期入院的符合WHO诊断标准的30例SAP病人,男18例,女12例,年龄42~85岁,平均65.2±11.6岁。
1.1.4 健康对照组(Normal Controls) 为门诊健康体检者,经全面体检、ECG、X-胸片、UCG以及血液生化检查未发现异常者20例,其中男16例,女4例,年龄49~68岁,平均63.4±6.2岁。近2周内未服用影响血液凝血和纤溶功能的药物。
1.2 治疗方法和判断标准
1.2.1 给药方法 自出现胸痛到入院时间小于24 h,无溶栓禁忌症,入院时仍有胸痛和心电图ST段抬高的AMI患者,给予UK(南京大学生物制药厂生产)50万U加入生理盐水20 ml中稀释后缓慢静注,随即50万U加入生理盐水100 ml中静滴,30分钟内滴完。AMI溶栓治疗开始后的一周内未用抗凝药物和抗血小板聚集药物治疗。
, http://www.100md.com
1.2.2 梗死相关动脉(IRA)再通判断标准 根据《中华心血管病杂志》编委会制定的“急性心肌梗死溶栓疗法参考方案”中的冠状动脉再通间接指征判定[1]。
1.3 实验方法
AMI组入院后未给溶栓药物前采即血标本,UK溶栓后1、3、6、12、24 h,第3、5、7天各采血一次。UAP、SAP组和健康对照组晨起空腹取血一次。采用塑料注射器一次取外周静脉血6 ml,分别取1.8 ml注入备有5.58%EDTA-Na2和6-氨基己酸各0.1 ml的塑料试管中,以3 000 r/min离心15 min,分别取上层血浆和血清,用于血浆纤维蛋白单体(FM)、D-二聚体(DD)和组织型纤溶酶原激活剂(t-PA),以及血清LP(a)浓度测定。标本置-30℃冰箱中保存备用。均采用酶联免疫吸附双抗体夹心法(ELISA)测定。试剂盒购自福建太阳生物技术公司,严格按其说明书介绍的实验方法操作。
, 百拇医药
1.4 统计处理方法
应用SPSS/PC+统计软件包进行统计处理,数据以均数±标准差(x±s)表示,组间资料比较用t检验、方差分析和相关分析。
2 结果
2.1 AMI、UAP、SAP患者的LP(a)含量和凝血、纤溶指标的比较
结果显示入院时AMI患者的DD、FM、LP(a)浓度最高,其次为UAP、SAP,与对照组比较有显著差异。t-PA含量与上述指标相反,见表1。血清LP(a)浓度≥25 mg/d1者,AMI组为60%(12/20),UAP组为37.5%(3/8),SAP组为16.7%(5/30),对照组均小于此值。
表1 AMI、UAP、SAP患者的LP(a)、DD、FM、t-PA含量比较(x±s)
, 百拇医药
n
LP(a)(mg/d1)
DD(mg/d1)
FM(ng/μl)
t-PA(ng/ml)
AMI
20
33.5±11.3*#++
29.2±10.5*#++
8.5±1.1*#+
, http://www.100md.com
0.58±0.10*#++
UAP
8
23.4±2.5*#
16.9±5.2*#
7.4±1.7*#
0.93±0.16*#
SAP
30
15.9±5.2*
, 百拇医药
5.7±2.6
5.6±1.6*
1.25±0.07*
Control
20
4.8±1.5
2.6±1.0
1.3±0.5
1.86±0.23
*P<0.01 vs Control,#P<0.01 vs SAP,+P<0.05,++P<0.01 vs UAP
, 百拇医药 2.2 AMI经UK溶栓治疗后,IRA再通组、未通组与未溶栓组之间的LP(a)含量和凝血、纤溶指标的比较
本组有12例AMI患者给予UK溶栓治疗,判定再通者7例,未通者5例,未溶栓者8例。再通者溶栓距发病平均为5.1±3.9 h,>6 h者2例(8.5 h和12 h);未通者距发病平均为12.2±7.6 h,有3例>6 h(12 h、14 h和24 h)。结果显示:IRA再通组和未通组溶栓前的LP(a)和FM水平分别为15.6±3.2 mg/d1 vs 21.2±3.6 mg/d1和7.6±0.6 ng/μl vs 8.7±0.7 ng/μl,有显著差异;再通组的LP(a)较未通组和未溶栓组显著下降,但6 h后再次升高,直到第三天后才开始下降。溶栓组的FM显著下降,但再通组更为明显,12 h后3组均开始再次升高,并持续在较高水平。再通组溶栓后3 h,DD浓度达峰值,是溶栓前的10 倍,24 h后恢复到溶栓前水平,未通组有类似的变化,但幅度较小,未溶栓组的DD发病12 h后开始升高,与溶栓组比较差异显著。溶栓后再通组的t-PA浓度明显升高,6 h达峰值,是溶栓前的近2倍,此后开始下降,24 h后再次升高,较未通组和未溶栓组持续显著增高;未通组溶栓后的t-PA呈持续性下降,未溶栓组t-PA变化较小。结果见图1~4。

, http://www.100md.com
图1 AMI溶栓后IRA再通组、未通组和未溶栓组血清LP(a)动态变化比较
*P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs未溶栓组;&P<0.05,&&P<0.01 vs溶栓未通组

图2 AMI溶栓后IRA再通组、未通组和未溶栓组血浆DD动态变化比较
*P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs未溶栓组;&P<0.05,&&P<0.01 vs溶栓未通组

, 百拇医药
图3 AMI溶栓后IRA再通组、未通组和未溶栓组血浆FM动态变化比较
*P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs未溶栓组;&P<0.05,&&P<0.01 vs溶栓未通组

图4 AMI溶栓后IRA再通组、未通组和未溶栓组血浆t-PA动态变化比较*P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs未溶栓组;&P<0.05,&&P<0.01 vs溶栓未通组
2.3 AMI患者LP(a)与凝血、纤溶指标之间的关系
未溶栓组的LP(a)与DD呈正相关(r=0.47,P<0.01),与t-PA呈负相关(r=-0.52,P<0.01)。溶栓未通组的LP(a)与DD呈正相关(r=0.38,P<0.01)。溶栓再通组的LP(a)与t-PA呈正相关(r=0.37,P<0.05)。
, http://www.100md.com
2.4 LP(a)、凝血和纤溶指标的峰值浓度与AMI梗死面积的关系
本组一处梗死者6例(Ⅰ组),两处梗死者14例(含心内膜下MI,Ⅱ组)。显示除LP(a)外,其它测值的峰值两者间均有显著差异,见表2。
表2 LP(a)、DD、FM、t-PA的峰值浓度与AMI梗死面积的关系(x±s)
n
LP(a)(mg/d1)
DD(mg/d1)
FM(ng/μl)
t-PA(ng/ml)
Ⅰ组
, 百拇医药
6
40.6±19.9
77.5±27.3*
5.3±1.6*
3.7±1.2*
Ⅱ组
14
39.3±16.5
306.4±91.6
8.8±1.4
1.2±0.4
, 百拇医药 *P<0.001 vs Ⅱ组
2.5 LP(a)、凝血和纤溶指标的峰值浓度与AMI并发症的关系
本组20例AMI中,出现心源性休克或严重心衰(Killip心功能Ⅲ级以上)7例,死亡3例(死因均为心源性休克),严重心律失常(包括Ⅲ°AVB,短阵室速)8例,无上述并发症者7例。结果显示LP(a)、DD、FM的浓度峰值有并发症者较无并发症者明显升高,t-PA峰值明显下降,结果见表3。
表3 LP(a)、DD、FM、t-PA的峰值浓度与AMI并发症的关系(x±s)
n
LP(a)(mg/dl)
DD(mg/dl)
, 百拇医药
FM(ng/μl)
t-PA(ng/ml)
心衰、休克
7
43.9±16.3*
345.0±83.8**
7.8±1.7**
1.0±0.3**
死亡
3
51.4±11.7*
, 百拇医药
219.0±69.1**
8.7±2.7**
0.7±0.1**
心律失常
8
46.7±11.3*
406.4±42.8**
10.5±1.8**
1.2±0.3**
无并发症
, 百拇医药
7
30.3±9.1
96.5±28.0
4.6±1.5
2.7±0.4
*P<0.05 **P<0.01 vs无并发症组
3 讨论
LP(a)是一种由低密度脂蛋白(LDL)、载脂蛋白(a)[apo(a)]和载脂蛋白B-100(apoB-100)组成的特殊脂蛋白,具有致AS和血栓形成的双重作用,其中的apo(a)与纤溶酶原(Plg)有部分同源性。
本组结果显示LP(a)浓度随CHD的严重程度增加而显著升高,AMI组最高,其次为UAP、SAP,均较对照组显著升高;LP(a)≥25 mg/dl者,AMI组为60%,UAP组为37.5%,SAP组为16.7%。与Terres等[2]的结果近似,表明LP(a)参与了冠状动脉(CA)AS的发生和发展。LP(a)致AS的机制为:①apo(a)可减少或阻滞β转移生长因子(TGF-β)和纤溶酶(Plm)的生成,从而刺激平滑肌细胞分裂和增生[3];②LP(a)可选择性地在病变组织的动脉壁中聚集,沉积在AS斑块中的LP(a)颗粒,部分退变为LDL样颗粒和自由的apo(a);③LP(a)通过与纤维蛋白(Fb)结合,将胆固醇(TC)运送至受损血管处,透过动脉内皮积聚在内膜下,以原颗粒apoB-100和apo(a)复合物或自由apo(a)的形式积聚在细胞基质,然后与氨基葡聚糖、蛋白多糖或纤维素形成复合物或通过氧化发生结构变化,这些经过修饰的LP(a)就更易被巨噬细胞吞噬而形成泡沫细胞,最终导致AS形成;④LP(a)与Fb结合后还可刺激粥样斑块的生长[4]。
, http://www.100md.com
CHD的发病与凝血和纤溶系统的功能失调密切相关。血栓形成是由内、外源性凝血系统的激活或纤溶系统的功能缺陷所导致的。凝血反应的最后阶段是纤维蛋白原(Fg)在凝血酶(Tb)的作用下形成Fb;Fb是血栓的主要结构成份,也是构成血栓的其它细胞和血液成分的网架;Fg经Tb作用后,释放出纤维蛋白肽A(FPA)和肽B(FPB)之后,形成的FM可以自然聚合,并在因子XⅢa作用下,形成交联纤维蛋白(CLFb)。t-PA是纤溶的主要生理激活剂,能激活Fb血凝块上的Plg,生成Plm,Plm可使CLFb降解而产生DD[5]。由此可见,FM升高是体内Tb形成的标志,表明凝血活性增强;DD升高一方面表明体内凝血活动增强,同时也反映了继发性的纤溶活动增强,而t-PA和UK可激活Plg生成Plm,促进血栓的溶解。
本研究的结果显示,CHD患者血浆FM、DD浓度较对照组显著升高,而t-PA浓度明显降低,且与疾病的严重程度有密切联系,高LP(a)和FM血症的AMI患者溶栓后的再通率明显减低;AMI合并心源性休克,心衰和严重心律失常者,以及梗死面积较大者的LP(a)、FM和DD浓度明显升高,t-PA浓度明显降低。Vaziri等[6]的研究与本文结果一致。可见,CHD患者,特别是急性心肌缺血患者体内存在凝血活性增强,原发性纤溶活性减低,与升高的LP(a)一起导致CA内血栓形成,继而造成心肌缺血,诱发心律失常和心源性休克,加重心衰,并可使AMI的梗死面积扩展。因此,降低LP(a)浓度、抗凝和增加体内纤溶活性的治疗措施在急性心肌缺血中有着非常重要的价值。
, http://www.100md.com
此外,本组AMI未溶栓组和溶栓未通组的LP(a)与DD正相关,溶栓未通组的LP(a)与t-PA呈负相关,提示LP(a)可能促进血栓形成并抑制纤溶活性。其机制可能为:①直接减少血管内皮细胞(EC)分泌t-PA,抑制t-PA、UK、链激酶介导的纤溶作用[7];②干扰Plg转变为Plm,使Plm生成减少,减弱血凝块的溶解;③抑制或与Plg竞争同Fg、Fb及其降解产物、血小板、EC、巨噬细胞上的Plg受体的结合,产生高凝状态和血栓形成前状态;④增强α2—抗纤溶酶对纤溶酶的抑制;⑤参与调节EC合成1型纤溶酶原激活剂抑制物(PAI-1)[4,8]。
AMI后尽早恢复心肌血供是治疗的关键。因此早期溶栓治疗显得特别重要。本实验结果显示溶栓后IRA再通组的LP(a)和FM浓度较未通组和溶栓组有显著的下降,DD和t-PA浓度均于溶栓后迅速升高,分别是溶栓前的10倍和近2倍。溶栓未通组上述指标较未溶栓组也有一定程度的改善。本文结果说明,AMI溶栓治疗,即使对IRA未通的病人,也可对机体产生有利的影响,而IRA再通者的凝血活性明显下降,纤溶活性明显升高。AMI溶栓后早期如有DD和t-PA浓度的显著升高,可能提示IRA再通。本组AMI溶栓早期LP(a)和FM浓度开始升高,并持续在较高水平,IRA再通组的LP(a)与t-PA正相关,提示在t-PA升高的同时,伴有LP(a)的升高,Goto等[9]的研究也证实了上述结果。表明UK溶栓后早期即有继发性凝血活性和抗纤溶物质的增加,因此溶栓后早期辅以抗凝治疗就显得特别重要。
, 百拇医药
本文结果表明,CHD患者,特别是急性心肌缺血患者体内的LP(a)浓度显著升高,并伴有凝血和纤溶功能失调。AMI伴并发症者的LP(a)浓度和凝血活性显著增高,纤溶活性显著下降。LP(a)与凝血活性正相关,与纤溶活性负相关。LP(a)和FM浓度升高可明显降低IRA再通率。AMI溶栓后早期出现DD和t-PA浓度明显升高可能提示IRA再通。
作者单位:迟东升(山东泰安解放军88医院心内科,271000)
吾柏铭(苏州医学院第二附属医院心内科)
洪小苏(苏州医学院第二附属医院心内科)
余荣水(苏州医学院第二附属医院心内科)
靳风霞(山东省泰山慢性病医院)
参考文献
, 百拇医药
[1]中华心血管杂志编委会.急性心肌梗死溶栓疗法参考方案[J].中华心血管病杂志,1991,19:137-138.
[2]Terres W,Tatsis E,Pfalzer B,et al.Rapid angiographic progression of coronary artery disease in patients with elevated lipoprotein(a)[J].Circulation,1995,91(4):948-950.
[3]Harpel PC,Hermann A,Zhang X,et al.Lipoprotein(a),plasmin modulation,and atherogenesis[J].Thromb Haemost,1995,74(1):382-386.
[4]Scanu AM.Lipoprotein(a).a genetic risk factor for premture coronary heart disease[J].JAMA,1992,267:3326-3329.
, 百拇医药
[5]迟东升,吾柏铭.D-二聚体在心血管疾病中的应用价值[J].心血管病学进展,1998,19(1):18-20.
[6]Vaziri ND,Kennedy SC,Kennnedy D,et al.Coagulation,fibrinolytic,and inhibitory proteins in acute myocardial infarction and angina pectoris[J].Am J Med,1992,93(6):651-657.
[7]Hajjar KA,Gavish D,Breslow JL,et al.Lipoprotein(a) modulation of endothelial cell surface fibrinolysis and its potential role in atherosclerosis[J].Nature,1989,339:303-305.
, http://www.100md.com
[8]Etingin OR,Najjar DP,Hajjar KA,et al.Lipoprotein(a) regulates plasminogen activator inhibitor-1 expression in endothelial cells.A potential mechanism in thrombogenesis[J].J Biol Chem,1991,266(4):2459-2465.
[9]Goto S,Kawai Y,Handa S,et al.Prolonged activation of fibrinolytic system induced fibrin nonselective thrombolytic agent can contribute to preventing early reocclusion after coronary thrombolytic therapy[J].Cardiology,1993,82(4):274-279., 百拇医药