兔坐骨神经实验性电损伤后形态学变化
李学拥 陈 璧
摘要 目的:观察在不同损伤电压情况下,神经轴突超微结构的变化. 方法:在兔梨状肌以远分别用50,75,200 V交流电损伤3 cm坐骨神经,然后在1 wk,2 wk,1 mo,3 mo时切取神经组织标本在透射电镜下观察神经纤维超微结构变化. 结果:50 V损伤组2 wk时形态改变轻微,1 mo时神经结构恢复正常. 75 V损伤组2 wk时神经纤维损伤程度加重,1 mo时可见有新生纤维,3 mo时变性纤维数目减少,新生纤维结构趋于成熟. 200 V损伤组神经结构破坏严重,血管内血栓形成,胶原纤维含量增加. 观察3 mo时仍无再生纤维出现. 结论:神经纤维超微结构随着损伤电压的增加破坏加大,神经内纤维化加重,使神经再生受阻.
关键词:电损伤 神经纤维/超微结构 兔
引言
周围神经系统电损伤后的形态学改变是感觉运动神经功能障碍的基础,而有关形态改变的资料少见报道. 本实验主要是观察神经损伤后的形态改变与损伤电压的关系,以期了解其内在机制.
, 百拇医药
1 材料和方法
1.1 动物实验 中国本兔40 只(本校实验动物中心提供),雌雄不拘,体重2 kg~2.5 kg ,随机分组,每小组4只动物,3 只进行实验观察,另一只备用. 正常对照组4只,损伤组按损伤电压大小分为50 V损伤组、75 V损伤组、200 V损伤组3 个小组,每小组按观察期限再分为1 wk,2 wk,1 mo,3 mo组,故本实验共计13个观察小组. 由兔耳缘静脉注射20 g/L戊巴比妥钠(30 mg/kg )麻醉动物,俯卧位四肢固定,剪除臀部和下肢的毛发,在下肢后侧正中线由月 国窝至臀大肌剪开皮肤,在月 国窝处分离皮下组织寻找月 国神经,然后沿神经走行剪开肌肉充分暴露神经, 使其与周围组织分离,自月 国窝至骶骨区域内电损伤3 cm神经,用不同电压值的交流电(50,75,200 V)损伤神经,缝合伤口按不同期限进行观察.
1.2 电镜观察 将新鲜组织制成1 mm×1 mm×1 mm的小块,置于30 mL/L戊二醛磷酸缓冲液中,固定12 h,10 g/L锇酸固定1 h,梯度乙醇脱水和丙酮泡5 min,Epon812包埋,常规切片染色,镜下观察定位. 定位后包埋块制作超薄切片,用醋酸铀和柠檬酸钠双染色,在透射电镜下观察.
, 百拇医药
2 结果
2.1 大体观察 50 V即时损伤的神经纤维外观无明显变化,各时间点上观察神经形态正常,动物下肢功能未见明显受限. 75 V即时损伤的神经纤维发现与电极接触区域颜色发黄,1 wk后解剖观察神经轻度水肿,颜色发红,2 wk后观察神经水肿减轻,质脆,颜色恢复正常,下肢功能轻度受限. 200 V即时损伤的神经纤维整个损伤神经段发黑. 1 wk后神经水肿与周围组织粘连,质脆. 2 wk后观察神经颜色为恢复正常,水肿减轻. 1 mo后神经颜色恢复正常,质地变硬如索条,不易拉断,未见与周围组织粘连. 动物下肢功能完全受限,后跟可见大块溃烂.
2.2 电镜观察 50 V神经损伤组:2 wk时,镜下观察无髓神经纤维有部分的空泡形成, 表现为轴突内微丝、微管等细胞器消失,呈低密度均质状态(Fig 1). 微血管内壁光滑,管腔无闭塞及栓塞(Fig 2),雪旺氏细胞轴突复合体无明显改变. 1 mo时,有髓神经、无髓神经结构已恢复正常,空泡现象消失,雪旺氏细胞形态正常. 3 mo时,神经结构未发现异常. 75 V神经损伤组:2 wk时,受损的神经纤维数目明显增加,损伤程度加重. 表现为无髓神经纤维轴膜破裂,轴浆外溢. 有髓神经纤维板层开始解体(Fig 3). 但微血管结构无明显变化. 仍可见到形态结构正常的神经纤维. 雪旺氏细胞形态无明显变化. 1 mo时,可见到新生的神经纤维,主要以两种形式存在. ①新生的神经纤维沿原有的溃变的神经膜管生长. 镜下可见到溃变解体的髓鞘内存有结构清晰的有髓神经纤维(Fig 4). ②新生的无髓神经纤维由雪旺氏细胞形成髓鞘逐渐包裹而成(Fig 5). 未得到神经再支配的神经纤维结构开始解体(Fig 6),无髓神经纤维轴膜破裂相互融合. 有髓神经纤维髓鞘厚薄不均,并溶解形成滴状结构. 3 mo时,再生的神经纤维结构进一步成熟. 可见新生髓鞘较薄,但外层光滑,亦可见到尚未完全形成包裹的板层髓鞘(Fig 7). 无髓神经纤维数目减少,但直径增大,雪旺氏细胞包裹的无髓神经纤维数目减少,并处于细胞的外层. 胶原纤维无明显增加. 200 V神经损伤组:1 wk时,镜下观血管内膜凹凸不平,管腔内有血栓形成(Fig 8). 无髓神经纤维变性,雪旺氏细胞数量减少. 有髓神经髓板全部呈松散结构,板层分离. 1 mo时,镜下观血管内膜凹凸不平加重,管腔完全闭塞. 胶原纤维含量开始增加. 雪旺氏细胞基膜与轴突分离,髓鞘厚薄不均,髓鞘板层松散呈丝瓜囊状(Fig 9). 3 mo时,镜下见胶原纤维含量明显增加,占据大部分视野. 无髓神经纤维消失,有髓神经纤维板层分离并皱缩成团,轴突管腔消失成为实心结构. 雪旺氏细胞结构消失.
, 百拇医药
3 讨论
周围神经电损伤后,可出现急性的神经系统损害改变,亦可出现延迟性病理损害[1,2],但就其病理改变及发生机制,目前尚无详尽报道.
3.1 周围神经电损伤后病理形态学改变 电损伤后的神经形态学改变,由试验结果观察主要有两种变化. 一种是无髓神经纤维和细的有髓神经纤维可逆性的改变为主. 如:50 V损伤组2 wk时无髓神经轴突出现空泡样变,1 mo时减少,3 mo时基本消失. 也就是说损伤的神经纤维通过自我修复使神经结构恢复正常. 第二种神经纤维大部分遭到破坏,神经纤维由近段通过再生的方式重新修复损伤的神经纤维. 如75 V损伤组,2 wk时髓板板层模糊,髓鞘扭曲. 1 mo时,虽然亦有神经纤维溃变形态加重,但亦可见到新生的神经纤维. 3 mo时,再生纤维数量增多,形态趋向成熟,溃变的神经纤维数量减少但溃变加重. 第三种是电损伤后神经纤维超微结构完全破坏,微血管亦遭到破坏,管腔闭塞. 观察3 mo时亦没有得到恢复. 胶原纤维含量逐渐增多并逐渐取代溃变的神经纤维.
, 百拇医药
3.2 周围神经电损伤后病理改变机制 ①电流对神经纤维的直接损害. 周围神经组织所造成的损伤主要通过两条途径:一是Baxer[3]提出的电流通过组织产生的热能造成的损伤,二是Raphael等[4]提出的电流通过组织时破坏了细胞膜的结构使细胞溶解,组织遭到损伤. 由本实验的结果看,电压较低时(50 V)主要的改变是轴突内细胞器的溶解消失形成空泡样改变,而轴突结构没有遭到破坏,所以主要是电流造成的损伤. 损伤电压增加时(75 V),神经纤维结构性损害逐渐加重,热能的损害逐渐显现. ②电损伤后的缺血性改变. 由试验结果可看出,50 V,75 V损伤组均未见到明显的血管病理改变. 说明电流的直接损伤对血管损害较小. 200 V损伤组2 wk时可见到血管内膜的改变及管腔内的血栓形成,说明热力是血管损伤的主要原因. 神经内的血管受损,进一步损害微循环,局部缺血可以使髓鞘代谢受到抑制,引起髓鞘的病理改变. 电镜下可看到Schwann细胞水肿,变性坏死,线粒体消失,这均与细胞的缺血缺氧有关. ③胶原纤维增多使神经再生受阻. 由实验中可以看出,随着损伤电压的增大神经内胶原纤维逐渐增多. 胶原纤维的增多首先可以阻碍再生神经的生长,另外由于其牵拉的作用使神经内微环境遭到破坏,再生困难. 因此,临床上常见高压电损伤后神经功能无法恢复完全的病例.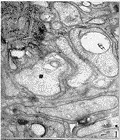

, http://www.100md.com
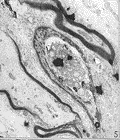
图 1 无髓神经纤维有部分的空泡形成
图 2 微血管内壁光滑,管腔无闭塞及栓塞
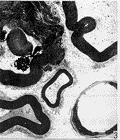
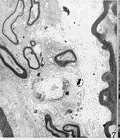
图 3 有髓神经纤维板层开始解体
图 4 新生轴突开始长入溃变的有髓神经纤维
图 5 髓鞘开始包裹轴突
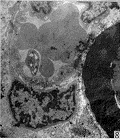
图 6 未得到神经再支配的神经纤维结构开始解体
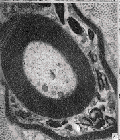
图 7 新生的有髓神经纤维髓鞘较薄
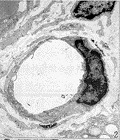
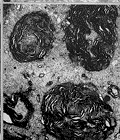
图 8 血管内膜凹凸不平,管腔内有血栓形成
图 9 有髓神经纤维板层分离并皱缩成团
作者简介:李学拥,男,1965-05-11生,北京人,汉族. 1987年第四军医大学军医系毕业,主治医生,讲师,博士研究生. 导师陈 璧教授. Tel:(029)3375297
, 百拇医药
作者单位:第四军医大学西京医院全军整形外科中心烧伤外科,陕西 西安 710033
参考文献
1 Grube Baiba J, Heimbach David M, Loren H. Neurologic consequences of electrical burns. J Trauma, 1990; 30(3):254-258
2 Christensen JA, Sherman RT, Balis G A. Delayed neurologic injury secondary to high voltage current with recovery. J Trauma, 1980; 20(1):166-168
3 Baxter C R. Present concepts in the management of major eletrical injury. Surg. Clin North Am, 1970; 50(8):1401-1418
4 Raphael C, Lee, Michael S, Kolodney. Electrical injury mechanisms: Electrical breakdown of cell membranes. Plast Reconstr Surg, 1987; 80(3):672-681, 百拇医药
摘要 目的:观察在不同损伤电压情况下,神经轴突超微结构的变化. 方法:在兔梨状肌以远分别用50,75,200 V交流电损伤3 cm坐骨神经,然后在1 wk,2 wk,1 mo,3 mo时切取神经组织标本在透射电镜下观察神经纤维超微结构变化. 结果:50 V损伤组2 wk时形态改变轻微,1 mo时神经结构恢复正常. 75 V损伤组2 wk时神经纤维损伤程度加重,1 mo时可见有新生纤维,3 mo时变性纤维数目减少,新生纤维结构趋于成熟. 200 V损伤组神经结构破坏严重,血管内血栓形成,胶原纤维含量增加. 观察3 mo时仍无再生纤维出现. 结论:神经纤维超微结构随着损伤电压的增加破坏加大,神经内纤维化加重,使神经再生受阻.
关键词:电损伤 神经纤维/超微结构 兔
引言
周围神经系统电损伤后的形态学改变是感觉运动神经功能障碍的基础,而有关形态改变的资料少见报道. 本实验主要是观察神经损伤后的形态改变与损伤电压的关系,以期了解其内在机制.
, 百拇医药
1 材料和方法
1.1 动物实验 中国本兔40 只(本校实验动物中心提供),雌雄不拘,体重2 kg~2.5 kg ,随机分组,每小组4只动物,3 只进行实验观察,另一只备用. 正常对照组4只,损伤组按损伤电压大小分为50 V损伤组、75 V损伤组、200 V损伤组3 个小组,每小组按观察期限再分为1 wk,2 wk,1 mo,3 mo组,故本实验共计13个观察小组. 由兔耳缘静脉注射20 g/L戊巴比妥钠(30 mg/kg )麻醉动物,俯卧位四肢固定,剪除臀部和下肢的毛发,在下肢后侧正中线由月 国窝至臀大肌剪开皮肤,在月 国窝处分离皮下组织寻找月 国神经,然后沿神经走行剪开肌肉充分暴露神经, 使其与周围组织分离,自月 国窝至骶骨区域内电损伤3 cm神经,用不同电压值的交流电(50,75,200 V)损伤神经,缝合伤口按不同期限进行观察.
1.2 电镜观察 将新鲜组织制成1 mm×1 mm×1 mm的小块,置于30 mL/L戊二醛磷酸缓冲液中,固定12 h,10 g/L锇酸固定1 h,梯度乙醇脱水和丙酮泡5 min,Epon812包埋,常规切片染色,镜下观察定位. 定位后包埋块制作超薄切片,用醋酸铀和柠檬酸钠双染色,在透射电镜下观察.
, 百拇医药
2 结果
2.1 大体观察 50 V即时损伤的神经纤维外观无明显变化,各时间点上观察神经形态正常,动物下肢功能未见明显受限. 75 V即时损伤的神经纤维发现与电极接触区域颜色发黄,1 wk后解剖观察神经轻度水肿,颜色发红,2 wk后观察神经水肿减轻,质脆,颜色恢复正常,下肢功能轻度受限. 200 V即时损伤的神经纤维整个损伤神经段发黑. 1 wk后神经水肿与周围组织粘连,质脆. 2 wk后观察神经颜色为恢复正常,水肿减轻. 1 mo后神经颜色恢复正常,质地变硬如索条,不易拉断,未见与周围组织粘连. 动物下肢功能完全受限,后跟可见大块溃烂.
2.2 电镜观察 50 V神经损伤组:2 wk时,镜下观察无髓神经纤维有部分的空泡形成, 表现为轴突内微丝、微管等细胞器消失,呈低密度均质状态(Fig 1). 微血管内壁光滑,管腔无闭塞及栓塞(Fig 2),雪旺氏细胞轴突复合体无明显改变. 1 mo时,有髓神经、无髓神经结构已恢复正常,空泡现象消失,雪旺氏细胞形态正常. 3 mo时,神经结构未发现异常. 75 V神经损伤组:2 wk时,受损的神经纤维数目明显增加,损伤程度加重. 表现为无髓神经纤维轴膜破裂,轴浆外溢. 有髓神经纤维板层开始解体(Fig 3). 但微血管结构无明显变化. 仍可见到形态结构正常的神经纤维. 雪旺氏细胞形态无明显变化. 1 mo时,可见到新生的神经纤维,主要以两种形式存在. ①新生的神经纤维沿原有的溃变的神经膜管生长. 镜下可见到溃变解体的髓鞘内存有结构清晰的有髓神经纤维(Fig 4). ②新生的无髓神经纤维由雪旺氏细胞形成髓鞘逐渐包裹而成(Fig 5). 未得到神经再支配的神经纤维结构开始解体(Fig 6),无髓神经纤维轴膜破裂相互融合. 有髓神经纤维髓鞘厚薄不均,并溶解形成滴状结构. 3 mo时,再生的神经纤维结构进一步成熟. 可见新生髓鞘较薄,但外层光滑,亦可见到尚未完全形成包裹的板层髓鞘(Fig 7). 无髓神经纤维数目减少,但直径增大,雪旺氏细胞包裹的无髓神经纤维数目减少,并处于细胞的外层. 胶原纤维无明显增加. 200 V神经损伤组:1 wk时,镜下观血管内膜凹凸不平,管腔内有血栓形成(Fig 8). 无髓神经纤维变性,雪旺氏细胞数量减少. 有髓神经髓板全部呈松散结构,板层分离. 1 mo时,镜下观血管内膜凹凸不平加重,管腔完全闭塞. 胶原纤维含量开始增加. 雪旺氏细胞基膜与轴突分离,髓鞘厚薄不均,髓鞘板层松散呈丝瓜囊状(Fig 9). 3 mo时,镜下见胶原纤维含量明显增加,占据大部分视野. 无髓神经纤维消失,有髓神经纤维板层分离并皱缩成团,轴突管腔消失成为实心结构. 雪旺氏细胞结构消失.
, 百拇医药
3 讨论
周围神经电损伤后,可出现急性的神经系统损害改变,亦可出现延迟性病理损害[1,2],但就其病理改变及发生机制,目前尚无详尽报道.
3.1 周围神经电损伤后病理形态学改变 电损伤后的神经形态学改变,由试验结果观察主要有两种变化. 一种是无髓神经纤维和细的有髓神经纤维可逆性的改变为主. 如:50 V损伤组2 wk时无髓神经轴突出现空泡样变,1 mo时减少,3 mo时基本消失. 也就是说损伤的神经纤维通过自我修复使神经结构恢复正常. 第二种神经纤维大部分遭到破坏,神经纤维由近段通过再生的方式重新修复损伤的神经纤维. 如75 V损伤组,2 wk时髓板板层模糊,髓鞘扭曲. 1 mo时,虽然亦有神经纤维溃变形态加重,但亦可见到新生的神经纤维. 3 mo时,再生纤维数量增多,形态趋向成熟,溃变的神经纤维数量减少但溃变加重. 第三种是电损伤后神经纤维超微结构完全破坏,微血管亦遭到破坏,管腔闭塞. 观察3 mo时亦没有得到恢复. 胶原纤维含量逐渐增多并逐渐取代溃变的神经纤维.
, 百拇医药
3.2 周围神经电损伤后病理改变机制 ①电流对神经纤维的直接损害. 周围神经组织所造成的损伤主要通过两条途径:一是Baxer[3]提出的电流通过组织产生的热能造成的损伤,二是Raphael等[4]提出的电流通过组织时破坏了细胞膜的结构使细胞溶解,组织遭到损伤. 由本实验的结果看,电压较低时(50 V)主要的改变是轴突内细胞器的溶解消失形成空泡样改变,而轴突结构没有遭到破坏,所以主要是电流造成的损伤. 损伤电压增加时(75 V),神经纤维结构性损害逐渐加重,热能的损害逐渐显现. ②电损伤后的缺血性改变. 由试验结果可看出,50 V,75 V损伤组均未见到明显的血管病理改变. 说明电流的直接损伤对血管损害较小. 200 V损伤组2 wk时可见到血管内膜的改变及管腔内的血栓形成,说明热力是血管损伤的主要原因. 神经内的血管受损,进一步损害微循环,局部缺血可以使髓鞘代谢受到抑制,引起髓鞘的病理改变. 电镜下可看到Schwann细胞水肿,变性坏死,线粒体消失,这均与细胞的缺血缺氧有关. ③胶原纤维增多使神经再生受阻. 由实验中可以看出,随着损伤电压的增大神经内胶原纤维逐渐增多. 胶原纤维的增多首先可以阻碍再生神经的生长,另外由于其牵拉的作用使神经内微环境遭到破坏,再生困难. 因此,临床上常见高压电损伤后神经功能无法恢复完全的病例.









, http://www.100md.com
图 1 无髓神经纤维有部分的空泡形成
图 2 微血管内壁光滑,管腔无闭塞及栓塞
图 3 有髓神经纤维板层开始解体
图 4 新生轴突开始长入溃变的有髓神经纤维
图 5 髓鞘开始包裹轴突
图 6 未得到神经再支配的神经纤维结构开始解体
图 7 新生的有髓神经纤维髓鞘较薄
图 8 血管内膜凹凸不平,管腔内有血栓形成
图 9 有髓神经纤维板层分离并皱缩成团
作者简介:李学拥,男,1965-05-11生,北京人,汉族. 1987年第四军医大学军医系毕业,主治医生,讲师,博士研究生. 导师陈 璧教授. Tel:(029)3375297
, 百拇医药
作者单位:第四军医大学西京医院全军整形外科中心烧伤外科,陕西 西安 710033
参考文献
1 Grube Baiba J, Heimbach David M, Loren H. Neurologic consequences of electrical burns. J Trauma, 1990; 30(3):254-258
2 Christensen JA, Sherman RT, Balis G A. Delayed neurologic injury secondary to high voltage current with recovery. J Trauma, 1980; 20(1):166-168
3 Baxter C R. Present concepts in the management of major eletrical injury. Surg. Clin North Am, 1970; 50(8):1401-1418
4 Raphael C, Lee, Michael S, Kolodney. Electrical injury mechanisms: Electrical breakdown of cell membranes. Plast Reconstr Surg, 1987; 80(3):672-681, 百拇医药