去甲二氢愈创木酸对胶质瘤细胞诱导的内皮细胞迁移的影响
去甲二氢愈创木酸对胶质瘤细胞诱导的内皮细胞迁移的影响
孙慧勤 卞修武 陈意生 史景泉
摘 要 目的:观察去甲二氢愈创木酸(NDGA)对胶质瘤细胞诱导的内皮细胞迁移的影响。方法:采用微孔滤膜培养小室及双室细胞联合培养法,进行人脐静脉内皮细胞系ECV-304细胞与人恶性胶质瘤细胞系SHG-44细胞的联合培养,并以免疫组化SP方法检测SHG-44细胞血管内皮生长因子(VEGF)、碱性成纤维细胞生长因子(bFGF)的表达。结果:100 μmol/L 的NDGA作用1~3 d后,SHG-44细胞VEGF、bFGF 的表达明显降低。100 μmol/L NDGA对内皮细胞的非定向运动有明显抑制作用,对胶质瘤细胞及其条件培养基诱导的内皮细胞定向迁移抑制显著(P<0.01)。在50、100、150、200 μmol/L 的实验浓度范围内,其抑制作用呈明显量效关系(抑制率各为12.0%,37.4%,86.7%和82.2%)。结论:NDGA对内皮细胞的非定向运动和胶质瘤细胞诱导的迁移均有抑制作用,并可降低瘤细胞血管生成因子的表达,提示NDGA具有抗血管生成的作用。
, http://www.100md.com
关键词:去甲二氢愈创木酸 神经胶质瘤 内皮,血管 共同培养
恶性胶质瘤是临床难以根治的原发性肿瘤之一,血管增生活跃不仅是该瘤的病理特征,也是该瘤发展的重要原因。近年来,肿瘤血管生成的理论研究和实践都得以迅速的深入和开展[1,2]。我们在应用去甲二氢愈创木酸(nordihydroguaiaretic acid,NDGA)抗胶质瘤研究时,发现它能明显减少移植瘤及诱发瘤的血管生成。在肿瘤血管生成中,内皮细胞向肿瘤细胞移行是实现肿瘤血管生成的重要环节,阻止此步的发生即能有效控制肿瘤血管生成。因此,我们就NDGA对内皮细胞及胶质瘤细胞诱导的内皮细胞迁移的影响进行了研究。
材料与方法
一、细胞培养、胶质瘤条件培养基的制备
人脐静脉内皮细胞系ECV-304(引自美国组织培养库,ATCC CRI-1998)和人恶性胶质瘤细胞系SHG-44细胞(引自苏州医学院附属第二医院脑肿瘤研究室)。分别在含10%新生小牛血清、双抗(青霉素100 U/ml,链霉素100 μg/ml)的M199和RPMI 1640培养基(Gibco公司产品)中常规培养。
, 百拇医药
等量的SHG-44细胞分别在含NDGA液(终浓度为100 μmol/L)和等体积PBS(pH 7.2)的含0.5%新生小牛血清的M199液10 ml中培养24 h,取上清,离心,0.22 μm微孔滤膜过滤,分别标记为条件培养基1、2(CM1,CM2),-20℃保存备用。
二、NDGA对胶质瘤细胞血管内皮生长因子(VEGF)、碱性成纤维细胞生长因子(bFGF)蛋白表达影响的观察
经NDGA(终浓度为100 μmol/L) 或 PBS(pH 7.2)处理后1~3 d的SHG-44 细胞,经4%多聚甲醛固定,采用SP法(Zymed公司产品)进行VEGF、bFGF(PcAb,1∶20, Santa Cruz 公司产品)的免疫组化染色。
三、迁移实验
1.微孔滤膜培养小室及双室联合培养系统:双室联合培养结构见图1。应用微孔滤膜培养小室,进行胶质瘤细胞与内皮细胞的联合培养,可以更接近体内环境,模拟瘤细胞对血管内皮细胞的作用,滤膜上8 μm的微孔可允许内皮细胞穿过到达膜的下面,这些穿越迁移的内皮细胞可粘附于膜的下面,通过计数滤膜下面的细胞可基本反映细胞的迁移情况。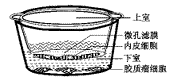
, http://www.100md.com
图1 双室联合培养示意图
2.SHG-44细胞诱导的迁移实验:用已长满的SHG-44细胞消化后制成悬液,用含10%新生小牛血清的RPMI 1640培养基调节其细胞浓度为1×105个/ml。对不同胶质瘤细胞相关的试验:分别按每孔细胞数为0、1×105个的量传入12孔培养板内,补加含10%新生小牛血清的RPMI 1640培养基至2 ml/孔,置于孵箱内培养。5 h后待细胞贴壁,吸出培养基,以D-Hanks液洗2次,加入含0.5%新生小牛血清M199或含100 μmol/L NDGA及0.5%新生小牛血清 M199液,入孵箱内培养。对不同浓度NDGA相关的试验:按每孔细胞数为1×105个的量传入12孔培养板内,培养5 h后吸出培养基,以D-Hanks液洗2次,加入含0.5%新生小牛血清 M199或各含50、100、150、200 μmol/L NDGA的0.5%新生小牛血清 M199液2 ml/孔,入孵箱内培养。每组3孔,并至少重复3次试验。18 h后取出,装配PET微孔滤膜培养小室(上室,Falcon Cell Culture Insert,Becton Dickinson公司产品)入12孔板(下室)内,同时消化生长良好的内皮细胞,调整其浓度为105个/ml,每个小室内加入0.1 ml (1×104个细胞),轻轻振荡使之分布均匀,放入孵箱内进行胶质瘤-内皮细胞的联合培养。6 h后取上室,以棉签拭去小室滤膜上的内皮细胞。PBS洗后将小室置于95%乙醇中固定10 min,PBS洗5 min 2次,苏木素染色2~5 min,水洗,或再加伊红染3~5 min,蒸馏水洗后倒置于普通显微镜下随机计数(×100)13个视野内的膜下面细胞数。同时计算细胞迁移的抑制率:细胞迁移的抑制率=(对照组迁移细胞数-NDGA组迁移细胞数)/对照组迁移细胞数×100%。
, 百拇医药
3.胶质瘤条件培养基引起的迁移实验:将已制备的条件培养基CM1、CM2(含NDGA 100 μmol/L)以1 ml、2 ml的量加入12孔培养板内,补加含0.5%新生小牛血清 的 M199培养基,使每孔2 ml。消化内皮细胞,调其浓度为1×105个/ml,每个小室内加入0.1 ml(1×104个细胞),轻振荡,入孵箱内培养6 h取出,后续处理步骤,方法同上。
四、数据统计学处理
数据以均数±标准差(x±s)表示, 采用Microsoft Excel提供的统计程序,进行t检验。
结果
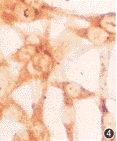
1.NDGA对SHG-44细胞VEGF、bFGF蛋白表达的影响:SHG-44细胞VEGF、bFGF 蛋白表达均较强,主要定位于瘤细胞的胞质。NDGA处理细胞1~3 d后,SHG-44细胞VEGF、bFGF 蛋白表达的阳性减弱, 如图2~5。
, 百拇医药
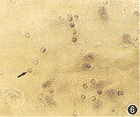
2.NDGA对内皮细胞的移行和胶质瘤细胞诱导的内皮细胞迁移的影响:传入微孔滤膜培养小室的内皮细胞与在培养板内相似,可很快贴壁生长。当下室无SHG-44细胞时,移行至膜下的内皮细胞多在10个左右。当下室有SHG-44细胞存在时,迁移的细胞数明显增加(图6)。而经100 μmol/L NDGA处理24 h后,内皮细胞的迁移数较对照组明显减少(图7),差异有显著性(图8,P<0.01)。当下室有一定量的胶质瘤细胞存在时,50、100、150和200 μmol/L的NDGA处理组迁移抑制率分别为12.0%,37.4%,86.7% 和82.2%;迁移的内皮细胞数随NDGA浓度的增加而减少,除50 μmol/L NDGA组外,与对照组比差异均有显著性(图9,P<0.05)。
3.NDGA对胶质瘤细胞条件培养基诱导的内皮细胞迁移的影响:加入条件培养基对内皮细胞作用6 h后,CM1表现出对内皮细胞更强的吸引作用,细胞计数显著高于CM2组,差异有显著性(P<0.01),说明在存在NDGA(100 μmol/L)的情况下,SHG-44细胞产生的迁移因子减少,对内皮细胞的诱导作用减弱,而CM含量多少之间也显示出明显差异,见图10。



, http://www.100md.com
图2 对照组48 h SHG-44细胞VEGF蛋白表达较强 SP法×200 图3 NDGA组48 h SHG-44细胞VEGF蛋白表达减弱 SP法×200
图4 对照组72 h SHG-44细胞bFGF蛋白表达强 SP法×400 图5 NDGA组72 h SHG-44细胞bFGF蛋白表达减弱 SP法×400
图6 SHG-44细胞与ECV-304细胞联合培养,见较多迁移至微孔滤膜(→)下面的内皮细胞(EC) 苏木素染色×200 图7 SHG-44细
胞与ECV-304细胞联合培养,并加入NDGA,见少数散在迁移至微孔滤膜(→)下面的内皮细胞(EC) 苏木素染色×200
图8 NDGA对内皮细胞迁移的影响
, http://www.100md.com
图9 不同浓度NDGA对内皮细胞迁移的影响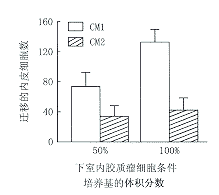
图10 胶质瘤细胞条件培养基对内皮细胞迁移的影响
讨论
NDGA作为脂氧化酶的强抑制剂具有抗氧化作用。最早是将其作为添加剂用于抗食物腐败之中,近年来发现其有抗肿瘤作用[3-6],引起了许多学者的关注,但至今尚不清楚其抗肿瘤机制。
我们在应用NDGA进行抗胶质瘤的研究中,发现其在显著抑制胶质瘤细胞生长、诱导其分化的同时,也明显抑制了移植瘤、诱发瘤内的血管生长。近年来,肿瘤血管生成的研究已成为肿瘤研究的热点及策略问题。肿瘤的生长、转移与肿瘤诱导的血管生成密切相关,而通过抑制血管生成进行抗肿瘤治疗,是肿瘤治疗中最有前途的方法之一[1,2]。脑胶质瘤能产生一些促血管生成的物质,如VEGF、bFGF、aFGF、内皮细胞生长因子、转化生长因子α和血小板源生长因子等。它们能通过不同机制从多种途径刺激血管生成[7],多数因子对血管内皮细胞的增生存在作用,bFGF、VEGF 、内皮细胞生长因子等因子还可引起内皮细胞迁移[8],而内皮细胞的移行在肿瘤血管生成中亦具有重要作用。只有通过内皮细胞向瘤组织内移行,才能实现肿瘤的血管生成,从而为迅速生长的肿瘤提供充足营养物质及氧气。因此,抑制内皮细胞向肿瘤细胞内移行,同样也能达到抑制肿瘤生长的目的。
, http://www.100md.com
Yassini等[9]采用联合培养的方法证明胶质瘤细胞能引起内皮、纤维母细胞的趋化移行。我们利用微孔滤膜培养小室,也成功地进行了胶质瘤细胞-内皮细胞的联合培养,同时观察了NDGA对胶质瘤细胞及其条件培养基诱导的内皮细胞迁移的影响。我们发现在胶质瘤细胞存在的情况下,可引起内皮细胞的迁移;同样采用胶质瘤细胞的条件培养基,也可见内皮细胞的明显移行,说明SHG-44细胞产生了一些对内皮细胞的趋化因子(包括可溶性因子),从而引起内皮细胞向胶质瘤细胞所在区(下室)趋化移行,验证了胶质瘤细胞对内皮细胞的趋化作用。Kumar等[10]比较了不同生长因子对血管生成不同步骤的影响,发现肝细胞生长因子对内皮细胞的趋化作用最强,其次是bFGF、VEGF 。本研究所用的恶性胶质瘤细胞系—— SHG-44细胞有较强的血管生成因子bFGF、VEGF的表达,从而也有强的对内皮细胞的趋化作用,所以联合培养时,我们观察到有明显的内皮细胞的迁移;而经 NDGA处理后bFGF、VEGF的表达降低,其趋化作用也相应减弱。所以,在存在NDGA的情况下进行的联合培养,内皮细胞迁移数减少,并随NDGA 含量的增加,其迁移减少也愈加明显。究其原因,一方面,是由于NDGA抑制胶质瘤细胞的增生,瘤细胞数量减少,从整体产生血管生长因子量的降低所致;另一方面,也是由于NDGA抑制并减少了胶质瘤细胞自身表达、产生bFGF、VEGF等因子的水平降低所致。此外,本研究结果还显示了NDGA对内皮细胞自身的非定向运动也有抑制作用。这一现象是否由于NDGA可导致细胞骨架的变化以致影响内皮细胞本身的运动能力所致,尚待进一步研究。
, http://www.100md.com
从我们既往的研究结果及本实验来看,NDGA抗胶质瘤的作用不仅针对瘤细胞本身,对肿瘤血管生成也具有作用,对此作进一步的研究可望为胶质瘤的临床治疗有所帮助。
基金项目:国家自然科学基金资助项目(39570295)
通信作者:卞修武
作者单位:孙慧勤 第三军医大学病理学教研室,重庆 400038
卞修武 第三军医大学病理学教研室,重庆 400038
陈意生 第三军医大学病理学教研室,重庆 400038
史景泉 第三军医大学病理学教研室,重庆 400038
参考文献
, http://www.100md.com
[1]Folkman J. Fighting cancer by attacking its blood supply. Sci Am, 1996,275:150-154.
[2]Lund EL, Spang-Thomsen M, Skovgaard-Poulsen H, et al. Tumor angiogenesis-a new theraeutic target in gliomas. Acta Neurol Scand, 1998,97:52-62.
[3]Wang ZY, Agarwal R, Zhou ZC, et al. Antimutagenic and antitumorigenic activities of nordihydroguaiaretic acid. Mutat Res, 1991,261:153-62.
[4]卞修武,史景泉,辛榕, 等. 去甲二氢愈创木酸对人恶性胶质瘤细胞系SHG-44生长和分化的影响. 中华病理学杂志,1997,26:285-288.
, 百拇医药
[5]McCormick DL,Spicer Am. Nordihydroguaiaretic acid suppression of rat mammary carcinogenesis induced by N-methyl-N-nitrosourea. Cancer Lett, 1987,37:139-146.
[6]Wilson DE,Anderson KM,Secd TM.Ultrastructural evidence for differentiation in a human glioblastoma cell line treated with inhibitors of eicosanoid metabolism. Neurosurgery, 1990,27:523-531.
[7]Jensen RL. Growth factor-mediated angiogenesis in the malignant progression of glial tumors: a review. Surg Neurol, 1998,49:189-196.
, 百拇医药
[8]Folkman J,Shing Y. Angiogenesis. J Biol Chem,1992,267:10931-10934.
[9]Yassini PR, Stickler DL, Bloomfield SM,et al. Glioma-stimulated chemoattraction of endothelial cells and fibroblasts in vitro:a model for the study of glioma-induced angiogenesis. Metab Brain Dis,1994,9:391-399.
[10]Kumar R, Yoneda J, Bucana CD,et al. Regulation of distinct steps of angiogenesis by different angiogenic molecules. Int J Oncol,1998,12: 749-757., http://www.100md.com
孙慧勤 卞修武 陈意生 史景泉
摘 要 目的:观察去甲二氢愈创木酸(NDGA)对胶质瘤细胞诱导的内皮细胞迁移的影响。方法:采用微孔滤膜培养小室及双室细胞联合培养法,进行人脐静脉内皮细胞系ECV-304细胞与人恶性胶质瘤细胞系SHG-44细胞的联合培养,并以免疫组化SP方法检测SHG-44细胞血管内皮生长因子(VEGF)、碱性成纤维细胞生长因子(bFGF)的表达。结果:100 μmol/L 的NDGA作用1~3 d后,SHG-44细胞VEGF、bFGF 的表达明显降低。100 μmol/L NDGA对内皮细胞的非定向运动有明显抑制作用,对胶质瘤细胞及其条件培养基诱导的内皮细胞定向迁移抑制显著(P<0.01)。在50、100、150、200 μmol/L 的实验浓度范围内,其抑制作用呈明显量效关系(抑制率各为12.0%,37.4%,86.7%和82.2%)。结论:NDGA对内皮细胞的非定向运动和胶质瘤细胞诱导的迁移均有抑制作用,并可降低瘤细胞血管生成因子的表达,提示NDGA具有抗血管生成的作用。
, http://www.100md.com
关键词:去甲二氢愈创木酸 神经胶质瘤 内皮,血管 共同培养
恶性胶质瘤是临床难以根治的原发性肿瘤之一,血管增生活跃不仅是该瘤的病理特征,也是该瘤发展的重要原因。近年来,肿瘤血管生成的理论研究和实践都得以迅速的深入和开展[1,2]。我们在应用去甲二氢愈创木酸(nordihydroguaiaretic acid,NDGA)抗胶质瘤研究时,发现它能明显减少移植瘤及诱发瘤的血管生成。在肿瘤血管生成中,内皮细胞向肿瘤细胞移行是实现肿瘤血管生成的重要环节,阻止此步的发生即能有效控制肿瘤血管生成。因此,我们就NDGA对内皮细胞及胶质瘤细胞诱导的内皮细胞迁移的影响进行了研究。
材料与方法
一、细胞培养、胶质瘤条件培养基的制备
人脐静脉内皮细胞系ECV-304(引自美国组织培养库,ATCC CRI-1998)和人恶性胶质瘤细胞系SHG-44细胞(引自苏州医学院附属第二医院脑肿瘤研究室)。分别在含10%新生小牛血清、双抗(青霉素100 U/ml,链霉素100 μg/ml)的M199和RPMI 1640培养基(Gibco公司产品)中常规培养。
, 百拇医药
等量的SHG-44细胞分别在含NDGA液(终浓度为100 μmol/L)和等体积PBS(pH 7.2)的含0.5%新生小牛血清的M199液10 ml中培养24 h,取上清,离心,0.22 μm微孔滤膜过滤,分别标记为条件培养基1、2(CM1,CM2),-20℃保存备用。
二、NDGA对胶质瘤细胞血管内皮生长因子(VEGF)、碱性成纤维细胞生长因子(bFGF)蛋白表达影响的观察
经NDGA(终浓度为100 μmol/L) 或 PBS(pH 7.2)处理后1~3 d的SHG-44 细胞,经4%多聚甲醛固定,采用SP法(Zymed公司产品)进行VEGF、bFGF(PcAb,1∶20, Santa Cruz 公司产品)的免疫组化染色。
三、迁移实验
1.微孔滤膜培养小室及双室联合培养系统:双室联合培养结构见图1。应用微孔滤膜培养小室,进行胶质瘤细胞与内皮细胞的联合培养,可以更接近体内环境,模拟瘤细胞对血管内皮细胞的作用,滤膜上8 μm的微孔可允许内皮细胞穿过到达膜的下面,这些穿越迁移的内皮细胞可粘附于膜的下面,通过计数滤膜下面的细胞可基本反映细胞的迁移情况。

, http://www.100md.com
图1 双室联合培养示意图
2.SHG-44细胞诱导的迁移实验:用已长满的SHG-44细胞消化后制成悬液,用含10%新生小牛血清的RPMI 1640培养基调节其细胞浓度为1×105个/ml。对不同胶质瘤细胞相关的试验:分别按每孔细胞数为0、1×105个的量传入12孔培养板内,补加含10%新生小牛血清的RPMI 1640培养基至2 ml/孔,置于孵箱内培养。5 h后待细胞贴壁,吸出培养基,以D-Hanks液洗2次,加入含0.5%新生小牛血清M199或含100 μmol/L NDGA及0.5%新生小牛血清 M199液,入孵箱内培养。对不同浓度NDGA相关的试验:按每孔细胞数为1×105个的量传入12孔培养板内,培养5 h后吸出培养基,以D-Hanks液洗2次,加入含0.5%新生小牛血清 M199或各含50、100、150、200 μmol/L NDGA的0.5%新生小牛血清 M199液2 ml/孔,入孵箱内培养。每组3孔,并至少重复3次试验。18 h后取出,装配PET微孔滤膜培养小室(上室,Falcon Cell Culture Insert,Becton Dickinson公司产品)入12孔板(下室)内,同时消化生长良好的内皮细胞,调整其浓度为105个/ml,每个小室内加入0.1 ml (1×104个细胞),轻轻振荡使之分布均匀,放入孵箱内进行胶质瘤-内皮细胞的联合培养。6 h后取上室,以棉签拭去小室滤膜上的内皮细胞。PBS洗后将小室置于95%乙醇中固定10 min,PBS洗5 min 2次,苏木素染色2~5 min,水洗,或再加伊红染3~5 min,蒸馏水洗后倒置于普通显微镜下随机计数(×100)13个视野内的膜下面细胞数。同时计算细胞迁移的抑制率:细胞迁移的抑制率=(对照组迁移细胞数-NDGA组迁移细胞数)/对照组迁移细胞数×100%。
, 百拇医药
3.胶质瘤条件培养基引起的迁移实验:将已制备的条件培养基CM1、CM2(含NDGA 100 μmol/L)以1 ml、2 ml的量加入12孔培养板内,补加含0.5%新生小牛血清 的 M199培养基,使每孔2 ml。消化内皮细胞,调其浓度为1×105个/ml,每个小室内加入0.1 ml(1×104个细胞),轻振荡,入孵箱内培养6 h取出,后续处理步骤,方法同上。
四、数据统计学处理
数据以均数±标准差(x±s)表示, 采用Microsoft Excel提供的统计程序,进行t检验。
结果
1.NDGA对SHG-44细胞VEGF、bFGF蛋白表达的影响:SHG-44细胞VEGF、bFGF 蛋白表达均较强,主要定位于瘤细胞的胞质。NDGA处理细胞1~3 d后,SHG-44细胞VEGF、bFGF 蛋白表达的阳性减弱, 如图2~5。
, 百拇医药
2.NDGA对内皮细胞的移行和胶质瘤细胞诱导的内皮细胞迁移的影响:传入微孔滤膜培养小室的内皮细胞与在培养板内相似,可很快贴壁生长。当下室无SHG-44细胞时,移行至膜下的内皮细胞多在10个左右。当下室有SHG-44细胞存在时,迁移的细胞数明显增加(图6)。而经100 μmol/L NDGA处理24 h后,内皮细胞的迁移数较对照组明显减少(图7),差异有显著性(图8,P<0.01)。当下室有一定量的胶质瘤细胞存在时,50、100、150和200 μmol/L的NDGA处理组迁移抑制率分别为12.0%,37.4%,86.7% 和82.2%;迁移的内皮细胞数随NDGA浓度的增加而减少,除50 μmol/L NDGA组外,与对照组比差异均有显著性(图9,P<0.05)。
3.NDGA对胶质瘤细胞条件培养基诱导的内皮细胞迁移的影响:加入条件培养基对内皮细胞作用6 h后,CM1表现出对内皮细胞更强的吸引作用,细胞计数显著高于CM2组,差异有显著性(P<0.01),说明在存在NDGA(100 μmol/L)的情况下,SHG-44细胞产生的迁移因子减少,对内皮细胞的诱导作用减弱,而CM含量多少之间也显示出明显差异,见图10。






, http://www.100md.com
图2 对照组48 h SHG-44细胞VEGF蛋白表达较强 SP法×200 图3 NDGA组48 h SHG-44细胞VEGF蛋白表达减弱 SP法×200
图4 对照组72 h SHG-44细胞bFGF蛋白表达强 SP法×400 图5 NDGA组72 h SHG-44细胞bFGF蛋白表达减弱 SP法×400
图6 SHG-44细胞与ECV-304细胞联合培养,见较多迁移至微孔滤膜(→)下面的内皮细胞(EC) 苏木素染色×200 图7 SHG-44细
胞与ECV-304细胞联合培养,并加入NDGA,见少数散在迁移至微孔滤膜(→)下面的内皮细胞(EC) 苏木素染色×200

图8 NDGA对内皮细胞迁移的影响

, http://www.100md.com
图9 不同浓度NDGA对内皮细胞迁移的影响

图10 胶质瘤细胞条件培养基对内皮细胞迁移的影响
讨论
NDGA作为脂氧化酶的强抑制剂具有抗氧化作用。最早是将其作为添加剂用于抗食物腐败之中,近年来发现其有抗肿瘤作用[3-6],引起了许多学者的关注,但至今尚不清楚其抗肿瘤机制。
我们在应用NDGA进行抗胶质瘤的研究中,发现其在显著抑制胶质瘤细胞生长、诱导其分化的同时,也明显抑制了移植瘤、诱发瘤内的血管生长。近年来,肿瘤血管生成的研究已成为肿瘤研究的热点及策略问题。肿瘤的生长、转移与肿瘤诱导的血管生成密切相关,而通过抑制血管生成进行抗肿瘤治疗,是肿瘤治疗中最有前途的方法之一[1,2]。脑胶质瘤能产生一些促血管生成的物质,如VEGF、bFGF、aFGF、内皮细胞生长因子、转化生长因子α和血小板源生长因子等。它们能通过不同机制从多种途径刺激血管生成[7],多数因子对血管内皮细胞的增生存在作用,bFGF、VEGF 、内皮细胞生长因子等因子还可引起内皮细胞迁移[8],而内皮细胞的移行在肿瘤血管生成中亦具有重要作用。只有通过内皮细胞向瘤组织内移行,才能实现肿瘤的血管生成,从而为迅速生长的肿瘤提供充足营养物质及氧气。因此,抑制内皮细胞向肿瘤细胞内移行,同样也能达到抑制肿瘤生长的目的。
, http://www.100md.com
Yassini等[9]采用联合培养的方法证明胶质瘤细胞能引起内皮、纤维母细胞的趋化移行。我们利用微孔滤膜培养小室,也成功地进行了胶质瘤细胞-内皮细胞的联合培养,同时观察了NDGA对胶质瘤细胞及其条件培养基诱导的内皮细胞迁移的影响。我们发现在胶质瘤细胞存在的情况下,可引起内皮细胞的迁移;同样采用胶质瘤细胞的条件培养基,也可见内皮细胞的明显移行,说明SHG-44细胞产生了一些对内皮细胞的趋化因子(包括可溶性因子),从而引起内皮细胞向胶质瘤细胞所在区(下室)趋化移行,验证了胶质瘤细胞对内皮细胞的趋化作用。Kumar等[10]比较了不同生长因子对血管生成不同步骤的影响,发现肝细胞生长因子对内皮细胞的趋化作用最强,其次是bFGF、VEGF 。本研究所用的恶性胶质瘤细胞系—— SHG-44细胞有较强的血管生成因子bFGF、VEGF的表达,从而也有强的对内皮细胞的趋化作用,所以联合培养时,我们观察到有明显的内皮细胞的迁移;而经 NDGA处理后bFGF、VEGF的表达降低,其趋化作用也相应减弱。所以,在存在NDGA的情况下进行的联合培养,内皮细胞迁移数减少,并随NDGA 含量的增加,其迁移减少也愈加明显。究其原因,一方面,是由于NDGA抑制胶质瘤细胞的增生,瘤细胞数量减少,从整体产生血管生长因子量的降低所致;另一方面,也是由于NDGA抑制并减少了胶质瘤细胞自身表达、产生bFGF、VEGF等因子的水平降低所致。此外,本研究结果还显示了NDGA对内皮细胞自身的非定向运动也有抑制作用。这一现象是否由于NDGA可导致细胞骨架的变化以致影响内皮细胞本身的运动能力所致,尚待进一步研究。
, http://www.100md.com
从我们既往的研究结果及本实验来看,NDGA抗胶质瘤的作用不仅针对瘤细胞本身,对肿瘤血管生成也具有作用,对此作进一步的研究可望为胶质瘤的临床治疗有所帮助。
基金项目:国家自然科学基金资助项目(39570295)
通信作者:卞修武
作者单位:孙慧勤 第三军医大学病理学教研室,重庆 400038
卞修武 第三军医大学病理学教研室,重庆 400038
陈意生 第三军医大学病理学教研室,重庆 400038
史景泉 第三军医大学病理学教研室,重庆 400038
参考文献
, http://www.100md.com
[1]Folkman J. Fighting cancer by attacking its blood supply. Sci Am, 1996,275:150-154.
[2]Lund EL, Spang-Thomsen M, Skovgaard-Poulsen H, et al. Tumor angiogenesis-a new theraeutic target in gliomas. Acta Neurol Scand, 1998,97:52-62.
[3]Wang ZY, Agarwal R, Zhou ZC, et al. Antimutagenic and antitumorigenic activities of nordihydroguaiaretic acid. Mutat Res, 1991,261:153-62.
[4]卞修武,史景泉,辛榕, 等. 去甲二氢愈创木酸对人恶性胶质瘤细胞系SHG-44生长和分化的影响. 中华病理学杂志,1997,26:285-288.
, 百拇医药
[5]McCormick DL,Spicer Am. Nordihydroguaiaretic acid suppression of rat mammary carcinogenesis induced by N-methyl-N-nitrosourea. Cancer Lett, 1987,37:139-146.
[6]Wilson DE,Anderson KM,Secd TM.Ultrastructural evidence for differentiation in a human glioblastoma cell line treated with inhibitors of eicosanoid metabolism. Neurosurgery, 1990,27:523-531.
[7]Jensen RL. Growth factor-mediated angiogenesis in the malignant progression of glial tumors: a review. Surg Neurol, 1998,49:189-196.
, 百拇医药
[8]Folkman J,Shing Y. Angiogenesis. J Biol Chem,1992,267:10931-10934.
[9]Yassini PR, Stickler DL, Bloomfield SM,et al. Glioma-stimulated chemoattraction of endothelial cells and fibroblasts in vitro:a model for the study of glioma-induced angiogenesis. Metab Brain Dis,1994,9:391-399.
[10]Kumar R, Yoneda J, Bucana CD,et al. Regulation of distinct steps of angiogenesis by different angiogenic molecules. Int J Oncol,1998,12: 749-757., http://www.100md.com