干细胞疗法的最新进展
http://www.100md.com
国外医学输血及血液学分册 2000年第23卷第3期
干细胞疗法的最新进展
南京大学医学院(210093) 苏 畅(综述)
南京大学医学院附属鼓楼医院血液科 欧阳建(审校)
摘 要 干细胞疗法(stem cell therapy)的研究是90年代医学和生物学中最引人关注的热点之一。干细胞具有自我更新与增殖分化的生物学特性,是基因疗法一种理想的靶细胞。虽然对于各类干细胞的分离、培养及体外扩增已进行了大量的研究,但其检测方法、发生和分化的具体过程等仍鲜为人知。本文就造血干细胞、神经元干细胞、胚胎干细胞和肝卵圆细胞研究方面的最新进展作一综述,并探讨它们用于临床治疗造血系统疾病以及其它多种疾病的可能性。
关键词:干细胞疗法 造血 移植 神经元 胚胎
, http://www.100md.com
细胞疗法(cell therapy)近年来已成为治疗多种疾病的新策略,其目的是替代、修复或加强受损的组织或器官的生物学功能[1]。细胞疗法中应用最多的靶细胞即是各种干细胞。干细胞(stem cell,SC)的定义多年来不断进行修正,大多数生物学家和医学家认为干细胞是一类具有自我更新与增殖分化能力的细胞,能产生表现型与基因型和自己完全相同的子细胞,同时还能分化为祖细胞。从干细胞到成熟细胞有许多分化阶段:最原始的干细胞是全能性干细胞(totipotent stem cell),具有自我更新和分化为任何类型组织的能力;迄今为止,只在受精卵才符合这样的定义,囊胚期的胚胎干细胞(embryonic stem cell,ESC)是否具有全能性仍存在很大争议[2]。分化方向已确定的干细胞叫做多能干细胞(pluripotent stem cell),它们将分化为特定的组织,例如造血干细胞将分化为血细胞,肝脏干细胞将分化为肝细胞;这些多能干细胞继续向前分化则成为定向祖细胞(committed progenitor)。持续停留在某种组织中的干细胞被称为组织特异性干细胞,造血干细胞(hematopoietic stem cell,HSC)、肌肉干细胞、表皮层干细胞等都属于此类[3]。随着机体的发育,干细胞逐渐分化为特定类型并行使特定功能。很多成人组织含有干细胞,当组织受到外伤、老化、疾病等的损伤时,这些细胞就增殖分化,产生新的组织来代替它们,以保持机体的稳态平衡。在所有干细胞中,HSC是人们认识最深入的一类。HSC移植用于临床已有多年历史,在治疗血液系统恶性疾病、实体肿瘤以及遗传性免疫缺陷方面已取得了举世公认的成就。90年代以来,分离和体外培养各种来源干细胞的技术不断成熟,引发了新一轮研究干细胞的热潮。1998年,分离人类胚胎干细胞并在体外培养首次获得成功[4-5];1999年1月,神经生物学家Bjornson等[6]在著名杂志《Science》上发表了一篇论文,报道他们用神经元干细胞在接受亚致死量照射毁髓处理的小鼠中实现造血重建的研究结果;9月,HSC的关键性表面标志物被发现[7]。这些干细胞生物学领域引人注目的进展立即激起了生命科学界的强烈反响。
, http://www.100md.com
1 KDR:定义造血干细胞的关键性标志物
造血干细胞是一种组织特异性干细胞,由胚胎期卵黄囊的中胚层细胞衍生而来,相继移行至胚胎内的造血器官、肝、脾以至骨髓,通过不对称性有丝分裂一方面维持自我数目不变, 另一方面不断产生各系祖细胞,维持机体的正常造血功能。HSC是进行造血组织移植后重建长期造血的关键因素。1961年Till和McCulloch第一次以小鼠脾结节实验证实了HSC的存在,但目前还不能从形态上识别HSC,因此尚无法直观地研究HSC的分化。寻找分离与纯化HSC的方法是通过研究HSC表面标志物来进行的。
目前医学界普遍认为人类HSC的表面标志应为CD34+,CD38-,Lin-,HLA-DR-,Thy-1+,ckit+,CD45RA-,CD71-。其中CD34是临床上应用最多的造血祖细胞标志物,但近来关于原始的干细胞应为CD34+还是CD34-仍存在争议[8,9]。人类出生后造血组织中有0.1%~0.5%的CD34+细胞表达KDR,即血管内皮生长因子受体2(VEGFR2)。Zieglar等[7]用分别来源于人类骨髓(BM)、外周血(PB)、脐带血(CB)的CD34+、CD34+KDR+和CD34+KDR-细胞对经致死剂量照射的NOD-SCID小鼠进行了造血组织移植,三种细胞移植总数分别为:0.5~2.5×105 CD34+细胞/小鼠、0.5~1.0×104 CD34+KDR+细胞/小鼠、1.0~2.5×105 CD34+KDR-细胞/小鼠;CD34+与CD34+KDR+细胞均成功植入,而CD34+/KDR-细胞未植入。限制性稀释试验表明:能长期持续植入的细胞均为KDR+,BM中的CD34+KDR+细胞有20%为HSC;由12周长期培养(long-term culture,LTC)试验得出的数据显示:BM、PB及CB中的CD34+KDR+细胞有25%~42%为HSC;若在LTC培养基中加入VEGF,此数据上升为53%~60%。在不加入生长因子的情况下,长期培养存活下来的细胞中有95%为KDR+。在CD34+细胞的LTC中,造血祖细胞(hematopoietic progenitor cell,HPC)产生数量在5~12周之间呈下降趋势;在KDR-LTC中,HPC产生数量在5~8周之间下降,12周时已检测不到HPC;而在KDR+/±LTC中,HPC数量在5~8周之间较低,而12周时显著上升。Zieglar等由此得出结论:KDR是定义HSC的阳性标志物,HSC存在于CD34+KDR-亚群,而HPC存在于CD34+KDR-亚群,分化程度介于这两者之间的祖细胞则同时存在于这两种亚群中,因而KDR可将干/祖细胞区别开来。在相同一组试验中,作者还观察到BM和CB里有1%CD34-Lin-细胞为KDR+,在移植细胞总数较大情况下(>105),来源于BM和CB的CD34-Lin-细胞也能植入绵羊胚胎和NOD-SCID小鼠中,并表达多系造血,但CD34+KDR+细胞群中所含的干细胞活性远大于CD34-KDR+细胞群中所含的干细胞活性远大于CD34-KDR+细胞群中所含的干细胞活性。因此作者认为,在长期植入能力的HSC为CD34+而非CD34-细胞群。
, http://www.100md.com
2 神经元干细胞重建造血
在传统的发生生物学观点看来,成人脑细胞一经受损就永远不能再生新的神经元。然而,近来有人报道中枢神经系统部分细胞具有自我修复和分化为三种类型成人脑细胞的能力,这三种细胞是:星状细胞,寡树突胶质细胞(两者均属胶质细胞)和神经元[10]。这些细胞显然符合干细胞的定义,因此被称为神经元干细胞(neural stem cell,NSC)。这个结果最近被Johansson等[11]的工作所进一步证实,他们发现很少一部分室管膜层细胞在组织受损伤或受到成纤维细胞因子(FGF-2)和上皮细胞生长因子(EGF)刺激时,可以快速增殖并分化出神经元和胶质细胞。然而NSC的功能似乎还不止于此。近年来有人提出大脑的部份细胞可完成分化为其它类型细胞的功能,在实验室中也观察到一系列现象暗示脑细胞的“多面性”(versatility)[12]:①在胚胎发育过程中,肌肉细胞(与脑细胞发生于不同胚层)可在脑组织中出现;②在某些类型的脑肿瘤中,也可见到肌肉细胞。没有知道这些肌肉细胞的真正来源,人们只能推测:“脑细胞可能具有比已知功能广泛得多的分化能力”(C.Bjornson),是脑细胞分化出了肌肉细胞。
, 百拇医药
1999年1月的《Science》上发表了Bjornson等[6]1年来在小鼠干细胞移植中得出的惊人结果:他们以ROSA26小鼠作为供体,将分别来自胎鼠和成年小鼠前脑的NSC以及成年小鼠骨髓细胞注射入受亚致死量照射、骨髓被摧毁的Balb/c小鼠中,注射的细胞数量分别为106 cells/受体小鼠(前脑细胞)、107 cells/受体小鼠(骨髓细胞)。研究人员还对来自ROSA26的NSC进行了体外集落培养,把培养后的细胞作为另一种供体细胞。选中ROSA26小鼠作为供体的原因是它们与Balb/c小鼠的免背景不同,并且可用转基因的方法在其NSC和骨髓HSC基因组中插入LazZ基因(编码半乳糖苷酶),便于移植后追踪细胞的去路。在ROSA26骨髓以及胎鼠、成年小鼠以及集落培养的NSC中均插入了LazZ基因。接受这四种来源细胞的Balb/c受体均成功地重建造血,并可观察到LazZ基因的强烈信号。移植后5个月,在受体的血液中追踪到一些细胞,它们同时表达供体标记基因编码的蛋白与成熟血细胞才能产生的蛋白;受体小鼠的骨髓中也有从供体NSC分化而来的不成熟的造血前体细胞。为了检验植入骨髓的NSC是否具有造血功能,研究人员应用了体外集落形成、免疫组化和流式细胞仪分析这些细胞,具体实验方法见文献[6]。在甲基纤维素培养基中接种植入的NSC,14天后可观察到造血前体细胞集落形成,集落中95%的细胞具有半乳糖苷酶活性。约5%的集落无此活性,说明某些内源性造血前体细胞在亚致死量照射后仍然存活。集落类型包括纯粒系(13%)、粒-巨噬系(30%)、纯巨噬系(22%)、混合性集落(19%),另外还有少量巨细胞(<1%)和B细胞(<10%)集落。小鼠脾集落分析证实供体来源的NSC产生了B、T及髓系细胞。在这一系列实验中红系未予考虑,因为检测半乳糖苷酶的染色方法对红系细胞不准确。Bjornson小组由此得出结论:ROSA26来源的NSC在植入经照射摧毁骨髓的Balb/c小鼠后可以生成造血前体细胞并重建造血。这个不同寻常的结果显示:成年动物NSC实际的分化能力要远远比预期的广泛。
, 百拇医药
脑与血液之间的关系向来复杂,人们早就发现脑细胞中有一种叫做小胶质细胞的巨噬细胞,这种细胞既可以起源于神经上皮,又可以起源于骨髓(Theele.DP,1993)。更有人推论:成年动物的骨髓细胞可能移行入脑,其中大部份分化为小胶质细胞,另一小部分则可能分化为星状细胞[4]。现在Bjornson小组的工作初步证实了相反的分化途径:从NSC分化为血细胞,(见图1)。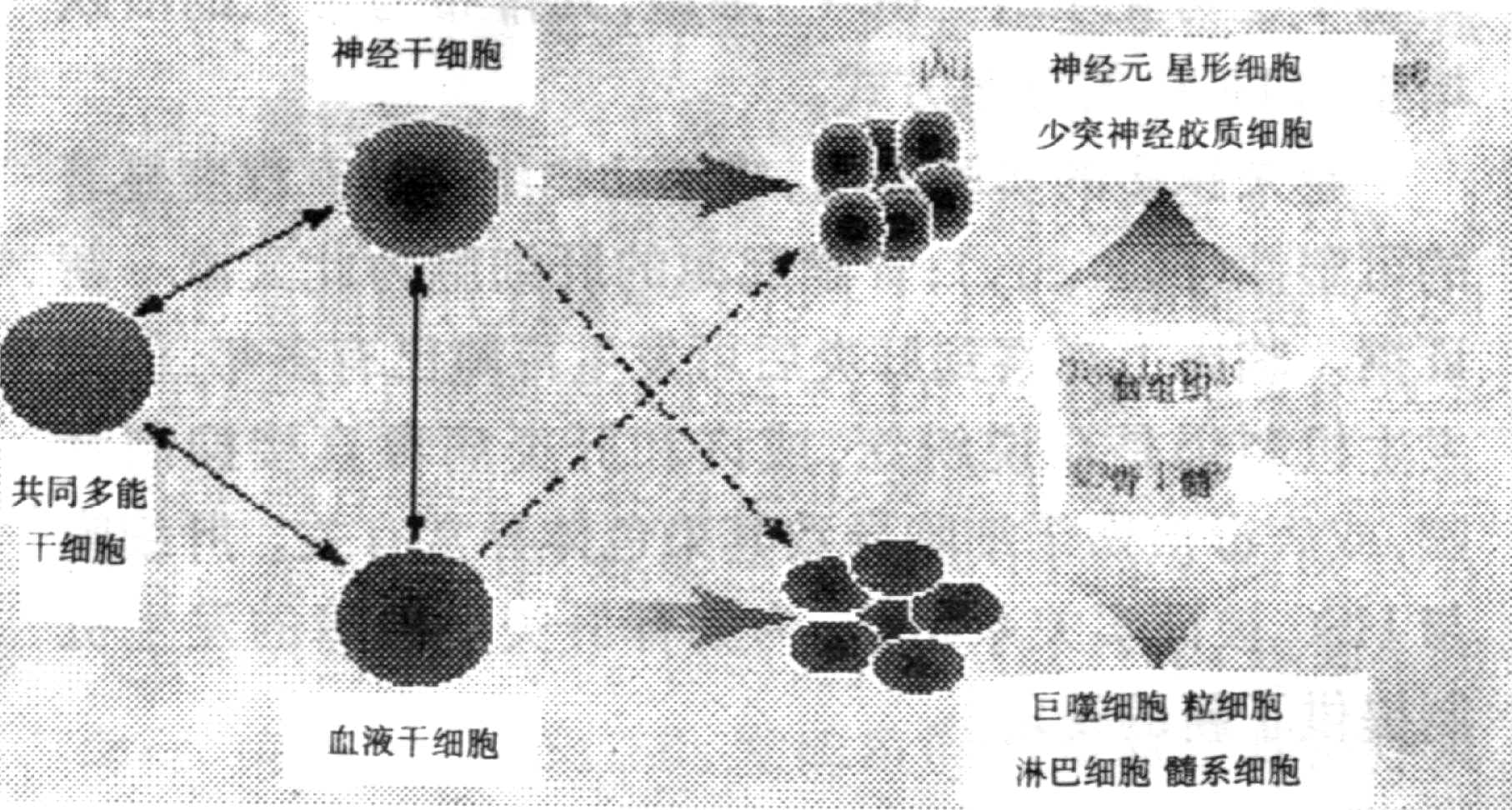
没人知道是什么机制导致NSC分化为血细胞。在受到TBI照射的小鼠中,有某种信号刺激残留的造血干细胞分化增殖,Bjornson等推论同样的信号可能对植入的NSC也起作用。Rochefeller大学的神经生物学家A.Alvarez-Buylla认为:“在成人的血液系统中,有某种强有力的信号可以指示起源不同的细胞该去做些什么。”植入的效果看来可以持续很长时间,在移植一年后仍可从受体小鼠血液中追踪到来源于NSC的血细胞——这意味着移植的效果可以长到足以满足临床应用的要求。如果这项研究结果在人类中也得到证实的话,我们可以大胆设想:NSC也许可以成为移植用造血干细胞的一种新来源,用于白血病、再障等血液系统疾病的治疗。NSC重建造血更重要的意义也许在于基因疗法方面:为了使目的基因能在体内长期甚至永久地表达,被导入基因的靶细胞需要具有在体内自我更新和自我维持的能力,造血干细胞是一种非常理想的选择。然而,骨髓来源的造血干细胞在体外培养基中生长不佳,给基因治疗的研究造成了不小困难。NSC易于在体外培养,作为转基因的靶细胞将更为理想。NSC可能将作为基因疗法的最新干细胞来源用于糖尿病、高血压、帕金森病和各种单基因缺陷疾病的治疗。既然NSC可以分化为HSC,反过来HSC亦可能分化为NSC,已经有人提出了这种设想:可否把纯化的HSC注射入脑中治疗神经系统疾病呢[13]?回答这个问题还需要大量的研究工作。
, 百拇医药
3 胚胎干细胞:热点和伦理禁区
干细胞研究的另一个热点首推胚胎干细胞。小鼠ESC为“多能干性”,即它们可以自我复制并分化为多种细胞类型,但尚未确认它们是“全能干性”的(即具有分化为所有细胞类型的能力);人类ESC也是如此[2]。但可以肯定,作为一种可分化为多种细胞类型、又能在培养基中不断自我更新的细胞来源,ESC在基础研究和临床移植方面具有重大价值。80年代早期就从小鼠囊胚中分离出了ESC[14];1998年有两个研究小组首次报道分出了人类胚胎干细胞,表明人类的胚胎生物学技术又有了一次重大飞跃[4,5]。这些细胞不仅可分化为所有类型的组织,在受控良好的条件下也能在培养基中长期维持不分化状态。人类ESC分离的成功开拓了一个应用干细胞的全新领域,这些细胞用于科研及临床的前景无限广阔,包括成为组织移植、细胞替代以及基因疗法的新来源。最初的设想是用患者本人的ESC。怎样才能以ESC作起始细胞形成所需的组织进行移植?怎样才能使成人的细胞变成ESC呢?研究者们设计了三种方法[2]。第一种方法被称为治疗性克隆(therapeutic cloning):把人类卵细胞的核用成人细胞核取代,在体外培养到囊胚期,然后从囊胚的内细胞层获得ESC。另一种方法是用动物的卵细胞作为人类的细胞核受体,这方面的试验尚未获得成功。第三种方法是融合成人细胞核与ESC的胞质。今天,用治疗性克隆方法获得的囊胚还无法发育成一个真正的胚胎,人类的伦理观念也无法接受这样的胚胎形成。
, http://www.100md.com
在组织移植中应用人类ESC是极为激动人心的设想,临床上首选的治疗目标包括神经退行性病变、糖尿病、脊髓损伤及造血系统疾病。为了实现成功的移植,人们必须首先获得足够数量的纯化的干细胞,并且要设法克服移植后的排斥反应,其可能的方法包括[15]:①建立ESC库,提供多个主要组织相容性抗原等位位点以供MHC相配合;②建立普遍适用的供者细胞系(donor lines),在这些细胞系中对MHC进行遗传学上的修饰或变更以避免排斥反应的发生。这一目标至少在小鼠中已部分实现;③用同源重组的方法将受体的MHC基因转导入ESC;④直接把受者的细胞的细胞核植入ESC中,子代细胞将全部含有受体的MHC基因。对细胞、组织相互作用的探索以及细胞基质的应用将使体外生成复杂的器官(例如肾、肺)成为可能。甚至可以想象用体内已有的器官作为“支架”,让从ESC衍生而来的细胞替代原有的细胞。但是,临床上应用ESC也有其内在的危险性。小鼠ESC注射入成年鼠后会长成畸胎瘤,没有证据证明人类ESC不具有同样的致肿瘤性。至今我们还不知道形成肿瘤要求的最小ESC数量和最短时间。解决这个问题的办法也许是:制造遗传学上的安全机制——在ESC中插入自杀基因,当移植的ESC变得致肿瘤时可以摧毁它们。人类ESC可以被强制沿着某一条人们需要的途径分化吗?能让培养基里的所有ESC都同时向着这个方面分化吗?什么是中间细胞类型,如何去定义它们?哪些标记物和什么方法可用于检出需要的细胞类型呢?找到这些问题的答案将使人类关于细胞的知识得到突飞猛进的拓展。
, 百拇医药
然而,ESC的研究也遭遇了许多来自生物学外的阻挠。当苏格兰科学家宣布成功克隆绵羊“多利”后,世界各国就曾关于胚胎研究涉及到的伦理、道德、法律问题展开激烈的争论,而这两次报道激起了新一轮的辩论热潮。人类胚胎是否享有“人”的权利?将胚胎细胞用于医学和生物学研究是否符合道德?迄今为止,包括美国在内的许多发达国家禁止政府赞助这方面的研究,甚至制定了相应的法律;ESC分离培养的成功再次触及到这个伦理禁区。我们在胚胎的研究上还能再走多远?这已不再是个纯粹的生物科学问题。
4 肝卵圆细胞可能起源于骨髓
成人肝卵圆细胞(hepatic oval cell,HOC)在某些条件下可以增殖分化,特别是当肝脏受到损伤而导致肝细胞停止分化时;HOC也许是肝脏干细胞到成熟肝细胞的中间产物。HOC表达CD34、Thy-1、C-kitmRNA及其蛋白、flt-3受体mRNA,而这些都是HSC的标记物,由此使人联想到:HOC与HSC有无内在联系?
, http://www.100md.com
Peterson等[6]猜想HOC及其它肝细胞来源于骨髓,或至少与骨髓有相关性, 他们用移植的方法来验证这个假设。移植在大鼠间进行,所有的受体大鼠均给予2-乙酰氟胺(2-acetylaminofluorene,2-AAF)或CC14以抑制自身肝细胞的分化,然后进行三组移植:①雄性大鼠的BM移植给受致死量照射的同种雌性大鼠,用DNA探针检测Y染色sry区的方法来分辨受体中的供体细胞。移植后,非实质性肝细胞中的Thy-1+和Thy-1-细胞亚群分别于第9天和第13天显示Y染色体PCR产物(+)。第9天时这实质性肝细胞无Y信号,但第13天即检测到此信号,这时HOC正开始分化为肝细胞。部份肝细胞为Y(+)的结果提示,它们来源于供体。为了证实PCR的结果,Peterson小组还进行了冰冻切片的Y染色体sry基因原位杂交,其结果与PCR完全一致。②二肽肽酶IV阳性(DPPTV+)的雄性大鼠BM移植给DPPTV-的同种雌性大鼠,检测受体中DPPTV+的细胞。移植后在HOC中及小肝细胞中检测到DDPTV+信号。对这些细胞进行三色荧光染色,DPPTV+的细胞H4和C-CAM染色为阳性,后两者是成熟肝细胞特异性标记物。这个结果雄辩地证明了带有移植标记(DPPTV+)的细胞为成熟肝细胞。③用表达L21-6抗原的Lewis大鼠做受体,不表达此抗原的Brown-Norway大鼠作异基因供体进行全肝移植,证实肝外来源的细胞(L21-6+)可以在移植后的肝中找到,这些细胞可能来自受体自身的骨髓。肝胆管结构中也可见L21-6(+)细胞,其排布为常见的活跃增生的HOC的分布方式。
, http://www.100md.com
越来越多的实验表明,成年动物细胞具有程度显著的可塑性(plasticity);骨髓起源的肝细胞为此又添一新证据。临床上观察到肝炎后可发生再障已有多年,但其发生机制仍是众说纷纭,或许和肝炎病毒直接抑制骨髓,或病毒损伤干细胞导致其染色体异常有关。肝细胞与HSC被证实关系密切,为解释肝炎后再障的发生机制提供了新的视角。
5 干细胞分化的复杂性
ESC已被用于在体外研究神经细胞、造血各系细胞和心肌细胞的起源及分化[17-19]。研究人员希望能够控制体外培育的干细胞分化的方向,而现在人们却只能在实验室中观察细胞的自发分化;迄今为止,触发和控制细胞分化的机制仍不明了,这是一个非常复杂的过程,也是发生生物学和细胞生物学中最大的谜语之一。以神经元的分化为例,即使应用现有的功能最强的神经生长因子,也只能诱导培养的神经元干细胞中的一半分化为神经元。
, 百拇医药 神经生物学家认为,脑细胞的分化也许依赖于一组相邻细胞相互作用的组合,细胞处于一种三维空间结构中,接受的分化信号也是三维的信号。甚至连机械作用力也可以影响干细胞的分化进程。有作者[20]对间充质干细胞进行了研究,发现在某种培养条件下这些细胞分化为骨组织,而轻轻旋转一下细胞周围的基质可就导致它们分化为腱,如果让细胞堆积生长则可分化为软骨。1998年,发生生物学家Prockop等[21]报道,当人类骨髓基质细胞(一般情况下分化为肌肉和其它间质组织)被注射入大鼠脑中时,部分细胞植入并分化为了神经胶质细胞。南佛罗里达大学Juan Sanchez-Ramos在一次会议上报道,培养的骨髓基质细胞中加入神经生长因子时变成了神经元。
毋庸置疑,干细胞是近年来生物学上最有趣、最复杂、也最有吸引力的领域之一。即使对于发现并且已应用于临床多年造血干细胞,至今也未有明确的检测方法,其生物学特性和移植后造血重建的具体过程仍处于一个未被破译的“黑匣子”中 。至于人们认识不久的NSC和ESC,其研究才刚刚开始起步,还有许多实际问题有待解决。例如:什么培养条件最适于干细胞的体外生长?在扩增干细胞以获得移植用足够数量的同时,如何能保持其自我维持不分化的特性?ESC研究遇到的伦理障碍如何去跨越?等等。可以预计,NSC和ESC作为成熟的干细胞来源用于临床还有一段长长的路要走。然而,这些初步成就为基因疗法开辟了新的领域,而且大大扩展了干细胞移植的适应症范围,必将使干细胞生物学发展到一个新纪元。
, http://www.100md.com
6 参考文献
1 Gage FH.Nature,1998,392:18
2 Soiter D,Gearhart J.Science,1999,283:1468
3 Loeffler M,Bratke T,Paulus U,et al.J Theor Biol,1997,186:41
4 Thomas JA,Itskovita-Eldor J,Shapiro SS,et al.Science,1998,282:1145
5 Marshall E.Science,1998,282:1014
6 Bjornson CR,Rietze RL,Reynolds BA,et al.Science,1999,283:534
, http://www.100md.com
7 Ziegler BL,Valtieri M,Porada GA,et al.Science,1999,285:1553
8 Goodell MA,Rosenzeig M,Kim H, et al.Nature Med,1997,3:1337
9 Zanjani ED,Almeida-Porada G,Linvingston AG,et al.Exp Hematol,1998,26:353
10 Morrison SJ,Shah NM,Anderson DJ.Cell,1997,88:287
11 Johansson CB,Momma S,Clarke DL,et al.Cell,1999,96:25
12 McKay RD.Science,1997,276:66
, 百拇医药
13 Vogel G,Science,1999,283,1432
14 Evans MJ,Kanfman MH.Nature,1981,292:154
15 Gearhart J.Science,1999,282:1061
16 Peterson BE,Bowen WC,Patrene KD,et al.Science,1999,284:1168
17 Finley MF,Kulkarni N,Huettner JE.J Neurosci,1996,16:1056
18 Li M,Pevney L,Lovell-Badge R,et al.Curr Biol,1998,8:971
19 Hde N,Graham GJ,Menzal U,et al.Blood,1996,88:1266
20 Pittenger MF,Mackay AM,Marshak DR.Science,1999,284:143
21 Azzi SA,Stokes D,Prockop DJ,et al.Proc Natl Acad Sci USA,1998,95:3908, 百拇医药
南京大学医学院(210093) 苏 畅(综述)
南京大学医学院附属鼓楼医院血液科 欧阳建(审校)
摘 要 干细胞疗法(stem cell therapy)的研究是90年代医学和生物学中最引人关注的热点之一。干细胞具有自我更新与增殖分化的生物学特性,是基因疗法一种理想的靶细胞。虽然对于各类干细胞的分离、培养及体外扩增已进行了大量的研究,但其检测方法、发生和分化的具体过程等仍鲜为人知。本文就造血干细胞、神经元干细胞、胚胎干细胞和肝卵圆细胞研究方面的最新进展作一综述,并探讨它们用于临床治疗造血系统疾病以及其它多种疾病的可能性。
关键词:干细胞疗法 造血 移植 神经元 胚胎
, http://www.100md.com
细胞疗法(cell therapy)近年来已成为治疗多种疾病的新策略,其目的是替代、修复或加强受损的组织或器官的生物学功能[1]。细胞疗法中应用最多的靶细胞即是各种干细胞。干细胞(stem cell,SC)的定义多年来不断进行修正,大多数生物学家和医学家认为干细胞是一类具有自我更新与增殖分化能力的细胞,能产生表现型与基因型和自己完全相同的子细胞,同时还能分化为祖细胞。从干细胞到成熟细胞有许多分化阶段:最原始的干细胞是全能性干细胞(totipotent stem cell),具有自我更新和分化为任何类型组织的能力;迄今为止,只在受精卵才符合这样的定义,囊胚期的胚胎干细胞(embryonic stem cell,ESC)是否具有全能性仍存在很大争议[2]。分化方向已确定的干细胞叫做多能干细胞(pluripotent stem cell),它们将分化为特定的组织,例如造血干细胞将分化为血细胞,肝脏干细胞将分化为肝细胞;这些多能干细胞继续向前分化则成为定向祖细胞(committed progenitor)。持续停留在某种组织中的干细胞被称为组织特异性干细胞,造血干细胞(hematopoietic stem cell,HSC)、肌肉干细胞、表皮层干细胞等都属于此类[3]。随着机体的发育,干细胞逐渐分化为特定类型并行使特定功能。很多成人组织含有干细胞,当组织受到外伤、老化、疾病等的损伤时,这些细胞就增殖分化,产生新的组织来代替它们,以保持机体的稳态平衡。在所有干细胞中,HSC是人们认识最深入的一类。HSC移植用于临床已有多年历史,在治疗血液系统恶性疾病、实体肿瘤以及遗传性免疫缺陷方面已取得了举世公认的成就。90年代以来,分离和体外培养各种来源干细胞的技术不断成熟,引发了新一轮研究干细胞的热潮。1998年,分离人类胚胎干细胞并在体外培养首次获得成功[4-5];1999年1月,神经生物学家Bjornson等[6]在著名杂志《Science》上发表了一篇论文,报道他们用神经元干细胞在接受亚致死量照射毁髓处理的小鼠中实现造血重建的研究结果;9月,HSC的关键性表面标志物被发现[7]。这些干细胞生物学领域引人注目的进展立即激起了生命科学界的强烈反响。
, http://www.100md.com
1 KDR:定义造血干细胞的关键性标志物
造血干细胞是一种组织特异性干细胞,由胚胎期卵黄囊的中胚层细胞衍生而来,相继移行至胚胎内的造血器官、肝、脾以至骨髓,通过不对称性有丝分裂一方面维持自我数目不变, 另一方面不断产生各系祖细胞,维持机体的正常造血功能。HSC是进行造血组织移植后重建长期造血的关键因素。1961年Till和McCulloch第一次以小鼠脾结节实验证实了HSC的存在,但目前还不能从形态上识别HSC,因此尚无法直观地研究HSC的分化。寻找分离与纯化HSC的方法是通过研究HSC表面标志物来进行的。
目前医学界普遍认为人类HSC的表面标志应为CD34+,CD38-,Lin-,HLA-DR-,Thy-1+,ckit+,CD45RA-,CD71-。其中CD34是临床上应用最多的造血祖细胞标志物,但近来关于原始的干细胞应为CD34+还是CD34-仍存在争议[8,9]。人类出生后造血组织中有0.1%~0.5%的CD34+细胞表达KDR,即血管内皮生长因子受体2(VEGFR2)。Zieglar等[7]用分别来源于人类骨髓(BM)、外周血(PB)、脐带血(CB)的CD34+、CD34+KDR+和CD34+KDR-细胞对经致死剂量照射的NOD-SCID小鼠进行了造血组织移植,三种细胞移植总数分别为:0.5~2.5×105 CD34+细胞/小鼠、0.5~1.0×104 CD34+KDR+细胞/小鼠、1.0~2.5×105 CD34+KDR-细胞/小鼠;CD34+与CD34+KDR+细胞均成功植入,而CD34+/KDR-细胞未植入。限制性稀释试验表明:能长期持续植入的细胞均为KDR+,BM中的CD34+KDR+细胞有20%为HSC;由12周长期培养(long-term culture,LTC)试验得出的数据显示:BM、PB及CB中的CD34+KDR+细胞有25%~42%为HSC;若在LTC培养基中加入VEGF,此数据上升为53%~60%。在不加入生长因子的情况下,长期培养存活下来的细胞中有95%为KDR+。在CD34+细胞的LTC中,造血祖细胞(hematopoietic progenitor cell,HPC)产生数量在5~12周之间呈下降趋势;在KDR-LTC中,HPC产生数量在5~8周之间下降,12周时已检测不到HPC;而在KDR+/±LTC中,HPC数量在5~8周之间较低,而12周时显著上升。Zieglar等由此得出结论:KDR是定义HSC的阳性标志物,HSC存在于CD34+KDR-亚群,而HPC存在于CD34+KDR-亚群,分化程度介于这两者之间的祖细胞则同时存在于这两种亚群中,因而KDR可将干/祖细胞区别开来。在相同一组试验中,作者还观察到BM和CB里有1%CD34-Lin-细胞为KDR+,在移植细胞总数较大情况下(>105),来源于BM和CB的CD34-Lin-细胞也能植入绵羊胚胎和NOD-SCID小鼠中,并表达多系造血,但CD34+KDR+细胞群中所含的干细胞活性远大于CD34-KDR+细胞群中所含的干细胞活性远大于CD34-KDR+细胞群中所含的干细胞活性。因此作者认为,在长期植入能力的HSC为CD34+而非CD34-细胞群。
, http://www.100md.com
2 神经元干细胞重建造血
在传统的发生生物学观点看来,成人脑细胞一经受损就永远不能再生新的神经元。然而,近来有人报道中枢神经系统部分细胞具有自我修复和分化为三种类型成人脑细胞的能力,这三种细胞是:星状细胞,寡树突胶质细胞(两者均属胶质细胞)和神经元[10]。这些细胞显然符合干细胞的定义,因此被称为神经元干细胞(neural stem cell,NSC)。这个结果最近被Johansson等[11]的工作所进一步证实,他们发现很少一部分室管膜层细胞在组织受损伤或受到成纤维细胞因子(FGF-2)和上皮细胞生长因子(EGF)刺激时,可以快速增殖并分化出神经元和胶质细胞。然而NSC的功能似乎还不止于此。近年来有人提出大脑的部份细胞可完成分化为其它类型细胞的功能,在实验室中也观察到一系列现象暗示脑细胞的“多面性”(versatility)[12]:①在胚胎发育过程中,肌肉细胞(与脑细胞发生于不同胚层)可在脑组织中出现;②在某些类型的脑肿瘤中,也可见到肌肉细胞。没有知道这些肌肉细胞的真正来源,人们只能推测:“脑细胞可能具有比已知功能广泛得多的分化能力”(C.Bjornson),是脑细胞分化出了肌肉细胞。
, 百拇医药
1999年1月的《Science》上发表了Bjornson等[6]1年来在小鼠干细胞移植中得出的惊人结果:他们以ROSA26小鼠作为供体,将分别来自胎鼠和成年小鼠前脑的NSC以及成年小鼠骨髓细胞注射入受亚致死量照射、骨髓被摧毁的Balb/c小鼠中,注射的细胞数量分别为106 cells/受体小鼠(前脑细胞)、107 cells/受体小鼠(骨髓细胞)。研究人员还对来自ROSA26的NSC进行了体外集落培养,把培养后的细胞作为另一种供体细胞。选中ROSA26小鼠作为供体的原因是它们与Balb/c小鼠的免背景不同,并且可用转基因的方法在其NSC和骨髓HSC基因组中插入LazZ基因(编码半乳糖苷酶),便于移植后追踪细胞的去路。在ROSA26骨髓以及胎鼠、成年小鼠以及集落培养的NSC中均插入了LazZ基因。接受这四种来源细胞的Balb/c受体均成功地重建造血,并可观察到LazZ基因的强烈信号。移植后5个月,在受体的血液中追踪到一些细胞,它们同时表达供体标记基因编码的蛋白与成熟血细胞才能产生的蛋白;受体小鼠的骨髓中也有从供体NSC分化而来的不成熟的造血前体细胞。为了检验植入骨髓的NSC是否具有造血功能,研究人员应用了体外集落形成、免疫组化和流式细胞仪分析这些细胞,具体实验方法见文献[6]。在甲基纤维素培养基中接种植入的NSC,14天后可观察到造血前体细胞集落形成,集落中95%的细胞具有半乳糖苷酶活性。约5%的集落无此活性,说明某些内源性造血前体细胞在亚致死量照射后仍然存活。集落类型包括纯粒系(13%)、粒-巨噬系(30%)、纯巨噬系(22%)、混合性集落(19%),另外还有少量巨细胞(<1%)和B细胞(<10%)集落。小鼠脾集落分析证实供体来源的NSC产生了B、T及髓系细胞。在这一系列实验中红系未予考虑,因为检测半乳糖苷酶的染色方法对红系细胞不准确。Bjornson小组由此得出结论:ROSA26来源的NSC在植入经照射摧毁骨髓的Balb/c小鼠后可以生成造血前体细胞并重建造血。这个不同寻常的结果显示:成年动物NSC实际的分化能力要远远比预期的广泛。
, 百拇医药
脑与血液之间的关系向来复杂,人们早就发现脑细胞中有一种叫做小胶质细胞的巨噬细胞,这种细胞既可以起源于神经上皮,又可以起源于骨髓(Theele.DP,1993)。更有人推论:成年动物的骨髓细胞可能移行入脑,其中大部份分化为小胶质细胞,另一小部分则可能分化为星状细胞[4]。现在Bjornson小组的工作初步证实了相反的分化途径:从NSC分化为血细胞,(见图1)。

没人知道是什么机制导致NSC分化为血细胞。在受到TBI照射的小鼠中,有某种信号刺激残留的造血干细胞分化增殖,Bjornson等推论同样的信号可能对植入的NSC也起作用。Rochefeller大学的神经生物学家A.Alvarez-Buylla认为:“在成人的血液系统中,有某种强有力的信号可以指示起源不同的细胞该去做些什么。”植入的效果看来可以持续很长时间,在移植一年后仍可从受体小鼠血液中追踪到来源于NSC的血细胞——这意味着移植的效果可以长到足以满足临床应用的要求。如果这项研究结果在人类中也得到证实的话,我们可以大胆设想:NSC也许可以成为移植用造血干细胞的一种新来源,用于白血病、再障等血液系统疾病的治疗。NSC重建造血更重要的意义也许在于基因疗法方面:为了使目的基因能在体内长期甚至永久地表达,被导入基因的靶细胞需要具有在体内自我更新和自我维持的能力,造血干细胞是一种非常理想的选择。然而,骨髓来源的造血干细胞在体外培养基中生长不佳,给基因治疗的研究造成了不小困难。NSC易于在体外培养,作为转基因的靶细胞将更为理想。NSC可能将作为基因疗法的最新干细胞来源用于糖尿病、高血压、帕金森病和各种单基因缺陷疾病的治疗。既然NSC可以分化为HSC,反过来HSC亦可能分化为NSC,已经有人提出了这种设想:可否把纯化的HSC注射入脑中治疗神经系统疾病呢[13]?回答这个问题还需要大量的研究工作。
, 百拇医药
3 胚胎干细胞:热点和伦理禁区
干细胞研究的另一个热点首推胚胎干细胞。小鼠ESC为“多能干性”,即它们可以自我复制并分化为多种细胞类型,但尚未确认它们是“全能干性”的(即具有分化为所有细胞类型的能力);人类ESC也是如此[2]。但可以肯定,作为一种可分化为多种细胞类型、又能在培养基中不断自我更新的细胞来源,ESC在基础研究和临床移植方面具有重大价值。80年代早期就从小鼠囊胚中分离出了ESC[14];1998年有两个研究小组首次报道分出了人类胚胎干细胞,表明人类的胚胎生物学技术又有了一次重大飞跃[4,5]。这些细胞不仅可分化为所有类型的组织,在受控良好的条件下也能在培养基中长期维持不分化状态。人类ESC分离的成功开拓了一个应用干细胞的全新领域,这些细胞用于科研及临床的前景无限广阔,包括成为组织移植、细胞替代以及基因疗法的新来源。最初的设想是用患者本人的ESC。怎样才能以ESC作起始细胞形成所需的组织进行移植?怎样才能使成人的细胞变成ESC呢?研究者们设计了三种方法[2]。第一种方法被称为治疗性克隆(therapeutic cloning):把人类卵细胞的核用成人细胞核取代,在体外培养到囊胚期,然后从囊胚的内细胞层获得ESC。另一种方法是用动物的卵细胞作为人类的细胞核受体,这方面的试验尚未获得成功。第三种方法是融合成人细胞核与ESC的胞质。今天,用治疗性克隆方法获得的囊胚还无法发育成一个真正的胚胎,人类的伦理观念也无法接受这样的胚胎形成。
, http://www.100md.com
在组织移植中应用人类ESC是极为激动人心的设想,临床上首选的治疗目标包括神经退行性病变、糖尿病、脊髓损伤及造血系统疾病。为了实现成功的移植,人们必须首先获得足够数量的纯化的干细胞,并且要设法克服移植后的排斥反应,其可能的方法包括[15]:①建立ESC库,提供多个主要组织相容性抗原等位位点以供MHC相配合;②建立普遍适用的供者细胞系(donor lines),在这些细胞系中对MHC进行遗传学上的修饰或变更以避免排斥反应的发生。这一目标至少在小鼠中已部分实现;③用同源重组的方法将受体的MHC基因转导入ESC;④直接把受者的细胞的细胞核植入ESC中,子代细胞将全部含有受体的MHC基因。对细胞、组织相互作用的探索以及细胞基质的应用将使体外生成复杂的器官(例如肾、肺)成为可能。甚至可以想象用体内已有的器官作为“支架”,让从ESC衍生而来的细胞替代原有的细胞。但是,临床上应用ESC也有其内在的危险性。小鼠ESC注射入成年鼠后会长成畸胎瘤,没有证据证明人类ESC不具有同样的致肿瘤性。至今我们还不知道形成肿瘤要求的最小ESC数量和最短时间。解决这个问题的办法也许是:制造遗传学上的安全机制——在ESC中插入自杀基因,当移植的ESC变得致肿瘤时可以摧毁它们。人类ESC可以被强制沿着某一条人们需要的途径分化吗?能让培养基里的所有ESC都同时向着这个方面分化吗?什么是中间细胞类型,如何去定义它们?哪些标记物和什么方法可用于检出需要的细胞类型呢?找到这些问题的答案将使人类关于细胞的知识得到突飞猛进的拓展。
, 百拇医药
然而,ESC的研究也遭遇了许多来自生物学外的阻挠。当苏格兰科学家宣布成功克隆绵羊“多利”后,世界各国就曾关于胚胎研究涉及到的伦理、道德、法律问题展开激烈的争论,而这两次报道激起了新一轮的辩论热潮。人类胚胎是否享有“人”的权利?将胚胎细胞用于医学和生物学研究是否符合道德?迄今为止,包括美国在内的许多发达国家禁止政府赞助这方面的研究,甚至制定了相应的法律;ESC分离培养的成功再次触及到这个伦理禁区。我们在胚胎的研究上还能再走多远?这已不再是个纯粹的生物科学问题。
4 肝卵圆细胞可能起源于骨髓
成人肝卵圆细胞(hepatic oval cell,HOC)在某些条件下可以增殖分化,特别是当肝脏受到损伤而导致肝细胞停止分化时;HOC也许是肝脏干细胞到成熟肝细胞的中间产物。HOC表达CD34、Thy-1、C-kitmRNA及其蛋白、flt-3受体mRNA,而这些都是HSC的标记物,由此使人联想到:HOC与HSC有无内在联系?
, http://www.100md.com
Peterson等[6]猜想HOC及其它肝细胞来源于骨髓,或至少与骨髓有相关性, 他们用移植的方法来验证这个假设。移植在大鼠间进行,所有的受体大鼠均给予2-乙酰氟胺(2-acetylaminofluorene,2-AAF)或CC14以抑制自身肝细胞的分化,然后进行三组移植:①雄性大鼠的BM移植给受致死量照射的同种雌性大鼠,用DNA探针检测Y染色sry区的方法来分辨受体中的供体细胞。移植后,非实质性肝细胞中的Thy-1+和Thy-1-细胞亚群分别于第9天和第13天显示Y染色体PCR产物(+)。第9天时这实质性肝细胞无Y信号,但第13天即检测到此信号,这时HOC正开始分化为肝细胞。部份肝细胞为Y(+)的结果提示,它们来源于供体。为了证实PCR的结果,Peterson小组还进行了冰冻切片的Y染色体sry基因原位杂交,其结果与PCR完全一致。②二肽肽酶IV阳性(DPPTV+)的雄性大鼠BM移植给DPPTV-的同种雌性大鼠,检测受体中DPPTV+的细胞。移植后在HOC中及小肝细胞中检测到DDPTV+信号。对这些细胞进行三色荧光染色,DPPTV+的细胞H4和C-CAM染色为阳性,后两者是成熟肝细胞特异性标记物。这个结果雄辩地证明了带有移植标记(DPPTV+)的细胞为成熟肝细胞。③用表达L21-6抗原的Lewis大鼠做受体,不表达此抗原的Brown-Norway大鼠作异基因供体进行全肝移植,证实肝外来源的细胞(L21-6+)可以在移植后的肝中找到,这些细胞可能来自受体自身的骨髓。肝胆管结构中也可见L21-6(+)细胞,其排布为常见的活跃增生的HOC的分布方式。
, http://www.100md.com
越来越多的实验表明,成年动物细胞具有程度显著的可塑性(plasticity);骨髓起源的肝细胞为此又添一新证据。临床上观察到肝炎后可发生再障已有多年,但其发生机制仍是众说纷纭,或许和肝炎病毒直接抑制骨髓,或病毒损伤干细胞导致其染色体异常有关。肝细胞与HSC被证实关系密切,为解释肝炎后再障的发生机制提供了新的视角。
5 干细胞分化的复杂性
ESC已被用于在体外研究神经细胞、造血各系细胞和心肌细胞的起源及分化[17-19]。研究人员希望能够控制体外培育的干细胞分化的方向,而现在人们却只能在实验室中观察细胞的自发分化;迄今为止,触发和控制细胞分化的机制仍不明了,这是一个非常复杂的过程,也是发生生物学和细胞生物学中最大的谜语之一。以神经元的分化为例,即使应用现有的功能最强的神经生长因子,也只能诱导培养的神经元干细胞中的一半分化为神经元。
, 百拇医药 神经生物学家认为,脑细胞的分化也许依赖于一组相邻细胞相互作用的组合,细胞处于一种三维空间结构中,接受的分化信号也是三维的信号。甚至连机械作用力也可以影响干细胞的分化进程。有作者[20]对间充质干细胞进行了研究,发现在某种培养条件下这些细胞分化为骨组织,而轻轻旋转一下细胞周围的基质可就导致它们分化为腱,如果让细胞堆积生长则可分化为软骨。1998年,发生生物学家Prockop等[21]报道,当人类骨髓基质细胞(一般情况下分化为肌肉和其它间质组织)被注射入大鼠脑中时,部分细胞植入并分化为了神经胶质细胞。南佛罗里达大学Juan Sanchez-Ramos在一次会议上报道,培养的骨髓基质细胞中加入神经生长因子时变成了神经元。
毋庸置疑,干细胞是近年来生物学上最有趣、最复杂、也最有吸引力的领域之一。即使对于发现并且已应用于临床多年造血干细胞,至今也未有明确的检测方法,其生物学特性和移植后造血重建的具体过程仍处于一个未被破译的“黑匣子”中 。至于人们认识不久的NSC和ESC,其研究才刚刚开始起步,还有许多实际问题有待解决。例如:什么培养条件最适于干细胞的体外生长?在扩增干细胞以获得移植用足够数量的同时,如何能保持其自我维持不分化的特性?ESC研究遇到的伦理障碍如何去跨越?等等。可以预计,NSC和ESC作为成熟的干细胞来源用于临床还有一段长长的路要走。然而,这些初步成就为基因疗法开辟了新的领域,而且大大扩展了干细胞移植的适应症范围,必将使干细胞生物学发展到一个新纪元。
, http://www.100md.com
6 参考文献
1 Gage FH.Nature,1998,392:18
2 Soiter D,Gearhart J.Science,1999,283:1468
3 Loeffler M,Bratke T,Paulus U,et al.J Theor Biol,1997,186:41
4 Thomas JA,Itskovita-Eldor J,Shapiro SS,et al.Science,1998,282:1145
5 Marshall E.Science,1998,282:1014
6 Bjornson CR,Rietze RL,Reynolds BA,et al.Science,1999,283:534
, http://www.100md.com
7 Ziegler BL,Valtieri M,Porada GA,et al.Science,1999,285:1553
8 Goodell MA,Rosenzeig M,Kim H, et al.Nature Med,1997,3:1337
9 Zanjani ED,Almeida-Porada G,Linvingston AG,et al.Exp Hematol,1998,26:353
10 Morrison SJ,Shah NM,Anderson DJ.Cell,1997,88:287
11 Johansson CB,Momma S,Clarke DL,et al.Cell,1999,96:25
12 McKay RD.Science,1997,276:66
, 百拇医药
13 Vogel G,Science,1999,283,1432
14 Evans MJ,Kanfman MH.Nature,1981,292:154
15 Gearhart J.Science,1999,282:1061
16 Peterson BE,Bowen WC,Patrene KD,et al.Science,1999,284:1168
17 Finley MF,Kulkarni N,Huettner JE.J Neurosci,1996,16:1056
18 Li M,Pevney L,Lovell-Badge R,et al.Curr Biol,1998,8:971
19 Hde N,Graham GJ,Menzal U,et al.Blood,1996,88:1266
20 Pittenger MF,Mackay AM,Marshak DR.Science,1999,284:143
21 Azzi SA,Stokes D,Prockop DJ,et al.Proc Natl Acad Sci USA,1998,95:3908, 百拇医药