实验性急性心肌梗死心肌细胞凋亡与p53和Bcl-2蛋白表达的相关性研究
作者:马中富 何建桂 马虹 叶任高 罗斌 高劲松
单位:马中富 何建桂 马虹 叶任高(中山医科大学附属第一医院,广州 510080);罗斌(法医教研室);高劲松(达安基因诊断中心)
关键词:细胞凋亡心肌;p53;Bcl-2;心肌梗塞;急性;兔
中国急救医学000801 [摘 要] 目的 探讨p53和Bcl-2蛋白在实验性急性心肌梗死(AMI)心肌细胞凋亡中的作用。方法 用TUNEL法检测48只兔AMI模型梗死区的心肌细胞凋亡,用免疫组化法检测p53和Bcl-2蛋白在心肌细胞中的表达水平,并探讨它们之间的相互关系。结果 TUNEL法发现兔梗死区心肌细胞凋亡千分率在冠脉结扎前(0 h)和结扎后1、2、3、4、6、8、12 h的改变如下:0 h组(31.00±14.00‰)和12 h组(68.00±31.72‰)<1 h组(142.33±53.52‰)<2 h组(370.83±66.01‰)和8 h组(321.17±86.43‰)<3 h组(586.83±55.02‰)<4 h组(836.17±43.73‰)(P均<0.05),即急性心梗心肌细胞凋亡数在冠脉结扎后1 h时开始逐渐增多,到4 h时达高峰,其后逐渐下降,到12 h时已逐渐降至正常;阳性表达的p53蛋白积聚于胞核内,阳性心肌细胞千分率在冠脉未结扎(0 h)组(4.5±4.14)和结扎后1 h组(37.33±35.43‰)、2 h组(71.33±54.93‰)、8 h组(76.60±45.31‰)、12 h组(6.50±4.32‰)(P均<0.05),而其它各组之间相互比较则无统计学上的差异(P均>0.05);阳性的Bcl-2蛋白积聚于胞浆中,阳性心肌细胞千分率在冠脉结扎后3 h组(41.00±21.60‰)、4 h组(6.83±5.34‰)和6 h组(32.50±19.13‰)<未结扎(0 h)组(169.50±60.68‰)和结扎后2 h组(107.00±36.30‰)、8 h组(175.67±69.25‰)<结扎后1 h组(207.50±49.75‰)和12 h组(248.83±96.00‰)(P均<0.05);且梗死区心肌细胞凋亡数与其内p53蛋白表达细胞数之间成明显的正相关性(r为0.9873,P<0.001),与Bcl-2蛋白表达阳性数成明显的负相关性(r为-0.9384,P<0.001),后两者之间亦呈明显的负相关性(r为-0.9269,P<0.001)。结论 AMI兔梗死区心肌细胞存在明显的凋亡现象,且受p53蛋白上调、Bcl-2蛋白下调,两者相反调节其凋亡。
, http://www.100md.com
[中图分类号] R 542.22;Q 255;Q 786 [文献标识码] A [文章编号] 1002-1949(2000)08-0443-05
Regulation of p53 and Bcl-2 protein on myocyte apoptosis in acute myocardial infarction in rabbit
MA Zhong-fu, HE Jian-gui, MA Hong, et al. Emergency Department, First Affiliated (Hospital, Sun Yat-sen University of Medical Sciences, Guangzhou 510080, China)
[Abstract] Objective To investigate the expression and significance of p53 and Bcl-2 protein in myocyte apoptosis in infarct area in AMI rabbit model.Methods TUNEL was applied to monitor the myocyte apoptosis. p53 and Bcl-2 protein expression were assessed by immunohistochemistry, and to investigate their relationships.Results In the AMI rabbit model, TUNEL method showed that the permillage of apoptotic myocytes in infarct area at 1 h, 2 h, 3 h, 4 h, 6 h, 8 h, 12 h after coronary artery occlusion and before coronary artery occlusion (0 h) were:0 h group (31.00±14.00‰) and 12 h group (68.00±31.72‰)<1 h group (142.33±53.52‰)<2 h group (370.83±66.01‰)and 8 h group (321.17±86.43‰)<3 h group (586.83±55.02‰)<4 h group (836.17±43.73‰)(P<0.05). The number of apoptotic myocytes was increased gradually after 1 h occlusion of coronary artery, reaching to the top at the 4th hour, then decreased slowly to normal at the 12th hour. Expression of p53 protein accumulated in nuclear of cells, the permillage of possitive myocytes at 3 h (175.67±76.38‰), 4 h(240.00±106.05‰) and 6 h (164.00±81.81‰) in occlusion group was significantly higher than that in 0 h group (4.5±4.14‰), 1 h group (37.33±35.43‰),2 h group (71.33±54.93‰), 8 h group (76.60±45.31‰),12 h group (6.50±4.32‰) after coronary artery occlusion (P<0.05),whereas the differences among other groups was not significant(P>0.05).Bcl-2 protein expression accumulated in plasma of myocyted. The permillage of positive myocytes at 3 h group (41.00±21.60‰), 4 h group (6.83±5.34‰) and 6 h group (32.50±19.13‰)<0 h group (169.50±60.68‰), 2 h group (107.00±36.30‰), and 8 h group (175.67±69.25‰)<1 h group (207.50±49.75‰) and 12 h group (248.83±96.00‰) after coronary artery occlusion (P<0.05).Morevere, the amount of most apoptosis in infarct area was positively correlated to p53 protein expression(r=0.9873,P<0.001),and was negatively correlated to Bcl-2 protein expression(r=-0.9384, P<0.001).In addition, the significantly negative correlation was found between expression of p53 protein and Bcl-2 protein in myocytes of infarct area (r=0.9269,P<0.001).Conclusions The marked characteristics of apoptosis in myocytes of infarct area induced by AMI were found, which were regulated by p53 protein up-regulate and Bcl-2 protein down-regulate.
, 百拇医药
[Key words] Apoptosis, myocyte; p53 protein; Bcl-2 protein; AMI; Rabbit
急性心肌梗死(AMI)时,由于有心肌细胞内容物如心肌酶和其它蛋白质等的释放,因经传统的观念认为AMI时心肌细胞的死亡形式是坏死。可是最近有大量的研究证实,鼠、兔和人类心肌细胞在经历长时间的缺血或缺血再灌注之后,出现明显的凋亡特征[1~6],其机制仍未完全明了,故本课题通过检测AMI兔梗死区的心肌细胞凋亡、用免疫组化法同步检测心肌细胞中p53和Bcl-2蛋白的表达水平,并探讨它们之间的相互关系及其在心肌细胞凋亡中的作用,现报告如下:
1 材料与方法
1.1 研究对象 取新西兰兔48只,雌雄不分,平均体重2.03±0.51 kg(1.70~2.53 kg),3%戊巴比妥(1 mg/kg)腹腔内麻醉后固定于手术台上,常规消毒、铺巾、剪毛、切开颈部皮肤,无菌下行气管切开,插入3号气管插管,固定后接电动呼吸机,常规切开胸骨、心包,暴露出心脏,于左冠状动脉前降支起始下2 mm处结扎,同时结扎第一对角支和右冠状动脉,正常对照组则不结扎(n=6),检查无出血,逐层关闭胸腔,放一引流条,分别于结扎后1小时(n=6)、2小时(n=6)、3小时(n=6)、4小时(n=6)、6小时(n=6)、8小时(n=6)、12小时(n=6)处死兔,打开胸腔,切取心脏,放于无菌的生理盐水碗中,立即取下1 mm3的梗死组织4、5块置于10%的甲醛液中固定以做凋亡及免疫组化检测。
, http://www.100md.com
1.2 AMI心肌细胞凋亡原位末端标记检测(TdT-mediated dUTP Nick End Labeling, TUNEL)法 按文献[1,2]进行,In Site Cell Death Kit, AP购自德国Bochringer Mannheim公司,按药盒说明书操作。
1.3 心肌细胞中p53、Bcl-2蛋白表达的免疫组化检测 将取材中10%甲醛固定的标本固定48~72 h后取出行石蜡包埋,切片,厚度3~4 μm,硅化玻片装载组织。①二甲苯和酒精脱蜡;②3%双氧水(H2O2)微波1分钟或孵育5分钟以消除内源性过氧化酶反应,PBS液洗;③加入1∶20倍稀释的正常血清(猪或山羊)阻断剂孵育,封闭抗原;④加入一抗(LSAB复合物,DAKO公司产品):p53 1∶100、Bcl-2 1∶50稀释后加入玻片中,湿盒中4℃下过夜,37℃下孵育1小时→PBS液洗3次,每次5分钟;⑤加入二抗:玻片加入葡聚糖(LSAB复合物,DAKO公司产品),覆盖,37℃30分钟,PBS洗5分钟×3次;⑥显色:加入DAB显色剂(过氧化酶基质3 mg+3% H2O2 12 ml+PBS 2 ml),显微镜下观察到显色,水冲洗;⑦复染并拍片。
, 百拇医药
1.4 统计方法 数值用 ±s表示,用SPSS6.0软件计算,标准曲线进行曲线拟合,结果之间的比较用单因素方差分析(One-way ANOVA Analysis)中的Student-Newman-Keuls Test,两两比较用Q检验;两指标间相关性用简单相关及直线回归,P<0.05为差异有显著性。
±s表示,用SPSS6.0软件计算,标准曲线进行曲线拟合,结果之间的比较用单因素方差分析(One-way ANOVA Analysis)中的Student-Newman-Keuls Test,两两比较用Q检验;两指标间相关性用简单相关及直线回归,P<0.05为差异有显著性。
2 结果
2.1 TUNEL法检测AMI和正常对照兔心肌细胞凋亡的结果 凋亡的心肌细胞出现核固缩,染色质浓集,在加入抗荧光抗体后用NBT显色时,凋亡的细胞核呈紫蓝色,见图1。在每张玻片上,分别随机选择10个区域,每个区域计数100个细胞,统计出凋亡细胞数,然后加在一起,即为每千个心肌细胞中的凋亡细胞数,其变化趋势见图2。兔梗死区心肌细胞凋亡千分率在冠脉结扎前(0 h)和结扎后1、2、3、4、6、8、12 h的改变如下:0 h组(31.00±14.00‰)和12 h组(68.00±31.72‰)<1 h组(142.33±53.52‰)<2 h组(370.83±66.01‰)和8 h组(321.17±86.43‰)<3 h组(586.83±55.02‰)<4 h组(836.17±43.73‰)(P均<0.05),即急性心梗心肌细胞凋亡数在冠脉结扎后1 h时开始逐渐增多,到4 h时达高峰,其后逐渐下降,到12 h时已逐渐降至正常。
, 百拇医药
图1 早期凋亡的心肌细胞核被标记,染色成紫蓝色,TUNEL×100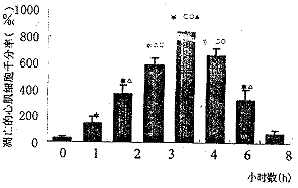
图2 冠脉结扎前后不同时间点和正常
对照组心肌细胞凋亡的千分率( ±s)
±s)
*0 h和12 h组比较,P<0.05;△与1 h组比较,P<0.05;
□与2 h和8 h组比较,P<0.05;○与3 h组比较,P<0.05;▲与6 h组比较,P<0.05。
2.2 冠脉结扎前后不同时间点兔心肌细胞p53和Bcl-2蛋白表达的改变 阳性表达的p53蛋白积聚于胞核内,可见阳性的心肌细胞胞浆浓缩、核固缩变稍圆,并见染色质浓缩聚集于核膜下,见图3,4。与TUNEL法检测到的凋亡心肌细胞相似,即形态学上表现为凋亡的心肌细胞,p53蛋白表达最强。而Bcl-2蛋白的表达主要积聚于胞浆,在结扎后12 h的心肌细胞中则有较强表达,见图5。在形态学上凋亡的心肌细胞中,Bcl-2蛋白则表达呈阴性或弱阳性,见图6。每张玻片,分别随机选择10个区域,每区统计100个细胞中p53和Bcl-2蛋白表达阳性的细胞数,然后加在一起,统计结果见表1。
, http://www.100md.com
表1 冠脉结扎前后不同时间心肌细胞
p53和Bcl-2蛋白表达阳性的细胞千分率( ±s) 时间(h)
±s) 时间(h)
例数
p53蛋白表达的阳性
心肌细胞数(‰)(范围)
Bcl-2表达的阳性
心肌细胞数(‰)(范围)
0
6
4.50±4.14(0~12)
, http://www.100md.com
169.50±60.68(87~243)▲
1
6
37.33±35.43(10~89)
207.50±49.75(134~273)
2
6
71.33±54.93(28~144)
107.00±36.30(56~140)
3
6
, http://www.100md.com
175.67±76.38(60~265)*
41.00±21.60(11~62)△
4
6
240.00±106.05(87~392)*
6.83±5.34(1~16)△
6
6
164.00±81.81(67~254)*
32.50±19.13(14~58)△
, http://www.100md.com
8
6
76.67±45.31(19~135)
175.67±69.25(97~274)▲
12
6
6.50±4.32(2~13)
248.83±96.00(114~367)
方差分析p53组:F=11.9472,P=0.0000;Bc1-2组F=17.3584,P=0.000;0 h表示冠脉未结扎的正常对照组;*与0 h组、冠脉结扎后1、2、8和12 h组比较,P<0.05;△与冠脉未结扎前及结扎后1、2、8、12 h组比较,P<0.05;▲与冠脉未结扎后1、12 h组比较,P<0.05。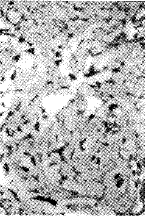

, http://www.100md.com
图3 兔冠脉结扎后4小时凋亡的心肌细胞核内p53蛋白强阳性表达,LSAB×200(上);p53蛋白阳性对照,见瘤细胞核染成棕黄色,LSAB×200(下)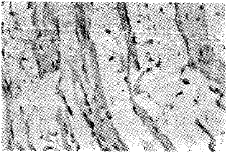
图4 兔冠脉结扎后8小时,凋亡的心肌细胞核p53蛋白弱阳性表达,散在心肌细胞核内见棕黄色颗粒,LSAB×200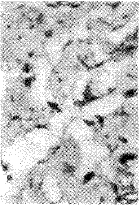
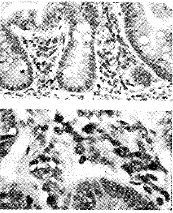
图5 兔冠脉结扎后12小时,凋亡的心肌细胞Bcl-2蛋白强阳性表达,LSAB×200(上);Bcl-2蛋白阳性对照,生长活跃的瘤细胞阴性,正常肠粘膜上皮细胞弱阳性,间质内纤维母细胞强阳性,LSAB×400和LSAB×200(下)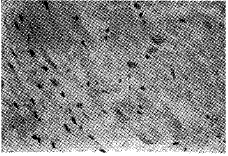
, 百拇医药
图6 兔冠脉结扎后4小时,见正常心肌细胞中Bcl-2蛋白弱阳性表达,梗死灶内心肌细胞阴性,LSAB×100
p53蛋白表达的阳性心肌细胞数在冠闽结扎后3、4、6 h时明显高于其它时间点及冠脉未结扎组(P均<0.05),其中以结扎后4 h时p53蛋白表达的阳性心肌细胞数量高,但与结扎后3、6 h组比较无统计学上的差异;结扎后12 h组心肌细胞表达p53蛋白阳性细胞数量低,接近冠脉未结扎组的水平;心肌细胞表达p53蛋白阳性细胞数的变化与凋亡的心肌细胞数量低,接近冠脉未结扎组的水平;心肌细胞表达p53蛋白阳性细胞数的变化与凋亡的心肌细胞数在不同时间点基本一致。可是,Bc1-2蛋白表达的阳性心肌细胞数以冠脉结扎后3、4、6 h的阳性细胞数量最低,明显低于结扎后1、2、8、12 h和未结扎组(P均<0.05),而结扎后2、8 h组和未结扎组心肌细胞Bc1-2蛋白表达的阳性数,又明显低于冠脉结扎后的1和12 h组(P均<0.05),这与凋亡的心肌细胞数和p53蛋白表达阳性的心肌细胞数在不同时间点中的改变刚好相反。表明心肌细胞中p53蛋白表达在冠脉结扎后逐渐升高,3~6 h时达高峰,然后逐渐下降,到12 h时已降至正常;而Bcl-2蛋白在心肌细胞中的表达,在冠脉结扎后逐渐下降,到3~6 h时降至最低水平,8 h时已恢复表达,到12 h时恢复到比正常还高的水平。
, 百拇医药
2.3 AMI兔心肌细胞凋亡与p53、Bcl-2蛋白表达量之间的相关性 兔冠脉结扎前后不同时间点心肌细胞凋亡数与心肌细胞p53蛋白的阳性表达数成明显的正相关(y=-11.96+0.29x,r=0.9873,tr=15.2227,P<0.001);相反与Bcl-2蛋白表达的阳性心肌细胞数之间成明显的负相关性(y=231.11-0.29x,r=-0.9384,tr=6.6532,P<0.01);且不同时间点的心肌细胞内p53蛋白表达与Bcl-2蛋白表达之间的阳性细胞数呈明显的负相关性(y=216.93-0.96x,r=0.9269,tr=6.0495,P<0.001)。提示兔急性心肌梗死时不同时间点的心肌细胞内p53和Bcl-2蛋白表达量的变化趋势相反。
3 讨论
3.1 急性心肌梗死心肌细胞内p53蛋白表达
近来研究表明,p53基因的表达在急性缺血或缺血再灌注的心肌细胞凋亡中起着重要的作用。Long等[1]在培养的新生儿鼠心肌细胞的研究中发现,缺氧诱导下新生儿鼠心肌细胞凋亡明显增加,同时p53蛋白和mRNA表达均明显增加,作者认为p53基因在调节缺血所致心肌细胞凋亡中起着重要的作用。Bialik等[4]在AMI模型的研究中观察到,缺血缺氧可明显诱导心肌细胞的凋亡,而梗死区心肌细胞p53基因表达增加;同时还发现在缺血p53基因的AMI鼠中梗死区心肌细胞同样亦发生明显的凋亡现象。我们在兔急性心梗模型中发生兔冠脉结扎后3、4、6 h时心肌细胞内p53蛋白表达的阳性细胞数明显高于冠脉未结扎和结扎后1、2、8、12 h时心肌细胞内p53蛋白表达的阳性数,而且与心肌细胞凋亡的变化一致。不同时间点p53蛋白表达的阳性细胞数与心肌细胞的凋亡数呈明显的正相关性,这提示在急性心梗时心肌细胞内的p53蛋白表达与心肌细胞凋亡发生一致,p53蛋白上调心肌细胞的凋亡。
, http://www.100md.com
在急性缺血时心肌细胞内p53基因过表达的机制,目前尚未完全清楚。Speir等[5]认为,p53基因引起痉挛的人冠状动脉平滑肌细胞凋亡,是通过人类巨细胞病毒IE84蛋白的表达与p53蛋白结合来介导的。Long等[3]则认为p53所致缺氧新生儿鼠心肌细胞凋亡是通过P 21/WAF-1/CIP-1基因的表达而实现的。另有作者认为wtp 53也可通过细胞毒效应[7]、细胞内产生活性致氧体(ROS)[6]、整合素介导的细胞间信号转位或诱导腺病毒EIA蛋白表达[8]的途径来介导细胞发生凋亡。而Long等[3]认为p53基因可抑制心肌细胞和中性粒细胞中空泡质子ATP酶(Vacular proton ATPase, VPATPase)的活性来介导细胞凋亡。p53基因也可通过上调c-myc、ICE、Fas抗原、Bax基因,下调Bcl-2基因,升高细胞内Ca2+来诱发细胞凋亡[6,8]。
, 百拇医药
3.2 AMI时心肌细胞内Bcl-2蛋白表达
研究已发现Bcl-2基因低表达与缺血性心肌细胞凋亡密切相关。Misao等[9]报导梗死区心肌细胞中Bcl-2蛋白表达阳性,而Bax蛋白在陈旧性梗死区心肌细胞中表达明显增加,提示Bcl-2和Bax蛋白的表达,在保护或加速心肌急性缺血和/或缺血再灌注后凋亡中起着重要的作用。Takemura等[10]在AMI模型中报导,梗死区和损伤区的兔心肌细胞的Bcl-2蛋白表达呈弱阳性,而Bax、Fas抗原蛋白呈强阳性,表明后两者与心肌细胞凋亡呈一致性变化,提示在急性心肌缺血时Bcl-2、Bax、Fas抗原基因的平衡在急性缺血所致心肌细胞凋亡中起重要作用。我们的研究表明,兔冠脉结扎后3、4、6 h的心肌细胞内Bcl-2蛋白表达阳性数明显低于冠脉未结扎和结扎后1、2、8、12 h组,而结扎后1、12 h组心肌细胞Bcl-2阳性数明显高于正常对照,提示在兔心肌梗死模型的心肌细胞中,Bcl-2蛋白表达在冠脉结扎后开始稍升高,而后逐渐下降,到3~6 h时降至最低,然后又逐渐恢复到结扎前水平。结果提示在AMI时心肌细胞的凋亡与其内Bcl-2蛋白表达呈相反的趋势,Bcl-2蛋白下调AMI时心肌细胞凋亡。
, 百拇医药
有研究表明Bcl-2基因凋亡的机制,是通过防止受损的DNA激活凋亡的诱导基因如p53来防止细胞凋亡的[6,10,11]。Bcl-2也可以和Bax结合,Bax表达水平增加可拮抗Bcl-2的作用[9,10],而促进细胞凋亡。也有作者认为Bcl-2通过一种抗氧化剂的作用或通过抑制氧自由基的产生而抑制细胞凋亡,但与活性氧中间体的生成减少无关。由于Bcl-2蛋白主要位于线粒体外膜上,故认为Bcl-2的作用与线粒体无关[6],Bcl-2可通过改变胞内Ca2+流而抑制细胞凋亡,由于Bcl-2定位于内质网膜中,其过度表达可能干扰了已在凋亡的细胞中穿越内质网膜的Ca2+外流,而抑制细胞的凋亡[5,6]。Wu等[12]在新生儿鼠心肌细胞凋亡的研究中认为Bcl-2基因抗凋亡是通过细胞内cGMP含量增加而实现的。
3.2 AMI心肌细胞内p53和Bcl-2蛋白表达的相互关系
, 百拇医药
关于p53和Bcl-2基因在细胞凋亡中的相互关系,目前认为是相互拮抗起相反的作用,Bcl-2拮抗p53基因诱导的心肌细胞凋亡呈剂量非依赖性。Kirshendbaum[13]的研究认为,p53基因表达明显可以触发急性损伤后的心肌细胞发生凋亡,而Bcl-2基因表达可防止这些改变,提示p53和Bcl-2基因在心肌细胞凋亡的调控中起重要作用。而Anversa[14]在成年鼠心肌细胞转染Adcmv.p53后的研究发现,p53明显降低Bcl-2/Bax基因的比率,而触发凋亡,这提示p53基因诱导的心肌细胞凋亡可能是通过下调Bcl-2、上调Bax基因而实现的。我们的结果显示,AMI兔心肌细胞内p53与Bcl-2蛋白表达量之间呈明显的负相关性,提示在急性心肌梗死中心肌细胞的凋亡由p53和Bcl-2蛋白共同调节所致。
至于p53基因和Bcl-2基因两者在细胞凋亡中相反作用的机制目前仍未完全明了。尽管p53被认为是一种转录激活因子,但p53也能够抑制某些基因的表达如p53可下调Bcl-2和细胞周期蛋白A表达,后者是细胞进入、渡过S期的关键性周期蛋白;p53可直接作用于Bcl-2的调控区,Bcl-2基因上游-287至-85bp区域含有TATAA box,p53蛋白与TATAA box结合蛋白(TBP)相互作用,导致Bcl-2基因的表达抑制[6,11]。Bcl-2基因亦可改变p53、Ced-2及CDKs细胞周期调节蛋白的核-胞浆转运,延缓p53诱导的细胞凋亡;另外Bcl-2和c-myc协同封闭p53进入核中,可阻断p53诱导的细胞凋亡和生长停止[6,11]。
, 百拇医药
综上所述,我们的研究提示在实验性急性心肌梗死时,心肌细胞存在明显的调亡现象,同时伴有p53蛋白表达明显增加,Bcl-2蛋白表达降低,Bcl-2与p53蛋白在心肌细胞中的变化呈相反关系,共同调节着AMI时心肌细胞的凋亡。
[基金项目]卫生部基金资助项目(1996-1-116)
[参考文献]
[1]马中富,马虹,叶任高,等.实验性急性心肌梗死心肌细胞凋亡的研究[J].中国急救医学,1999,19(10):577-580.
[2]马中富,马虹,叶任高,等.急性心肌梗死猝死者心肌细胞凋亡的研究[J].中国危重病急救医学,2000,12(3):134-138.
[3]Long X, Boluyt MO, Hipolito ML, et al. p53 and the hypoxia-induced apoptosis of cultured neonatal rat cardiac myocytes[J]. J Clin Invest, 1997, 99(11):2635-43.
, 百拇医药
[4]Bialik S, Geenen DL, Sasson IE, et al. Myocyte apoptosis during acute myocardial infarction in the mouse localizes to hypoxic regions but occurs independently of p53[J]. J Clin Invest, 1997, 100(6):1363-72.
[5]Cheng EHY, Kirsch DG, Clem RJ, et al. Conversion of Bcl-2 to a bax-like death effector by caspases[J]. Science, 1997, 278:1966-8.
[6]Steller H. Mechanisms and genes of cellular suicide[J]. Science, 1995,267:1445-9.
, 百拇医药
[7]Sakurai Y, Hirata C, Onishi Y, et al. Preincubation of thymocytes with 1-(5-isoquinolinesulfony1)-2-methylpiperazine dihydrochoride (H-7) induces apoptosis in non-stimulated thymocytes[J]. Biochem Mol Biol Int, 1997,42(3):433-41.
[8]Yonemitsu Y, Kaneda Y, Tanaka S, et al. Transfer of Wild-Type p53 gene effectively inhibits vascular smooth muscle cell proliferation in vitro and in vivo[J]. Circ Res, 1998,82:147-56.
[9]Misao J, Hayakawa Y, Ohno M, et al. Expression of Bcl-2 protein, an inhibitor of apoptosis, and Bax, an accelerator of apoptosis, in ventricular myocytes of human hearts with myocardial infarction[J]. Circulation, 1996,94(7):1506-12.
, 百拇医药
[10]Takemura G, Ohno M, Fujiwara H. Ischemic heart disease and apoptosis[J]. Rinsho Byori, 1997,45(7):606-13.
[11]Bartling B, Hol J, Darmer D. Contribution of myocyte apoptosis to myocardial infarction[J]. Basic Rex Cardiol, 1998,93(2):71-84.
[12]Wu CF, Bishopric NH, Pratt RE. Atrial natriuretic peptide induces apoptosis in neonatal rat cardiac myocytes[J]. J Biol Chem, 1997,272(23):14860-6.
[13]Kirshenbaum LA. Regulators of apoptosis in the heart:a matter of life and death[J]. Can J Cardiol, 1998,14(3):457-60.
[14]Pierzchalski P, Reiss K, Cheng W, et al. p53 induces myocyte apoptosis via the activation of the renin-angiotensin system[J]. Exp Cell Res, 1997,234(1):57-65.
[收稿:2000-07-05], 百拇医药
单位:马中富 何建桂 马虹 叶任高(中山医科大学附属第一医院,广州 510080);罗斌(法医教研室);高劲松(达安基因诊断中心)
关键词:细胞凋亡心肌;p53;Bcl-2;心肌梗塞;急性;兔
中国急救医学000801 [摘 要] 目的 探讨p53和Bcl-2蛋白在实验性急性心肌梗死(AMI)心肌细胞凋亡中的作用。方法 用TUNEL法检测48只兔AMI模型梗死区的心肌细胞凋亡,用免疫组化法检测p53和Bcl-2蛋白在心肌细胞中的表达水平,并探讨它们之间的相互关系。结果 TUNEL法发现兔梗死区心肌细胞凋亡千分率在冠脉结扎前(0 h)和结扎后1、2、3、4、6、8、12 h的改变如下:0 h组(31.00±14.00‰)和12 h组(68.00±31.72‰)<1 h组(142.33±53.52‰)<2 h组(370.83±66.01‰)和8 h组(321.17±86.43‰)<3 h组(586.83±55.02‰)<4 h组(836.17±43.73‰)(P均<0.05),即急性心梗心肌细胞凋亡数在冠脉结扎后1 h时开始逐渐增多,到4 h时达高峰,其后逐渐下降,到12 h时已逐渐降至正常;阳性表达的p53蛋白积聚于胞核内,阳性心肌细胞千分率在冠脉未结扎(0 h)组(4.5±4.14)和结扎后1 h组(37.33±35.43‰)、2 h组(71.33±54.93‰)、8 h组(76.60±45.31‰)、12 h组(6.50±4.32‰)(P均<0.05),而其它各组之间相互比较则无统计学上的差异(P均>0.05);阳性的Bcl-2蛋白积聚于胞浆中,阳性心肌细胞千分率在冠脉结扎后3 h组(41.00±21.60‰)、4 h组(6.83±5.34‰)和6 h组(32.50±19.13‰)<未结扎(0 h)组(169.50±60.68‰)和结扎后2 h组(107.00±36.30‰)、8 h组(175.67±69.25‰)<结扎后1 h组(207.50±49.75‰)和12 h组(248.83±96.00‰)(P均<0.05);且梗死区心肌细胞凋亡数与其内p53蛋白表达细胞数之间成明显的正相关性(r为0.9873,P<0.001),与Bcl-2蛋白表达阳性数成明显的负相关性(r为-0.9384,P<0.001),后两者之间亦呈明显的负相关性(r为-0.9269,P<0.001)。结论 AMI兔梗死区心肌细胞存在明显的凋亡现象,且受p53蛋白上调、Bcl-2蛋白下调,两者相反调节其凋亡。
, http://www.100md.com
[中图分类号] R 542.22;Q 255;Q 786 [文献标识码] A [文章编号] 1002-1949(2000)08-0443-05
Regulation of p53 and Bcl-2 protein on myocyte apoptosis in acute myocardial infarction in rabbit
MA Zhong-fu, HE Jian-gui, MA Hong, et al. Emergency Department, First Affiliated (Hospital, Sun Yat-sen University of Medical Sciences, Guangzhou 510080, China)
[Abstract] Objective To investigate the expression and significance of p53 and Bcl-2 protein in myocyte apoptosis in infarct area in AMI rabbit model.Methods TUNEL was applied to monitor the myocyte apoptosis. p53 and Bcl-2 protein expression were assessed by immunohistochemistry, and to investigate their relationships.Results In the AMI rabbit model, TUNEL method showed that the permillage of apoptotic myocytes in infarct area at 1 h, 2 h, 3 h, 4 h, 6 h, 8 h, 12 h after coronary artery occlusion and before coronary artery occlusion (0 h) were:0 h group (31.00±14.00‰) and 12 h group (68.00±31.72‰)<1 h group (142.33±53.52‰)<2 h group (370.83±66.01‰)and 8 h group (321.17±86.43‰)<3 h group (586.83±55.02‰)<4 h group (836.17±43.73‰)(P<0.05). The number of apoptotic myocytes was increased gradually after 1 h occlusion of coronary artery, reaching to the top at the 4th hour, then decreased slowly to normal at the 12th hour. Expression of p53 protein accumulated in nuclear of cells, the permillage of possitive myocytes at 3 h (175.67±76.38‰), 4 h(240.00±106.05‰) and 6 h (164.00±81.81‰) in occlusion group was significantly higher than that in 0 h group (4.5±4.14‰), 1 h group (37.33±35.43‰),2 h group (71.33±54.93‰), 8 h group (76.60±45.31‰),12 h group (6.50±4.32‰) after coronary artery occlusion (P<0.05),whereas the differences among other groups was not significant(P>0.05).Bcl-2 protein expression accumulated in plasma of myocyted. The permillage of positive myocytes at 3 h group (41.00±21.60‰), 4 h group (6.83±5.34‰) and 6 h group (32.50±19.13‰)<0 h group (169.50±60.68‰), 2 h group (107.00±36.30‰), and 8 h group (175.67±69.25‰)<1 h group (207.50±49.75‰) and 12 h group (248.83±96.00‰) after coronary artery occlusion (P<0.05).Morevere, the amount of most apoptosis in infarct area was positively correlated to p53 protein expression(r=0.9873,P<0.001),and was negatively correlated to Bcl-2 protein expression(r=-0.9384, P<0.001).In addition, the significantly negative correlation was found between expression of p53 protein and Bcl-2 protein in myocytes of infarct area (r=0.9269,P<0.001).Conclusions The marked characteristics of apoptosis in myocytes of infarct area induced by AMI were found, which were regulated by p53 protein up-regulate and Bcl-2 protein down-regulate.
, 百拇医药
[Key words] Apoptosis, myocyte; p53 protein; Bcl-2 protein; AMI; Rabbit
急性心肌梗死(AMI)时,由于有心肌细胞内容物如心肌酶和其它蛋白质等的释放,因经传统的观念认为AMI时心肌细胞的死亡形式是坏死。可是最近有大量的研究证实,鼠、兔和人类心肌细胞在经历长时间的缺血或缺血再灌注之后,出现明显的凋亡特征[1~6],其机制仍未完全明了,故本课题通过检测AMI兔梗死区的心肌细胞凋亡、用免疫组化法同步检测心肌细胞中p53和Bcl-2蛋白的表达水平,并探讨它们之间的相互关系及其在心肌细胞凋亡中的作用,现报告如下:
1 材料与方法
1.1 研究对象 取新西兰兔48只,雌雄不分,平均体重2.03±0.51 kg(1.70~2.53 kg),3%戊巴比妥(1 mg/kg)腹腔内麻醉后固定于手术台上,常规消毒、铺巾、剪毛、切开颈部皮肤,无菌下行气管切开,插入3号气管插管,固定后接电动呼吸机,常规切开胸骨、心包,暴露出心脏,于左冠状动脉前降支起始下2 mm处结扎,同时结扎第一对角支和右冠状动脉,正常对照组则不结扎(n=6),检查无出血,逐层关闭胸腔,放一引流条,分别于结扎后1小时(n=6)、2小时(n=6)、3小时(n=6)、4小时(n=6)、6小时(n=6)、8小时(n=6)、12小时(n=6)处死兔,打开胸腔,切取心脏,放于无菌的生理盐水碗中,立即取下1 mm3的梗死组织4、5块置于10%的甲醛液中固定以做凋亡及免疫组化检测。
, http://www.100md.com
1.2 AMI心肌细胞凋亡原位末端标记检测(TdT-mediated dUTP Nick End Labeling, TUNEL)法 按文献[1,2]进行,In Site Cell Death Kit, AP购自德国Bochringer Mannheim公司,按药盒说明书操作。
1.3 心肌细胞中p53、Bcl-2蛋白表达的免疫组化检测 将取材中10%甲醛固定的标本固定48~72 h后取出行石蜡包埋,切片,厚度3~4 μm,硅化玻片装载组织。①二甲苯和酒精脱蜡;②3%双氧水(H2O2)微波1分钟或孵育5分钟以消除内源性过氧化酶反应,PBS液洗;③加入1∶20倍稀释的正常血清(猪或山羊)阻断剂孵育,封闭抗原;④加入一抗(LSAB复合物,DAKO公司产品):p53 1∶100、Bcl-2 1∶50稀释后加入玻片中,湿盒中4℃下过夜,37℃下孵育1小时→PBS液洗3次,每次5分钟;⑤加入二抗:玻片加入葡聚糖(LSAB复合物,DAKO公司产品),覆盖,37℃30分钟,PBS洗5分钟×3次;⑥显色:加入DAB显色剂(过氧化酶基质3 mg+3% H2O2 12 ml+PBS 2 ml),显微镜下观察到显色,水冲洗;⑦复染并拍片。
, 百拇医药
1.4 统计方法 数值用
 ±s表示,用SPSS6.0软件计算,标准曲线进行曲线拟合,结果之间的比较用单因素方差分析(One-way ANOVA Analysis)中的Student-Newman-Keuls Test,两两比较用Q检验;两指标间相关性用简单相关及直线回归,P<0.05为差异有显著性。
±s表示,用SPSS6.0软件计算,标准曲线进行曲线拟合,结果之间的比较用单因素方差分析(One-way ANOVA Analysis)中的Student-Newman-Keuls Test,两两比较用Q检验;两指标间相关性用简单相关及直线回归,P<0.05为差异有显著性。2 结果
2.1 TUNEL法检测AMI和正常对照兔心肌细胞凋亡的结果 凋亡的心肌细胞出现核固缩,染色质浓集,在加入抗荧光抗体后用NBT显色时,凋亡的细胞核呈紫蓝色,见图1。在每张玻片上,分别随机选择10个区域,每个区域计数100个细胞,统计出凋亡细胞数,然后加在一起,即为每千个心肌细胞中的凋亡细胞数,其变化趋势见图2。兔梗死区心肌细胞凋亡千分率在冠脉结扎前(0 h)和结扎后1、2、3、4、6、8、12 h的改变如下:0 h组(31.00±14.00‰)和12 h组(68.00±31.72‰)<1 h组(142.33±53.52‰)<2 h组(370.83±66.01‰)和8 h组(321.17±86.43‰)<3 h组(586.83±55.02‰)<4 h组(836.17±43.73‰)(P均<0.05),即急性心梗心肌细胞凋亡数在冠脉结扎后1 h时开始逐渐增多,到4 h时达高峰,其后逐渐下降,到12 h时已逐渐降至正常。

, 百拇医药
图1 早期凋亡的心肌细胞核被标记,染色成紫蓝色,TUNEL×100

图2 冠脉结扎前后不同时间点和正常
对照组心肌细胞凋亡的千分率(
 ±s)
±s)*0 h和12 h组比较,P<0.05;△与1 h组比较,P<0.05;
□与2 h和8 h组比较,P<0.05;○与3 h组比较,P<0.05;▲与6 h组比较,P<0.05。
2.2 冠脉结扎前后不同时间点兔心肌细胞p53和Bcl-2蛋白表达的改变 阳性表达的p53蛋白积聚于胞核内,可见阳性的心肌细胞胞浆浓缩、核固缩变稍圆,并见染色质浓缩聚集于核膜下,见图3,4。与TUNEL法检测到的凋亡心肌细胞相似,即形态学上表现为凋亡的心肌细胞,p53蛋白表达最强。而Bcl-2蛋白的表达主要积聚于胞浆,在结扎后12 h的心肌细胞中则有较强表达,见图5。在形态学上凋亡的心肌细胞中,Bcl-2蛋白则表达呈阴性或弱阳性,见图6。每张玻片,分别随机选择10个区域,每区统计100个细胞中p53和Bcl-2蛋白表达阳性的细胞数,然后加在一起,统计结果见表1。
, http://www.100md.com
表1 冠脉结扎前后不同时间心肌细胞
p53和Bcl-2蛋白表达阳性的细胞千分率(
 ±s) 时间(h)
±s) 时间(h)例数
p53蛋白表达的阳性
心肌细胞数(‰)(范围)
Bcl-2表达的阳性
心肌细胞数(‰)(范围)
0
6
4.50±4.14(0~12)
, http://www.100md.com
169.50±60.68(87~243)▲
1
6
37.33±35.43(10~89)
207.50±49.75(134~273)
2
6
71.33±54.93(28~144)
107.00±36.30(56~140)
3
6
, http://www.100md.com
175.67±76.38(60~265)*
41.00±21.60(11~62)△
4
6
240.00±106.05(87~392)*
6.83±5.34(1~16)△
6
6
164.00±81.81(67~254)*
32.50±19.13(14~58)△
, http://www.100md.com
8
6
76.67±45.31(19~135)
175.67±69.25(97~274)▲
12
6
6.50±4.32(2~13)
248.83±96.00(114~367)
方差分析p53组:F=11.9472,P=0.0000;Bc1-2组F=17.3584,P=0.000;0 h表示冠脉未结扎的正常对照组;*与0 h组、冠脉结扎后1、2、8和12 h组比较,P<0.05;△与冠脉未结扎前及结扎后1、2、8、12 h组比较,P<0.05;▲与冠脉未结扎后1、12 h组比较,P<0.05。


, http://www.100md.com
图3 兔冠脉结扎后4小时凋亡的心肌细胞核内p53蛋白强阳性表达,LSAB×200(上);p53蛋白阳性对照,见瘤细胞核染成棕黄色,LSAB×200(下)

图4 兔冠脉结扎后8小时,凋亡的心肌细胞核p53蛋白弱阳性表达,散在心肌细胞核内见棕黄色颗粒,LSAB×200


图5 兔冠脉结扎后12小时,凋亡的心肌细胞Bcl-2蛋白强阳性表达,LSAB×200(上);Bcl-2蛋白阳性对照,生长活跃的瘤细胞阴性,正常肠粘膜上皮细胞弱阳性,间质内纤维母细胞强阳性,LSAB×400和LSAB×200(下)

, 百拇医药
图6 兔冠脉结扎后4小时,见正常心肌细胞中Bcl-2蛋白弱阳性表达,梗死灶内心肌细胞阴性,LSAB×100
p53蛋白表达的阳性心肌细胞数在冠闽结扎后3、4、6 h时明显高于其它时间点及冠脉未结扎组(P均<0.05),其中以结扎后4 h时p53蛋白表达的阳性心肌细胞数量高,但与结扎后3、6 h组比较无统计学上的差异;结扎后12 h组心肌细胞表达p53蛋白阳性细胞数量低,接近冠脉未结扎组的水平;心肌细胞表达p53蛋白阳性细胞数的变化与凋亡的心肌细胞数量低,接近冠脉未结扎组的水平;心肌细胞表达p53蛋白阳性细胞数的变化与凋亡的心肌细胞数在不同时间点基本一致。可是,Bc1-2蛋白表达的阳性心肌细胞数以冠脉结扎后3、4、6 h的阳性细胞数量最低,明显低于结扎后1、2、8、12 h和未结扎组(P均<0.05),而结扎后2、8 h组和未结扎组心肌细胞Bc1-2蛋白表达的阳性数,又明显低于冠脉结扎后的1和12 h组(P均<0.05),这与凋亡的心肌细胞数和p53蛋白表达阳性的心肌细胞数在不同时间点中的改变刚好相反。表明心肌细胞中p53蛋白表达在冠脉结扎后逐渐升高,3~6 h时达高峰,然后逐渐下降,到12 h时已降至正常;而Bcl-2蛋白在心肌细胞中的表达,在冠脉结扎后逐渐下降,到3~6 h时降至最低水平,8 h时已恢复表达,到12 h时恢复到比正常还高的水平。
, 百拇医药
2.3 AMI兔心肌细胞凋亡与p53、Bcl-2蛋白表达量之间的相关性 兔冠脉结扎前后不同时间点心肌细胞凋亡数与心肌细胞p53蛋白的阳性表达数成明显的正相关(y=-11.96+0.29x,r=0.9873,tr=15.2227,P<0.001);相反与Bcl-2蛋白表达的阳性心肌细胞数之间成明显的负相关性(y=231.11-0.29x,r=-0.9384,tr=6.6532,P<0.01);且不同时间点的心肌细胞内p53蛋白表达与Bcl-2蛋白表达之间的阳性细胞数呈明显的负相关性(y=216.93-0.96x,r=0.9269,tr=6.0495,P<0.001)。提示兔急性心肌梗死时不同时间点的心肌细胞内p53和Bcl-2蛋白表达量的变化趋势相反。
3 讨论
3.1 急性心肌梗死心肌细胞内p53蛋白表达
近来研究表明,p53基因的表达在急性缺血或缺血再灌注的心肌细胞凋亡中起着重要的作用。Long等[1]在培养的新生儿鼠心肌细胞的研究中发现,缺氧诱导下新生儿鼠心肌细胞凋亡明显增加,同时p53蛋白和mRNA表达均明显增加,作者认为p53基因在调节缺血所致心肌细胞凋亡中起着重要的作用。Bialik等[4]在AMI模型的研究中观察到,缺血缺氧可明显诱导心肌细胞的凋亡,而梗死区心肌细胞p53基因表达增加;同时还发现在缺血p53基因的AMI鼠中梗死区心肌细胞同样亦发生明显的凋亡现象。我们在兔急性心梗模型中发生兔冠脉结扎后3、4、6 h时心肌细胞内p53蛋白表达的阳性细胞数明显高于冠脉未结扎和结扎后1、2、8、12 h时心肌细胞内p53蛋白表达的阳性数,而且与心肌细胞凋亡的变化一致。不同时间点p53蛋白表达的阳性细胞数与心肌细胞的凋亡数呈明显的正相关性,这提示在急性心梗时心肌细胞内的p53蛋白表达与心肌细胞凋亡发生一致,p53蛋白上调心肌细胞的凋亡。
, http://www.100md.com
在急性缺血时心肌细胞内p53基因过表达的机制,目前尚未完全清楚。Speir等[5]认为,p53基因引起痉挛的人冠状动脉平滑肌细胞凋亡,是通过人类巨细胞病毒IE84蛋白的表达与p53蛋白结合来介导的。Long等[3]则认为p53所致缺氧新生儿鼠心肌细胞凋亡是通过P 21/WAF-1/CIP-1基因的表达而实现的。另有作者认为wtp 53也可通过细胞毒效应[7]、细胞内产生活性致氧体(ROS)[6]、整合素介导的细胞间信号转位或诱导腺病毒EIA蛋白表达[8]的途径来介导细胞发生凋亡。而Long等[3]认为p53基因可抑制心肌细胞和中性粒细胞中空泡质子ATP酶(Vacular proton ATPase, VPATPase)的活性来介导细胞凋亡。p53基因也可通过上调c-myc、ICE、Fas抗原、Bax基因,下调Bcl-2基因,升高细胞内Ca2+来诱发细胞凋亡[6,8]。
, 百拇医药
3.2 AMI时心肌细胞内Bcl-2蛋白表达
研究已发现Bcl-2基因低表达与缺血性心肌细胞凋亡密切相关。Misao等[9]报导梗死区心肌细胞中Bcl-2蛋白表达阳性,而Bax蛋白在陈旧性梗死区心肌细胞中表达明显增加,提示Bcl-2和Bax蛋白的表达,在保护或加速心肌急性缺血和/或缺血再灌注后凋亡中起着重要的作用。Takemura等[10]在AMI模型中报导,梗死区和损伤区的兔心肌细胞的Bcl-2蛋白表达呈弱阳性,而Bax、Fas抗原蛋白呈强阳性,表明后两者与心肌细胞凋亡呈一致性变化,提示在急性心肌缺血时Bcl-2、Bax、Fas抗原基因的平衡在急性缺血所致心肌细胞凋亡中起重要作用。我们的研究表明,兔冠脉结扎后3、4、6 h的心肌细胞内Bcl-2蛋白表达阳性数明显低于冠脉未结扎和结扎后1、2、8、12 h组,而结扎后1、12 h组心肌细胞Bcl-2阳性数明显高于正常对照,提示在兔心肌梗死模型的心肌细胞中,Bcl-2蛋白表达在冠脉结扎后开始稍升高,而后逐渐下降,到3~6 h时降至最低,然后又逐渐恢复到结扎前水平。结果提示在AMI时心肌细胞的凋亡与其内Bcl-2蛋白表达呈相反的趋势,Bcl-2蛋白下调AMI时心肌细胞凋亡。
, 百拇医药
有研究表明Bcl-2基因凋亡的机制,是通过防止受损的DNA激活凋亡的诱导基因如p53来防止细胞凋亡的[6,10,11]。Bcl-2也可以和Bax结合,Bax表达水平增加可拮抗Bcl-2的作用[9,10],而促进细胞凋亡。也有作者认为Bcl-2通过一种抗氧化剂的作用或通过抑制氧自由基的产生而抑制细胞凋亡,但与活性氧中间体的生成减少无关。由于Bcl-2蛋白主要位于线粒体外膜上,故认为Bcl-2的作用与线粒体无关[6],Bcl-2可通过改变胞内Ca2+流而抑制细胞凋亡,由于Bcl-2定位于内质网膜中,其过度表达可能干扰了已在凋亡的细胞中穿越内质网膜的Ca2+外流,而抑制细胞的凋亡[5,6]。Wu等[12]在新生儿鼠心肌细胞凋亡的研究中认为Bcl-2基因抗凋亡是通过细胞内cGMP含量增加而实现的。
3.2 AMI心肌细胞内p53和Bcl-2蛋白表达的相互关系
, 百拇医药
关于p53和Bcl-2基因在细胞凋亡中的相互关系,目前认为是相互拮抗起相反的作用,Bcl-2拮抗p53基因诱导的心肌细胞凋亡呈剂量非依赖性。Kirshendbaum[13]的研究认为,p53基因表达明显可以触发急性损伤后的心肌细胞发生凋亡,而Bcl-2基因表达可防止这些改变,提示p53和Bcl-2基因在心肌细胞凋亡的调控中起重要作用。而Anversa[14]在成年鼠心肌细胞转染Adcmv.p53后的研究发现,p53明显降低Bcl-2/Bax基因的比率,而触发凋亡,这提示p53基因诱导的心肌细胞凋亡可能是通过下调Bcl-2、上调Bax基因而实现的。我们的结果显示,AMI兔心肌细胞内p53与Bcl-2蛋白表达量之间呈明显的负相关性,提示在急性心肌梗死中心肌细胞的凋亡由p53和Bcl-2蛋白共同调节所致。
至于p53基因和Bcl-2基因两者在细胞凋亡中相反作用的机制目前仍未完全明了。尽管p53被认为是一种转录激活因子,但p53也能够抑制某些基因的表达如p53可下调Bcl-2和细胞周期蛋白A表达,后者是细胞进入、渡过S期的关键性周期蛋白;p53可直接作用于Bcl-2的调控区,Bcl-2基因上游-287至-85bp区域含有TATAA box,p53蛋白与TATAA box结合蛋白(TBP)相互作用,导致Bcl-2基因的表达抑制[6,11]。Bcl-2基因亦可改变p53、Ced-2及CDKs细胞周期调节蛋白的核-胞浆转运,延缓p53诱导的细胞凋亡;另外Bcl-2和c-myc协同封闭p53进入核中,可阻断p53诱导的细胞凋亡和生长停止[6,11]。
, 百拇医药
综上所述,我们的研究提示在实验性急性心肌梗死时,心肌细胞存在明显的调亡现象,同时伴有p53蛋白表达明显增加,Bcl-2蛋白表达降低,Bcl-2与p53蛋白在心肌细胞中的变化呈相反关系,共同调节着AMI时心肌细胞的凋亡。
[基金项目]卫生部基金资助项目(1996-1-116)
[参考文献]
[1]马中富,马虹,叶任高,等.实验性急性心肌梗死心肌细胞凋亡的研究[J].中国急救医学,1999,19(10):577-580.
[2]马中富,马虹,叶任高,等.急性心肌梗死猝死者心肌细胞凋亡的研究[J].中国危重病急救医学,2000,12(3):134-138.
[3]Long X, Boluyt MO, Hipolito ML, et al. p53 and the hypoxia-induced apoptosis of cultured neonatal rat cardiac myocytes[J]. J Clin Invest, 1997, 99(11):2635-43.
, 百拇医药
[4]Bialik S, Geenen DL, Sasson IE, et al. Myocyte apoptosis during acute myocardial infarction in the mouse localizes to hypoxic regions but occurs independently of p53[J]. J Clin Invest, 1997, 100(6):1363-72.
[5]Cheng EHY, Kirsch DG, Clem RJ, et al. Conversion of Bcl-2 to a bax-like death effector by caspases[J]. Science, 1997, 278:1966-8.
[6]Steller H. Mechanisms and genes of cellular suicide[J]. Science, 1995,267:1445-9.
, 百拇医药
[7]Sakurai Y, Hirata C, Onishi Y, et al. Preincubation of thymocytes with 1-(5-isoquinolinesulfony1)-2-methylpiperazine dihydrochoride (H-7) induces apoptosis in non-stimulated thymocytes[J]. Biochem Mol Biol Int, 1997,42(3):433-41.
[8]Yonemitsu Y, Kaneda Y, Tanaka S, et al. Transfer of Wild-Type p53 gene effectively inhibits vascular smooth muscle cell proliferation in vitro and in vivo[J]. Circ Res, 1998,82:147-56.
[9]Misao J, Hayakawa Y, Ohno M, et al. Expression of Bcl-2 protein, an inhibitor of apoptosis, and Bax, an accelerator of apoptosis, in ventricular myocytes of human hearts with myocardial infarction[J]. Circulation, 1996,94(7):1506-12.
, 百拇医药
[10]Takemura G, Ohno M, Fujiwara H. Ischemic heart disease and apoptosis[J]. Rinsho Byori, 1997,45(7):606-13.
[11]Bartling B, Hol J, Darmer D. Contribution of myocyte apoptosis to myocardial infarction[J]. Basic Rex Cardiol, 1998,93(2):71-84.
[12]Wu CF, Bishopric NH, Pratt RE. Atrial natriuretic peptide induces apoptosis in neonatal rat cardiac myocytes[J]. J Biol Chem, 1997,272(23):14860-6.
[13]Kirshenbaum LA. Regulators of apoptosis in the heart:a matter of life and death[J]. Can J Cardiol, 1998,14(3):457-60.
[14]Pierzchalski P, Reiss K, Cheng W, et al. p53 induces myocyte apoptosis via the activation of the renin-angiotensin system[J]. Exp Cell Res, 1997,234(1):57-65.
[收稿:2000-07-05], 百拇医药