阳离子脂质体对重组腺病毒转染效率的影响
徐彤 殷慧君 唐佩弦
摘 要 目的 观察不同因素对重组腺病毒转染效率的影响。方法 以重组腺病毒去感染小鼠T淋巴瘤细胞株EL-4,加入不同的刺激因子和lipofectamine,通过计数X-gal染色阳性细胞数测定转染效率。结果 rmIL-2,植物血凝素均不能改善重组腺病毒对EL-4的感染效率,而阳离子脂质体可以明显提高重组腺病毒对EL-4的感染效率。结论 可以利用阳离子脂质体来提高重组腺病毒的转染效率。
关键词:阳离子脂质体 重组腺病毒 转染效率
将外源基因导入细胞内的方式有多种,腺病毒既可以感染分裂期细胞也可感染非分裂期细胞,病毒颗粒比较稳定,可以纯化和浓缩,不整合,安全性高,因此近来受到广泛关注,以其作载体将不同的外源基因导入真核细胞的研究纷纷开展,尤其是利用重组腺病毒将细胞因子导入实体瘤细胞,激活机体抗肿瘤免疫的研究。关于重组腺病毒转染血液系统肿瘤的报道很少,因此我们用重组腺病毒AdCMVLacZ感染小鼠淋巴瘤细胞EL-4,测定不同因素对重组腺病毒感染效率的影响,以期找到提高腺病毒感染效率的有效途径。
, http://www.100md.com
1 材料与方法
1.1 主要试剂 重组腺病毒AdCMVLacZ、AdCMVIL-12粗提液(西班牙Navarra大学Dr Cheng Qian惠赠)。氯化铯(Boehringer公司)。阳离子脂质体lipofectamine(Gibco公司产品)。X-gal(5-溴-4-氯-3-吲哚-β-半乳糖苷,Sigma公司产品)。mIL-12的ELISA检测试剂盒购自Endogen公司。植物血凝素(PHA,广州医学工程研究所产品)。rmIL-2纯品由军事医学科学院惠赠。
1.2 细胞株 EL-4细胞是化学致癌剂在C57BL/6(H-2b)小鼠诱导T淋巴瘤细胞株(由北京医科大学免疫系提供)。复制缺陷型重组腺病毒载体包装细胞株293(人胚肾细胞株)由军事医学科学院吴祖泽院士惠赠。Hela为人宫颈癌细胞株,CHO细胞株为中国仓鼠卵巢细胞。
1.3 腺病毒的扩增、收集及纯化
, http://www.100md.com
1.3.1 293细胞用完全DMEM 含体积分数为10%新生牛血清,1×105 U.L-1青霉素、100 mg.L-1链霉素,37℃、0.05 CO2、饱和湿度培养。待细胞长至培养瓶底的70%~80%时培养基更换为含体积分数为2.5%新生牛血清的DMEM,加入重组腺病毒粗提液,继续培养观察48~72 h,收集呈病态反应(cytopathic effect,CPE)的293细胞,反复冻融5次,每次冻融后振摇30 s,1 500 rpm离心20 min,弃细胞碎片,收集上清,经氯化铯密度梯度两次离心浓缩腺病毒颗粒[1],经Hanks液透析后,加入体积分数为20%甘油,分装后于-70℃冻存备用。
1.3.2 重组腺病毒滴度的测定 病毒滴度采用噬斑分析法结合细胞病变测定法[2]。
1.3.3 重组腺病毒感染EL-4细胞的测定 AdCMVLacZ以MOI(multiplicity of infection)5,50,500,5 000分别感染EL-4细胞,4 h后用RPMI 1640洗涤去除游离病毒,于37℃、0.05 CO2培养24 h,体积分数为2.5%戊二醛固定15 min,再以含10 mmol.L-1 MgCl2的PBS洗2遍,X-gal染色48 h后计数蓝染细胞。
, http://www.100md.com
1.4 重组腺病毒对不同细胞株感染效率的测定 AdCMVLacZ以MOI 50分别感染HeLa,CHO细胞株,测定转染效率。
1.5 不同刺激分子对重组腺病毒感染EL-4效率的影响 EL-4细胞分别以rmIL-2,PHA或rmIL-2+PHA刺激72 h,rmIL-2的终浓度为20 kU.L-1,PHA的终浓度为5 mg.L-1,刺激后以AdCMVLacZ感染,测定转染效率。
1.6 阳离子脂质体(lipofectamine)对重组腺病毒感染EL-4效率的影响 50 μl纯化的腺病毒加入50 μl无抗生素RPMI 1640,在此100 μl体系内加入1 μl的lipofectamine(终浓度为1 mg.L-1)室温静置30 min。100 μl浓度为2×1010 cells.L-1的EL-4细胞与该体系共同孵育105 min(MOI为50),以RPMI 1640洗涤2次去除游离病毒,用完全RPMI 1640培养24 h,固定,X-gal染色48 h观察结果。
, 百拇医药
1.7 AdCMVIL-12感染EL-4细胞培养上清中IL-12含量的测定 AdCMVIL-12分别在有无lipofectamine的情况下感染EL-4细胞,收集感染48 h的培养上清,ELISA测定mIL-12的含量,结果以450 nm OD值在标准曲线上对应值表示。
1.8 统计学处理 采用未配对计量资料的t检验。
2 结果
2.1 重组腺病毒对EL-4细胞感染效率的观察 重组腺病毒颗粒经扩增浓缩纯化后AdCMVLacZ和AdCMVIL-12的滴度分别为2.1×1013 pfu.L-1及4.5×1012 pfu.L-1(plaque forming unit,空斑形成单位)。AdCMVLacZ的MOI值为5时,感染EL-4后X-gal染色阳性细胞率达4.6%±2.97%,MOI为50时,感染阳性率达12.3%±2.51%,MOI达500时,X-gal染色阳性细胞率为20.3%±4.73%,以后随着MOI的升高,细胞感染阳性细胞率没有明显提高,见图1。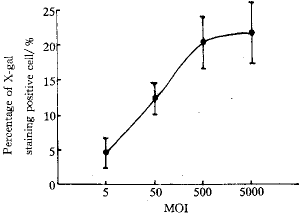
, 百拇医药
Fig 1 The efficacy of recombinant adenovirus at different MOI
2.2 重组腺病毒对不同细胞株感染效率的影响 当AdCMVLacZ的MOI值为50时,HeLa和CHO感染的阳性细胞率均高于90%,而EL-4的感染率仅为12.3%±2.51%,提示HeLa和CHO是腺病毒的易感细胞,而EL-4不易被腺病毒感染。
2.3 不同因素对重组腺病毒感染EL-4效率的影响 培养的EL-4细胞分别以rmIL-2、PHA、rmIL-2+PHA刺激后,AdCMVLacZ的感染率分别为20%±4.4%、23.7%±3.1%、22.0%±2.7%,而EL-4细胞用lipofectamine协同感染后,在MOI=50时,AdCMVLacZ的感染率就可上升到37.0%±4.0%,见图2。由图可见,EL-4细胞经rmIL-2,PHA,rmIL-2+PHA刺激,重组腺病毒对其的感染率没有明显的增加。而与未经刺激的AdCMVLacZ感染的EL-4组相比,lipofectamine可以明显提高重组腺病毒的感染效率(P<0.01)。
, 百拇医药
Fig 2 The influence of different factors on the
efficacy of recombinant adenovirus
A:rmIL-2;B:PHA;C:rmIL-2+PHA;D:control;E:lipofectamine(MOI=50)
2.4 AdCMVIL-12感染EL-4细胞mlL-12的测定 AdCMVIL-12以MOI 500感染EL-4细胞,ELISA检测感染48 h的培养上清中mIL-12的含量达(37±6.4) μg.L-1;在lipofectamine的协助下,MOI为50时,感染48 h的培养上清中mIL-12含量可以上升到(84.6±9.5) μg.L-1,明显高于未加lipofectamine者(P<0.01)。
, 百拇医药
3 讨论
基因治疗的关键是基因转移,即将目的基因导至靶细胞内。基因转移有物理方法,化学方法和生物方法。物理方法包括电穿孔、显微注射;化学方法包括磷酸钙沉淀、脂质体及DEAE-葡聚糖等方法;生物方法主要指的是病毒介导基因转移,包括逆转录病毒、腺病毒、腺相关病毒、痘病毒等。物理和化学方法转染效率低但相对安全,病毒转染效率高但有潜在危险性。腺病毒作为基因转染的载体之一,具有病毒颗粒比较稳定,可以纯化和浓缩、可感染非分裂细胞、无随机插入的危险性,宿主范围广的特点[3],因而近来受到广泛关注。但腺病毒并非对所有细胞的感染效率均令人满意,有学者[4]用AdRSV β-gal感染13种不同的血液系统肿瘤的细胞株及27例血液病患者血细胞,发现K 562和PRMI 8226感染效率分别为65%和64%,MT达38%,其余的细胞株感染效率均不足20%,甚至为零,AML(急性粒细胞白血病)、CLL(慢性淋巴细胞白血病)、NHL(非何杰金淋巴病)、MDS(骨髓增生异常综合症)患者新鲜血细胞转染效率也几乎为零。腺病毒要进入细胞,需先和细胞表面的受体结合,继而在αv整合素介导下被细胞内吞[5,6]。腺病毒对一些特定细胞的感染受到限制,可能就是由于这些细胞表面缺乏受体和整合素。Cantwell等[7]比较了腺病毒感染CLL和HeLa的效率,发现腺病毒对CLL的转染效率在MOI(1~10 000)时均低于对HeLa的转染效率100~1 000倍,抗CD 40单抗刺激CLL,可以诱导CLL表面表达αvβ3和αvβ5,腺病毒对CLL的感染效率可以提高5倍。我们在本实验中用AdCMVLacZ感染EL-4细胞株,发现当MOI为500时,转染效率为20%,单纯提高MOI值或用PHA和rmIL-2刺激细胞均未能明显提高腺病毒的感染效率。而lipofectamine与腺病毒先行作用30 min,在较低的MOI时可以明显地提高转染效率(P<0.01)。lipofectamine既往通常被用来转染质粒,寡聚核苷酸之用,其在病毒转染中的作用刚刚起步,究其提高腺病毒感染效率的机制可能是lipofectamine与腺病毒通过电荷作用,形成复合物,复合物表面被脂质包裹,与带负电荷的细胞表面相互接触,细胞内吞或通过胞膜融合摄取腺病毒与lipofectamine的复合物。这种摄取方式可以不依赖细胞表面的腺病毒蛋白受体、整合素的参与[8]。我们在本实验中,还采用lipofectamine协同重组腺病毒AdCMVIL-12感染EL-4细胞,提高了mlL-12基因的转染效率,将其作为肿瘤疫苗的研究另见报道。
, 百拇医药
作者简介:徐彤,女,29岁,博士
徐彤(北京医科大学附属人民医院儿科,北京 100044)
殷慧君(北京医科大学附属人民医院儿科,北京 100044)
唐佩弦(军事医学科学院基础医学研究所,北京 100850)
参考文献
1.Graham FL, Prevec L. Manipulation of adenovirus vectors. In:Murray EJ ed. Methods in molecular biology,Clifton:The Humana Press Inc,1991:109~27
2.耿雨红,吴昊泉,应蓓蓓 et al.带HSV-tk的重组腺病毒杀伤离体肺癌细胞的研究.复旦大学学报(自然科学版),1996;35:121~6
, 百拇医药
3.彭朝晖主编.基因治疗——基因与临床,北京:中国科学技术出版社,1994:212~3
4.Wattel E, Vanrumbeke M, Abina MA et al. Deferential efficacy of adenoviral mediated gene transfer into cells from hematological cell lines and fresh hematological malignancies. Leukemia,1996;10:171~4
5.Goldman MJ, Wilson JM. Gradient of RGD-dependent entry of adenoviral vector in nasal and intrapulmonary epithelia; implications for gene therapy of cystic fibrosis. Gene Ther,1996;3:811~8
, 百拇医药
6.Bergelson JM, Cunningham JA, Droguett G et al. Isolation of a common receptor for coxsackie B viruses and adenoviruses 2 and 5. Science,1997;275:1320~3
7.Cantwill MJ, Sharma S, Friedmann T et al. Adenovirus vector infection of chronic lymphocytic leukemia B cells. Blood,1996;88:4676~83
8.Changbin Q, Mary BDY, Aloke F et al. Cationic liposomes enhance adenovirus entry via a pathway independent of the fiber receptor and αv-integrins. Human Gene Therapy,1998;9:507~20, 百拇医药
摘 要 目的 观察不同因素对重组腺病毒转染效率的影响。方法 以重组腺病毒去感染小鼠T淋巴瘤细胞株EL-4,加入不同的刺激因子和lipofectamine,通过计数X-gal染色阳性细胞数测定转染效率。结果 rmIL-2,植物血凝素均不能改善重组腺病毒对EL-4的感染效率,而阳离子脂质体可以明显提高重组腺病毒对EL-4的感染效率。结论 可以利用阳离子脂质体来提高重组腺病毒的转染效率。
关键词:阳离子脂质体 重组腺病毒 转染效率
将外源基因导入细胞内的方式有多种,腺病毒既可以感染分裂期细胞也可感染非分裂期细胞,病毒颗粒比较稳定,可以纯化和浓缩,不整合,安全性高,因此近来受到广泛关注,以其作载体将不同的外源基因导入真核细胞的研究纷纷开展,尤其是利用重组腺病毒将细胞因子导入实体瘤细胞,激活机体抗肿瘤免疫的研究。关于重组腺病毒转染血液系统肿瘤的报道很少,因此我们用重组腺病毒AdCMVLacZ感染小鼠淋巴瘤细胞EL-4,测定不同因素对重组腺病毒感染效率的影响,以期找到提高腺病毒感染效率的有效途径。
, http://www.100md.com
1 材料与方法
1.1 主要试剂 重组腺病毒AdCMVLacZ、AdCMVIL-12粗提液(西班牙Navarra大学Dr Cheng Qian惠赠)。氯化铯(Boehringer公司)。阳离子脂质体lipofectamine(Gibco公司产品)。X-gal(5-溴-4-氯-3-吲哚-β-半乳糖苷,Sigma公司产品)。mIL-12的ELISA检测试剂盒购自Endogen公司。植物血凝素(PHA,广州医学工程研究所产品)。rmIL-2纯品由军事医学科学院惠赠。
1.2 细胞株 EL-4细胞是化学致癌剂在C57BL/6(H-2b)小鼠诱导T淋巴瘤细胞株(由北京医科大学免疫系提供)。复制缺陷型重组腺病毒载体包装细胞株293(人胚肾细胞株)由军事医学科学院吴祖泽院士惠赠。Hela为人宫颈癌细胞株,CHO细胞株为中国仓鼠卵巢细胞。
1.3 腺病毒的扩增、收集及纯化
, http://www.100md.com
1.3.1 293细胞用完全DMEM 含体积分数为10%新生牛血清,1×105 U.L-1青霉素、100 mg.L-1链霉素,37℃、0.05 CO2、饱和湿度培养。待细胞长至培养瓶底的70%~80%时培养基更换为含体积分数为2.5%新生牛血清的DMEM,加入重组腺病毒粗提液,继续培养观察48~72 h,收集呈病态反应(cytopathic effect,CPE)的293细胞,反复冻融5次,每次冻融后振摇30 s,1 500 rpm离心20 min,弃细胞碎片,收集上清,经氯化铯密度梯度两次离心浓缩腺病毒颗粒[1],经Hanks液透析后,加入体积分数为20%甘油,分装后于-70℃冻存备用。
1.3.2 重组腺病毒滴度的测定 病毒滴度采用噬斑分析法结合细胞病变测定法[2]。
1.3.3 重组腺病毒感染EL-4细胞的测定 AdCMVLacZ以MOI(multiplicity of infection)5,50,500,5 000分别感染EL-4细胞,4 h后用RPMI 1640洗涤去除游离病毒,于37℃、0.05 CO2培养24 h,体积分数为2.5%戊二醛固定15 min,再以含10 mmol.L-1 MgCl2的PBS洗2遍,X-gal染色48 h后计数蓝染细胞。
, http://www.100md.com
1.4 重组腺病毒对不同细胞株感染效率的测定 AdCMVLacZ以MOI 50分别感染HeLa,CHO细胞株,测定转染效率。
1.5 不同刺激分子对重组腺病毒感染EL-4效率的影响 EL-4细胞分别以rmIL-2,PHA或rmIL-2+PHA刺激72 h,rmIL-2的终浓度为20 kU.L-1,PHA的终浓度为5 mg.L-1,刺激后以AdCMVLacZ感染,测定转染效率。
1.6 阳离子脂质体(lipofectamine)对重组腺病毒感染EL-4效率的影响 50 μl纯化的腺病毒加入50 μl无抗生素RPMI 1640,在此100 μl体系内加入1 μl的lipofectamine(终浓度为1 mg.L-1)室温静置30 min。100 μl浓度为2×1010 cells.L-1的EL-4细胞与该体系共同孵育105 min(MOI为50),以RPMI 1640洗涤2次去除游离病毒,用完全RPMI 1640培养24 h,固定,X-gal染色48 h观察结果。
, 百拇医药
1.7 AdCMVIL-12感染EL-4细胞培养上清中IL-12含量的测定 AdCMVIL-12分别在有无lipofectamine的情况下感染EL-4细胞,收集感染48 h的培养上清,ELISA测定mIL-12的含量,结果以450 nm OD值在标准曲线上对应值表示。
1.8 统计学处理 采用未配对计量资料的t检验。
2 结果
2.1 重组腺病毒对EL-4细胞感染效率的观察 重组腺病毒颗粒经扩增浓缩纯化后AdCMVLacZ和AdCMVIL-12的滴度分别为2.1×1013 pfu.L-1及4.5×1012 pfu.L-1(plaque forming unit,空斑形成单位)。AdCMVLacZ的MOI值为5时,感染EL-4后X-gal染色阳性细胞率达4.6%±2.97%,MOI为50时,感染阳性率达12.3%±2.51%,MOI达500时,X-gal染色阳性细胞率为20.3%±4.73%,以后随着MOI的升高,细胞感染阳性细胞率没有明显提高,见图1。

, 百拇医药
Fig 1 The efficacy of recombinant adenovirus at different MOI
2.2 重组腺病毒对不同细胞株感染效率的影响 当AdCMVLacZ的MOI值为50时,HeLa和CHO感染的阳性细胞率均高于90%,而EL-4的感染率仅为12.3%±2.51%,提示HeLa和CHO是腺病毒的易感细胞,而EL-4不易被腺病毒感染。
2.3 不同因素对重组腺病毒感染EL-4效率的影响 培养的EL-4细胞分别以rmIL-2、PHA、rmIL-2+PHA刺激后,AdCMVLacZ的感染率分别为20%±4.4%、23.7%±3.1%、22.0%±2.7%,而EL-4细胞用lipofectamine协同感染后,在MOI=50时,AdCMVLacZ的感染率就可上升到37.0%±4.0%,见图2。由图可见,EL-4细胞经rmIL-2,PHA,rmIL-2+PHA刺激,重组腺病毒对其的感染率没有明显的增加。而与未经刺激的AdCMVLacZ感染的EL-4组相比,lipofectamine可以明显提高重组腺病毒的感染效率(P<0.01)。

, 百拇医药
Fig 2 The influence of different factors on the
efficacy of recombinant adenovirus
A:rmIL-2;B:PHA;C:rmIL-2+PHA;D:control;E:lipofectamine(MOI=50)
2.4 AdCMVIL-12感染EL-4细胞mlL-12的测定 AdCMVIL-12以MOI 500感染EL-4细胞,ELISA检测感染48 h的培养上清中mIL-12的含量达(37±6.4) μg.L-1;在lipofectamine的协助下,MOI为50时,感染48 h的培养上清中mIL-12含量可以上升到(84.6±9.5) μg.L-1,明显高于未加lipofectamine者(P<0.01)。
, 百拇医药
3 讨论
基因治疗的关键是基因转移,即将目的基因导至靶细胞内。基因转移有物理方法,化学方法和生物方法。物理方法包括电穿孔、显微注射;化学方法包括磷酸钙沉淀、脂质体及DEAE-葡聚糖等方法;生物方法主要指的是病毒介导基因转移,包括逆转录病毒、腺病毒、腺相关病毒、痘病毒等。物理和化学方法转染效率低但相对安全,病毒转染效率高但有潜在危险性。腺病毒作为基因转染的载体之一,具有病毒颗粒比较稳定,可以纯化和浓缩、可感染非分裂细胞、无随机插入的危险性,宿主范围广的特点[3],因而近来受到广泛关注。但腺病毒并非对所有细胞的感染效率均令人满意,有学者[4]用AdRSV β-gal感染13种不同的血液系统肿瘤的细胞株及27例血液病患者血细胞,发现K 562和PRMI 8226感染效率分别为65%和64%,MT达38%,其余的细胞株感染效率均不足20%,甚至为零,AML(急性粒细胞白血病)、CLL(慢性淋巴细胞白血病)、NHL(非何杰金淋巴病)、MDS(骨髓增生异常综合症)患者新鲜血细胞转染效率也几乎为零。腺病毒要进入细胞,需先和细胞表面的受体结合,继而在αv整合素介导下被细胞内吞[5,6]。腺病毒对一些特定细胞的感染受到限制,可能就是由于这些细胞表面缺乏受体和整合素。Cantwell等[7]比较了腺病毒感染CLL和HeLa的效率,发现腺病毒对CLL的转染效率在MOI(1~10 000)时均低于对HeLa的转染效率100~1 000倍,抗CD 40单抗刺激CLL,可以诱导CLL表面表达αvβ3和αvβ5,腺病毒对CLL的感染效率可以提高5倍。我们在本实验中用AdCMVLacZ感染EL-4细胞株,发现当MOI为500时,转染效率为20%,单纯提高MOI值或用PHA和rmIL-2刺激细胞均未能明显提高腺病毒的感染效率。而lipofectamine与腺病毒先行作用30 min,在较低的MOI时可以明显地提高转染效率(P<0.01)。lipofectamine既往通常被用来转染质粒,寡聚核苷酸之用,其在病毒转染中的作用刚刚起步,究其提高腺病毒感染效率的机制可能是lipofectamine与腺病毒通过电荷作用,形成复合物,复合物表面被脂质包裹,与带负电荷的细胞表面相互接触,细胞内吞或通过胞膜融合摄取腺病毒与lipofectamine的复合物。这种摄取方式可以不依赖细胞表面的腺病毒蛋白受体、整合素的参与[8]。我们在本实验中,还采用lipofectamine协同重组腺病毒AdCMVIL-12感染EL-4细胞,提高了mlL-12基因的转染效率,将其作为肿瘤疫苗的研究另见报道。
, 百拇医药
作者简介:徐彤,女,29岁,博士
徐彤(北京医科大学附属人民医院儿科,北京 100044)
殷慧君(北京医科大学附属人民医院儿科,北京 100044)
唐佩弦(军事医学科学院基础医学研究所,北京 100850)
参考文献
1.Graham FL, Prevec L. Manipulation of adenovirus vectors. In:Murray EJ ed. Methods in molecular biology,Clifton:The Humana Press Inc,1991:109~27
2.耿雨红,吴昊泉,应蓓蓓 et al.带HSV-tk的重组腺病毒杀伤离体肺癌细胞的研究.复旦大学学报(自然科学版),1996;35:121~6
, 百拇医药
3.彭朝晖主编.基因治疗——基因与临床,北京:中国科学技术出版社,1994:212~3
4.Wattel E, Vanrumbeke M, Abina MA et al. Deferential efficacy of adenoviral mediated gene transfer into cells from hematological cell lines and fresh hematological malignancies. Leukemia,1996;10:171~4
5.Goldman MJ, Wilson JM. Gradient of RGD-dependent entry of adenoviral vector in nasal and intrapulmonary epithelia; implications for gene therapy of cystic fibrosis. Gene Ther,1996;3:811~8
, 百拇医药
6.Bergelson JM, Cunningham JA, Droguett G et al. Isolation of a common receptor for coxsackie B viruses and adenoviruses 2 and 5. Science,1997;275:1320~3
7.Cantwill MJ, Sharma S, Friedmann T et al. Adenovirus vector infection of chronic lymphocytic leukemia B cells. Blood,1996;88:4676~83
8.Changbin Q, Mary BDY, Aloke F et al. Cationic liposomes enhance adenovirus entry via a pathway independent of the fiber receptor and αv-integrins. Human Gene Therapy,1998;9:507~20, 百拇医药