超氧阴离子自由基致NIH3T3细胞DNA损伤与c-myc基因表达
http://www.100md.com
超氧阴离子自由基致NIH3T3细胞DNA损伤与c-myc基因表达
超氧阴离子自由基致NIH3T3细胞DNA损伤与c-myc基因表达
余斌 李芸 盛齐 廖钢陵 吴元德
摘 要 目的 研究超氧阴离子自由基( alt="14.gif (125 字节)"> alt="14.gif (125 字节)">)对NIH3T3细胞DNA的损伤及其脂质过氧化作用和对c-myc基因表达的影响。方法 用黄嘌呤-黄嘌呤氧化酶(X-XO)系统产生
alt="14.gif (125 字节)"> alt="14.gif (125 字节)">)对NIH3T3细胞DNA的损伤及其脂质过氧化作用和对c-myc基因表达的影响。方法 用黄嘌呤-黄嘌呤氧化酶(X-XO)系统产生 alt="14.gif (125 字节)">;测定DNA-溴乙锭结合物荧光强度变化确定DNA损伤程度;以硫代巴比妥酸法测定脂质过氧化产物丙二醛(MDA)含量;以细胞原位杂交法检测c-myc基因表达。 结果 高剂量
alt="14.gif (125 字节)">;测定DNA-溴乙锭结合物荧光强度变化确定DNA损伤程度;以硫代巴比妥酸法测定脂质过氧化产物丙二醛(MDA)含量;以细胞原位杂交法检测c-myc基因表达。 结果 高剂量 alt="14.gif (125 字节)">能直接引起DNA断裂损伤。
alt="14.gif (125 字节)">能直接引起DNA断裂损伤。 alt="14.gif (125 字节)">作用于完整细胞,MDA含量及DNA断裂损伤显著增加,过氧化氢酶能明显抑制此效应。中、高剂量
alt="14.gif (125 字节)">作用于完整细胞,MDA含量及DNA断裂损伤显著增加,过氧化氢酶能明显抑制此效应。中、高剂量 alt="14.gif (125 字节)">能引起明显的c-myc基因表达。结论
alt="14.gif (125 字节)">能引起明显的c-myc基因表达。结论  alt="14.gif (125 字节)">引起细胞DNA 损伤与过氧化氢的形成有关,其损伤的途径可能是通过膜脂质过氧化;
alt="14.gif (125 字节)">引起细胞DNA 损伤与过氧化氢的形成有关,其损伤的途径可能是通过膜脂质过氧化;  alt="14.gif (125 字节)">诱导NIH3T3细胞c-myc基因表达与剂量密切相关。
alt="14.gif (125 字节)">诱导NIH3T3细胞c-myc基因表达与剂量密切相关。
, 百拇医药
关键词:超氧阴离子自由基 活性氧 DNA损伤 脂质过氧化 基因表达
氧化应激损伤DNA导致细胞突变与肿瘤的发生、发展密切相关。已有研究证明,许多种类的活性氧引发脂质过氧化后的产物可与提取的DNA反应并导致损伤[1~3]。但是对体内活性氧的重要来源超氧阴离子( )与DNA损伤的关系,
)与DNA损伤的关系, 作用于完整细胞,引发膜脂质过氧化,损伤细胞内基因组DNA,影响细胞功能的研究尚鲜见报道。本研究采用黄嘌呤-黄嘌呤氧化酶(X-XO)反应系统产生的
作用于完整细胞,引发膜脂质过氧化,损伤细胞内基因组DNA,影响细胞功能的研究尚鲜见报道。本研究采用黄嘌呤-黄嘌呤氧化酶(X-XO)反应系统产生的 ,以溴乙锭(EB)作为荧光探针,检测DNA断裂损伤程度,并在完整NIH3T3细胞水平,研究
,以溴乙锭(EB)作为荧光探针,检测DNA断裂损伤程度,并在完整NIH3T3细胞水平,研究 致膜脂质过氧化、诱导基因组DNA损伤及其对细胞c-myc基因表达的影响。
致膜脂质过氧化、诱导基因组DNA损伤及其对细胞c-myc基因表达的影响。
, 百拇医药
材料和方法
材料与仪器 NIH3T3 细胞由本所细胞生物室惠赠。X、EB、过氧化氢酶(CAT)、硫代巴比妥酸(TBA)为Sigma公司产品;XO、地高辛标记检测试剂盒为Boehringer Mannbeim公司产品;四乙氧基丙烷为Fluka公司产品;其余试剂均为国产分析纯级。荧光分光光度计为日本Hitachi MPF-4型;紫外分光光度计为Shimadz uv-1206型;高速分散器为上海XHF-1型;双光束薄层扫描仪为日本Shimadzu CS-910型。
细胞培养 NIH3T3细胞在37 ℃、含5% CO2的孵箱中培养,培养基为DMEM(含10%灭活小牛血清,100 U/ml青霉素和100 μg/ml链霉素, pH 7.2~7.4)。 的产生 用D-Hank′s液配制浓度为0.2%的X液,以NaOH促溶;XO用D-Hank′s液制备成l U/ml母液备用;以化学发光法确定一定量
的产生 用D-Hank′s液配制浓度为0.2%的X液,以NaOH促溶;XO用D-Hank′s液制备成l U/ml母液备用;以化学发光法确定一定量 的发光值,检测每次实验
的发光值,检测每次实验 产生的均一性。
产生的均一性。
, http://www.100md.com
DNA提取和测定 采用酚-氯仿抽提法[4]。测定波长为260、280 nm处光密度值,然后计算DNA纯度和浓度。
测定 损伤NIH3T3细胞中提取的DNA
损伤NIH3T3细胞中提取的DNA  直接作用于提取的细胞DNA,实验分成6组,每组取20 μg DNA,溶入总体积为200 μl的0.2 mol/L PBS(pH 7.0)中,分别加入:(1)正常对照,未加任何作用物;(2)低剂量
直接作用于提取的细胞DNA,实验分成6组,每组取20 μg DNA,溶入总体积为200 μl的0.2 mol/L PBS(pH 7.0)中,分别加入:(1)正常对照,未加任何作用物;(2)低剂量 (由加入0.4 μg X,4×10-5U XO产生);(3)高剂量
(由加入0.4 μg X,4×10-5U XO产生);(3)高剂量 (由加入20 μg X,2×10-3 U XO产生);(4)高剂量
(由加入20 μg X,2×10-3 U XO产生);(4)高剂量 +20 U超氧化物歧化酶(SOD)+0.1 mmol/L FeSO4;(5)0.1 mmol/L FeSO4;(6)高剂量
+20 U超氧化物歧化酶(SOD)+0.1 mmol/L FeSO4;(5)0.1 mmol/L FeSO4;(6)高剂量 +20 U SOD+0.1 mmol/L FeSO4+50 μl大鼠肝微粒体,该组DNA改为最后加入。各组在37 ℃温育120 min后加入10 μg EB,再温育15 min,以0.1×SSC(pH 6.8)溶液稀释至2.0 ml,以520 nm为激发波长,测定600 nm时的DNA-EB结合物的相对荧光强度。
+20 U SOD+0.1 mmol/L FeSO4+50 μl大鼠肝微粒体,该组DNA改为最后加入。各组在37 ℃温育120 min后加入10 μg EB,再温育15 min,以0.1×SSC(pH 6.8)溶液稀释至2.0 ml,以520 nm为激发波长,测定600 nm时的DNA-EB结合物的相对荧光强度。 作用于完整的NIH3T3细胞后MDA含量及DNA损伤的测定 实验分成7组,在含有107个细胞的l ml 培养基中,各组分别加入:(1)正常对照,未加任何作用物:(2)低剂量
作用于完整的NIH3T3细胞后MDA含量及DNA损伤的测定 实验分成7组,在含有107个细胞的l ml 培养基中,各组分别加入:(1)正常对照,未加任何作用物:(2)低剂量 ;(3)高剂量
;(3)高剂量 ;(4)高剂量
;(4)高剂量 +20 U SOD+0.1 mmol/L FeSO4;(5)0.1 mmol/L FeSO4;(6)高剂量
+20 U SOD+0.1 mmol/L FeSO4;(5)0.1 mmol/L FeSO4;(6)高剂量 +0.1 mg/ml CAT;(7)高剂量
+0.1 mg/ml CAT;(7)高剂量 +0.1 mmol/L FeSO4+0.1 mg/ml CAT。各组在37 ℃温育5 h后,以高速分散器(2000 r/min,10 s,3次)分散细胞,以TBA法测定MDA含量[5]。DNA损伤测定实验分组及处理过程同上。各组在37 ℃温育5 h后,提取细胞基因组DNA,直接在含有20 μg DNA的200 μl 0.2 mol/L PBS(pH7.0)中加入10 μg EB,温育15 min。荧光测定方法同前述。
+0.1 mmol/L FeSO4+0.1 mg/ml CAT。各组在37 ℃温育5 h后,以高速分散器(2000 r/min,10 s,3次)分散细胞,以TBA法测定MDA含量[5]。DNA损伤测定实验分组及处理过程同上。各组在37 ℃温育5 h后,提取细胞基因组DNA,直接在含有20 μg DNA的200 μl 0.2 mol/L PBS(pH7.0)中加入10 μg EB,温育15 min。荧光测定方法同前述。
, http://www.100md.com
X作用于完整的NIH3T3细胞检测c-myc基因表达 在含有107个细胞的l ml培养基中分别加入高、中(由加入4 μg X,4×10-4U XO产生)、低剂量X,37 ℃温育不同时间后以地高辛配基标记的c-myc基因探针进行原位杂交[6],并对杂交显色斑点结果进行薄层扫描分析。
统计学处理 数据以平均值±标准差(X±s)表示,组间差异的显著性采用t检验分析。
结 果 对NIH3T3细胞中提取的DNA的损伤作用 加入高剂量
对NIH3T3细胞中提取的DNA的损伤作用 加入高剂量 及同时加入SOD、FeSO4和SOD、FeSO4、微粒体3组,DNA-EB结合物荧光强度较未经
及同时加入SOD、FeSO4和SOD、FeSO4、微粒体3组,DNA-EB结合物荧光强度较未经 作用的对照组显著降低,低剂量
作用的对照组显著降低,低剂量 及采用FeSO4作用组DNA-EB结合物荧光强度虽比对照组降低但差异无显著性(表1)。
及采用FeSO4作用组DNA-EB结合物荧光强度虽比对照组降低但差异无显著性(表1)。 作用于完整NIH3T3细胞后测定MDA含量及DNA损伤 低剂量
作用于完整NIH3T3细胞后测定MDA含量及DNA损伤 低剂量 及单独FeSO4作用组MDA 含量及DNA-EB结合物荧光强度与对照组相比无显著差异。高剂量
及单独FeSO4作用组MDA 含量及DNA-EB结合物荧光强度与对照组相比无显著差异。高剂量 作用后MDA含量显著增加,DNA-EB结合物荧光强度则显著降低,高剂量
作用后MDA含量显著增加,DNA-EB结合物荧光强度则显著降低,高剂量 +SOD+FeSO4作用组,上述变化更为剧烈。在高剂量
+SOD+FeSO4作用组,上述变化更为剧烈。在高剂量 +CAT作用组,MDA含量与对照组相比差异无显著性,但DNA-EB结合物荧光强度仍有显著降低(表2)。
+CAT作用组,MDA含量与对照组相比差异无显著性,但DNA-EB结合物荧光强度仍有显著降低(表2)。
, http://www.100md.com
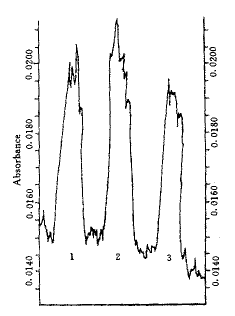
c-myc 基因的表达 低剂量 作用15和60 min,c-myc基因基本无表达;中剂量
作用15和60 min,c-myc基因基本无表达;中剂量 作用60 min,有明显表达;而高剂量
作用60 min,有明显表达;而高剂量 作用15 min后即有明显表达,60 min后表达甚微(图1,2)。
作用15 min后即有明显表达,60 min后表达甚微(图1,2)。
表1 各种反应物作用后DNA-EB结合
物相对荧光强度值变化
Table 1 Relative fluorescence intensity value of EB combined with isolated NIH3T3 cell DNA reacted with various substances (x±s,n=4)
, 百拇医药
Group
Relative
fluorescence
intensity
Control
41.2±1.8
0.4 μg X+4×10-5 U XO
39.3±1.5
20 μg X+2×10-3 U XO
37.5±1.4*
20 μg X+2×10-3 U XO+SOD+FeSO4
, 百拇医药
17.8±1.2**
FeSO4
39.3±1.2
20 μg X+2×10-3 U XO+SOD
+FeSO4+microsome
20.3±1.4**
*P<0.05,**P<0.01 compared with the control group;SOD:superoxide dismutase,20 U/ml;FeSO4:0.1mmol/L;Microsome:50 μl;X:xanthine; XO:xanthine oxidase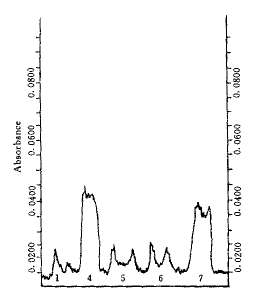
, http://www.100md.com
图 1 地高辛配基标记的c-myc基因探针与低浓度 作用的NIH3T3细胞原位杂交RNA斑点扫描吸收分析
作用的NIH3T3细胞原位杂交RNA斑点扫描吸收分析
Fig 1 Absorbance of screening the dot blot of situ RNA hybridization with digoxigenin-labled c-myc oncogene probes in the NIH3T3 cell pretreated with of low concentration
of low concentration
1.control;2.cell treated with of low concentration after sixty minutes;3.cell treated with
of low concentration after sixty minutes;3.cell treated with  of low concentration after fifteen minutes
of low concentration after fifteen minutes
, 百拇医药
图 2 地高辛配基标记的c-myc 基因探 针与不同浓度 作用的NIH3T3细胞原位杂交RNA斑点扫描吸收分析
作用的NIH3T3细胞原位杂交RNA斑点扫描吸收分析
Fig 2 Absorbance of screening the dot blot of situ RNA hybridization with digoxigenin-labled c-myc oncogene probes in the NIH3T3 cell pretreated with of various concentrations
of various concentrations
1.control;4.cell treated with of middle concentration after sixty minutes;5.cell treated with
of middle concentration after sixty minutes;5.cell treated with  of middle concentration after fifteen minutes;6.cell treated with
of middle concentration after fifteen minutes;6.cell treated with  of high concentration after sixty minutes;7.cell treated with
of high concentration after sixty minutes;7.cell treated with  of high concentration after fifteen minutes
of high concentration after fifteen minutes
, 百拇医药
表2 各种反应物作用后细胞MDA含量及DNA-EB 结合物相对荧光强度值
Table 2 MDA content and relative fluorescence
intensity value of EB combined with DNA
which were isolated from whole NIH3T3 cell pretreated by
various substances(x±s,n=4)
Group
MDA content (nmol/107 cells)
Relative fluorescence intensity
, 百拇医药
Control
0.0424±0.0043
41.1±1.1
0.4 μg X+4×10-5 U XO
0.0428±0.0039
39.8±1.8
20 μg X+2×10-3 U XO
0.0800±0.0043**
29.4±3.3
20 μg X+2×10-3 U XO +SOD+FeSO4
, http://www.100md.com
0.1012±0.0067**
25.3±2.3**
FeSO4
0.0428±0.0058
40.2±3.7
20 μg X+2×10-3 U XO+CAT
0.0459±0.0049
37.0±1.6*
20 μg X+2×10-3 U XO+FeSO4+CAT
, http://www.100md.com
0.0430±0.0050
37.6±1.8*
*P<0.05,**P<0.01 compared with the control group;SOD:20U/ml;FeSO4:0.1 mmol/L;CAT:catalase(0.1 mg/ml)讨 论
一些实验表明 和H2O2不能与DNA发生反应[7]。但本实验结果显示高剂量
和H2O2不能与DNA发生反应[7]。但本实验结果显示高剂量  直接作用于DNA时,DNA-EB结合物荧光强度显著低于对照组,这可能是细胞染色体上存在铜离子[8]促使
直接作用于DNA时,DNA-EB结合物荧光强度显著低于对照组,这可能是细胞染色体上存在铜离子[8]促使  歧化生成的H2O2经过Fenton反应生成羟自由基(.OH)后引起的DNA断裂所致。在有一定量的SOD和亚铁离子条件下,.OH产生的更多,引起DNA断裂损伤更为显著。高剂量的
歧化生成的H2O2经过Fenton反应生成羟自由基(.OH)后引起的DNA断裂所致。在有一定量的SOD和亚铁离子条件下,.OH产生的更多,引起DNA断裂损伤更为显著。高剂量的  经过SOD歧化及由Fenton反应作用肝微粒体诱发脂质过氧化的产物也能造成DNA明显的断裂损伤。
经过SOD歧化及由Fenton反应作用肝微粒体诱发脂质过氧化的产物也能造成DNA明显的断裂损伤。
, http://www.100md.com
高剂量 作用于完整的NIH3T3细胞后MDA含量显著增加,DNA-EB结合物荧光强度明显下降,提示细胞膜受到脂质过氧化损伤,及细胞内DNA链发生损伤断裂。Fe2+加重这种作用及足量的CAT可以明显抑制这种损伤效应,说明
作用于完整的NIH3T3细胞后MDA含量显著增加,DNA-EB结合物荧光强度明显下降,提示细胞膜受到脂质过氧化损伤,及细胞内DNA链发生损伤断裂。Fe2+加重这种作用及足量的CAT可以明显抑制这种损伤效应,说明  歧化生成的H2O2经Fenton反应产生的.OH与细胞膜及胞内DNA的损伤密切相关。在CAT抑制效应中,出现MDA含量维持在正常水平,而DNA-EB结合物荧光强度显著降低,表明DNA仍有一定的断裂损伤。提示
歧化生成的H2O2经Fenton反应产生的.OH与细胞膜及胞内DNA的损伤密切相关。在CAT抑制效应中,出现MDA含量维持在正常水平,而DNA-EB结合物荧光强度显著降低,表明DNA仍有一定的断裂损伤。提示  对细胞内DNA的损伤除与反应生成.OH造成细胞膜的氧化损伤密切相关外,可能还存在着其它的作用途径,如影响细胞信号转导系统[9]。
对细胞内DNA的损伤除与反应生成.OH造成细胞膜的氧化损伤密切相关外,可能还存在着其它的作用途径,如影响细胞信号转导系统[9]。
, http://www.100md.com
小剂量 作用于NIH3T3细胞,未能观察到c-myc基因表达,但在本室以往的研究中发现,小剂量
作用于NIH3T3细胞,未能观察到c-myc基因表达,但在本室以往的研究中发现,小剂量  作用于NIH3T3细胞一定时间后,细胞可出现恶性转化[10],提示一次小剂量
作用于NIH3T3细胞一定时间后,细胞可出现恶性转化[10],提示一次小剂量  作用于细胞不足以引起c-myc基因过度表达,而反复多次的作用则可能会引起c-myc基因的过度表达,调控细胞转化。一次中剂量或高剂量
作用于细胞不足以引起c-myc基因过度表达,而反复多次的作用则可能会引起c-myc基因的过度表达,调控细胞转化。一次中剂量或高剂量  作用于NIH3T3细胞,均能在不同时间观察到c-myc基因的高表达。本室另有研究发现,该剂量
作用于NIH3T3细胞,均能在不同时间观察到c-myc基因的高表达。本室另有研究发现,该剂量  可促使NIH3T3细胞凋亡[11]。有学者认为c-myc基因起双向作用,既调控细胞增殖又调控细胞凋亡[12],故本研究中、高剂量
可促使NIH3T3细胞凋亡[11]。有学者认为c-myc基因起双向作用,既调控细胞增殖又调控细胞凋亡[12],故本研究中、高剂量  引起c-myc基因高表达可能与调控细胞凋亡有关。
引起c-myc基因高表达可能与调控细胞凋亡有关。
, http://www.100md.com
国家自然科学基金(39670196)资助
余斌(中国医学科学院 中国协和医科大学 基础医学研究所生物物理室,北京 100005)
李芸(中国医学科学院 中国协和医科大学 基础医学研究所生物物理室,北京 100005)
盛齐(中国医学科学院 中国协和医科大学 基础医学研究所生物物理室,北京 100005)
廖钢陵(中国医学科学院 中国协和医科大学 基础医学研究所生物物理室,北京 100005)
吴元德(中国医学科学院 中国协和医科大学 基础医学研究所生物物理室,北京 100005)
参考文献
[1]Wang YJ,Ho YS,Lo MI,et al.Oxidative modification of DNA bases in rat liver and lung during chemical carcinogenesis and aging.Chem Biol Interact,1995,94:135-145
, http://www.100md.com
[2]刘晓麒,曹恩华.脂质过氧化引起DNA损伤研究进展.生物化学与生物物理进展,1994,12(3):218-222
[3]曹恩华,刘晓麒,朱曰荣.脂质过氧化对DNA的损伤研究.生物物理学报,1994,10(1):68-74
[4]李尹雄.核酸的分离与纯化.见:卢圣栋主编.现代分子生物学实验技术.北京:高等教育出版社,1993.95
[5]Slater TF.Overview of methods used for detecting lipid peroxidation.Methods Enzymol,1984,105:283-288
[6]鲍家驹,沈德瑜,王瑞瑜,等.一种简便且灵敏的核酸杂交新方法——地高辛配基标记探针细胞原位杂交法应用于原癌基因表达研究.中国医学科学院学报,1991,13(6):439-442
, 百拇医药
[7]Aruama OI,Halliwell B,Gajewski Z,et al.Damage to the bases in DNA induced by hydrogen peroxide and ferric ion chalates.J Biol Chem,1989,264:20509-20512
[8]Prutz WA,Butler J,Lad EJ.Interaction of capper (l)with nucleic acids .Int J Rad Biol,1990,58(2):215-234
[9]Suzuki YJ,Forman HJ,Sevanion A.Oxidants as stimulators of signal transduction.Free Rad Biol Med,1997,22:269-285
[10]房克忠,俞志宏,邱 琦,等.超氧阴离子自由基对NIH3T3细胞的转化作用.基础医学与临床,1996,16(2):49-52
[11]郭 玲,薛安娜,王淑琴,等.氧自由基诱导细胞凋亡及硒与维生素E的防护作用.营养学报,1999,21(2):163-167
[12]Evan GI,Wyllie AH,Gilbert CS,et al.Induction of apoptosis in fibroblasts by c-myc protein.Cell,1992,69:119-128, http://www.100md.com
余斌 李芸 盛齐 廖钢陵 吴元德
摘 要 目的 研究超氧阴离子自由基(
 alt="14.gif (125 字节)"> alt="14.gif (125 字节)">)对NIH3T3细胞DNA的损伤及其脂质过氧化作用和对c-myc基因表达的影响。方法 用黄嘌呤-黄嘌呤氧化酶(X-XO)系统产生
alt="14.gif (125 字节)"> alt="14.gif (125 字节)">)对NIH3T3细胞DNA的损伤及其脂质过氧化作用和对c-myc基因表达的影响。方法 用黄嘌呤-黄嘌呤氧化酶(X-XO)系统产生 alt="14.gif (125 字节)">;测定DNA-溴乙锭结合物荧光强度变化确定DNA损伤程度;以硫代巴比妥酸法测定脂质过氧化产物丙二醛(MDA)含量;以细胞原位杂交法检测c-myc基因表达。 结果 高剂量
alt="14.gif (125 字节)">;测定DNA-溴乙锭结合物荧光强度变化确定DNA损伤程度;以硫代巴比妥酸法测定脂质过氧化产物丙二醛(MDA)含量;以细胞原位杂交法检测c-myc基因表达。 结果 高剂量 alt="14.gif (125 字节)">能直接引起DNA断裂损伤。
alt="14.gif (125 字节)">能直接引起DNA断裂损伤。 alt="14.gif (125 字节)">作用于完整细胞,MDA含量及DNA断裂损伤显著增加,过氧化氢酶能明显抑制此效应。中、高剂量
alt="14.gif (125 字节)">作用于完整细胞,MDA含量及DNA断裂损伤显著增加,过氧化氢酶能明显抑制此效应。中、高剂量 alt="14.gif (125 字节)">能引起明显的c-myc基因表达。结论
alt="14.gif (125 字节)">能引起明显的c-myc基因表达。结论  alt="14.gif (125 字节)">引起细胞DNA 损伤与过氧化氢的形成有关,其损伤的途径可能是通过膜脂质过氧化;
alt="14.gif (125 字节)">引起细胞DNA 损伤与过氧化氢的形成有关,其损伤的途径可能是通过膜脂质过氧化;  alt="14.gif (125 字节)">诱导NIH3T3细胞c-myc基因表达与剂量密切相关。
alt="14.gif (125 字节)">诱导NIH3T3细胞c-myc基因表达与剂量密切相关。, 百拇医药
关键词:超氧阴离子自由基 活性氧 DNA损伤 脂质过氧化 基因表达
氧化应激损伤DNA导致细胞突变与肿瘤的发生、发展密切相关。已有研究证明,许多种类的活性氧引发脂质过氧化后的产物可与提取的DNA反应并导致损伤[1~3]。但是对体内活性氧的重要来源超氧阴离子(
 )与DNA损伤的关系,
)与DNA损伤的关系, 作用于完整细胞,引发膜脂质过氧化,损伤细胞内基因组DNA,影响细胞功能的研究尚鲜见报道。本研究采用黄嘌呤-黄嘌呤氧化酶(X-XO)反应系统产生的
作用于完整细胞,引发膜脂质过氧化,损伤细胞内基因组DNA,影响细胞功能的研究尚鲜见报道。本研究采用黄嘌呤-黄嘌呤氧化酶(X-XO)反应系统产生的 ,以溴乙锭(EB)作为荧光探针,检测DNA断裂损伤程度,并在完整NIH3T3细胞水平,研究
,以溴乙锭(EB)作为荧光探针,检测DNA断裂损伤程度,并在完整NIH3T3细胞水平,研究 致膜脂质过氧化、诱导基因组DNA损伤及其对细胞c-myc基因表达的影响。
致膜脂质过氧化、诱导基因组DNA损伤及其对细胞c-myc基因表达的影响。, 百拇医药
材料和方法
材料与仪器 NIH3T3 细胞由本所细胞生物室惠赠。X、EB、过氧化氢酶(CAT)、硫代巴比妥酸(TBA)为Sigma公司产品;XO、地高辛标记检测试剂盒为Boehringer Mannbeim公司产品;四乙氧基丙烷为Fluka公司产品;其余试剂均为国产分析纯级。荧光分光光度计为日本Hitachi MPF-4型;紫外分光光度计为Shimadz uv-1206型;高速分散器为上海XHF-1型;双光束薄层扫描仪为日本Shimadzu CS-910型。
细胞培养 NIH3T3细胞在37 ℃、含5% CO2的孵箱中培养,培养基为DMEM(含10%灭活小牛血清,100 U/ml青霉素和100 μg/ml链霉素, pH 7.2~7.4)。
 的产生 用D-Hank′s液配制浓度为0.2%的X液,以NaOH促溶;XO用D-Hank′s液制备成l U/ml母液备用;以化学发光法确定一定量
的产生 用D-Hank′s液配制浓度为0.2%的X液,以NaOH促溶;XO用D-Hank′s液制备成l U/ml母液备用;以化学发光法确定一定量 的发光值,检测每次实验
的发光值,检测每次实验 产生的均一性。
产生的均一性。, http://www.100md.com
DNA提取和测定 采用酚-氯仿抽提法[4]。测定波长为260、280 nm处光密度值,然后计算DNA纯度和浓度。
测定
 损伤NIH3T3细胞中提取的DNA
损伤NIH3T3细胞中提取的DNA  直接作用于提取的细胞DNA,实验分成6组,每组取20 μg DNA,溶入总体积为200 μl的0.2 mol/L PBS(pH 7.0)中,分别加入:(1)正常对照,未加任何作用物;(2)低剂量
直接作用于提取的细胞DNA,实验分成6组,每组取20 μg DNA,溶入总体积为200 μl的0.2 mol/L PBS(pH 7.0)中,分别加入:(1)正常对照,未加任何作用物;(2)低剂量 (由加入0.4 μg X,4×10-5U XO产生);(3)高剂量
(由加入0.4 μg X,4×10-5U XO产生);(3)高剂量 (由加入20 μg X,2×10-3 U XO产生);(4)高剂量
(由加入20 μg X,2×10-3 U XO产生);(4)高剂量 +20 U超氧化物歧化酶(SOD)+0.1 mmol/L FeSO4;(5)0.1 mmol/L FeSO4;(6)高剂量
+20 U超氧化物歧化酶(SOD)+0.1 mmol/L FeSO4;(5)0.1 mmol/L FeSO4;(6)高剂量 +20 U SOD+0.1 mmol/L FeSO4+50 μl大鼠肝微粒体,该组DNA改为最后加入。各组在37 ℃温育120 min后加入10 μg EB,再温育15 min,以0.1×SSC(pH 6.8)溶液稀释至2.0 ml,以520 nm为激发波长,测定600 nm时的DNA-EB结合物的相对荧光强度。
+20 U SOD+0.1 mmol/L FeSO4+50 μl大鼠肝微粒体,该组DNA改为最后加入。各组在37 ℃温育120 min后加入10 μg EB,再温育15 min,以0.1×SSC(pH 6.8)溶液稀释至2.0 ml,以520 nm为激发波长,测定600 nm时的DNA-EB结合物的相对荧光强度。 作用于完整的NIH3T3细胞后MDA含量及DNA损伤的测定 实验分成7组,在含有107个细胞的l ml 培养基中,各组分别加入:(1)正常对照,未加任何作用物:(2)低剂量
作用于完整的NIH3T3细胞后MDA含量及DNA损伤的测定 实验分成7组,在含有107个细胞的l ml 培养基中,各组分别加入:(1)正常对照,未加任何作用物:(2)低剂量 ;(3)高剂量
;(3)高剂量 ;(4)高剂量
;(4)高剂量 +20 U SOD+0.1 mmol/L FeSO4;(5)0.1 mmol/L FeSO4;(6)高剂量
+20 U SOD+0.1 mmol/L FeSO4;(5)0.1 mmol/L FeSO4;(6)高剂量 +0.1 mg/ml CAT;(7)高剂量
+0.1 mg/ml CAT;(7)高剂量 +0.1 mmol/L FeSO4+0.1 mg/ml CAT。各组在37 ℃温育5 h后,以高速分散器(2000 r/min,10 s,3次)分散细胞,以TBA法测定MDA含量[5]。DNA损伤测定实验分组及处理过程同上。各组在37 ℃温育5 h后,提取细胞基因组DNA,直接在含有20 μg DNA的200 μl 0.2 mol/L PBS(pH7.0)中加入10 μg EB,温育15 min。荧光测定方法同前述。
+0.1 mmol/L FeSO4+0.1 mg/ml CAT。各组在37 ℃温育5 h后,以高速分散器(2000 r/min,10 s,3次)分散细胞,以TBA法测定MDA含量[5]。DNA损伤测定实验分组及处理过程同上。各组在37 ℃温育5 h后,提取细胞基因组DNA,直接在含有20 μg DNA的200 μl 0.2 mol/L PBS(pH7.0)中加入10 μg EB,温育15 min。荧光测定方法同前述。, http://www.100md.com
X作用于完整的NIH3T3细胞检测c-myc基因表达 在含有107个细胞的l ml培养基中分别加入高、中(由加入4 μg X,4×10-4U XO产生)、低剂量X,37 ℃温育不同时间后以地高辛配基标记的c-myc基因探针进行原位杂交[6],并对杂交显色斑点结果进行薄层扫描分析。
统计学处理 数据以平均值±标准差(X±s)表示,组间差异的显著性采用t检验分析。
结 果
 对NIH3T3细胞中提取的DNA的损伤作用 加入高剂量
对NIH3T3细胞中提取的DNA的损伤作用 加入高剂量 及同时加入SOD、FeSO4和SOD、FeSO4、微粒体3组,DNA-EB结合物荧光强度较未经
及同时加入SOD、FeSO4和SOD、FeSO4、微粒体3组,DNA-EB结合物荧光强度较未经 作用的对照组显著降低,低剂量
作用的对照组显著降低,低剂量 及采用FeSO4作用组DNA-EB结合物荧光强度虽比对照组降低但差异无显著性(表1)。
及采用FeSO4作用组DNA-EB结合物荧光强度虽比对照组降低但差异无显著性(表1)。 作用于完整NIH3T3细胞后测定MDA含量及DNA损伤 低剂量
作用于完整NIH3T3细胞后测定MDA含量及DNA损伤 低剂量 及单独FeSO4作用组MDA 含量及DNA-EB结合物荧光强度与对照组相比无显著差异。高剂量
及单独FeSO4作用组MDA 含量及DNA-EB结合物荧光强度与对照组相比无显著差异。高剂量 作用后MDA含量显著增加,DNA-EB结合物荧光强度则显著降低,高剂量
作用后MDA含量显著增加,DNA-EB结合物荧光强度则显著降低,高剂量 +SOD+FeSO4作用组,上述变化更为剧烈。在高剂量
+SOD+FeSO4作用组,上述变化更为剧烈。在高剂量 +CAT作用组,MDA含量与对照组相比差异无显著性,但DNA-EB结合物荧光强度仍有显著降低(表2)。
+CAT作用组,MDA含量与对照组相比差异无显著性,但DNA-EB结合物荧光强度仍有显著降低(表2)。, http://www.100md.com
c-myc 基因的表达 低剂量
 作用15和60 min,c-myc基因基本无表达;中剂量
作用15和60 min,c-myc基因基本无表达;中剂量 作用60 min,有明显表达;而高剂量
作用60 min,有明显表达;而高剂量 作用15 min后即有明显表达,60 min后表达甚微(图1,2)。
作用15 min后即有明显表达,60 min后表达甚微(图1,2)。表1 各种反应物作用后DNA-EB结合
物相对荧光强度值变化
Table 1 Relative fluorescence intensity value of EB combined with isolated NIH3T3 cell DNA reacted with various substances (x±s,n=4)
, 百拇医药
Group
Relative
fluorescence
intensity
Control
41.2±1.8
0.4 μg X+4×10-5 U XO
39.3±1.5
20 μg X+2×10-3 U XO
37.5±1.4*
20 μg X+2×10-3 U XO+SOD+FeSO4
, 百拇医药
17.8±1.2**
FeSO4
39.3±1.2
20 μg X+2×10-3 U XO+SOD
+FeSO4+microsome
20.3±1.4**
*P<0.05,**P<0.01 compared with the control group;SOD:superoxide dismutase,20 U/ml;FeSO4:0.1mmol/L;Microsome:50 μl;X:xanthine; XO:xanthine oxidase


, http://www.100md.com
图 1 地高辛配基标记的c-myc基因探针与低浓度
 作用的NIH3T3细胞原位杂交RNA斑点扫描吸收分析
作用的NIH3T3细胞原位杂交RNA斑点扫描吸收分析Fig 1 Absorbance of screening the dot blot of situ RNA hybridization with digoxigenin-labled c-myc oncogene probes in the NIH3T3 cell pretreated with
 of low concentration
of low concentration1.control;2.cell treated with
 of low concentration after sixty minutes;3.cell treated with
of low concentration after sixty minutes;3.cell treated with  of low concentration after fifteen minutes
of low concentration after fifteen minutes, 百拇医药
图 2 地高辛配基标记的c-myc 基因探 针与不同浓度
 作用的NIH3T3细胞原位杂交RNA斑点扫描吸收分析
作用的NIH3T3细胞原位杂交RNA斑点扫描吸收分析Fig 2 Absorbance of screening the dot blot of situ RNA hybridization with digoxigenin-labled c-myc oncogene probes in the NIH3T3 cell pretreated with
 of various concentrations
of various concentrations1.control;4.cell treated with
 of middle concentration after sixty minutes;5.cell treated with
of middle concentration after sixty minutes;5.cell treated with  of middle concentration after fifteen minutes;6.cell treated with
of middle concentration after fifteen minutes;6.cell treated with  of high concentration after sixty minutes;7.cell treated with
of high concentration after sixty minutes;7.cell treated with  of high concentration after fifteen minutes
of high concentration after fifteen minutes, 百拇医药
表2 各种反应物作用后细胞MDA含量及DNA-EB 结合物相对荧光强度值
Table 2 MDA content and relative fluorescence
intensity value of EB combined with DNA
which were isolated from whole NIH3T3 cell pretreated by
various substances(x±s,n=4)
Group
MDA content (nmol/107 cells)
Relative fluorescence intensity
, 百拇医药
Control
0.0424±0.0043
41.1±1.1
0.4 μg X+4×10-5 U XO
0.0428±0.0039
39.8±1.8
20 μg X+2×10-3 U XO
0.0800±0.0043**
29.4±3.3
20 μg X+2×10-3 U XO +SOD+FeSO4
, http://www.100md.com
0.1012±0.0067**
25.3±2.3**
FeSO4
0.0428±0.0058
40.2±3.7
20 μg X+2×10-3 U XO+CAT
0.0459±0.0049
37.0±1.6*
20 μg X+2×10-3 U XO+FeSO4+CAT
, http://www.100md.com
0.0430±0.0050
37.6±1.8*
*P<0.05,**P<0.01 compared with the control group;SOD:20U/ml;FeSO4:0.1 mmol/L;CAT:catalase(0.1 mg/ml)讨 论
一些实验表明
 和H2O2不能与DNA发生反应[7]。但本实验结果显示高剂量
和H2O2不能与DNA发生反应[7]。但本实验结果显示高剂量  直接作用于DNA时,DNA-EB结合物荧光强度显著低于对照组,这可能是细胞染色体上存在铜离子[8]促使
直接作用于DNA时,DNA-EB结合物荧光强度显著低于对照组,这可能是细胞染色体上存在铜离子[8]促使  歧化生成的H2O2经过Fenton反应生成羟自由基(.OH)后引起的DNA断裂所致。在有一定量的SOD和亚铁离子条件下,.OH产生的更多,引起DNA断裂损伤更为显著。高剂量的
歧化生成的H2O2经过Fenton反应生成羟自由基(.OH)后引起的DNA断裂所致。在有一定量的SOD和亚铁离子条件下,.OH产生的更多,引起DNA断裂损伤更为显著。高剂量的  经过SOD歧化及由Fenton反应作用肝微粒体诱发脂质过氧化的产物也能造成DNA明显的断裂损伤。
经过SOD歧化及由Fenton反应作用肝微粒体诱发脂质过氧化的产物也能造成DNA明显的断裂损伤。, http://www.100md.com
高剂量
 作用于完整的NIH3T3细胞后MDA含量显著增加,DNA-EB结合物荧光强度明显下降,提示细胞膜受到脂质过氧化损伤,及细胞内DNA链发生损伤断裂。Fe2+加重这种作用及足量的CAT可以明显抑制这种损伤效应,说明
作用于完整的NIH3T3细胞后MDA含量显著增加,DNA-EB结合物荧光强度明显下降,提示细胞膜受到脂质过氧化损伤,及细胞内DNA链发生损伤断裂。Fe2+加重这种作用及足量的CAT可以明显抑制这种损伤效应,说明  歧化生成的H2O2经Fenton反应产生的.OH与细胞膜及胞内DNA的损伤密切相关。在CAT抑制效应中,出现MDA含量维持在正常水平,而DNA-EB结合物荧光强度显著降低,表明DNA仍有一定的断裂损伤。提示
歧化生成的H2O2经Fenton反应产生的.OH与细胞膜及胞内DNA的损伤密切相关。在CAT抑制效应中,出现MDA含量维持在正常水平,而DNA-EB结合物荧光强度显著降低,表明DNA仍有一定的断裂损伤。提示  对细胞内DNA的损伤除与反应生成.OH造成细胞膜的氧化损伤密切相关外,可能还存在着其它的作用途径,如影响细胞信号转导系统[9]。
对细胞内DNA的损伤除与反应生成.OH造成细胞膜的氧化损伤密切相关外,可能还存在着其它的作用途径,如影响细胞信号转导系统[9]。, http://www.100md.com
小剂量
 作用于NIH3T3细胞,未能观察到c-myc基因表达,但在本室以往的研究中发现,小剂量
作用于NIH3T3细胞,未能观察到c-myc基因表达,但在本室以往的研究中发现,小剂量  作用于NIH3T3细胞一定时间后,细胞可出现恶性转化[10],提示一次小剂量
作用于NIH3T3细胞一定时间后,细胞可出现恶性转化[10],提示一次小剂量  作用于细胞不足以引起c-myc基因过度表达,而反复多次的作用则可能会引起c-myc基因的过度表达,调控细胞转化。一次中剂量或高剂量
作用于细胞不足以引起c-myc基因过度表达,而反复多次的作用则可能会引起c-myc基因的过度表达,调控细胞转化。一次中剂量或高剂量  作用于NIH3T3细胞,均能在不同时间观察到c-myc基因的高表达。本室另有研究发现,该剂量
作用于NIH3T3细胞,均能在不同时间观察到c-myc基因的高表达。本室另有研究发现,该剂量  可促使NIH3T3细胞凋亡[11]。有学者认为c-myc基因起双向作用,既调控细胞增殖又调控细胞凋亡[12],故本研究中、高剂量
可促使NIH3T3细胞凋亡[11]。有学者认为c-myc基因起双向作用,既调控细胞增殖又调控细胞凋亡[12],故本研究中、高剂量  引起c-myc基因高表达可能与调控细胞凋亡有关。
引起c-myc基因高表达可能与调控细胞凋亡有关。, http://www.100md.com
国家自然科学基金(39670196)资助
余斌(中国医学科学院 中国协和医科大学 基础医学研究所生物物理室,北京 100005)
李芸(中国医学科学院 中国协和医科大学 基础医学研究所生物物理室,北京 100005)
盛齐(中国医学科学院 中国协和医科大学 基础医学研究所生物物理室,北京 100005)
廖钢陵(中国医学科学院 中国协和医科大学 基础医学研究所生物物理室,北京 100005)
吴元德(中国医学科学院 中国协和医科大学 基础医学研究所生物物理室,北京 100005)
参考文献
[1]Wang YJ,Ho YS,Lo MI,et al.Oxidative modification of DNA bases in rat liver and lung during chemical carcinogenesis and aging.Chem Biol Interact,1995,94:135-145
, http://www.100md.com
[2]刘晓麒,曹恩华.脂质过氧化引起DNA损伤研究进展.生物化学与生物物理进展,1994,12(3):218-222
[3]曹恩华,刘晓麒,朱曰荣.脂质过氧化对DNA的损伤研究.生物物理学报,1994,10(1):68-74
[4]李尹雄.核酸的分离与纯化.见:卢圣栋主编.现代分子生物学实验技术.北京:高等教育出版社,1993.95
[5]Slater TF.Overview of methods used for detecting lipid peroxidation.Methods Enzymol,1984,105:283-288
[6]鲍家驹,沈德瑜,王瑞瑜,等.一种简便且灵敏的核酸杂交新方法——地高辛配基标记探针细胞原位杂交法应用于原癌基因表达研究.中国医学科学院学报,1991,13(6):439-442
, 百拇医药
[7]Aruama OI,Halliwell B,Gajewski Z,et al.Damage to the bases in DNA induced by hydrogen peroxide and ferric ion chalates.J Biol Chem,1989,264:20509-20512
[8]Prutz WA,Butler J,Lad EJ.Interaction of capper (l)with nucleic acids .Int J Rad Biol,1990,58(2):215-234
[9]Suzuki YJ,Forman HJ,Sevanion A.Oxidants as stimulators of signal transduction.Free Rad Biol Med,1997,22:269-285
[10]房克忠,俞志宏,邱 琦,等.超氧阴离子自由基对NIH3T3细胞的转化作用.基础医学与临床,1996,16(2):49-52
[11]郭 玲,薛安娜,王淑琴,等.氧自由基诱导细胞凋亡及硒与维生素E的防护作用.营养学报,1999,21(2):163-167
[12]Evan GI,Wyllie AH,Gilbert CS,et al.Induction of apoptosis in fibroblasts by c-myc protein.Cell,1992,69:119-128, http://www.100md.com