选择性磷酸二酯酶抑制剂研究进展
王晓英 吴俊芳 张均田
摘 要 磷酸二酯酶(PDEs)迄今已报道有9个基因家族,每个家族又包括多个亚家族。PDEs分布于多个组织中,其抑制剂具有广泛的生理作用。其中,PDE 4抑制剂被认为是作用于细胞内靶点的新型免疫调节、抗炎药物。新型PDE 5抑制剂sildenafil通过NO/cGMP通路舒张海绵体血管及平滑肌,应用于阳痿治疗取得了较好的临床效果。该文简要综述选择性PDEs抑制剂近年研究进展。
关键词:磷酸二酯酶抑制剂 同工酶 抗炎 抗阳痿
cAMP和cGMP是细胞内第二信使,对于细胞活动起着重要的调节作用。而其浓度的调节主要由核苷酸环化酶的合成和磷酸二酯酶(PDEs)水解作用之间的平衡决定。PDEs在人体内分布广泛,生理作用涉及多个研究领域。近年来,PDEs作为新的治疗靶点[1],引起了众多学者广泛的关注,成为一个新的研究热点,选择性PDE 4和PDE 5抑制剂的临床研究受到格外的重视。下面就近年来关于PDEs抑制剂的相关研究进展作一综述。
, 百拇医药
1 PDEs同工酶家族概述
1.1 家族成员及特点 PDEs大家族中,据其对底物作用的特异选择性、抑制剂的敏感性和钙/钙调素的依赖性及不同的氨基酸序列分为7种PDEs基因家族[2]。家族1:钙/钙调素激活,水解cAMP、cGMP;家族2:由cGMP刺激,以cGMP、cAMP为作用底物;家族3:被cGMP抑制;家族4:为cAMP特异性的;家族5:在酶非催化部位结合cGMP,并特异水解cGMP;家族6:视网膜特有PDE,水解cGMP;家族7:为一种Km很低的cAMP特异性PDE。
近年,Fisher DA等[3]报道了PDE 8A这种PDE家族新成员。它与PDE 4结构最接近,在催化结构域有38.5%氨基酸同源序列。但它不属于任何已报道的7个成员。PDE 8A mRNA约4.5 kb,在许多组织得以表达,其中,在卵巢,结肠,小肠和睾丸中表达最高。PDE 8A为一种高亲和力的cAMP特异性PDE,它对不同的PDE抑制剂如:rolipram,zapinast,vinpocetine,SKF-94120和IBMX不敏感,但能被dipyridimole抑制,IC50=9 mmol.L-1。随后,Scott H等[2]报道了PDE家族第9个成员——PDE 9A1,为cGMP高特异性的,它在肾中呈现出高mRNA表达,而在肝、肺、脑中表达较低,经Northen杂交分析,mRNA约2.0 kb,当在COS-7细胞中表达时,PDE 9A1活性没有被非选择性抑制剂IBMX抑制,也没有被新的选择性PDE 5抑制剂sildenafil抑制。但它被PDE 1/5抑制剂SCH 51866抑制,IC50=1.55 μmol.L-1。
, 百拇医药
1.2 PDEs同工酶作用机制 cAMP和cGMP作为神经递质、激素、光和气味等物质的第二信使,广泛作用于细胞内靶器官,如:激酶、离子通道及各种PDEs。当外来信号经跨膜传递并引起一系列生理反应使核苷酸环化酶激活后(如图1所示),cAMP和cGMP产生,PDEs家族的使命便是使之水解失活为5单磷酸核苷(5monophosphate nucleoside, 5AMP)。核苷酸环化酶的合成和PDEs水解失活之间的平衡决定了第二信使cAMP和cGMP的浓度。值得注意的是[4],cGMP不但被PDEs水解,而且能调节一些PDEs活性,如PDE 2可被cGMP刺激,而PDE 3可被cGMP抑制,PDE 4对cGMP不敏感。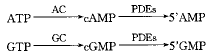
Fig 1 Action mechanism of PDE isoenzymes
, 百拇医药
2 选择性磷酸二酯酶分布、特点及其抑制剂作用机制
2.1 PDE 4分布、特点及其抑制剂相关作用机制 PDE 4主要分布于各种炎性细胞内,包括肥大细胞、巨噬细胞(MΦ)、噬酸粒细胞(EOS)、淋巴细胞和上皮细胞等。PDE 4的组织分布说明它与中枢神经系统和免疫系统息息相关,其抑制剂被认为是作用于细胞内作用靶点的新的抗炎药和中枢神经系统药物[5]。研究表明,选择性PDE 4抑制剂可作用于中性粒细胞、巨噬细胞、噬碱粒细胞、单核细胞和噬酸粒细胞[6]。
PDE 4共分为4种亚型,即PDE 4A、4B、4C、4D,各种亚型又有新的分支,如4D、4B各有3种次亚型[7]。各亚型的开发将有可能更有针对性增加疗效,减少不良反应。较早研究的选择性PDE 4抑制剂主要有zaprinst,rolipram,Ro20-1724等。其中,rolipram和ro20-174具有抑制呼吸道肥大细胞及噬碱粒细胞释放组胺和白三烯及噬酸粒细胞产生的超氧化物歧化酶(SOD),还可抑制中性粒细胞释放的溶菌酶、PAF、LTB4。PDE 4抑制剂中,rolipram的抑制作用最大,它主要作用在淋巴细胞,对单核细胞抑制作用最小。晚近有CP-0633,SB 207499(Ariflo)等,其中CDP 840正在进行临床试验。
, http://www.100md.com
PDE 4抑制剂的抗炎作用机制主要涉及[5,8,9]:①抑制多种炎症介质/细胞因子的释放,能够抑制TH 2细胞IL-4、 IL-5基因的表达。②抑制白细胞的激活(呼吸爆发),抑制白细胞游走。③抑制细胞粘附因子(CAM)的表达或上调。④诱导产生具有抑制活性的细胞因子,如IL-6。⑤诱导细胞凋亡。⑥刺激内源性激素和儿茶酚胺类物质的释放。
总之,经研究证实,PDE 4抑制剂具有明显抗炎、抗过敏、抗血小板活化作用。甚至有人认为PDE 4抑制剂的抗炎作用仅次于肾上腺皮质激素。
2.2 PDE 5的分布、特点及其抑制剂相关作用机制 PDE 5主要分布在海绵体组织及血小板中,以cGMP为特异性底物[10],PDE 5抑制剂sildenafil近年来成为研究的热点,1998年3月,美国FDA批准其口服应用于阳痿的治疗,取得了较好的临床效果[11,12]。
, 百拇医药
2.2.1 结构特征及理化性质 sildenafil为新型甲基哌嗪衍生物,其化学结构见图2,化学名为1-〔4-乙氧基-3-(6,7-二氢-1-甲基-7-氧代-3-丙基-1氢-吡唑啉酮 〔4,3-d〕嘧啶-5)-苯磺酰基〕 4-甲基哌嗪枸橼酸盐,其水溶解度为3.5 g.L-1,相对分子量为666.7。白色结晶,成品为蓝色片剂,规格为25、50、100 mg 。其中除活性成分外,尚有微晶纤维素、磷酸盐、硬脂酸盐、乳糖、甘油三脂等。
2.2.2 sildenafil作用机制 关于阴茎勃起的机制很复杂,目前尚无统一认识。现在多数研究者已将注意力从血流动力学转向神经介质。已证实有三种神经机制共同参与海绵体平滑肌和螺旋动脉张力调控。即肾上腺素能、胆碱能、和非肾上腺素能非胆碱能(NANC)。现在认为NANC机制是海绵体血管、平滑肌舒张的主要机制,而NO为NANC的神经介质[13]。在整个勃起生理过程中,阴茎血管及海绵体平滑肌舒张是关键因素。sildenafil通过NO/cGMP通路而发挥作用[14](见图3)。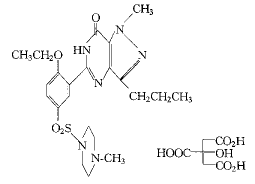
, 百拇医药
Fig 2 Chemical structure of sildenafil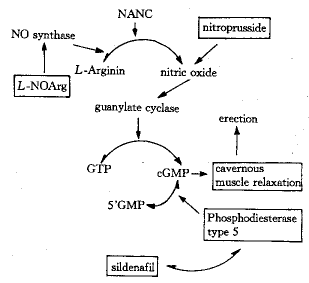
Fig 3 Action mechanism of sildenafil
在盆腔神经NANC神经系统刺激下,NO合酶(NOS)作用于L-精氨酸的胍基氮末端产生NO,由于其亲脂性,可透过细胞膜在邻近细胞间迅速扩散,并作用于细胞中的鸟苷酸环化酶(GC),与其亚铁血红素分子中的铁离子结合,形成NO-GC复合物。这种复合物与该酶的卟啉部位相结合,导致构型的改变而激活GC,使细胞中cGMP大量产生,cGMP作为细胞内第二信使,可产生一系列生理反应,使海绵体平滑肌及血管舒张。cGMP传递信息的同时被PDE 5水解转化为5GMP而失活。sildenafil选择性抑制PDE 5对cGMP水解,从而使cGMP积聚性浓度提高,大大增强了其血管舒张效果[15]。
, 百拇医药
在动物离体器官试验中[15], 用新西兰大白兔取其海绵体组织,用不同浓度的sildenafil在NO供体硝普钠存在下,孵育不同时间,检测cGMP浓度,结果cGMP浓度呈时间依赖性增加, 且对sildenafil呈剂量依赖性。当硝普钠达最大浓度时,可使cGMP浓度增加28倍。
阴茎组织中的NO有血窦内皮细胞系和NANC神经纤维两种来源[16]。在离体器官水浴试验中[17],将兔海绵体条用苯丙肾上腺素(PE)收缩以后,用类似神经冲动的电刺激方法,在1~16 Hz 进行舒张试验,结果单纯用sildenafil对PE的收缩基本无作用,而用sildenafil合并电刺激,可大大提高其舒张百分率。说明sildenafil通过类似神经冲动的电刺激而使海绵体组织NO释放,进而通过NO/cGMP通路发挥其舒张作用。同样用乙酰甲基胆碱(MCH)对PE收缩后的海绵体进行舒张,结果sildenafil可大大提高MCH的舒张幅度。说明sildenafil通过内皮依赖性海绵体组织NO释放,继之利用NO/cGMP通路达到舒张效果。
, 百拇医药
3 展望
PDEs同工酶分布在不同组织中,具有不同的生理功能。同时[18],不只每个PDE家族有特异性底物和调节特点,而且每个家族各成员间也有组织、细胞、亚细胞特异性表达的不同,参与不同的信号传导通路。选择性PDEs抑制剂可特异性作用于不同的同工酶而发挥不同的作用。所以PDEs成为药物开发很有吸引力的作用靶点。在心血管、生殖、抗炎、免疫等诸多领域均涉及到PDE同工酶家族。而且随着分子生物学、生物化学、药理学的研究发展,PDE同工酶被细分为若干亚家族及次亚家族,所以药物可高特异性作用于某靶点,而大大减少毒副作用。对于选择性PDEs抑制剂的研究,目前大多尚处于基础试验阶段,临床试验刚刚起步。而且,新的家族成员不断被发现,家族成员之间的差异也逐步达到能够精细的定位。这预示药理工作者在此领域将拥有一个艰辛而又前景无限的未来。
者简介:王晓英,女,29岁,博士研究生;
, http://www.100md.com 张均田,男,68岁,教授,博士生导师,中国药理学会理事长
王晓英(中国医学科学院.中国协和医科大学药物研究所,北京 100050)
吴俊芳(中国医学科学院.中国协和医科大学药物研究所,北京 100050)
张均田(中国医学科学院.中国协和医科大学药物研究所,北京 100050)
参考文献
1.Palacios JM, Beleta J, Segarra V. Second messenger systems as targets for new therpeutic agents: focus on selective phosphodiesterase inhibitor. Farmaco, 1995; 150: 819~27
, http://www.100md.com
2.Scott H, Sharon J, Joseph A. A novel family of cyclic nucleotide phosphodiesterase. The Journal of Biology Chemistry, 1998;273:15553~8
3.Fisher DA, Smith JF, Pillar JS. Isolation and characterization of PDE8A, a novel human cGMP-specific phosphodiesterase. Biochem Biophys Res Commun, 1998; 246:570~7
4.Eckly AE, Lugnier C. Role of phosphodiesterase Ⅲ and Ⅳ in the modulation of vascular cyclic AMP content by the NO/cyclic GMP pathway. Br J Pharmacol, 1994;113:445~50
, 百拇医药
5.Teixeira MM, Gristwood RW, Cooper N. Phosphodiesterase (PDE) inhibitors:anti-inflammatory drugs of the future? TiPS, 1997;18:164~70
6.Wright KF, Turner CR, Beck JR et al. Differential in vivo and in vitro bronchorelaxant activities of CP-80,633, a selective phosphodiesterase 4 inhibitor. Can J Physiol Pharmacol, 1997;75:1001~8
7.Kostic MM.Altered expression of PDE 1 and PDE 4 cyclic nucleotide phospho-diesterase isoforms in 7-oxo-prostacyclin-preconditioned rat heart. J Mol Cell Cardiol, 1997;29:3135~46
, http://www.100md.com
8.Barnette MS, Bartus JO. Association of the anti-inflammatory activity of phospho-diesterase 4(PDE 4)inhibitors with either inhibitor of PDE 4 catalytic activity or competition for [3H]rolipram binding. Biochem Pharmacol, 1996;51:949~56
9.Barnette MS, Christensen SB. SB 207499(Ariflo), a potent and selsctive second gen-eration phosphodiesterase 4 inhibitor in vitro anti-inflammatory actions. J Pharmacol Exp Ther, 1998;284:420~6
, 百拇医药
10.Taher AM, Meyer CG, Stief UJ,Forssmann WG. Cyclic nucleotide phosphodiesterase in human caverous smooth muscle. World J Urol , 1997; 15:32~5
11.Weidmann P. New principle in therapy of erectile dysfunction: sildenafil. Ther Umsch , 1996;55:384~8
12.Morales A, Gingell C, Collins M. Clinical safety of oral sildenafil citrate (VIAGRA) in the treatment of erectile dysfunction. Int J Impot Res, 1998;10:69~73, discussion 73~4
, 百拇医药
13.Alex T, John D, Richard A. Sildenafil, a type-5 cGMP phosphodiesterase inhibitor, specifically amplifies endogenous cGMP-dependent relaxation in rabbit corpus cavernosum mooth muscle in vitro. J Urol, 1998;160:257~61
14.Anthony J, Stephen A, Alasdair M. Effect of the selective phosphodiesterese type 5 inhibitor-sildenafil on erectile function in the anesthetized dog. J Urol, 1998; 160:242~6
15.Jeremy JY. Effect of sildenafil, a type-5 cGMP phosphodiesterase hibitior and pap-erverine on cyclic GMP and cyclic AMP in the rabbit corpus cavernosum in vitro.Br J Urol,1997; 179:958~63
, 百拇医药
16 Burnett A. Nitric oxide in the penis:physiology and pathology. J Urol, 1998;157: 320~4
17.Stephen AB, Clive JG, Tang GK. Effect of sildenafil on the relaxation of human corpus cavernosum tssue in vitro and on the activities of cyclic nucleotide phosphodiesterase isozymes. J Urol, 1998;159:2164~71
18.Christian G, Stefan U, Armin J. The effect of the specific phosphodiesterase (PDE) inhibitor on human and rabbit cavernous tissue in vitro and in vivo. J Urol, 1998; 159:1390~3, 百拇医药
摘 要 磷酸二酯酶(PDEs)迄今已报道有9个基因家族,每个家族又包括多个亚家族。PDEs分布于多个组织中,其抑制剂具有广泛的生理作用。其中,PDE 4抑制剂被认为是作用于细胞内靶点的新型免疫调节、抗炎药物。新型PDE 5抑制剂sildenafil通过NO/cGMP通路舒张海绵体血管及平滑肌,应用于阳痿治疗取得了较好的临床效果。该文简要综述选择性PDEs抑制剂近年研究进展。
关键词:磷酸二酯酶抑制剂 同工酶 抗炎 抗阳痿
cAMP和cGMP是细胞内第二信使,对于细胞活动起着重要的调节作用。而其浓度的调节主要由核苷酸环化酶的合成和磷酸二酯酶(PDEs)水解作用之间的平衡决定。PDEs在人体内分布广泛,生理作用涉及多个研究领域。近年来,PDEs作为新的治疗靶点[1],引起了众多学者广泛的关注,成为一个新的研究热点,选择性PDE 4和PDE 5抑制剂的临床研究受到格外的重视。下面就近年来关于PDEs抑制剂的相关研究进展作一综述。
, 百拇医药
1 PDEs同工酶家族概述
1.1 家族成员及特点 PDEs大家族中,据其对底物作用的特异选择性、抑制剂的敏感性和钙/钙调素的依赖性及不同的氨基酸序列分为7种PDEs基因家族[2]。家族1:钙/钙调素激活,水解cAMP、cGMP;家族2:由cGMP刺激,以cGMP、cAMP为作用底物;家族3:被cGMP抑制;家族4:为cAMP特异性的;家族5:在酶非催化部位结合cGMP,并特异水解cGMP;家族6:视网膜特有PDE,水解cGMP;家族7:为一种Km很低的cAMP特异性PDE。
近年,Fisher DA等[3]报道了PDE 8A这种PDE家族新成员。它与PDE 4结构最接近,在催化结构域有38.5%氨基酸同源序列。但它不属于任何已报道的7个成员。PDE 8A mRNA约4.5 kb,在许多组织得以表达,其中,在卵巢,结肠,小肠和睾丸中表达最高。PDE 8A为一种高亲和力的cAMP特异性PDE,它对不同的PDE抑制剂如:rolipram,zapinast,vinpocetine,SKF-94120和IBMX不敏感,但能被dipyridimole抑制,IC50=9 mmol.L-1。随后,Scott H等[2]报道了PDE家族第9个成员——PDE 9A1,为cGMP高特异性的,它在肾中呈现出高mRNA表达,而在肝、肺、脑中表达较低,经Northen杂交分析,mRNA约2.0 kb,当在COS-7细胞中表达时,PDE 9A1活性没有被非选择性抑制剂IBMX抑制,也没有被新的选择性PDE 5抑制剂sildenafil抑制。但它被PDE 1/5抑制剂SCH 51866抑制,IC50=1.55 μmol.L-1。
, 百拇医药
1.2 PDEs同工酶作用机制 cAMP和cGMP作为神经递质、激素、光和气味等物质的第二信使,广泛作用于细胞内靶器官,如:激酶、离子通道及各种PDEs。当外来信号经跨膜传递并引起一系列生理反应使核苷酸环化酶激活后(如图1所示),cAMP和cGMP产生,PDEs家族的使命便是使之水解失活为5单磷酸核苷(5monophosphate nucleoside, 5AMP)。核苷酸环化酶的合成和PDEs水解失活之间的平衡决定了第二信使cAMP和cGMP的浓度。值得注意的是[4],cGMP不但被PDEs水解,而且能调节一些PDEs活性,如PDE 2可被cGMP刺激,而PDE 3可被cGMP抑制,PDE 4对cGMP不敏感。
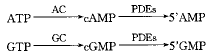
Fig 1 Action mechanism of PDE isoenzymes
, 百拇医药
2 选择性磷酸二酯酶分布、特点及其抑制剂作用机制
2.1 PDE 4分布、特点及其抑制剂相关作用机制 PDE 4主要分布于各种炎性细胞内,包括肥大细胞、巨噬细胞(MΦ)、噬酸粒细胞(EOS)、淋巴细胞和上皮细胞等。PDE 4的组织分布说明它与中枢神经系统和免疫系统息息相关,其抑制剂被认为是作用于细胞内作用靶点的新的抗炎药和中枢神经系统药物[5]。研究表明,选择性PDE 4抑制剂可作用于中性粒细胞、巨噬细胞、噬碱粒细胞、单核细胞和噬酸粒细胞[6]。
PDE 4共分为4种亚型,即PDE 4A、4B、4C、4D,各种亚型又有新的分支,如4D、4B各有3种次亚型[7]。各亚型的开发将有可能更有针对性增加疗效,减少不良反应。较早研究的选择性PDE 4抑制剂主要有zaprinst,rolipram,Ro20-1724等。其中,rolipram和ro20-174具有抑制呼吸道肥大细胞及噬碱粒细胞释放组胺和白三烯及噬酸粒细胞产生的超氧化物歧化酶(SOD),还可抑制中性粒细胞释放的溶菌酶、PAF、LTB4。PDE 4抑制剂中,rolipram的抑制作用最大,它主要作用在淋巴细胞,对单核细胞抑制作用最小。晚近有CP-0633,SB 207499(Ariflo)等,其中CDP 840正在进行临床试验。
, http://www.100md.com
PDE 4抑制剂的抗炎作用机制主要涉及[5,8,9]:①抑制多种炎症介质/细胞因子的释放,能够抑制TH 2细胞IL-4、 IL-5基因的表达。②抑制白细胞的激活(呼吸爆发),抑制白细胞游走。③抑制细胞粘附因子(CAM)的表达或上调。④诱导产生具有抑制活性的细胞因子,如IL-6。⑤诱导细胞凋亡。⑥刺激内源性激素和儿茶酚胺类物质的释放。
总之,经研究证实,PDE 4抑制剂具有明显抗炎、抗过敏、抗血小板活化作用。甚至有人认为PDE 4抑制剂的抗炎作用仅次于肾上腺皮质激素。
2.2 PDE 5的分布、特点及其抑制剂相关作用机制 PDE 5主要分布在海绵体组织及血小板中,以cGMP为特异性底物[10],PDE 5抑制剂sildenafil近年来成为研究的热点,1998年3月,美国FDA批准其口服应用于阳痿的治疗,取得了较好的临床效果[11,12]。
, 百拇医药
2.2.1 结构特征及理化性质 sildenafil为新型甲基哌嗪衍生物,其化学结构见图2,化学名为1-〔4-乙氧基-3-(6,7-二氢-1-甲基-7-氧代-3-丙基-1氢-吡唑啉酮 〔4,3-d〕嘧啶-5)-苯磺酰基〕 4-甲基哌嗪枸橼酸盐,其水溶解度为3.5 g.L-1,相对分子量为666.7。白色结晶,成品为蓝色片剂,规格为25、50、100 mg 。其中除活性成分外,尚有微晶纤维素、磷酸盐、硬脂酸盐、乳糖、甘油三脂等。
2.2.2 sildenafil作用机制 关于阴茎勃起的机制很复杂,目前尚无统一认识。现在多数研究者已将注意力从血流动力学转向神经介质。已证实有三种神经机制共同参与海绵体平滑肌和螺旋动脉张力调控。即肾上腺素能、胆碱能、和非肾上腺素能非胆碱能(NANC)。现在认为NANC机制是海绵体血管、平滑肌舒张的主要机制,而NO为NANC的神经介质[13]。在整个勃起生理过程中,阴茎血管及海绵体平滑肌舒张是关键因素。sildenafil通过NO/cGMP通路而发挥作用[14](见图3)。

, 百拇医药
Fig 2 Chemical structure of sildenafil

Fig 3 Action mechanism of sildenafil
在盆腔神经NANC神经系统刺激下,NO合酶(NOS)作用于L-精氨酸的胍基氮末端产生NO,由于其亲脂性,可透过细胞膜在邻近细胞间迅速扩散,并作用于细胞中的鸟苷酸环化酶(GC),与其亚铁血红素分子中的铁离子结合,形成NO-GC复合物。这种复合物与该酶的卟啉部位相结合,导致构型的改变而激活GC,使细胞中cGMP大量产生,cGMP作为细胞内第二信使,可产生一系列生理反应,使海绵体平滑肌及血管舒张。cGMP传递信息的同时被PDE 5水解转化为5GMP而失活。sildenafil选择性抑制PDE 5对cGMP水解,从而使cGMP积聚性浓度提高,大大增强了其血管舒张效果[15]。
, 百拇医药
在动物离体器官试验中[15], 用新西兰大白兔取其海绵体组织,用不同浓度的sildenafil在NO供体硝普钠存在下,孵育不同时间,检测cGMP浓度,结果cGMP浓度呈时间依赖性增加, 且对sildenafil呈剂量依赖性。当硝普钠达最大浓度时,可使cGMP浓度增加28倍。
阴茎组织中的NO有血窦内皮细胞系和NANC神经纤维两种来源[16]。在离体器官水浴试验中[17],将兔海绵体条用苯丙肾上腺素(PE)收缩以后,用类似神经冲动的电刺激方法,在1~16 Hz 进行舒张试验,结果单纯用sildenafil对PE的收缩基本无作用,而用sildenafil合并电刺激,可大大提高其舒张百分率。说明sildenafil通过类似神经冲动的电刺激而使海绵体组织NO释放,进而通过NO/cGMP通路发挥其舒张作用。同样用乙酰甲基胆碱(MCH)对PE收缩后的海绵体进行舒张,结果sildenafil可大大提高MCH的舒张幅度。说明sildenafil通过内皮依赖性海绵体组织NO释放,继之利用NO/cGMP通路达到舒张效果。
, 百拇医药
3 展望
PDEs同工酶分布在不同组织中,具有不同的生理功能。同时[18],不只每个PDE家族有特异性底物和调节特点,而且每个家族各成员间也有组织、细胞、亚细胞特异性表达的不同,参与不同的信号传导通路。选择性PDEs抑制剂可特异性作用于不同的同工酶而发挥不同的作用。所以PDEs成为药物开发很有吸引力的作用靶点。在心血管、生殖、抗炎、免疫等诸多领域均涉及到PDE同工酶家族。而且随着分子生物学、生物化学、药理学的研究发展,PDE同工酶被细分为若干亚家族及次亚家族,所以药物可高特异性作用于某靶点,而大大减少毒副作用。对于选择性PDEs抑制剂的研究,目前大多尚处于基础试验阶段,临床试验刚刚起步。而且,新的家族成员不断被发现,家族成员之间的差异也逐步达到能够精细的定位。这预示药理工作者在此领域将拥有一个艰辛而又前景无限的未来。
者简介:王晓英,女,29岁,博士研究生;
, http://www.100md.com 张均田,男,68岁,教授,博士生导师,中国药理学会理事长
王晓英(中国医学科学院.中国协和医科大学药物研究所,北京 100050)
吴俊芳(中国医学科学院.中国协和医科大学药物研究所,北京 100050)
张均田(中国医学科学院.中国协和医科大学药物研究所,北京 100050)
参考文献
1.Palacios JM, Beleta J, Segarra V. Second messenger systems as targets for new therpeutic agents: focus on selective phosphodiesterase inhibitor. Farmaco, 1995; 150: 819~27
, http://www.100md.com
2.Scott H, Sharon J, Joseph A. A novel family of cyclic nucleotide phosphodiesterase. The Journal of Biology Chemistry, 1998;273:15553~8
3.Fisher DA, Smith JF, Pillar JS. Isolation and characterization of PDE8A, a novel human cGMP-specific phosphodiesterase. Biochem Biophys Res Commun, 1998; 246:570~7
4.Eckly AE, Lugnier C. Role of phosphodiesterase Ⅲ and Ⅳ in the modulation of vascular cyclic AMP content by the NO/cyclic GMP pathway. Br J Pharmacol, 1994;113:445~50
, 百拇医药
5.Teixeira MM, Gristwood RW, Cooper N. Phosphodiesterase (PDE) inhibitors:anti-inflammatory drugs of the future? TiPS, 1997;18:164~70
6.Wright KF, Turner CR, Beck JR et al. Differential in vivo and in vitro bronchorelaxant activities of CP-80,633, a selective phosphodiesterase 4 inhibitor. Can J Physiol Pharmacol, 1997;75:1001~8
7.Kostic MM.Altered expression of PDE 1 and PDE 4 cyclic nucleotide phospho-diesterase isoforms in 7-oxo-prostacyclin-preconditioned rat heart. J Mol Cell Cardiol, 1997;29:3135~46
, http://www.100md.com
8.Barnette MS, Bartus JO. Association of the anti-inflammatory activity of phospho-diesterase 4(PDE 4)inhibitors with either inhibitor of PDE 4 catalytic activity or competition for [3H]rolipram binding. Biochem Pharmacol, 1996;51:949~56
9.Barnette MS, Christensen SB. SB 207499(Ariflo), a potent and selsctive second gen-eration phosphodiesterase 4 inhibitor in vitro anti-inflammatory actions. J Pharmacol Exp Ther, 1998;284:420~6
, 百拇医药
10.Taher AM, Meyer CG, Stief UJ,Forssmann WG. Cyclic nucleotide phosphodiesterase in human caverous smooth muscle. World J Urol , 1997; 15:32~5
11.Weidmann P. New principle in therapy of erectile dysfunction: sildenafil. Ther Umsch , 1996;55:384~8
12.Morales A, Gingell C, Collins M. Clinical safety of oral sildenafil citrate (VIAGRA) in the treatment of erectile dysfunction. Int J Impot Res, 1998;10:69~73, discussion 73~4
, 百拇医药
13.Alex T, John D, Richard A. Sildenafil, a type-5 cGMP phosphodiesterase inhibitor, specifically amplifies endogenous cGMP-dependent relaxation in rabbit corpus cavernosum mooth muscle in vitro. J Urol, 1998;160:257~61
14.Anthony J, Stephen A, Alasdair M. Effect of the selective phosphodiesterese type 5 inhibitor-sildenafil on erectile function in the anesthetized dog. J Urol, 1998; 160:242~6
15.Jeremy JY. Effect of sildenafil, a type-5 cGMP phosphodiesterase hibitior and pap-erverine on cyclic GMP and cyclic AMP in the rabbit corpus cavernosum in vitro.Br J Urol,1997; 179:958~63
, 百拇医药
16 Burnett A. Nitric oxide in the penis:physiology and pathology. J Urol, 1998;157: 320~4
17.Stephen AB, Clive JG, Tang GK. Effect of sildenafil on the relaxation of human corpus cavernosum tssue in vitro and on the activities of cyclic nucleotide phosphodiesterase isozymes. J Urol, 1998;159:2164~71
18.Christian G, Stefan U, Armin J. The effect of the specific phosphodiesterase (PDE) inhibitor on human and rabbit cavernous tissue in vitro and in vivo. J Urol, 1998; 159:1390~3, 百拇医药