叶绿素光敏剂诱导大鼠脑梗死模型
叶绿素光敏剂诱导大鼠脑梗死模型
徐莉 李玲 陈景藻 施新猷 郭振援 王斌 袁华 易南
摘 要: 目的 观察光敏剂叶绿素光化学诱导的大鼠脑梗死模型. 方法 大鼠60只随机分为8组:单纯光照组,单纯光敏剂组及6组不同光敏剂浓度(10, 20, 30, 40, 50和60 mg.kg-1)的光化学诱导组,不同的光敏剂浓度光化学诱导组给予静脉注射叶绿素衍生物四号(chlorophyll derivative IV, CPD4) 10 min后,He-Ne激光照射左侧大脑上下肢感觉、运动区,24 h后观察其神经行为学、梗死面积及组织病理学改变,以评估模型的可行性. 结果 CPD4 40, 50 mg.kg-1经He-Ne激光照射,可诱导大鼠脑梗死,且面积恒定,神经行为学评分及病理形态学改变明显. 结论 CPD4诱导的大鼠脑梗死模型稳定性,重复性好,梗死成功率高.
, http://www.100md.com
关键词:叶绿素衍生物;大鼠;光化学法;激光;脑梗死
0 引言
在实验中,理想的动物模型是研究的关键,我们采用叶绿素衍生物四号作光敏剂,氦氖(He-Ne)激光作光源,制做光化学诱导的脑梗死模型,并计算梗死面积,进行神经功能评估及病理学方面的观察.
1 材料和方法
1.1 材料 CPD4粉剂由杭州民生药厂提供,批号930502于0~4℃避光保存,使用前用生理盐水稀释至所需浓度. 雄性SD大鼠,由本校实验动物中心提供,体质量(240±50) g,鼠龄12 wk左右,二级动物. 采用西安激光仪器厂生产的795B型氦氖激光双管治疗机,输出波长632.8 nm(可见红光),采用原光束双管照射,输出功率8 mW.
, 百拇医药
1.2 方法
1.2.1 动物分组 单纯光照组6只;单纯光敏剂组6只;光敏剂浓度为50 mg.kg-1;实验组按光敏剂的浓度分组:10 mg.kg-1组6只;20 mg.kg-1组6只;30 mg.kg-1组6只;40 mg.kg-1组10只;50 mg.kg-1组10只;60 mg.kg-1组10只.
1.2.2 模型制作方法 大鼠10 g.L-1戊巴比妥钠ip麻醉,尾iv CPD4后10 min内,将鼠俯卧位于脑立体固定仪上,沿头颅正中线偏右切开头皮暴露颅骨前沿部位,在前囟门后1.8 mm,正中线旁开约2 mm,即脑上下肢皮层感觉运动区,用黑色避光纸(中央有一8 mm×5 mm的小孔)遮避周围组织,He-Ne激光照射20 min,术后缝合头皮,避光24 h.
, http://www.100md.com
1.2.3 神经症状评定 造模后24 h,按Bederson等[1]人制定的标准评分,共分4级. 0级:未见行为缺陷;1级:前肢屈曲(既提尾悬空试验阳性);2级:侧推抵抗力下降(即侧向推力试验阳性),伴前肢屈曲,无转圈行为;3级:同2级行为,伴自发性悬转.
1.2.4 观察、取材及处理 实验后24 h进行Bederson神经功能评估,然后灌注取材,100 mL.L-1福尔马林液固定,在视交叉前后每间隔2 mm做6个脑冠状切片,进行计算机扫描,利用灰度对比,Photoshop软件图像处理计算梗死面积,然后石蜡包埋切片,HE染色,光镜下观察组织学变化.
统计学处理: 所有数据以X±s表示,组间比较采用两样本t检验.
2 结果
2.1 神经行为学改变 造模后24 h进行神经行为学评分,40, 50和60 mg.kg-1光化学诱导组的大鼠造模后24 h内有呃逆,呕吐等颅内高压征象,尤以60 mg.kg-1组的大鼠呕吐分泌物多,呼吸道易堵塞,神志极差,多在脑梗死后6~8 h内死亡. 脑梗死面积的测量 造模后24 h取材,经扫描仪扫描,计算机图像处理,结果表明,单纯光照组,单纯光敏剂,10 mg.kg-1组无明显梗死灶,20及30 mg.kg-1组仅有皮层表浅的梗死灶,40及50 mg.kg-1组有明显的梗死灶. 药物浓度与神经学评分及梗死面积关系如Fig 1, 2所示.
, 百拇医药
2.2 脑组织病理学改变 HE染色,光镜下单纯光照组,单光敏剂组无明显改变. 10 mg.kg-1组有个别神经元细胞固缩,其他大部分正常, 20, 30 mg.kg-1组可见小的缺血病灶区有神经元固缩,胞质红染,其余正常(Fig 1, 2). 40 mg.kg-1组局部脑组织有梗死灶,神经细胞固缩胞质红染,周围胶质癍痕形成,海马区有退变. 50 mg.kg-1组可见明显的梗死灶,灶区细胞变性坏死,神经元细胞肿胀或固缩,有的溶解消失,梗死区有小灶的中性粒细胞浸润(Fig 3, 4).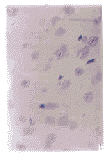
图1 单光照组细胞形态
, 百拇医药
Fig 1 Cell morphology in light group HE ×400
图2 单光敏组细胞形态
Fig 2 Cell morphology in group treated with photoseneitizing only HE ×400
图3 50 mg.kg-1组细胞形态
, 百拇医药 Fig 3 Cell morphology in 50 mg.kg-1 group HE ×200
图4 50 mg.kg-1组细胞形态
Fig 4 Cell morphology in 50 mg.kg-1 group HE ×400
3 讨论
国内外有不少造模方法有创伤大,需开颅,易感染,难以控制梗死面积等缺点; 光化学法诱导的脑梗死动物模型是1985年由Watson等[2]首先报道,其原理是注入动物体内的光敏染料,在特定波长的光源照射下,产生并释放单态氧,使血管内皮细胞膜不饱和脂肪酸发生脂质过氧化反应,膜通透性增加,导致血管内皮损害,诱发血小板聚集,光照区血管内血栓形成,局部脑组织发生不可逆缺血性损伤[3], 这可能与兼有缺血和血栓形成双重病理损害有关[4], 鼠梗死形成与人类动脉血栓形成梗死的发病过程相似[5].
, 百拇医药
CPD4造影剂是从中药蚕纱中提取的一种新型光敏剂,由主要成分叶绿三酸的钠盐及其余部分胡萝卜素为主的黄色素组成,与血卟啉类光敏剂相比,CPD4具有体内排泄快,光毒反应小等优点,用药后避光仅需1 d,CPD4特征吸收峰就位于红光区,作用波长长,穿透深,因而较其他造影剂具有明显的优越性[6]. 以往研究显示[7],CPD4损伤的靶部位是内皮细胞(EC),首先产生单态氧或氧自由基对EC造成直接光毒损伤,随后血管内皮损伤导致的凝血因子释放,血管收缩,血栓形成使缺氧加重,血液停止,从而加速了血管组织的损伤. 实验结果显示,在照射时间相同的情况下,大鼠脑梗死与CPD4浓度相关. 其中CPD4 40, 50 mg.kg-1在照射后24 h梗死灶对侧肢体出现运动障碍,表明鼠感觉运动皮质区受损,光镜下感觉运动皮质区有不可逆的缺血性病理改变,梗死面积大;相比之下,单纯光照组,单纯光敏剂组未见行为学及病理学改变,光敏剂浓度10, 20和30 mg.kg-1的光化学诱导组,神经行为学及组织病理学改变较轻.
, 百拇医药
根据神经功能评分可反映缺血性损伤的程度,而且与皮质缺血性坏死神经元的数目密切相关[8,9],我们采用Bederson神经功能评分反映大鼠脑皮质梗死前后神经行为方面的改变,发现不同浓度的CPD4经过光诱导形成一侧大脑皮质梗死后,出现不同程度的神经功能缺损,而且随着浓度的增加,神经功能评分增加,其梗死面积,缺血程度也相应加重;证实了不同的药物浓度与神经学评分及梗死面积成正相关(Fig 5,6),光镜检查也说明了浓度越高,损伤程度越重,梗死灶区细胞明显变性,坏死,神经元细胞肿胀,萎缩,有的溶解消失,严重还可深入皮质下区域,如纹状体、海马、丘脑等其他底节区.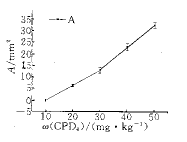
图5 不同的CPD4质量分数与梗死面积的关系
, 百拇医药 Fig 5 Relationship between mass fraction of CPD4 and the infarction size
总之,叶绿素诱导的脑梗死模型稳定性,重复性好,梗死成功率高,操作简单,可在指定的皮质区发生梗死,而不局限于大脑中动脉供血区,该方法光源成本低,单色性好,无须开颅,避免了手术对脑组织和血管的机械性损伤,对全身影响小,适宜大鼠行为障碍及功能定位研究. 由于该模型是终末动脉永久性闭塞,妨碍扩血管药物疗效的观察,不宜用于复制再灌注损伤的模型研究[10],可用于脑血管病康复领域中脑可塑性等其他研究.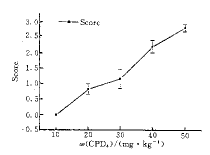
图6 不同CPD4质量分数与神经功能评分的关系
, 百拇医药
Fig 6 Relationship between mass fraction of CPD4 and the neurobehavoral evaluation
基金项目:军队留学人员回国启动基金(97卫科训字116号回国基金)
作者简介:徐 莉(1966-), 女(汉族), 陕西省紫阳县人. 主治医师, 硕士生(导师李 玲). Tel.(029)3375437(O) Email. Lilingdr@fmmu.edu.cn
徐莉(第四军医大学西京医院康复与理疗科)
李玲(第四军医大学西京医院康复与理疗科)
陈景藻(第四军医大学西京医院康复与理疗科)
, 百拇医药 施新猷(第四军医大学实验动物中心,陕西 西安 710033)
郭振援(解放军兰州军区临潼第二疗养院)
王斌(第四军医大学西京医院康复与理疗科)
袁华(第四军医大学西京医院康复与理疗科)
易南(第四军医大学西京医院康复与理疗科)
参考文献:
[1] Bederson JB, Pitts LH, Tsuji M. Rat middle cerebral artery occlusion: Evaluation of the model and development of a neurologic examination [J]. Stroke, 1986;17(3):472-476.
, 百拇医药
[2] Watson BD, Dietrich WD, Busto R et al. Induction of reproduciole brain infarction by photochemically irritated thrombosis [J]. Ann Neurol, 1985;17(3):97-504.
[3] Matsuno H, Umemura K. A simple and reproducible cerebral thrombosis model in rats induced by a photochemical reaction and the effect of plasminapen plasminafels activator chimera in this model [J]. J Pharmacol Toxicol Methods, 1993;29(30):65-73.
[4] 王 伟, 董为伟, 傅雅各et al. 光化学诱导鼠大脑中动脉闭塞及再通模型[J]. 中国神经精神疾病杂志, 1996;22(1):27-30.
, 百拇医药
[5] Furtell N. An improved photochemical model of embolic cerebral infarction in rats [J]. Stroke, 1999;22(2):225-232.
[6] 王潭时, 杨永华, 郭 勇et al. 叶绿素光敏剂诊治恶性肿瘤[J]. 浙江中医学院学报,1988;12(4):53-54.
[7] 杨耀武, 吕春莹, 吴 洋et al. 叶绿素光敏剂光动力治疗鲜红斑痔[J]. 第四军医大学学报,1997;18(6):582-585.
[8] 李红戈, 张茂悦, 童萼塘et al. 光化学诱导大鼠脑皮质梗塞模型的研究[J]. 卒中与神经疾病,1996;3(3):126-128.
[9] Garcia JH, Wagner S, Liu KF et al. Neurological deficit and extent of neuronal necrosis attributable to middle cerebral artery occlusion in rats [J]. Stroke,1995;26(4):627-632.
[10] 陈春富. 大鼠局灶性脑缺血模型研究进展[研究综述][J]. 国外医学 脑血管疾病分册, 1995;3(5):227-230., http://www.100md.com
徐莉 李玲 陈景藻 施新猷 郭振援 王斌 袁华 易南
摘 要: 目的 观察光敏剂叶绿素光化学诱导的大鼠脑梗死模型. 方法 大鼠60只随机分为8组:单纯光照组,单纯光敏剂组及6组不同光敏剂浓度(10, 20, 30, 40, 50和60 mg.kg-1)的光化学诱导组,不同的光敏剂浓度光化学诱导组给予静脉注射叶绿素衍生物四号(chlorophyll derivative IV, CPD4) 10 min后,He-Ne激光照射左侧大脑上下肢感觉、运动区,24 h后观察其神经行为学、梗死面积及组织病理学改变,以评估模型的可行性. 结果 CPD4 40, 50 mg.kg-1经He-Ne激光照射,可诱导大鼠脑梗死,且面积恒定,神经行为学评分及病理形态学改变明显. 结论 CPD4诱导的大鼠脑梗死模型稳定性,重复性好,梗死成功率高.
, http://www.100md.com
关键词:叶绿素衍生物;大鼠;光化学法;激光;脑梗死
0 引言
在实验中,理想的动物模型是研究的关键,我们采用叶绿素衍生物四号作光敏剂,氦氖(He-Ne)激光作光源,制做光化学诱导的脑梗死模型,并计算梗死面积,进行神经功能评估及病理学方面的观察.
1 材料和方法
1.1 材料 CPD4粉剂由杭州民生药厂提供,批号930502于0~4℃避光保存,使用前用生理盐水稀释至所需浓度. 雄性SD大鼠,由本校实验动物中心提供,体质量(240±50) g,鼠龄12 wk左右,二级动物. 采用西安激光仪器厂生产的795B型氦氖激光双管治疗机,输出波长632.8 nm(可见红光),采用原光束双管照射,输出功率8 mW.
, 百拇医药
1.2 方法
1.2.1 动物分组 单纯光照组6只;单纯光敏剂组6只;光敏剂浓度为50 mg.kg-1;实验组按光敏剂的浓度分组:10 mg.kg-1组6只;20 mg.kg-1组6只;30 mg.kg-1组6只;40 mg.kg-1组10只;50 mg.kg-1组10只;60 mg.kg-1组10只.
1.2.2 模型制作方法 大鼠10 g.L-1戊巴比妥钠ip麻醉,尾iv CPD4后10 min内,将鼠俯卧位于脑立体固定仪上,沿头颅正中线偏右切开头皮暴露颅骨前沿部位,在前囟门后1.8 mm,正中线旁开约2 mm,即脑上下肢皮层感觉运动区,用黑色避光纸(中央有一8 mm×5 mm的小孔)遮避周围组织,He-Ne激光照射20 min,术后缝合头皮,避光24 h.
, http://www.100md.com
1.2.3 神经症状评定 造模后24 h,按Bederson等[1]人制定的标准评分,共分4级. 0级:未见行为缺陷;1级:前肢屈曲(既提尾悬空试验阳性);2级:侧推抵抗力下降(即侧向推力试验阳性),伴前肢屈曲,无转圈行为;3级:同2级行为,伴自发性悬转.
1.2.4 观察、取材及处理 实验后24 h进行Bederson神经功能评估,然后灌注取材,100 mL.L-1福尔马林液固定,在视交叉前后每间隔2 mm做6个脑冠状切片,进行计算机扫描,利用灰度对比,Photoshop软件图像处理计算梗死面积,然后石蜡包埋切片,HE染色,光镜下观察组织学变化.
统计学处理: 所有数据以X±s表示,组间比较采用两样本t检验.
2 结果
2.1 神经行为学改变 造模后24 h进行神经行为学评分,40, 50和60 mg.kg-1光化学诱导组的大鼠造模后24 h内有呃逆,呕吐等颅内高压征象,尤以60 mg.kg-1组的大鼠呕吐分泌物多,呼吸道易堵塞,神志极差,多在脑梗死后6~8 h内死亡. 脑梗死面积的测量 造模后24 h取材,经扫描仪扫描,计算机图像处理,结果表明,单纯光照组,单纯光敏剂,10 mg.kg-1组无明显梗死灶,20及30 mg.kg-1组仅有皮层表浅的梗死灶,40及50 mg.kg-1组有明显的梗死灶. 药物浓度与神经学评分及梗死面积关系如Fig 1, 2所示.
, 百拇医药
2.2 脑组织病理学改变 HE染色,光镜下单纯光照组,单光敏剂组无明显改变. 10 mg.kg-1组有个别神经元细胞固缩,其他大部分正常, 20, 30 mg.kg-1组可见小的缺血病灶区有神经元固缩,胞质红染,其余正常(Fig 1, 2). 40 mg.kg-1组局部脑组织有梗死灶,神经细胞固缩胞质红染,周围胶质癍痕形成,海马区有退变. 50 mg.kg-1组可见明显的梗死灶,灶区细胞变性坏死,神经元细胞肿胀或固缩,有的溶解消失,梗死区有小灶的中性粒细胞浸润(Fig 3, 4).

图1 单光照组细胞形态
, 百拇医药
Fig 1 Cell morphology in light group HE ×400

图2 单光敏组细胞形态
Fig 2 Cell morphology in group treated with photoseneitizing only HE ×400

图3 50 mg.kg-1组细胞形态
, 百拇医药 Fig 3 Cell morphology in 50 mg.kg-1 group HE ×200

图4 50 mg.kg-1组细胞形态
Fig 4 Cell morphology in 50 mg.kg-1 group HE ×400
3 讨论
国内外有不少造模方法有创伤大,需开颅,易感染,难以控制梗死面积等缺点; 光化学法诱导的脑梗死动物模型是1985年由Watson等[2]首先报道,其原理是注入动物体内的光敏染料,在特定波长的光源照射下,产生并释放单态氧,使血管内皮细胞膜不饱和脂肪酸发生脂质过氧化反应,膜通透性增加,导致血管内皮损害,诱发血小板聚集,光照区血管内血栓形成,局部脑组织发生不可逆缺血性损伤[3], 这可能与兼有缺血和血栓形成双重病理损害有关[4], 鼠梗死形成与人类动脉血栓形成梗死的发病过程相似[5].
, 百拇医药
CPD4造影剂是从中药蚕纱中提取的一种新型光敏剂,由主要成分叶绿三酸的钠盐及其余部分胡萝卜素为主的黄色素组成,与血卟啉类光敏剂相比,CPD4具有体内排泄快,光毒反应小等优点,用药后避光仅需1 d,CPD4特征吸收峰就位于红光区,作用波长长,穿透深,因而较其他造影剂具有明显的优越性[6]. 以往研究显示[7],CPD4损伤的靶部位是内皮细胞(EC),首先产生单态氧或氧自由基对EC造成直接光毒损伤,随后血管内皮损伤导致的凝血因子释放,血管收缩,血栓形成使缺氧加重,血液停止,从而加速了血管组织的损伤. 实验结果显示,在照射时间相同的情况下,大鼠脑梗死与CPD4浓度相关. 其中CPD4 40, 50 mg.kg-1在照射后24 h梗死灶对侧肢体出现运动障碍,表明鼠感觉运动皮质区受损,光镜下感觉运动皮质区有不可逆的缺血性病理改变,梗死面积大;相比之下,单纯光照组,单纯光敏剂组未见行为学及病理学改变,光敏剂浓度10, 20和30 mg.kg-1的光化学诱导组,神经行为学及组织病理学改变较轻.
, 百拇医药
根据神经功能评分可反映缺血性损伤的程度,而且与皮质缺血性坏死神经元的数目密切相关[8,9],我们采用Bederson神经功能评分反映大鼠脑皮质梗死前后神经行为方面的改变,发现不同浓度的CPD4经过光诱导形成一侧大脑皮质梗死后,出现不同程度的神经功能缺损,而且随着浓度的增加,神经功能评分增加,其梗死面积,缺血程度也相应加重;证实了不同的药物浓度与神经学评分及梗死面积成正相关(Fig 5,6),光镜检查也说明了浓度越高,损伤程度越重,梗死灶区细胞明显变性,坏死,神经元细胞肿胀,萎缩,有的溶解消失,严重还可深入皮质下区域,如纹状体、海马、丘脑等其他底节区.

图5 不同的CPD4质量分数与梗死面积的关系
, 百拇医药 Fig 5 Relationship between mass fraction of CPD4 and the infarction size
总之,叶绿素诱导的脑梗死模型稳定性,重复性好,梗死成功率高,操作简单,可在指定的皮质区发生梗死,而不局限于大脑中动脉供血区,该方法光源成本低,单色性好,无须开颅,避免了手术对脑组织和血管的机械性损伤,对全身影响小,适宜大鼠行为障碍及功能定位研究. 由于该模型是终末动脉永久性闭塞,妨碍扩血管药物疗效的观察,不宜用于复制再灌注损伤的模型研究[10],可用于脑血管病康复领域中脑可塑性等其他研究.

图6 不同CPD4质量分数与神经功能评分的关系
, 百拇医药
Fig 6 Relationship between mass fraction of CPD4 and the neurobehavoral evaluation
基金项目:军队留学人员回国启动基金(97卫科训字116号回国基金)
作者简介:徐 莉(1966-), 女(汉族), 陕西省紫阳县人. 主治医师, 硕士生(导师李 玲). Tel.(029)3375437(O) Email. Lilingdr@fmmu.edu.cn
徐莉(第四军医大学西京医院康复与理疗科)
李玲(第四军医大学西京医院康复与理疗科)
陈景藻(第四军医大学西京医院康复与理疗科)
, 百拇医药 施新猷(第四军医大学实验动物中心,陕西 西安 710033)
郭振援(解放军兰州军区临潼第二疗养院)
王斌(第四军医大学西京医院康复与理疗科)
袁华(第四军医大学西京医院康复与理疗科)
易南(第四军医大学西京医院康复与理疗科)
参考文献:
[1] Bederson JB, Pitts LH, Tsuji M. Rat middle cerebral artery occlusion: Evaluation of the model and development of a neurologic examination [J]. Stroke, 1986;17(3):472-476.
, 百拇医药
[2] Watson BD, Dietrich WD, Busto R et al. Induction of reproduciole brain infarction by photochemically irritated thrombosis [J]. Ann Neurol, 1985;17(3):97-504.
[3] Matsuno H, Umemura K. A simple and reproducible cerebral thrombosis model in rats induced by a photochemical reaction and the effect of plasminapen plasminafels activator chimera in this model [J]. J Pharmacol Toxicol Methods, 1993;29(30):65-73.
[4] 王 伟, 董为伟, 傅雅各et al. 光化学诱导鼠大脑中动脉闭塞及再通模型[J]. 中国神经精神疾病杂志, 1996;22(1):27-30.
, 百拇医药
[5] Furtell N. An improved photochemical model of embolic cerebral infarction in rats [J]. Stroke, 1999;22(2):225-232.
[6] 王潭时, 杨永华, 郭 勇et al. 叶绿素光敏剂诊治恶性肿瘤[J]. 浙江中医学院学报,1988;12(4):53-54.
[7] 杨耀武, 吕春莹, 吴 洋et al. 叶绿素光敏剂光动力治疗鲜红斑痔[J]. 第四军医大学学报,1997;18(6):582-585.
[8] 李红戈, 张茂悦, 童萼塘et al. 光化学诱导大鼠脑皮质梗塞模型的研究[J]. 卒中与神经疾病,1996;3(3):126-128.
[9] Garcia JH, Wagner S, Liu KF et al. Neurological deficit and extent of neuronal necrosis attributable to middle cerebral artery occlusion in rats [J]. Stroke,1995;26(4):627-632.
[10] 陈春富. 大鼠局灶性脑缺血模型研究进展[研究综述][J]. 国外医学 脑血管疾病分册, 1995;3(5):227-230., http://www.100md.com