黑色素细胞培养上清液对增生性瘢痕成纤维细胞的生物学效应
黑色素细胞培养上清液对增生性瘢痕成纤维细胞的生物学效应
张琳西 郭树忠 王臻
摘 要: 目的 观察正常的黑色素细胞(MC)对增生性瘢痕成纤维细胞(HSFib)的生物学效应. 方法 收集MC的上清液按不同的浓度加入培养的HSFib中,MTT法测定细胞的增殖率, 3H-TdR参入法测定细胞DNA合成率. 结果 加入MC上清液的HSFib,培养48 h后,较正常对照组,实验组细胞增殖明显(P<0.05). DNA合成率各实验组(除MC1组外)与对照组相差显著(P<0.01),但高浓度组(75%)的合成率有下降趋势. 结论 MC细胞可能分泌活性物质促进HSFib细胞DNA合成及殖增,可能与烧伤后瘢痕形成及色素形成有关.
, 百拇医药
关键词:黑色素细胞;增生;成纤维细胞
0 引言
黑色素细胞(melanocyte, MC)位于表皮的基底层,与表皮细胞共同组成表皮黑素单位,其主要功能是产生黑素小体保护皮肤免受损害. 最近研究表明 ,在某些不良条件刺激下,黑色素细胞可发生分裂、增殖、黑素形成、移行等一系列行为参与机体代谢[1],本文拟观察体外培养的MC对烧伤后增生性瘢痕成纤维细胞(hypertrophic scar fibroblast, HSFib)的生物学影响,探讨其在烧伤后瘢痕形成及色素沉着方面的作用.
1 材料和方法
1.1 材料 黑色素细胞培养参照文献[2]; 用HMB-45免疫组化鉴定细胞(Fig 1);当细胞融合达80%左右,培养基换为无因子的DMEM/F12, 96 h后收集上清,-40℃保存备用. 参照文献[3]按组织块法进行原代HSFib培养,实验选用4~10代细胞.
, 百拇医药
图1 原代培养5 d后的黑色素细胞
Fig 1 Fifth generation melanocytes derived from newborn foreskin
1.2 方法 取对数生长期的HSFib,常规消化,按5×106.L-1接种于96孔板;24 h后换为不同浓度MC上清液的条件培养液,稀释度分别为对照组(C),MC1 (10∶1), MC2 (4∶1), MC3 (2∶1), MC4 (4∶3),每组重复6孔,200 μL.孔-1,培养48 h;采用MTT法则定HSFib的增殖量.
3H-TdR参入法: 细胞接种及所加条件培养液方法同前;加入MC条件上清液48 h后,每孔加入3.7×104 kBq.L-1(体积100 μL)的3H-TdR,继续培养3 h后,用冰冷的PBS洗2次,2.5 g.L-1胰酶消化,收集细胞于999型纤维膜上,红外线烤干后Beckman闪烁仪计数.
, 百拇医药
统计学处理: 数据处理采用我校卫生统计教研室开发的SPLM医用统计软件进行方差分析.
2 结果
2.1 MC上清液对HSFib细胞生长及活力的影响 MC上清液对HSFib有显著促进增殖作用(Fig 2). MC1, MC2与对照组相比相差显著(P<0.05),MC3,MC4与对照组相比相差非常显著(P<0.01),组间无差异.
图2 MC上清液对HSFib的生长增殖效应(MTT)
Fig 2 Effects of supernatant from the MC culture on proliferation of hypertrophic scar
, 百拇医药
2.2 MC上清液对HSFib DNA合成的影响 MC上清液对HSFib DNA合成有明显促进作用(Fig 3), MC1, MC2, MC3, MC4与C相比提高率分为1.4, 2.6, 3.8, 3倍,相差非常显著(P<0.01),MC3组(50%)达到高峰,MC4组(75%)对HSFib DNA合成有下调作用,与MTT方法结果一致.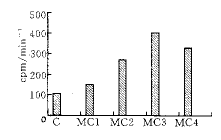
图3 MC上清液对HSFib DNA合成的影响
Fig 3 Effects of supernatant from the MC culture on HSFib DNA synthesis
3 讨论
, 百拇医药
人黑色素细胞(MC)在妊娠5~6 wk自胚胎神经嵴开始移行,7 wk到达表皮,移行入表皮的MC定居在基底膜上,每一个MC与其相邻约36个角朊细胞在形态上、功能上组成密切相关的表皮黑素单位. 在正常情况下,MC既不增生也不表达与其相关的抗体,但当表皮受损时,会导致MC生存局部微环境的改变,引起MC大量增殖分裂,黑素形成,诱导MC向受损区移行[1] . Bose[4]用这一观点解释临床上白癜风患者白斑区周围皮肤出现色素增加. Boyce等[5]的研究表明在培养的人皮肤替代物中加入黑色素细胞可增加愈合伤口皮肤颜色,减少植皮术后低色素症的发生及皮片的挛缩. Danen等[6]实验表明,在伤口愈合时,MC很容易自基底膜游离并在纤维粘连蛋白(fibronectin, FN)表面移行参与伤口愈合,皮肤色素恢复.
目前,关于烧伤后瘢痕增生的机制众说纷纭,国内外学者普遍认为成纤维细胞,细胞外基质及生长因子三者关系密切,是瘢痕形成的生物学基础. 烧伤后,表皮及真皮层细胞的生存环境发生改变,成纤维细胞不但受到缺氧,炎症介质等不良因素刺激,而且还受许多因子的调节. 这些因子不仅刺激成纤维母细胞,毛细血管增生,而且某些因子还可引起MC的分裂增殖,产生黑素并诱导MC向受损区移行,如碱性成纤维细胞生长因子(bFGF)、干细胞因子(SCF)、神经生长因子(NGF)、内皮素(ET)及花生四烯酸的代谢产物等[1]. Matsumoto等[7]研究发现早期伤口愈合中,MC逐渐增加,并在MC中发现了白介素1(IL-1)及转化生长因子(TGF-β). 我们实验结果发现增殖态的MC上清液可刺激HSFib细胞增殖,说明该细胞可能具有潜在的以分泌形成来刺激真皮间质成纤维细胞增殖的能力. Zachariae等[8]也证明在炎症中细胞因子不仅具有对MC旁分泌作用,而且MC通过自身合成因子,又具有一定的自分泌影响作用. 因此,我们推测,烧伤后,在瘢痕增生的过程中,MC细胞被某些因子激活,被激活的MC逐渐向受损区域移行,不仅能分泌因子刺激间质成纤维细胞增生,而且还可以合成分泌大量的黑素小体,输送给角朊细胞,引起色素的沉着,在瘢痕增生过程中,激活的MC可能参与了瘢痕形成及色素沉着.
, 百拇医药
基金项目:教育部1997年留学回国人员启动基金资助
作者简介:张琳西(1971-) , 女(汉族), 陕西省蓝田县人. 技师. Tel.(029)3375306 Email. xjzxwka@fmmu.edu.cn
张琳西(第四军医大学西京医院整形外科中心,陕西 西安 710033)
郭树忠(第四军医大学西京医院整形外科中心,陕西 西安 710033)
王臻(第四军医大学西京医院整形外科中心,陕西 西安 710033)
参考文献:
[1] 雷铁池. 表皮黑素细胞移行的分子机制及其生物学意义[J]. 国外医学皮肤病分册, 1998;24(4):216-220.
, 百拇医药
[2] Eisinger M, Marko O. Selective proliferation of normal human melanocytes in vitro in the presence of phorbolester and cholera toxin [J ]. Proc Natl Acad Sci USA, 1982;79(3):2018-2022.
[3] 司徒镇强. 细胞培养[M]. 北京: 世界图书出版西安公司, 1996:69-71.
[4] Bose SK. Is vitiligo a result of migration melancoytes due to bad local environment [J]. J Dermatol, 1994;21(12):984-984.
[5] Boyce ST, Medrano EE, Abdel-Malek Z et al. Pigmentation and Inhibition of wound contration by cultured skin substitutes with adult melanocytes after transplantation to athymic mice [J]. J Invest Dermatol, 1993; 100(4):360-365.
, 百拇医药
[6] Danen EH, Jansen KF, Klein CE et al. Loss of adhesion to basement membrane components but not to keratinocytes in proliferating melanocytes [J]. Eup J Cell Biol, 1996; 70(1): 69-75.
[7] Matsumoto K, Robb E, Warden G et al. The expression of cytokines, growth factors and ICAM-1 in the healing of human cutaneous xenografts on nude mice [J]. Exp Dermatol, 1997;6(1):13-21.
[8] Zachariae COC, Pedersen KP, Matsushima K. Expression and secretion of leuocyte chemotactic cytokines by normal human melanocytes and melanoma cell [J]. J Invest Dermatol, 1991; 97(3):593-599., 百拇医药
张琳西 郭树忠 王臻
摘 要: 目的 观察正常的黑色素细胞(MC)对增生性瘢痕成纤维细胞(HSFib)的生物学效应. 方法 收集MC的上清液按不同的浓度加入培养的HSFib中,MTT法测定细胞的增殖率, 3H-TdR参入法测定细胞DNA合成率. 结果 加入MC上清液的HSFib,培养48 h后,较正常对照组,实验组细胞增殖明显(P<0.05). DNA合成率各实验组(除MC1组外)与对照组相差显著(P<0.01),但高浓度组(75%)的合成率有下降趋势. 结论 MC细胞可能分泌活性物质促进HSFib细胞DNA合成及殖增,可能与烧伤后瘢痕形成及色素形成有关.
, 百拇医药
关键词:黑色素细胞;增生;成纤维细胞
0 引言
黑色素细胞(melanocyte, MC)位于表皮的基底层,与表皮细胞共同组成表皮黑素单位,其主要功能是产生黑素小体保护皮肤免受损害. 最近研究表明 ,在某些不良条件刺激下,黑色素细胞可发生分裂、增殖、黑素形成、移行等一系列行为参与机体代谢[1],本文拟观察体外培养的MC对烧伤后增生性瘢痕成纤维细胞(hypertrophic scar fibroblast, HSFib)的生物学影响,探讨其在烧伤后瘢痕形成及色素沉着方面的作用.
1 材料和方法
1.1 材料 黑色素细胞培养参照文献[2]; 用HMB-45免疫组化鉴定细胞(Fig 1);当细胞融合达80%左右,培养基换为无因子的DMEM/F12, 96 h后收集上清,-40℃保存备用. 参照文献[3]按组织块法进行原代HSFib培养,实验选用4~10代细胞.

, 百拇医药
图1 原代培养5 d后的黑色素细胞
Fig 1 Fifth generation melanocytes derived from newborn foreskin
1.2 方法 取对数生长期的HSFib,常规消化,按5×106.L-1接种于96孔板;24 h后换为不同浓度MC上清液的条件培养液,稀释度分别为对照组(C),MC1 (10∶1), MC2 (4∶1), MC3 (2∶1), MC4 (4∶3),每组重复6孔,200 μL.孔-1,培养48 h;采用MTT法则定HSFib的增殖量.
3H-TdR参入法: 细胞接种及所加条件培养液方法同前;加入MC条件上清液48 h后,每孔加入3.7×104 kBq.L-1(体积100 μL)的3H-TdR,继续培养3 h后,用冰冷的PBS洗2次,2.5 g.L-1胰酶消化,收集细胞于999型纤维膜上,红外线烤干后Beckman闪烁仪计数.
, 百拇医药
统计学处理: 数据处理采用我校卫生统计教研室开发的SPLM医用统计软件进行方差分析.
2 结果
2.1 MC上清液对HSFib细胞生长及活力的影响 MC上清液对HSFib有显著促进增殖作用(Fig 2). MC1, MC2与对照组相比相差显著(P<0.05),MC3,MC4与对照组相比相差非常显著(P<0.01),组间无差异.

图2 MC上清液对HSFib的生长增殖效应(MTT)
Fig 2 Effects of supernatant from the MC culture on proliferation of hypertrophic scar
, 百拇医药
2.2 MC上清液对HSFib DNA合成的影响 MC上清液对HSFib DNA合成有明显促进作用(Fig 3), MC1, MC2, MC3, MC4与C相比提高率分为1.4, 2.6, 3.8, 3倍,相差非常显著(P<0.01),MC3组(50%)达到高峰,MC4组(75%)对HSFib DNA合成有下调作用,与MTT方法结果一致.

图3 MC上清液对HSFib DNA合成的影响
Fig 3 Effects of supernatant from the MC culture on HSFib DNA synthesis
3 讨论
, 百拇医药
人黑色素细胞(MC)在妊娠5~6 wk自胚胎神经嵴开始移行,7 wk到达表皮,移行入表皮的MC定居在基底膜上,每一个MC与其相邻约36个角朊细胞在形态上、功能上组成密切相关的表皮黑素单位. 在正常情况下,MC既不增生也不表达与其相关的抗体,但当表皮受损时,会导致MC生存局部微环境的改变,引起MC大量增殖分裂,黑素形成,诱导MC向受损区移行[1] . Bose[4]用这一观点解释临床上白癜风患者白斑区周围皮肤出现色素增加. Boyce等[5]的研究表明在培养的人皮肤替代物中加入黑色素细胞可增加愈合伤口皮肤颜色,减少植皮术后低色素症的发生及皮片的挛缩. Danen等[6]实验表明,在伤口愈合时,MC很容易自基底膜游离并在纤维粘连蛋白(fibronectin, FN)表面移行参与伤口愈合,皮肤色素恢复.
目前,关于烧伤后瘢痕增生的机制众说纷纭,国内外学者普遍认为成纤维细胞,细胞外基质及生长因子三者关系密切,是瘢痕形成的生物学基础. 烧伤后,表皮及真皮层细胞的生存环境发生改变,成纤维细胞不但受到缺氧,炎症介质等不良因素刺激,而且还受许多因子的调节. 这些因子不仅刺激成纤维母细胞,毛细血管增生,而且某些因子还可引起MC的分裂增殖,产生黑素并诱导MC向受损区移行,如碱性成纤维细胞生长因子(bFGF)、干细胞因子(SCF)、神经生长因子(NGF)、内皮素(ET)及花生四烯酸的代谢产物等[1]. Matsumoto等[7]研究发现早期伤口愈合中,MC逐渐增加,并在MC中发现了白介素1(IL-1)及转化生长因子(TGF-β). 我们实验结果发现增殖态的MC上清液可刺激HSFib细胞增殖,说明该细胞可能具有潜在的以分泌形成来刺激真皮间质成纤维细胞增殖的能力. Zachariae等[8]也证明在炎症中细胞因子不仅具有对MC旁分泌作用,而且MC通过自身合成因子,又具有一定的自分泌影响作用. 因此,我们推测,烧伤后,在瘢痕增生的过程中,MC细胞被某些因子激活,被激活的MC逐渐向受损区域移行,不仅能分泌因子刺激间质成纤维细胞增生,而且还可以合成分泌大量的黑素小体,输送给角朊细胞,引起色素的沉着,在瘢痕增生过程中,激活的MC可能参与了瘢痕形成及色素沉着.
, 百拇医药
基金项目:教育部1997年留学回国人员启动基金资助
作者简介:张琳西(1971-) , 女(汉族), 陕西省蓝田县人. 技师. Tel.(029)3375306 Email. xjzxwka@fmmu.edu.cn
张琳西(第四军医大学西京医院整形外科中心,陕西 西安 710033)
郭树忠(第四军医大学西京医院整形外科中心,陕西 西安 710033)
王臻(第四军医大学西京医院整形外科中心,陕西 西安 710033)
参考文献:
[1] 雷铁池. 表皮黑素细胞移行的分子机制及其生物学意义[J]. 国外医学皮肤病分册, 1998;24(4):216-220.
, 百拇医药
[2] Eisinger M, Marko O. Selective proliferation of normal human melanocytes in vitro in the presence of phorbolester and cholera toxin [J ]. Proc Natl Acad Sci USA, 1982;79(3):2018-2022.
[3] 司徒镇强. 细胞培养[M]. 北京: 世界图书出版西安公司, 1996:69-71.
[4] Bose SK. Is vitiligo a result of migration melancoytes due to bad local environment [J]. J Dermatol, 1994;21(12):984-984.
[5] Boyce ST, Medrano EE, Abdel-Malek Z et al. Pigmentation and Inhibition of wound contration by cultured skin substitutes with adult melanocytes after transplantation to athymic mice [J]. J Invest Dermatol, 1993; 100(4):360-365.
, 百拇医药
[6] Danen EH, Jansen KF, Klein CE et al. Loss of adhesion to basement membrane components but not to keratinocytes in proliferating melanocytes [J]. Eup J Cell Biol, 1996; 70(1): 69-75.
[7] Matsumoto K, Robb E, Warden G et al. The expression of cytokines, growth factors and ICAM-1 in the healing of human cutaneous xenografts on nude mice [J]. Exp Dermatol, 1997;6(1):13-21.
[8] Zachariae COC, Pedersen KP, Matsushima K. Expression and secretion of leuocyte chemotactic cytokines by normal human melanocytes and melanoma cell [J]. J Invest Dermatol, 1991; 97(3):593-599., 百拇医药