染色体外游离态的子宫颈癌HPV 16分离株E1/!E2区的基因序列重排
染色体外游离态的子宫颈癌HPV 16分离株E1/!E2区的基因序列重排
董小平 周伟 H.Pfister
摘 要 目的 观测子宫颈癌组织中呈染色体外质粒状态的HPV 16分离株E1/E2基因序列。方法 Southern转印杂交检测癌组织中HPV 16基因组的物理状态,对8例游离状态的HPV 16分离株E1/E2区进行PCR扩增,克隆后酶切分析和DNA序列分析。结果 对28例HPV 16阳性子宫颈癌中病毒DNA杂交结果显示8例呈染色体外质粒方式存在。PCR克隆鉴定发现8例分离株都具有完整的E1/E2区域。此外4例分离株还带有不同比率的基因重排,序列检测证实E1/E2区存在有不同的重复序列插入、缺失。8例分离株中仅1例带有与HPV 16原毒株相同的1138位点“G”缺失。结论 在游离态的HPV 16分离株E1/E2区域存在有不同的基因序列重排,这可能在病毒致癌方面起一定的作用。
, 百拇医药
关键词:乳头状瘤病毒,人 宫颈肿瘤 基因重排 序列分析
人乳头瘤病毒16型(human papillomavirus type 16,HPV 16)感染与子宫颈癌发病密切相关,病毒的主要癌基因为病毒早期基因E6/E7。研究表明E6/E7基因的存在和表达对保持转化细胞以及癌细胞的表现型起决定性作用[1]。E6/E7基因的表达受位于病毒长控制区(long control region, LCR)的启动子P97的控制。E2蛋白可通过结合至位于P97上游的4个特异性结合位点抑制P97活性,从而抑制E6/E7蛋白的表达[2]。细胞转录调节因子YY1也可结合至位于LCR的位点抑制P97活性[3~5]。YY1结合位点的突变和缺失可增强P97活性,从而引起病毒癌基因转录和病毒对原代细胞的转化、永生化能力增强[6~8]。HPV 16 E1区结构完整性对病毒的转化作用也十分重要,E1区的突变可导致病毒对人原代角源细胞永生化能力增强[9]。
, 百拇医药
在70% HPV 16阳性子宫颈癌细胞中病毒基因组整合到宿主细胞染色体上,这一整合过程常常破坏了E1/E2区域的完整性,因而引起E6/E7基因的过量表达导致细胞恶变[10]。在HPV 16 DNA呈染色体外质粒方式存在的子宫颈癌组织中,YY1位点的突变较为常见,这也被认为是病毒致癌的途径之一[3,4],研究中还发现在同一肿瘤组织中并非所有的HPV 16 LCR序列都呈均一性[3]。为了观测呈质粒状态的病毒基因组中E1/E2序列的完整性,我们分析了8例HPV 16分离株E1/E2区域DNA序列,结果发现存在有不同的基因重排现象。
1 材料和方法
1.1 宫颈癌组织DNA提取 实验所用宫颈癌组织标本均取自德国Erlangen大学妇产医院。所有标本都经临床病理学诊断。取5g组织加入无菌海砂在TE缓冲液中研磨,离心去除海砂。上清液在100 μg/ml蛋白酶K,0.5%的SDS条件下37℃过夜消化。酚-氯仿抽提,乙醇沉淀。
, http://www.100md.com
1.2 Southern转印杂交 取10μg组织DNA经适当内切酶消化后行0.8%琼脂糖凝胶电泳,DNA转印按常规方法进行。DNA/DNA杂交所用同位素α-32P-dATP为Amersham公司产品,缺口翻译反应试剂盒为Pharmacia公司产品。以HPV 16全基因组序列按试剂盒提供方法进行探针标记。杂交、洗膜以及放射自显影按常规法进行。
1.3 PCR 用于扩增HPV 16 E1/E2区的引物为H16-849(5′-GAAACCTAATCTACCATGGCTG-3′, nt.849-871)和H16-3889(5′-CACGCCAGTAATGTTGTGGATGC-3′, nt.3889-3867)。1 μg细胞DNA与1U Taq多聚酶(Pharmacia公司产品)、2 mmol/L 4×dNTP混匀,50-100 μl总体积行PCR反应。反应条件为:94℃,1 min; 57℃,40 s;72℃,1.5min;30个循环。
, http://www.100md.com 1.4 质粒构建 PCR产物经PstⅠ水解后连接至克隆载体pBS M13+,构成重组质粒pT-,酶切分析鉴定插入片段和克隆方向。
1.5 DNA序列分析 同位素α-35S-dATP为Amersham公司产品,T7Sequencing kit为Pharmacia公司产品。DNA测序按操作说明进行。
2 结果
2.1 HPV 16阳性子宫颈癌组织中存在有染色体外质粒方式的病毒基因组 对28例经点杂交鉴定为HPV 16阳性的子宫颈癌组织进行Southern转印杂交。所有组织DNA均经在HPV 16基因组上单切点酶BamHⅠ,无切点酶HindⅢ以及未加内切酶作用。图1为呈质粒状态的HPV 16基因组杂交图形,在无酶切泳道(N道)和HindⅢ酶解泳道(H道)Tu-390和Tu-423均出现2条泳动位置相同的杂交带,分别代表病毒基因组的两种存在方式。在BamHⅠ酶解泳道(B道)均显示有一条约8.0 kb的杂交条带。对28例宫颈癌组织DNA分析显示8例HPV 16基因组呈明显的质粒状态,其余杂交结果都未在8.0 kb处出现单一杂交条带(结果未现)。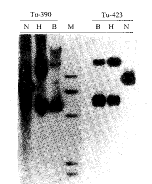
, 百拇医药
图1 Southern blot杂交检测子宫颈癌组织中HPV 16基因组
Fig.1 Analysis of physical states of HPV 16 DNAs from cervical
carcinomas with Southern blot hybridization
M:λ-DNA Hind Ⅲ fragments. N: Noenzyme digestion
H:Digestion with Hind Ⅲ. B:Digestion with BamHⅠ
2.2 呈质粒方式存在的HPV 16都带有完整的E1和E2区 用位于HPV 16 E1/!E2区两侧的特异性引物对8例呈染色体外质粒方式存在HPV 16阳性宫颈癌细胞DNA进行扩增,结果显示所有被检组织DNA中均可扩增出约3.0 kb的阳性条带,与HPV 16阳性对照中的扩增片段长度相符。将这些PCR产物克隆至质粒pBS M13+后序列分析结果表明确系HPV 16 E1/E2 DNA序列。
, http://www.100md.com
2.3 HPV 16原毒株E1区1138位“G”缺失也出现于其它HPV 16分离株 1138位的“G”缺失存在于HPV 16原毒株[9]。对8例HPV 16 E1区DNA序列分析发现一例分离株中也存在这一突变(表1)。
2.4 HPV 16分离株E1/E2区域存在有不同的基因序列重排 对8例HPV分离株E1/E2区域PCR后克隆质粒的酶切鉴定发现除了标准长度的PCR插入片段外存在有其它长度片段。质粒pT1326的插入片段长于标准长度的插入片段。用内切酶AccⅠ水解后发现在插入片段5′端部位明显长于标准长度。DNA序列分析表明在E1区nt 1311位有一63 bp的E1重复序列(nt 1311-1373,图2~3)。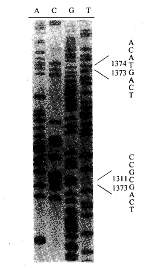
图2 质粒pT1326带有一63-bp的重复插入序列
, http://www.100md.com
Fig.2 An insertion of 63-bp repeated sequence was detected in plasmid pT1326
The nucleotide sequence and position were shown in the right
图3 游离态HPV 16分离株E1/E2区的分子重排
Fig.3 DNA rearrangements in E1/E2 regions of episomal HPV 16 isolates
The nucleotide positions of different insertion and deletions were shown below
, http://www.100md.com
表1 8例游离态HPV 16分离株E1/E2序列检测结果
Tab.1 Sequence analysis of E1/E2 ORFs from eight episomal HPV 16 isolates
病例
Case
来源
Origin
状态
Physical state
G缺失(nt 1138)
G deletion
, 百拇医药
(nt 1138)
DNA重排
DNA
rearrangement
Tu-367
Primary tumor1
Episomal3
-
+
Tu-390
Primary tumor
Episomal
, http://www.100md.com
-
+
Tu-397
Primary tumor
Episomal
+
-
Tu-423
Primary tumor
Episomal
-
-
Tu-432
, http://www.100md.com
Metastasis2
Episomal
-
-
Tu-433
Primary tumor
Episomal
-
+
Tu-435
Primary tumor
Episomal
, http://www.100md.com
-
-
Tu-1326
Primary tumor
Episomal
-
+
1:原发肿瘤; 2:转移肿瘤; 3:染色体外质粒方式
1:Primary tumor. 2:Metastasis. 3:Episomal
对10个带有肿瘤Tu-367 PCR扩增产物的重组质粒酶切分析发现其中8例的插入片段同标准长度一致,而另2例的插入片段明显比标准为短。序列分析结果显示这2例的HPV 16 E1/E2区域带有1865 bp的缺失突变,丢失了nt 1581-3446区间的序列(图3)。这一缺失涉及到E1区3′端和E2区5′端。对8例带有标准长度PCR片段质粒中的2例测序结果表明为HPV 16野毒株E1/E2序列。
, 百拇医药
10个带有肿瘤Tu-390 PCR扩增产物质粒的酶切分析发现9例的插入片段同标准长度一致,1例的插入片段较标准为短。序列分析结果显示9例的标准长度片段为HPV 16野毒株E1/E2序列,而另一例的短片段的缺失长度为1580 bp,除去了nt 1060-2640区间的序列(图3)。这一缺失导致E1区缺损。
10个带有Tu-433 PCR扩增产物质粒的酶切分析显示7例的插入片段同标准长度一致,3例带有不同长度的插入片段。其中2例的短片段泳动位置相同,另一例带有更短的插入片段。序列分析结果显示2例短片段的缺失长度为706 bp (nt 2924-3630),缺损部位在E2区(图3)。另一更短插入片段的缺失长度为1748 bp,缺失范围为nt 1162-2204和net 2924-3630,分别涉及E1和E2区(图3)。
3 讨论
HPV 16 E1/E2区为病毒的重要转录和复制蛋白,参与病毒癌基因转录的调控。E1区的突变可导致病毒对原代细胞永生化能力的增强。在HPV 16原毒株E1序列nt 1138位点存在有一“G”的单一核苷酸缺失,引起E1阅读框架的移码突变,导致病毒的转化能力加强[9]。对于这一突变在子宫颈癌HPV 16分离株中的存在情况尚无报道。我们对8例呈染色体外游离状态的子宫颈癌HPV 16其它分离株E1区序列分析发现有1例带有与野毒株原毒株相同的“G”缺失突变。这表明这一突变并非是从该例子宫颈癌分离的HPV 16野毒株[11]所特有,这一毒株在其它地区也有流行。
, 百拇医药
整合状态的HPV 16基因组中E1/E2区域的缺失被认为是病毒致癌的重要途径,游离状态的HPV 16在LCR区域的核苷酸序列改变也是病毒诱导细胞癌变的途径之一[3,4,6~9]。同一肿瘤组织内存在有两种或两种以上的病毒基因组类型已有报道[3,12]。我们在对8例子宫颈癌HPV 16分离株E1/E2区序列测定也发现在同一肿瘤组织中存在有两种以及两种以上的E1/E2序列。这提示发生在同一病人,甚至同一部位的肿瘤组织可能来自两种或多种癌变细胞克隆。
出现于pT-1326 E1区的63 bp的重复序列为HPV 16 E1序列,根据其核苷酸数目它将不形成框架移码突变。出现重复序列对病毒基因复制和转化作用的意义尚不清楚,但就病毒在肿瘤细胞中的游离存在方式和较高的拷贝数推测可能对病毒基因的复制影响不大。其它的E1/E2区域缺损将导致E1或/和E2的表达障碍,但在肿瘤组织中存在的占70%~90%的完整E1/E2序列可提供足够的E1/E2蛋白以供病毒DNA复制,因而病毒基因组也可呈游离状态存在,同时在细胞中有一定的拷贝数。这些缺损病毒在病毒致癌方面的生物学特性尚不清楚,但根据HPV 16 E1/E2蛋白对癌基因表达和病毒转化作用的影响可以推测在病毒诱导细胞癌变上可能会起一定的作用。
, 百拇医药
作者单位:董小平(100052 北京,中国预防医学科学院病毒学研究所病毒形态室;)
周伟(100052 北京,中国预防医学科学院病毒学研究所病毒形态室;)
H Pfister(德国科隆大学病毒学研究所)
参考文献
1,Von Knebel Doeberitz M, Rittmuller C, zur Hausen H, et al. Inhibition of tumorigenicity of cervical-cancer cells in nude mice by HPV 16 E6-E7 antisense RNA. Int J Cancer, 1992, 51:831-834.
2,McBride AA, Romanczuk H, Howley PM. The papillomavirus E2 regulatory proteins. J Biol Chem, 1991, 266:18411-18414.
, 百拇医药
3,Dong XP, Stubenrauch F, Beyer-Finkler E, et al. Prevalence of deletions of YY1-binding sites in episomal HPV 16 DNA from cervical cancers. Int J Cancer, 1994, 58:803-808.
4,May M, Dong XP, Beyer-Finkler E, et al. The E6-E7 promoter of extrachromosomal HPV 16 DNA in cervical cancers escapes from cellular repression by mutation of target sequences for YY1. EMBO J, 1994,13:1460-1466.
5,O'Connor MJ, Tan SH, Tan CH, et al. YY1 represses human papillomavirus type 16 transcription by quenching AP-1 activity. J Virol,1996,70:6529-6539.
, http://www.100md.com
6,董小平,刘红,Herbert Pfister. YY1抑制效应的破坏可促进HPV 16癌基因的转录.病毒学报,1999,15:125-129.
7,董小平,刘红,Herbert Pfister.人乳头瘤病毒16型长控制区域上YY1位点的缺失可增强病毒对小鼠纤维细胞的转化能力.中华实验和临床病毒学杂志,1999,13:5-8.
8 董小平,刘红,周伟.HPV 16 LCR上YY1结合位点的破坏可增强病毒诱导细胞永生化能力.病毒学报,1999,15:217-224.
9,Romanczuk H, Howley PM. Disruption of either the E1 or E2 regulatory gene of human papillomavirus type 16 increases viral immortalization capacity. Proc Natl Acad Sci USA, 1992,89:3159-3163.
, 百拇医药
10,Zur Hausen H. Human papillomavirus in the pathogenesis of anogenital cancer. Virology, 1991, 184:9-14.
11,Durst M, Gissmann L, Ikenberg H, et al. A papillomavirus DNA from a cervical carcinoma and its prevalence in cancer biopsy samples from different geographic regions. Proc Natl Acad Sci USA, 1983,80:3812-3814.
12,Giradi F, Pickel H, Beyer-Finckler E, et al. Specific rearrangement of human papillomavirus DNA provide molecular evidence for genetic heterogenicity of primary cancers, recurrences, and lymph-node metastases in 2 patients. Gynecol Oncol, 1993,51:281-286., 百拇医药
董小平 周伟 H.Pfister
摘 要 目的 观测子宫颈癌组织中呈染色体外质粒状态的HPV 16分离株E1/E2基因序列。方法 Southern转印杂交检测癌组织中HPV 16基因组的物理状态,对8例游离状态的HPV 16分离株E1/E2区进行PCR扩增,克隆后酶切分析和DNA序列分析。结果 对28例HPV 16阳性子宫颈癌中病毒DNA杂交结果显示8例呈染色体外质粒方式存在。PCR克隆鉴定发现8例分离株都具有完整的E1/E2区域。此外4例分离株还带有不同比率的基因重排,序列检测证实E1/E2区存在有不同的重复序列插入、缺失。8例分离株中仅1例带有与HPV 16原毒株相同的1138位点“G”缺失。结论 在游离态的HPV 16分离株E1/E2区域存在有不同的基因序列重排,这可能在病毒致癌方面起一定的作用。
, 百拇医药
关键词:乳头状瘤病毒,人 宫颈肿瘤 基因重排 序列分析
人乳头瘤病毒16型(human papillomavirus type 16,HPV 16)感染与子宫颈癌发病密切相关,病毒的主要癌基因为病毒早期基因E6/E7。研究表明E6/E7基因的存在和表达对保持转化细胞以及癌细胞的表现型起决定性作用[1]。E6/E7基因的表达受位于病毒长控制区(long control region, LCR)的启动子P97的控制。E2蛋白可通过结合至位于P97上游的4个特异性结合位点抑制P97活性,从而抑制E6/E7蛋白的表达[2]。细胞转录调节因子YY1也可结合至位于LCR的位点抑制P97活性[3~5]。YY1结合位点的突变和缺失可增强P97活性,从而引起病毒癌基因转录和病毒对原代细胞的转化、永生化能力增强[6~8]。HPV 16 E1区结构完整性对病毒的转化作用也十分重要,E1区的突变可导致病毒对人原代角源细胞永生化能力增强[9]。
, 百拇医药
在70% HPV 16阳性子宫颈癌细胞中病毒基因组整合到宿主细胞染色体上,这一整合过程常常破坏了E1/E2区域的完整性,因而引起E6/E7基因的过量表达导致细胞恶变[10]。在HPV 16 DNA呈染色体外质粒方式存在的子宫颈癌组织中,YY1位点的突变较为常见,这也被认为是病毒致癌的途径之一[3,4],研究中还发现在同一肿瘤组织中并非所有的HPV 16 LCR序列都呈均一性[3]。为了观测呈质粒状态的病毒基因组中E1/E2序列的完整性,我们分析了8例HPV 16分离株E1/E2区域DNA序列,结果发现存在有不同的基因重排现象。
1 材料和方法
1.1 宫颈癌组织DNA提取 实验所用宫颈癌组织标本均取自德国Erlangen大学妇产医院。所有标本都经临床病理学诊断。取5g组织加入无菌海砂在TE缓冲液中研磨,离心去除海砂。上清液在100 μg/ml蛋白酶K,0.5%的SDS条件下37℃过夜消化。酚-氯仿抽提,乙醇沉淀。
, http://www.100md.com
1.2 Southern转印杂交 取10μg组织DNA经适当内切酶消化后行0.8%琼脂糖凝胶电泳,DNA转印按常规方法进行。DNA/DNA杂交所用同位素α-32P-dATP为Amersham公司产品,缺口翻译反应试剂盒为Pharmacia公司产品。以HPV 16全基因组序列按试剂盒提供方法进行探针标记。杂交、洗膜以及放射自显影按常规法进行。
1.3 PCR 用于扩增HPV 16 E1/E2区的引物为H16-849(5′-GAAACCTAATCTACCATGGCTG-3′, nt.849-871)和H16-3889(5′-CACGCCAGTAATGTTGTGGATGC-3′, nt.3889-3867)。1 μg细胞DNA与1U Taq多聚酶(Pharmacia公司产品)、2 mmol/L 4×dNTP混匀,50-100 μl总体积行PCR反应。反应条件为:94℃,1 min; 57℃,40 s;72℃,1.5min;30个循环。
, http://www.100md.com 1.4 质粒构建 PCR产物经PstⅠ水解后连接至克隆载体pBS M13+,构成重组质粒pT-,酶切分析鉴定插入片段和克隆方向。
1.5 DNA序列分析 同位素α-35S-dATP为Amersham公司产品,T7Sequencing kit为Pharmacia公司产品。DNA测序按操作说明进行。
2 结果
2.1 HPV 16阳性子宫颈癌组织中存在有染色体外质粒方式的病毒基因组 对28例经点杂交鉴定为HPV 16阳性的子宫颈癌组织进行Southern转印杂交。所有组织DNA均经在HPV 16基因组上单切点酶BamHⅠ,无切点酶HindⅢ以及未加内切酶作用。图1为呈质粒状态的HPV 16基因组杂交图形,在无酶切泳道(N道)和HindⅢ酶解泳道(H道)Tu-390和Tu-423均出现2条泳动位置相同的杂交带,分别代表病毒基因组的两种存在方式。在BamHⅠ酶解泳道(B道)均显示有一条约8.0 kb的杂交条带。对28例宫颈癌组织DNA分析显示8例HPV 16基因组呈明显的质粒状态,其余杂交结果都未在8.0 kb处出现单一杂交条带(结果未现)。

, 百拇医药
图1 Southern blot杂交检测子宫颈癌组织中HPV 16基因组
Fig.1 Analysis of physical states of HPV 16 DNAs from cervical
carcinomas with Southern blot hybridization
M:λ-DNA Hind Ⅲ fragments. N: Noenzyme digestion
H:Digestion with Hind Ⅲ. B:Digestion with BamHⅠ
2.2 呈质粒方式存在的HPV 16都带有完整的E1和E2区 用位于HPV 16 E1/!E2区两侧的特异性引物对8例呈染色体外质粒方式存在HPV 16阳性宫颈癌细胞DNA进行扩增,结果显示所有被检组织DNA中均可扩增出约3.0 kb的阳性条带,与HPV 16阳性对照中的扩增片段长度相符。将这些PCR产物克隆至质粒pBS M13+后序列分析结果表明确系HPV 16 E1/E2 DNA序列。
, http://www.100md.com
2.3 HPV 16原毒株E1区1138位“G”缺失也出现于其它HPV 16分离株 1138位的“G”缺失存在于HPV 16原毒株[9]。对8例HPV 16 E1区DNA序列分析发现一例分离株中也存在这一突变(表1)。
2.4 HPV 16分离株E1/E2区域存在有不同的基因序列重排 对8例HPV分离株E1/E2区域PCR后克隆质粒的酶切鉴定发现除了标准长度的PCR插入片段外存在有其它长度片段。质粒pT1326的插入片段长于标准长度的插入片段。用内切酶AccⅠ水解后发现在插入片段5′端部位明显长于标准长度。DNA序列分析表明在E1区nt 1311位有一63 bp的E1重复序列(nt 1311-1373,图2~3)。

图2 质粒pT1326带有一63-bp的重复插入序列
, http://www.100md.com
Fig.2 An insertion of 63-bp repeated sequence was detected in plasmid pT1326
The nucleotide sequence and position were shown in the right

图3 游离态HPV 16分离株E1/E2区的分子重排
Fig.3 DNA rearrangements in E1/E2 regions of episomal HPV 16 isolates
The nucleotide positions of different insertion and deletions were shown below
, http://www.100md.com
表1 8例游离态HPV 16分离株E1/E2序列检测结果
Tab.1 Sequence analysis of E1/E2 ORFs from eight episomal HPV 16 isolates
病例
Case
来源
Origin
状态
Physical state
G缺失(nt 1138)
G deletion
, 百拇医药
(nt 1138)
DNA重排
DNA
rearrangement
Tu-367
Primary tumor1
Episomal3
-
+
Tu-390
Primary tumor
Episomal
, http://www.100md.com
-
+
Tu-397
Primary tumor
Episomal
+
-
Tu-423
Primary tumor
Episomal
-
-
Tu-432
, http://www.100md.com
Metastasis2
Episomal
-
-
Tu-433
Primary tumor
Episomal
-
+
Tu-435
Primary tumor
Episomal
, http://www.100md.com
-
-
Tu-1326
Primary tumor
Episomal
-
+
1:原发肿瘤; 2:转移肿瘤; 3:染色体外质粒方式
1:Primary tumor. 2:Metastasis. 3:Episomal
对10个带有肿瘤Tu-367 PCR扩增产物的重组质粒酶切分析发现其中8例的插入片段同标准长度一致,而另2例的插入片段明显比标准为短。序列分析结果显示这2例的HPV 16 E1/E2区域带有1865 bp的缺失突变,丢失了nt 1581-3446区间的序列(图3)。这一缺失涉及到E1区3′端和E2区5′端。对8例带有标准长度PCR片段质粒中的2例测序结果表明为HPV 16野毒株E1/E2序列。
, 百拇医药
10个带有肿瘤Tu-390 PCR扩增产物质粒的酶切分析发现9例的插入片段同标准长度一致,1例的插入片段较标准为短。序列分析结果显示9例的标准长度片段为HPV 16野毒株E1/E2序列,而另一例的短片段的缺失长度为1580 bp,除去了nt 1060-2640区间的序列(图3)。这一缺失导致E1区缺损。
10个带有Tu-433 PCR扩增产物质粒的酶切分析显示7例的插入片段同标准长度一致,3例带有不同长度的插入片段。其中2例的短片段泳动位置相同,另一例带有更短的插入片段。序列分析结果显示2例短片段的缺失长度为706 bp (nt 2924-3630),缺损部位在E2区(图3)。另一更短插入片段的缺失长度为1748 bp,缺失范围为nt 1162-2204和net 2924-3630,分别涉及E1和E2区(图3)。
3 讨论
HPV 16 E1/E2区为病毒的重要转录和复制蛋白,参与病毒癌基因转录的调控。E1区的突变可导致病毒对原代细胞永生化能力的增强。在HPV 16原毒株E1序列nt 1138位点存在有一“G”的单一核苷酸缺失,引起E1阅读框架的移码突变,导致病毒的转化能力加强[9]。对于这一突变在子宫颈癌HPV 16分离株中的存在情况尚无报道。我们对8例呈染色体外游离状态的子宫颈癌HPV 16其它分离株E1区序列分析发现有1例带有与野毒株原毒株相同的“G”缺失突变。这表明这一突变并非是从该例子宫颈癌分离的HPV 16野毒株[11]所特有,这一毒株在其它地区也有流行。
, 百拇医药
整合状态的HPV 16基因组中E1/E2区域的缺失被认为是病毒致癌的重要途径,游离状态的HPV 16在LCR区域的核苷酸序列改变也是病毒诱导细胞癌变的途径之一[3,4,6~9]。同一肿瘤组织内存在有两种或两种以上的病毒基因组类型已有报道[3,12]。我们在对8例子宫颈癌HPV 16分离株E1/E2区序列测定也发现在同一肿瘤组织中存在有两种以及两种以上的E1/E2序列。这提示发生在同一病人,甚至同一部位的肿瘤组织可能来自两种或多种癌变细胞克隆。
出现于pT-1326 E1区的63 bp的重复序列为HPV 16 E1序列,根据其核苷酸数目它将不形成框架移码突变。出现重复序列对病毒基因复制和转化作用的意义尚不清楚,但就病毒在肿瘤细胞中的游离存在方式和较高的拷贝数推测可能对病毒基因的复制影响不大。其它的E1/E2区域缺损将导致E1或/和E2的表达障碍,但在肿瘤组织中存在的占70%~90%的完整E1/E2序列可提供足够的E1/E2蛋白以供病毒DNA复制,因而病毒基因组也可呈游离状态存在,同时在细胞中有一定的拷贝数。这些缺损病毒在病毒致癌方面的生物学特性尚不清楚,但根据HPV 16 E1/E2蛋白对癌基因表达和病毒转化作用的影响可以推测在病毒诱导细胞癌变上可能会起一定的作用。
, 百拇医药
作者单位:董小平(100052 北京,中国预防医学科学院病毒学研究所病毒形态室;)
周伟(100052 北京,中国预防医学科学院病毒学研究所病毒形态室;)
H Pfister(德国科隆大学病毒学研究所)
参考文献
1,Von Knebel Doeberitz M, Rittmuller C, zur Hausen H, et al. Inhibition of tumorigenicity of cervical-cancer cells in nude mice by HPV 16 E6-E7 antisense RNA. Int J Cancer, 1992, 51:831-834.
2,McBride AA, Romanczuk H, Howley PM. The papillomavirus E2 regulatory proteins. J Biol Chem, 1991, 266:18411-18414.
, 百拇医药
3,Dong XP, Stubenrauch F, Beyer-Finkler E, et al. Prevalence of deletions of YY1-binding sites in episomal HPV 16 DNA from cervical cancers. Int J Cancer, 1994, 58:803-808.
4,May M, Dong XP, Beyer-Finkler E, et al. The E6-E7 promoter of extrachromosomal HPV 16 DNA in cervical cancers escapes from cellular repression by mutation of target sequences for YY1. EMBO J, 1994,13:1460-1466.
5,O'Connor MJ, Tan SH, Tan CH, et al. YY1 represses human papillomavirus type 16 transcription by quenching AP-1 activity. J Virol,1996,70:6529-6539.
, http://www.100md.com
6,董小平,刘红,Herbert Pfister. YY1抑制效应的破坏可促进HPV 16癌基因的转录.病毒学报,1999,15:125-129.
7,董小平,刘红,Herbert Pfister.人乳头瘤病毒16型长控制区域上YY1位点的缺失可增强病毒对小鼠纤维细胞的转化能力.中华实验和临床病毒学杂志,1999,13:5-8.
8 董小平,刘红,周伟.HPV 16 LCR上YY1结合位点的破坏可增强病毒诱导细胞永生化能力.病毒学报,1999,15:217-224.
9,Romanczuk H, Howley PM. Disruption of either the E1 or E2 regulatory gene of human papillomavirus type 16 increases viral immortalization capacity. Proc Natl Acad Sci USA, 1992,89:3159-3163.
, 百拇医药
10,Zur Hausen H. Human papillomavirus in the pathogenesis of anogenital cancer. Virology, 1991, 184:9-14.
11,Durst M, Gissmann L, Ikenberg H, et al. A papillomavirus DNA from a cervical carcinoma and its prevalence in cancer biopsy samples from different geographic regions. Proc Natl Acad Sci USA, 1983,80:3812-3814.
12,Giradi F, Pickel H, Beyer-Finckler E, et al. Specific rearrangement of human papillomavirus DNA provide molecular evidence for genetic heterogenicity of primary cancers, recurrences, and lymph-node metastases in 2 patients. Gynecol Oncol, 1993,51:281-286., 百拇医药