雌二醇对兔血管平滑肌细胞诱导型一氧化氮合酶的影响
雌二醇对兔血管平滑肌细胞诱导型一氧化氮合酶的影响
贾真 向农 孙明 周宏研 顾复生
摘 要 目的 通过测定兔血管平滑肌细胞(VSMC)一氧化氮(NO)产物及诱导型一氧化氮合酶(iNOS)mRNA的表达,验证雌二醇影响NO合成的机制。方法 测定细胞培养液中硝酸盐和亚硝酸盐含量作为培养兔血管平滑肌细胞NO产物的指标,用Northern杂交方法检测培养兔血管平滑肌细胞iNOS表达。结果 (1)雌二醇呈时间依赖关系(0~24 h, P<0.05)和剂量依赖关系(10-7~10-3 mol/L,P<0.01),增加白细胞介素-1β刺激的血管平滑肌细胞所致NO产物。(2)雌二醇的这种效应被NOS阻滞剂NG-单甲基-L-精氨酸(L-NMMA)阻滞。(3)雌二醇明显增加白细胞介素-1β刺激下的培养血管平滑肌细胞iNOS mRNA的表达(P<0.01)。结论 雌二醇通过激活白细胞介素-1β刺激下的培养血管平滑肌细胞的iNOS mRNA表达从而增加NO合成,提示雌激素抗动脉粥样硬化可能部分是通过NO增加而介导的。
, 百拇医药
关键词:雌二醇 一氧化氮 肌,平滑,血管
雌激素替代治疗明显减少冠状动脉损伤事件的发生,已有一系列潜在机制用来解释雌激素对冠状动脉的保护作用[1],其中一个保护机制是雌激素诱导一氧化氮(NO)释放增多[2]。
NO由NO合酶(NOS)催化L-精氨酸合成的。NO合酶有三种形式:Ⅰ型即神经原型NOS(nNOS);Ⅱ型即细胞因子刺激的诱导型NOS(iNOS);Ⅲ型即内皮源性结构型NOS(eNOS)。iNOS不仅在内毒素或(和)细胞因子处理的神经细胞、肝细胞、内皮细胞和心肌细胞中表达,且在内毒素或(和)细胞因子处理的主动脉环和培养的血管平滑肌细胞(VSMC)中表达[3]。雌二醇对血管内皮细胞的iNOS的作用已有报道[4],而对血管平滑肌细胞的保护作用研究较少, 故本研究通过雌二醇对兔血管平滑肌细胞iNOS mRNA表达和NO合成的影响,从而探讨雌二醇对血管平滑肌细胞保护作用的可能机制。
, 百拇医药
材料与方法
1.材料:雌二醇(E2)、 NG-单甲基-L-精氨酸(L-NMMA)购于美国Sigma公司,Trizal试剂盒由上海华美公司提供, Griess reagent 试剂盒购于中国军事科学院, 667 bp iNOS cDNA和GAPDH cDNA 由湖南医科大学附属第二医院向旭东博士提供, 重组人白细胞介素-1β(IL-1β)由湖南医科大学临床药理中心牛喜林博士提供,其余化学试剂均为国产分析纯。新西兰白兔(雄性,2.2~2.8 kg/只),由湖南医科大学动物室提供,动物实验经湖南医科大学动物管理办公室批准。
2.细胞培养:用1%乌拉坦麻醉新西兰白兔,在无菌条件下,取4~6 cm长胸主动脉,用加105 IU/L青霉素、10 g/L链霉素的Hank′s液清洗3次,去除内皮细胞,取中膜内层,剪成1 mm大小的碎片,用2~3 ml 0.1%的I型胶原酶消化4 h,离心(1 000 rpm) 7 min,去上清液,用Hank′s清洗2次,最后用含青霉素(105 IU/L)、链霉素(100 g/L)及20%小牛血清的199培养基(pH 7.2)稀释,放入50 ml细胞培养瓶培养,静置于37℃的CO2培养箱3天,待细胞呈放射形伸展、部分细胞长成单层和多层交错致密层后即可传代。用0.125%胰蛋白酶及0.2%EDTA消化细胞以1∶2分瓶接种,进行传代。取3~8代细胞进行实验。
, 百拇医药
3. NO测定: NO产物测定根据培养液中硝酸盐和亚硝酸盐含量来确定[5]。①分别用双蒸水、IL-1β(10 μg/L)和IL-1β(10 μg/L)+E2(10-4 mol/L)刺激细胞(n=6)24 h,于0、6、12、18、24 h测定细胞培养液中NO产物;②分别用E2及E2+IL-1β(10 μg/L) 刺激细胞(n=6)24 h,E2浓度从10-7 mol/L逐渐增加至10-3 mol/L,测定细胞培养液中NO产物;③用L-NMMA(1 mmol/L)预处理细胞(n=6) 2 h,再加用IL-1β(10 μg/L)及IL-1β (10 μg/L)+E2 (10-4 mol/L)预处理细胞24 h,测定培养液中NO产物。
4. Northern Blot杂交:按Traizal试剂盒说明书操作提取VSMC的总RNA。用随机引物法标记探针,按试剂盒说明书操作,将[a-32P]dATP分别标记于200 ng iNOS探针,将已标记的探针煮沸变性10 min,分别加入预杂交液中,密封杂交塑料袋后在杂交炉(42℃)杂交24 h。用X光片进行放射自显影,附加增感屏,-70℃曝光7天。用光密度扫描仪扫描X光片,以ODiNOS/ODGAPDH取值进行评价iNOS mRNA的表达。
, 百拇医药
5. 统计学方法: 数据用均数±标准误表示。用SPSS6.0软件进行统计学处理,采用方差分析及t检验等方法。
结果
1.白细胞介素-1β对血管平滑肌细胞NO产物的影响:雌二醇(10-4 mol/L)呈时间依赖关系增加白细胞介素-1β(10 μg/L)刺激下的血管平滑肌细胞产生NO产物。持续用雌二醇(10-4 mol/L)预处理血管平滑肌细胞, 白细胞介素-1β刺激的NO产物浓度明显增加(P<0.01),通过24 h的雌二醇预处理,白细胞介素-1β刺激细胞产生的NO产物是未经雌二醇处理的二倍(P<0.05)。见图1。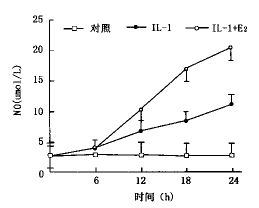
图1 E2刺激VSMC产生NO的时效关系
, 百拇医药
2.剂量依赖关系:随着雌二醇剂量加大(从10-7~10-4 mol/L),白细胞介素-1β刺激下的细胞产生的NO产物逐渐增加(P<0.01),当雌二醇剂量增加到10-3 mol/L时其效应亦不再升高,在无白细胞介素-1β刺激状况下,雌二醇本身并不明显增加NO产物。见图2。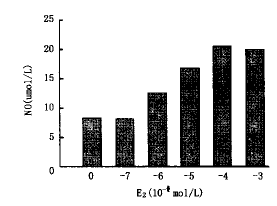
图2 E2刺激VSMC产生NO的量效关系
3.先用NO合酶阻滞剂L-NMMA(1 mmol/L)预处理细胞2 h,雌二醇(10-4 mol/L)和白细胞介素-1β(10 μg/L)的效应完全消失。见图3。
, 百拇医药 4.Northern 杂交:未处理及仅雌二醇处理的细胞iNOS mRNA无明显表达,通过白细胞介素-1β处理的细胞iNOS mRNA表达增强(P<0.05),而同时用白细胞介素-1β和雌二醇处理的细胞iNOS mRNA表达尤为明显(P<0.01)。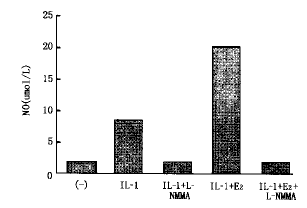
图3 L-NMMA阻滞E2刺激VSMC产生NO的效应
讨论
相对男性和绝经后妇女而言,雌激素降低了绝经前妇女动脉粥样硬化和冠心病事件发生率,虽雌激素的心血管保护作用已得到公认,但其心血管的保护作用机理仍不十分清楚。到目前为止已提出了血脂、凝血因子、血糖代谢、胰岛素的变化和动脉血压的下降等方面来解释雌激素诱导的心血管保护作用[1],但这些方面仍不能完全解释雌激素对心血管系统的正效应。许多研究支持这样一个观点[6,7]:雌激素诱导NO释放增加可能参与了心血管的保护作用,因为在心血管疾病中(如高血压病和动脉粥样硬化)伴随细胞因子增加(如IL-1β),而NO含量是低下的。NO对心血管有保护作用,如血管舒张,阻滞血小板粘附和转移,阻止血管平滑肌细胞增殖和迁移;从而证明NO是一个潜在的抗动脉粥样硬化和抗纤维化的因子。
, 百拇医药
本研究雌二醇影响血管平滑肌细胞NO合成的机理,表明雌二醇呈剂量依赖关系增加通过白细胞介素-1β诱导的血管平滑肌细胞的NO产物。当白细胞介素-1β预处理后加雌二醇处理数小时后雌二醇的刺激效应明显增加,而雌激素本身无效应。因而为雌二醇与NO产物之间存在因果关系提供了依据。
试验证明:性激素能调节NOS的活性,怀孕期动物以及通过雌二醇处理的非怀孕期雌性和雄性动物的骨骼肌中NOS mRNA表达明显增强[8,9]。目前大鼠iNOS基因已从巨噬细胞中克隆出来,而且在血管平滑肌细胞中发现iNOS, 相对而言,iNOS更易于被激活,干扰素-β(INF-β)和脂多糖(LPS)能迅速增加基因的表达,虽然NO通过iNOS合成慢于通过cNOS,但其合成却明显高于cNOS合成[10]。
本研究发现,雌二醇使白细胞介素-1β诱导的血管平滑肌细胞iNOS mRNA表达增加,表明iNOS增加可能是通过雌二醇介导的,故认为NOS活性增加是由于酶合成(诱导型酶)增加所致。本研究结果证明离体iNOS的激素调节影响了iNOS表达。正常情况下白细胞介素-1β并不增加,在高血压病和动脉粥样硬化等病理情况下明显增加,这样可促进雌激素发挥更有效的作用。NO可以在各种病理状态下从血管组织中产生,并且调节血管收缩性和血管组织的细胞增殖。本研究证明雌二醇可以通过细胞因子刺激血管平滑肌细胞增加NO产生,其机制之一,可能是增加其iNOS水平。
, 百拇医药
作者单位:贾真(100050 北京,首都医科大学附属北京友谊医院心内科)
顾复生(100050 北京,首都医科大学附属北京友谊医院心内科)
向农(湖南医科大学附属湘雅医院心内科)
孙明(湖南医科大学附属湘雅医院心内科)
周宏研(湖南医科大学附属湘雅医院心内科)
参考文献
1,Stamfer MJ, Colditz GA, Willett WC, et al. Post menopausal estrogen therapy and cardiovascular disease. N Engl J Med,1991, 325:756-762.
, http://www.100md.com
2,Imthurn B, Rosselli M, Jaeger AW, et al. Differential effects of hormone-replacement therapy on endogenous nitric oxide (nitrite/ nitrate) levels in postmenopausal women substituted with 17β- estradiol valerate and cyproterone acetateor medroxyprogesterone acetate. J Clin Endocrinol Metab, 1997, 82: 388-394.
3,Shindo T, Ikeda U, Ohkawa F, et al. Nitric oxide synthesis in rat cardiac myocytes and fibroblasts. Life Sci, 1994, 55:1101-1108.
, 百拇医药
4,Dinesman JL, Lowenstein CJ, Snyder SH. Molecular mechanisms of nitric oxide regulation. Circ Res, 1993, 73: 217-222.
5,贾真,孙明,顾复生,等. 绝经后妇女冠心病患者及正常妇女尼尔雌醇替代治疗的观察. 中华心血管病杂志,1999,27:346-349.
6,Dubey RK. Vasodilator-derived nitric oxide inhibits angiotension-Ⅱ and fetal calf serum-induced growth of arteriolar smooth muscle cells. J Pharmacol Exp Ther, 1994, 269: 402-408.
7,Reis SE, Gloth ST, Blumenthal RS, et al. Ethinyl estrogen acutely attenuates abnormal coronary vasmotor responses to acctylcholine in postmenipausal women. Circulation, 1994, 89:52-60.
, 百拇医药
8,Hammarstrom EM, Adolfsson J, Wilund NP, et al. Induction of calcium-dependent nitric oxide synthase by sex hormonrs in the guinea-pig urinary bladder. Acta Physiol Scand, 1995, 153: 393-394.
9,Weiner CP, Lizasoain I, Baylis SA, et al. Induction of calcium dependent nitric oxide synthase by sex hormones. Proc Natl Acad Sci U S A, 1994, 91:5212-5216.
10,Nathan C. Nitric oxide as a secretory production of mammalian cells. FASEB J, 1992, 6: 3051-3064., 百拇医药
贾真 向农 孙明 周宏研 顾复生
摘 要 目的 通过测定兔血管平滑肌细胞(VSMC)一氧化氮(NO)产物及诱导型一氧化氮合酶(iNOS)mRNA的表达,验证雌二醇影响NO合成的机制。方法 测定细胞培养液中硝酸盐和亚硝酸盐含量作为培养兔血管平滑肌细胞NO产物的指标,用Northern杂交方法检测培养兔血管平滑肌细胞iNOS表达。结果 (1)雌二醇呈时间依赖关系(0~24 h, P<0.05)和剂量依赖关系(10-7~10-3 mol/L,P<0.01),增加白细胞介素-1β刺激的血管平滑肌细胞所致NO产物。(2)雌二醇的这种效应被NOS阻滞剂NG-单甲基-L-精氨酸(L-NMMA)阻滞。(3)雌二醇明显增加白细胞介素-1β刺激下的培养血管平滑肌细胞iNOS mRNA的表达(P<0.01)。结论 雌二醇通过激活白细胞介素-1β刺激下的培养血管平滑肌细胞的iNOS mRNA表达从而增加NO合成,提示雌激素抗动脉粥样硬化可能部分是通过NO增加而介导的。
, 百拇医药
关键词:雌二醇 一氧化氮 肌,平滑,血管
雌激素替代治疗明显减少冠状动脉损伤事件的发生,已有一系列潜在机制用来解释雌激素对冠状动脉的保护作用[1],其中一个保护机制是雌激素诱导一氧化氮(NO)释放增多[2]。
NO由NO合酶(NOS)催化L-精氨酸合成的。NO合酶有三种形式:Ⅰ型即神经原型NOS(nNOS);Ⅱ型即细胞因子刺激的诱导型NOS(iNOS);Ⅲ型即内皮源性结构型NOS(eNOS)。iNOS不仅在内毒素或(和)细胞因子处理的神经细胞、肝细胞、内皮细胞和心肌细胞中表达,且在内毒素或(和)细胞因子处理的主动脉环和培养的血管平滑肌细胞(VSMC)中表达[3]。雌二醇对血管内皮细胞的iNOS的作用已有报道[4],而对血管平滑肌细胞的保护作用研究较少, 故本研究通过雌二醇对兔血管平滑肌细胞iNOS mRNA表达和NO合成的影响,从而探讨雌二醇对血管平滑肌细胞保护作用的可能机制。
, 百拇医药
材料与方法
1.材料:雌二醇(E2)、 NG-单甲基-L-精氨酸(L-NMMA)购于美国Sigma公司,Trizal试剂盒由上海华美公司提供, Griess reagent 试剂盒购于中国军事科学院, 667 bp iNOS cDNA和GAPDH cDNA 由湖南医科大学附属第二医院向旭东博士提供, 重组人白细胞介素-1β(IL-1β)由湖南医科大学临床药理中心牛喜林博士提供,其余化学试剂均为国产分析纯。新西兰白兔(雄性,2.2~2.8 kg/只),由湖南医科大学动物室提供,动物实验经湖南医科大学动物管理办公室批准。
2.细胞培养:用1%乌拉坦麻醉新西兰白兔,在无菌条件下,取4~6 cm长胸主动脉,用加105 IU/L青霉素、10 g/L链霉素的Hank′s液清洗3次,去除内皮细胞,取中膜内层,剪成1 mm大小的碎片,用2~3 ml 0.1%的I型胶原酶消化4 h,离心(1 000 rpm) 7 min,去上清液,用Hank′s清洗2次,最后用含青霉素(105 IU/L)、链霉素(100 g/L)及20%小牛血清的199培养基(pH 7.2)稀释,放入50 ml细胞培养瓶培养,静置于37℃的CO2培养箱3天,待细胞呈放射形伸展、部分细胞长成单层和多层交错致密层后即可传代。用0.125%胰蛋白酶及0.2%EDTA消化细胞以1∶2分瓶接种,进行传代。取3~8代细胞进行实验。
, 百拇医药
3. NO测定: NO产物测定根据培养液中硝酸盐和亚硝酸盐含量来确定[5]。①分别用双蒸水、IL-1β(10 μg/L)和IL-1β(10 μg/L)+E2(10-4 mol/L)刺激细胞(n=6)24 h,于0、6、12、18、24 h测定细胞培养液中NO产物;②分别用E2及E2+IL-1β(10 μg/L) 刺激细胞(n=6)24 h,E2浓度从10-7 mol/L逐渐增加至10-3 mol/L,测定细胞培养液中NO产物;③用L-NMMA(1 mmol/L)预处理细胞(n=6) 2 h,再加用IL-1β(10 μg/L)及IL-1β (10 μg/L)+E2 (10-4 mol/L)预处理细胞24 h,测定培养液中NO产物。
4. Northern Blot杂交:按Traizal试剂盒说明书操作提取VSMC的总RNA。用随机引物法标记探针,按试剂盒说明书操作,将[a-32P]dATP分别标记于200 ng iNOS探针,将已标记的探针煮沸变性10 min,分别加入预杂交液中,密封杂交塑料袋后在杂交炉(42℃)杂交24 h。用X光片进行放射自显影,附加增感屏,-70℃曝光7天。用光密度扫描仪扫描X光片,以ODiNOS/ODGAPDH取值进行评价iNOS mRNA的表达。
, 百拇医药
5. 统计学方法: 数据用均数±标准误表示。用SPSS6.0软件进行统计学处理,采用方差分析及t检验等方法。
结果
1.白细胞介素-1β对血管平滑肌细胞NO产物的影响:雌二醇(10-4 mol/L)呈时间依赖关系增加白细胞介素-1β(10 μg/L)刺激下的血管平滑肌细胞产生NO产物。持续用雌二醇(10-4 mol/L)预处理血管平滑肌细胞, 白细胞介素-1β刺激的NO产物浓度明显增加(P<0.01),通过24 h的雌二醇预处理,白细胞介素-1β刺激细胞产生的NO产物是未经雌二醇处理的二倍(P<0.05)。见图1。

图1 E2刺激VSMC产生NO的时效关系
, 百拇医药
2.剂量依赖关系:随着雌二醇剂量加大(从10-7~10-4 mol/L),白细胞介素-1β刺激下的细胞产生的NO产物逐渐增加(P<0.01),当雌二醇剂量增加到10-3 mol/L时其效应亦不再升高,在无白细胞介素-1β刺激状况下,雌二醇本身并不明显增加NO产物。见图2。

图2 E2刺激VSMC产生NO的量效关系
3.先用NO合酶阻滞剂L-NMMA(1 mmol/L)预处理细胞2 h,雌二醇(10-4 mol/L)和白细胞介素-1β(10 μg/L)的效应完全消失。见图3。
, 百拇医药 4.Northern 杂交:未处理及仅雌二醇处理的细胞iNOS mRNA无明显表达,通过白细胞介素-1β处理的细胞iNOS mRNA表达增强(P<0.05),而同时用白细胞介素-1β和雌二醇处理的细胞iNOS mRNA表达尤为明显(P<0.01)。

图3 L-NMMA阻滞E2刺激VSMC产生NO的效应
讨论
相对男性和绝经后妇女而言,雌激素降低了绝经前妇女动脉粥样硬化和冠心病事件发生率,虽雌激素的心血管保护作用已得到公认,但其心血管的保护作用机理仍不十分清楚。到目前为止已提出了血脂、凝血因子、血糖代谢、胰岛素的变化和动脉血压的下降等方面来解释雌激素诱导的心血管保护作用[1],但这些方面仍不能完全解释雌激素对心血管系统的正效应。许多研究支持这样一个观点[6,7]:雌激素诱导NO释放增加可能参与了心血管的保护作用,因为在心血管疾病中(如高血压病和动脉粥样硬化)伴随细胞因子增加(如IL-1β),而NO含量是低下的。NO对心血管有保护作用,如血管舒张,阻滞血小板粘附和转移,阻止血管平滑肌细胞增殖和迁移;从而证明NO是一个潜在的抗动脉粥样硬化和抗纤维化的因子。
, 百拇医药
本研究雌二醇影响血管平滑肌细胞NO合成的机理,表明雌二醇呈剂量依赖关系增加通过白细胞介素-1β诱导的血管平滑肌细胞的NO产物。当白细胞介素-1β预处理后加雌二醇处理数小时后雌二醇的刺激效应明显增加,而雌激素本身无效应。因而为雌二醇与NO产物之间存在因果关系提供了依据。
试验证明:性激素能调节NOS的活性,怀孕期动物以及通过雌二醇处理的非怀孕期雌性和雄性动物的骨骼肌中NOS mRNA表达明显增强[8,9]。目前大鼠iNOS基因已从巨噬细胞中克隆出来,而且在血管平滑肌细胞中发现iNOS, 相对而言,iNOS更易于被激活,干扰素-β(INF-β)和脂多糖(LPS)能迅速增加基因的表达,虽然NO通过iNOS合成慢于通过cNOS,但其合成却明显高于cNOS合成[10]。
本研究发现,雌二醇使白细胞介素-1β诱导的血管平滑肌细胞iNOS mRNA表达增加,表明iNOS增加可能是通过雌二醇介导的,故认为NOS活性增加是由于酶合成(诱导型酶)增加所致。本研究结果证明离体iNOS的激素调节影响了iNOS表达。正常情况下白细胞介素-1β并不增加,在高血压病和动脉粥样硬化等病理情况下明显增加,这样可促进雌激素发挥更有效的作用。NO可以在各种病理状态下从血管组织中产生,并且调节血管收缩性和血管组织的细胞增殖。本研究证明雌二醇可以通过细胞因子刺激血管平滑肌细胞增加NO产生,其机制之一,可能是增加其iNOS水平。
, 百拇医药
作者单位:贾真(100050 北京,首都医科大学附属北京友谊医院心内科)
顾复生(100050 北京,首都医科大学附属北京友谊医院心内科)
向农(湖南医科大学附属湘雅医院心内科)
孙明(湖南医科大学附属湘雅医院心内科)
周宏研(湖南医科大学附属湘雅医院心内科)
参考文献
1,Stamfer MJ, Colditz GA, Willett WC, et al. Post menopausal estrogen therapy and cardiovascular disease. N Engl J Med,1991, 325:756-762.
, http://www.100md.com
2,Imthurn B, Rosselli M, Jaeger AW, et al. Differential effects of hormone-replacement therapy on endogenous nitric oxide (nitrite/ nitrate) levels in postmenopausal women substituted with 17β- estradiol valerate and cyproterone acetateor medroxyprogesterone acetate. J Clin Endocrinol Metab, 1997, 82: 388-394.
3,Shindo T, Ikeda U, Ohkawa F, et al. Nitric oxide synthesis in rat cardiac myocytes and fibroblasts. Life Sci, 1994, 55:1101-1108.
, 百拇医药
4,Dinesman JL, Lowenstein CJ, Snyder SH. Molecular mechanisms of nitric oxide regulation. Circ Res, 1993, 73: 217-222.
5,贾真,孙明,顾复生,等. 绝经后妇女冠心病患者及正常妇女尼尔雌醇替代治疗的观察. 中华心血管病杂志,1999,27:346-349.
6,Dubey RK. Vasodilator-derived nitric oxide inhibits angiotension-Ⅱ and fetal calf serum-induced growth of arteriolar smooth muscle cells. J Pharmacol Exp Ther, 1994, 269: 402-408.
7,Reis SE, Gloth ST, Blumenthal RS, et al. Ethinyl estrogen acutely attenuates abnormal coronary vasmotor responses to acctylcholine in postmenipausal women. Circulation, 1994, 89:52-60.
, 百拇医药
8,Hammarstrom EM, Adolfsson J, Wilund NP, et al. Induction of calcium-dependent nitric oxide synthase by sex hormonrs in the guinea-pig urinary bladder. Acta Physiol Scand, 1995, 153: 393-394.
9,Weiner CP, Lizasoain I, Baylis SA, et al. Induction of calcium dependent nitric oxide synthase by sex hormones. Proc Natl Acad Sci U S A, 1994, 91:5212-5216.
10,Nathan C. Nitric oxide as a secretory production of mammalian cells. FASEB J, 1992, 6: 3051-3064., 百拇医药