基因转移人TGF-β1在NIH/3T3细胞中表达鉴定
基因转移人TGF-β1在NIH/3T3细胞中表达鉴定
李勇 韩本立 王会信 龙建银 李昆
摘 要 目的:基因转移人转化生长因子β1(TGF-β1)在真核细胞系中蛋白表达。方法:借助真核质粒表达载体,将人TGF-β1转移入小鼠成纤维细胞株(NIH/3T3)细胞中,经G418筛选,克隆扩增,Southernblot、Northernblot、PCR、RT-PCR鉴定,并经水貂肺上皮细胞(CCL-64)生长抑制法,对克隆细胞分泌TGF-β1蛋白进行活性检测。结果:证实了重组人TGF-β1基因在NIH/3T3细胞基因组中的稳定重组和mRNA水平的表达,TGF-β1蛋白活性检测及流式细胞仪免疫荧光测定结果,均证实了克隆细胞表达并分泌TGF-β1蛋白。结论:通过基因转移方法成功地在NIH/3T3细胞中重组并表达人TGF-β1蛋白,PCR结果还提示NIH/3T3细胞系基因组中无人TGF-β1序列存在。
, http://www.100md.com
关键词:转化生长因子β1;重组;载体;成纤维细胞株
转化生长因子(Transforming growth factor,TGF-β1)因其功能的特异性而被广泛用于基础和临床研究[1]。天然TGF-β1自动物血小板中提取,其含量甚微,来源有限,有必要利用基因工程技术重组其蛋白[2]。本研究借助真核质粒表达载体PMAM,将人TGF-β1基因转移入小鼠成纤维细胞株(NIH/3T3)细胞系中,并对克隆细胞及对照组进行了分子生物学鉴定,现报道如下。
1 材料与方法
1.1 菌种和质粒
大肠杆菌JM109本室保存,真核质粒表达载体购自Promega公司,含有人TGF-β1,全长编码区cDNA重组质粒PMAMneoTGF-β1本室自制[3];β-半乳糖酐酶真核质粒表达载体PSV-β1购自Promega公司。
, http://www.100md.com
1.2 细胞株
NIH/3T3系美国NIH研究所原株引进,选择DMEM培养基添加10%小牛血清培养,水貂肺上皮细胞株(CCL-64),引自美国ATCC细胞保藏中心,选择RPMI1640培养基添加10%小牛血清培养。以上两株细胞均为本室冻存。
1.3 工具酶和主要试剂
工具酶均购自Sigma公司,X-Gal,NP-40和G418为Sigma产品,人TGF-β1标准品购自Promega公司,DMEM和RPMI1640培养基为GIBCO产品,兔抗人TGF-β1多抗LC(1-30-1),美国Bethesda州立肿瘤研究所Sporn博士惠赠。脂质体转染试剂盒(Lipofectin)和磷酸钙-DNA转染试剂盒购自GIBCO公司,PCR和RT-PCR反转录试剂盒购于德国BM公司,直接酶标-化学发光自显影分子杂交试剂盒为Amersham产品。
, http://www.100md.com
1.4 重组表达载体构建及鉴定
PTGF-β1cDNA质粒经XhoI和NcoI双酶切,琼脂糖凝胶电泳回收1.35kb目的片段,补平缺口,将其连接于PMAMNheI酶切点,然后转化受体菌JM109,经氨苄和X-Gal互补筛选,获得阳性菌落,提取质粒酶切鉴定分析,得到TGF-β1正、反义质粒表达载体。
1.5 基因转移及克隆筛选
依据报告基因β-半乳糖酐酶基因在NIH/3T3细胞中转移后表达比较,选取高转染率脂质体基因转移方法,按照脂质体∶质粒为6.4∶1混合后加入待转NIH/3T3(对数生长中期)细胞中,置37℃,5%CO2孵育5~8h,换含10%小牛血清正常DMEM培养液,稳定培养48h后,选用G418(450μg/ml)培养液进行细胞传代,每3~4d换1次培养液,约2周克隆形成,分别单个克隆扩增。
, http://www.100md.com
1.6 克隆细胞TGF-β1蛋白检测和活性测定
参照文献[4]方法将克隆细胞上清液经酸化处理后进行了TGF-β1活性测定;同时对高分泌克隆及对照组细胞进行了免疫标记流式细胞仪测定,LC(1-30-1)(1∶10000),IgG-FITC(1∶10),进一步证实克隆高表达人TGF-β1。
1.7 基因转移分子生物学鉴定
选择高表达正义克隆,反义克隆及正常NIH/3T3细胞扩增培养作为对照组,细胞生长至对数生长期进行计数,参照文献[5]进行如下实验。
1.7.1 抽提细胞总DNA,用于Southernblot检测(酶标-化学发生自显影法)。
1.7.2 抽提细胞总mRNA(30μg)用于Northenblot检测(酶标-化学发生自显影法)。
, 百拇医药
1.7.3 抽提细胞总DNA,PCR扩增,其作用细胞为:
正向引物5′-GGAATTCATGGCCCTGGACACCAACTA-3′
负向引物5′-TTATCAGCTGCACTTGCAGG-3′
依引物设计,PCR扩增片段长度应是360bp。
1.7.4 抽提细胞总mRNA,反转录合成cDNA,继续PCR扩增,引物如上,反应条件不变。
PCR、RT-PCR产物于1.5%琼脂糖凝胶电泳。EB染色,紫外灯下观察结果并拍照记录。
2 结果
2.1 重组表达载体酶切鉴定
, http://www.100md.com
将重组质粒转化菌株小量培养,碱裂解法提取质粒DNA后进行酶切,琼脂糖凝胶电泳,结果表明,酶切片段符合质粒载体酶切分子量理论值,说明目的片段定向克隆于质粒载体中。
2.2 克隆筛选及分泌人TGF-β1活性测定
在已形成的众多正义载体克隆中,采用小滤纸片胰酶定点消化法,随机挑选13个克隆,分别进行扩增,并对每个克隆定量测定上清液TGF-β1分泌量,正常NIH/3T3及空载体转染(NIH/3T30)、反义载体转染(NIH/3T3-阴性)克隆用于对照,见表1。
表1 不同克隆间分泌TGF-β1水平比较
Tab1 Comparison of TGF-β1 levels secreted by different clons
, http://www.100md.com
Clone No.
Bq
TGF-β1*(ng.ml-1.48h-1)
NIH/3T3
3.056
38.2
NIH/3T30
3.007
45.1
NIH/3T3-
, 百拇医药
3.083
34.5
NIH3T01+
2.538
110.5
NIH3T02+
2.454
122.3
NIH3T03+**
2.206
156.8
NIH3T04+
, 百拇医药
2.612
100.2
NIH3T05+
2.397
130.2
NIH3T06+
2.653
94.4
NIH3T07+
2.297
144.1
NIH3T08+
, 百拇医药 2.768
78.4
NIH3T09+
2.470
120.0
NIH3T10+
2.502
115.5
NIH3T11+
2.626
98.2
NIH3T12+
2.612
, http://www.100md.com
100.3
NIH3513+
2.390
131.2
*:More than 100 ng.ml-1.48h-1 were secreted by the most clones;**:Highest level of secretion
2.3 克隆细胞TGF-β1蛋白表达FCM测定
用间接免疫标记法,经FCM所测每1万个细胞荧光强度均值和标记率为一组,统计学处理后比较,见TGF-β1,阳性克隆荧光强度和标记率较对照组明显增强(P<0.001),提示其TGF-β1蛋白表达量增加,而反义TGF-β1组TGF-β1表达减弱,正义、反义两组间差异非常显著(P<0.001),见表2,图1。
, http://www.100md.com
表2 不同转移基因细胞TGF-β1表达比较
Tab2 Comparison of TGF-β1 expression in different clones
NIH/3T3
NIH/3T3+
NIH/3T3-
MF1
66.50±2.258
75.33±4.926**△
63.33±1.367*
, 百拇医药
Tot%
23.37±2.246
32.77±2.370**△
16.67±1.283**
MFI:Mean fluorescence intensity;Tot%: Total precentage of the positive cells;*:P<0.05,**:P<0.01 vs NIH/3T3;△:P<0.001 vs NIH/3T3-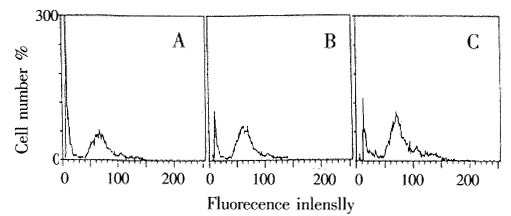
图1 FCM检测不同组细胞TGF-β1表达比较
, 百拇医药
Fig1 Comparison of TGF-β1 expression in different
clones by FCM
A:NIH/3T3-;B:NIH/3T3;C:NIH/3T3+
2.4 基因转移的分子生物学鉴定
2.4.1 Southernblot结果 转移有人TGF-β1正义和反义基因的克隆细胞组DNA在分子量大约6.0kb和2.4kb处有明显杂交带,而对照组均为阴性,阳性杂交带分子量与质粒表达载体中BamHI酶切点间片断长度一致,说明了外源TGF-β1基因已稳定整合入克隆细胞基因组中。
2.4.2 Northernblot结果 在转移有人TGF-β1正义和反义基因的克隆细胞总mRNA中,杂交出2.8kb的阳性杂交带,对照各组均为阴性,见图2。杂交带恰好与克隆表达载体的PMAMneoTGF-β1质粒的5′MMTV-LTR至插入片断另一端之间的长度相一致,故可以认为此条带为表达的外源人TGF-β1,但图像处理结果显示了正义杂交带比反义杂带强1.9倍。提示反义转录的mRNA有部分消耗,这可能与NIH/3T3细胞自身存在的鼠TGF-β1有关。
, http://www.100md.com
图2 对照和转染细胞mRNA Northern blot杂交分析
Fig2 Northern blot hybridization analysis of the
NIH/3T3 and transfection cells lines
A:Marker; B:3T3-; C:3T3+; D:3T3
2.4.3 PCR与RT-PCR NIH/3T3+、NIH/3T3-正反义克隆中分别扩增出相同长度的片断360bp,见图3、4,与人TGF-β1引物设计目的片段长度一致,可以认为在上述两组细胞基因组DNA及转录出胞核的mRNA中,分别含有重组的人TGF-β1正义和反义序列,说明了外源TGF-β1基因已整合入NIH/3T3靶细胞基因组中并被转录,且基因的重组没有造成人TGF-β1基因的缺失断裂或突变。对照组PCR、RT-PCR均为阳性,说明了动物品系NIH/3T3细胞基因组中不含有人TGF-β1基因序列。

, 百拇医药
图3 PCR检测对照和转染细胞TGF-β1 DNA
Fig3 DNA analysis of the NIH/3T3 and transfection
cell lines by PCR
A:Marker; B:3T3; C:3T3-; D:3T3+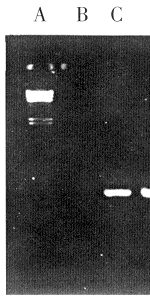
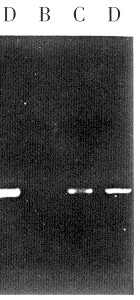
图4 RT-PCR检测对照和转染细胞TGF-β1mRNA
, 百拇医药
Fig4 mRNA analysis of the NIH/3T3 and transfection
cell lines by RT-PCR
A:Marker; B:3T3; C:3T3-; D:3T3+
3 讨论
TGF-β1活性的维持有赖于严格的翻译后加工修饰,特别是双体分子的形成[6],原核表达系统是无法达到的,理想的重组人TGF-β1方案是真核细胞表达系统,此点已取得国内外学者共识。目前,国内仅有龙建银等[3]作了真核细胞(COS-7)内TGF-β1短暂表达研究,尚无人TGF-β1重组成功的报道。
成纤维细胞株作为载体细胞有许多优点[7],如易获取和体外扩增;易受外源基因的转染并能稳定地表达外源基因;携带外源性基因后仍能稳定地植回体内并表达分泌;回植的成纤维细胞很容易被取出;成纤维细胞致瘤性低,相对其它细胞安全等。基于已有的实验条件和经验,我们选择了脂质体介导方法转移人TGF-β1基因至NIH/3T3靶细胞内,目前已有数十种疾病相关基因和细胞因子基因转移以成纤维细胞作为靶细胞。因此,以NIH/3T3为靶细胞重组人TGF-β1,是今后开展TGF-β1体内表达研究的基础工作。
, 百拇医药
我们所开展的分子生物学鉴定工作证明了人TGF-β1基因随机整合NIH/3T3细胞基因组DNA中的稳定性和mRNA转录的完整性,结果同时还进一步证明了动物品系小鼠成纤维细胞NIH/3T3基因中不存在人TGF-β1基因序列,这就为在NIH/3T3细胞中重组人TGF-β1,提供了安全保障。文献[1]报道,人、鼠TGF-β1有相当高的同源性,本研究固相杂交中对照组阴性结果可能与内源TGF-β1基因通过BamHI酶切后,产生大小不同的碱基片段,导致与探针同源互补率更低,经不起严格的洗脱条件,致使杂交信号丢失有关[8]。Northern杂交结果显示正义比反义杂交带强,提示反义转录mRNA有部分消耗的事实也客观说明了NIH/3T3细胞基因组中存在一定量的鼠TGF-β1,且与人TGF-β1有部分同源性。
免疫标记流式细胞仪检测法,是检测细胞表达分泌蛋白最为灵敏的方法之一,本研究采用间接免疫标记法,结合统计学处理,比较客观反映了克隆重组人TGF-β1在靶细胞NIH/3T3中的有效表达,此结果与CCL-64细胞生长抑制法所测克隆细胞上清液TGF-β1蛋白活性结果完全一致,更进一步证明了克隆表达TGF-β1蛋白的事实。
, http://www.100md.com
TBF-β1功能广泛,它参与了胚胎的发育、损伤组织的修复、肿瘤的发生以及免疫系统自稳定和负调节作用[9];它在调控间质细胞分化、创伤愈合、肌肉、神经、骨骼、肝脏等组织器官的损伤修复方面具有较好的临床应用前景[10]。因此,我们克隆表达rhTGF-β1为进一步生产开发其重组产品及应用于基础和临床研究提供了资料。
作者简介:李勇(1966.3),男,河南省永城市人,博士,主治医师,讲师,主要从事移植免疫耐受方面的研究,发表论文7篇。电话:(023)68773110
李勇(第三军医大学附属西南医院肝胆外科中心,重庆 400038)
韩本立(第三军医大学附属西南医院肝胆外科中心,重庆 400038)
王会信(军事医学科学院基础医学研究所,北京 100850)
, http://www.100md.com
龙建银(军事医学科学院基础医学研究所,北京 100850)
李昆(第三军医大学附属西南医院肝胆外科中心,重庆 400038)
参考文献
[1]Roberts A B,Sporn M B.The transforming growth factor-beta[A].In:Sporn M B ed.Peptide growth factors and their receptors[M].Berlin:Springer-Verlag,1990.417-419.
[2]Assoian R K.Purification of type-B transforming growth factor from human platelets[J].Methods Enzymol,1987,146(13):153.
, 百拇医药
[3]龙建银,王会信,张宏权,等.人转化生长因子β1cDNA在COS-7细胞中的表达[J].生物化学杂志,1995,11(4):396-397.
[4]李勇,韩本立,李昆,等.细胞生长抑制测定TGF-β1生物活性[J].第三军医大学学报,1998,21(2):138-140.
[5]金冬雁,黎孟枫.分子克隆实验指南[M].第2版.北京:科学出版社,1993.350-353.
[6]Romeo D S,Park K,Roberts A B,et al.An element of the TGF-β1 5′ -untranslated region represses translation and specifically binds a cytosolic factor[J].Mol Endocrinol,1993,7(6):759-761.
, 百拇医药
[7]曹雪涛,章卫平,陈国友.肿瘤基因治疗的受体细胞研究进展[J].国外医学:肿瘤学分册,1995,28(2):174-175.
[8]从笑倩,夏顺汉,徐露霞,等.外源TGF-β1基因在小鼠Es细胞中的表达及其对细胞分化的影响[J].实验生物学报,1995,28(2):174-176.
[9]Border W A,Ruoslahti E.TGF-β1 in disease:the dark side of tissue repair[J].J Clin Invest,1992,90(1):1-3.
[10]Rowe P M.Clinical potential for TGF-β1[J].Lancet,1994,344(8915):72-74., 百拇医药
李勇 韩本立 王会信 龙建银 李昆
摘 要 目的:基因转移人转化生长因子β1(TGF-β1)在真核细胞系中蛋白表达。方法:借助真核质粒表达载体,将人TGF-β1转移入小鼠成纤维细胞株(NIH/3T3)细胞中,经G418筛选,克隆扩增,Southernblot、Northernblot、PCR、RT-PCR鉴定,并经水貂肺上皮细胞(CCL-64)生长抑制法,对克隆细胞分泌TGF-β1蛋白进行活性检测。结果:证实了重组人TGF-β1基因在NIH/3T3细胞基因组中的稳定重组和mRNA水平的表达,TGF-β1蛋白活性检测及流式细胞仪免疫荧光测定结果,均证实了克隆细胞表达并分泌TGF-β1蛋白。结论:通过基因转移方法成功地在NIH/3T3细胞中重组并表达人TGF-β1蛋白,PCR结果还提示NIH/3T3细胞系基因组中无人TGF-β1序列存在。
, http://www.100md.com
关键词:转化生长因子β1;重组;载体;成纤维细胞株
转化生长因子(Transforming growth factor,TGF-β1)因其功能的特异性而被广泛用于基础和临床研究[1]。天然TGF-β1自动物血小板中提取,其含量甚微,来源有限,有必要利用基因工程技术重组其蛋白[2]。本研究借助真核质粒表达载体PMAM,将人TGF-β1基因转移入小鼠成纤维细胞株(NIH/3T3)细胞系中,并对克隆细胞及对照组进行了分子生物学鉴定,现报道如下。
1 材料与方法
1.1 菌种和质粒
大肠杆菌JM109本室保存,真核质粒表达载体购自Promega公司,含有人TGF-β1,全长编码区cDNA重组质粒PMAMneoTGF-β1本室自制[3];β-半乳糖酐酶真核质粒表达载体PSV-β1购自Promega公司。
, http://www.100md.com
1.2 细胞株
NIH/3T3系美国NIH研究所原株引进,选择DMEM培养基添加10%小牛血清培养,水貂肺上皮细胞株(CCL-64),引自美国ATCC细胞保藏中心,选择RPMI1640培养基添加10%小牛血清培养。以上两株细胞均为本室冻存。
1.3 工具酶和主要试剂
工具酶均购自Sigma公司,X-Gal,NP-40和G418为Sigma产品,人TGF-β1标准品购自Promega公司,DMEM和RPMI1640培养基为GIBCO产品,兔抗人TGF-β1多抗LC(1-30-1),美国Bethesda州立肿瘤研究所Sporn博士惠赠。脂质体转染试剂盒(Lipofectin)和磷酸钙-DNA转染试剂盒购自GIBCO公司,PCR和RT-PCR反转录试剂盒购于德国BM公司,直接酶标-化学发光自显影分子杂交试剂盒为Amersham产品。
, http://www.100md.com
1.4 重组表达载体构建及鉴定
PTGF-β1cDNA质粒经XhoI和NcoI双酶切,琼脂糖凝胶电泳回收1.35kb目的片段,补平缺口,将其连接于PMAMNheI酶切点,然后转化受体菌JM109,经氨苄和X-Gal互补筛选,获得阳性菌落,提取质粒酶切鉴定分析,得到TGF-β1正、反义质粒表达载体。
1.5 基因转移及克隆筛选
依据报告基因β-半乳糖酐酶基因在NIH/3T3细胞中转移后表达比较,选取高转染率脂质体基因转移方法,按照脂质体∶质粒为6.4∶1混合后加入待转NIH/3T3(对数生长中期)细胞中,置37℃,5%CO2孵育5~8h,换含10%小牛血清正常DMEM培养液,稳定培养48h后,选用G418(450μg/ml)培养液进行细胞传代,每3~4d换1次培养液,约2周克隆形成,分别单个克隆扩增。
, http://www.100md.com
1.6 克隆细胞TGF-β1蛋白检测和活性测定
参照文献[4]方法将克隆细胞上清液经酸化处理后进行了TGF-β1活性测定;同时对高分泌克隆及对照组细胞进行了免疫标记流式细胞仪测定,LC(1-30-1)(1∶10000),IgG-FITC(1∶10),进一步证实克隆高表达人TGF-β1。
1.7 基因转移分子生物学鉴定
选择高表达正义克隆,反义克隆及正常NIH/3T3细胞扩增培养作为对照组,细胞生长至对数生长期进行计数,参照文献[5]进行如下实验。
1.7.1 抽提细胞总DNA,用于Southernblot检测(酶标-化学发生自显影法)。
1.7.2 抽提细胞总mRNA(30μg)用于Northenblot检测(酶标-化学发生自显影法)。
, 百拇医药
1.7.3 抽提细胞总DNA,PCR扩增,其作用细胞为:
正向引物5′-GGAATTCATGGCCCTGGACACCAACTA-3′
负向引物5′-TTATCAGCTGCACTTGCAGG-3′
依引物设计,PCR扩增片段长度应是360bp。
1.7.4 抽提细胞总mRNA,反转录合成cDNA,继续PCR扩增,引物如上,反应条件不变。
PCR、RT-PCR产物于1.5%琼脂糖凝胶电泳。EB染色,紫外灯下观察结果并拍照记录。
2 结果
2.1 重组表达载体酶切鉴定
, http://www.100md.com
将重组质粒转化菌株小量培养,碱裂解法提取质粒DNA后进行酶切,琼脂糖凝胶电泳,结果表明,酶切片段符合质粒载体酶切分子量理论值,说明目的片段定向克隆于质粒载体中。
2.2 克隆筛选及分泌人TGF-β1活性测定
在已形成的众多正义载体克隆中,采用小滤纸片胰酶定点消化法,随机挑选13个克隆,分别进行扩增,并对每个克隆定量测定上清液TGF-β1分泌量,正常NIH/3T3及空载体转染(NIH/3T30)、反义载体转染(NIH/3T3-阴性)克隆用于对照,见表1。
表1 不同克隆间分泌TGF-β1水平比较
Tab1 Comparison of TGF-β1 levels secreted by different clons
, http://www.100md.com
Clone No.
Bq
TGF-β1*(ng.ml-1.48h-1)
NIH/3T3
3.056
38.2
NIH/3T30
3.007
45.1
NIH/3T3-
, 百拇医药
3.083
34.5
NIH3T01+
2.538
110.5
NIH3T02+
2.454
122.3
NIH3T03+**
2.206
156.8
NIH3T04+
, 百拇医药
2.612
100.2
NIH3T05+
2.397
130.2
NIH3T06+
2.653
94.4
NIH3T07+
2.297
144.1
NIH3T08+
, 百拇医药 2.768
78.4
NIH3T09+
2.470
120.0
NIH3T10+
2.502
115.5
NIH3T11+
2.626
98.2
NIH3T12+
2.612
, http://www.100md.com
100.3
NIH3513+
2.390
131.2
*:More than 100 ng.ml-1.48h-1 were secreted by the most clones;**:Highest level of secretion
2.3 克隆细胞TGF-β1蛋白表达FCM测定
用间接免疫标记法,经FCM所测每1万个细胞荧光强度均值和标记率为一组,统计学处理后比较,见TGF-β1,阳性克隆荧光强度和标记率较对照组明显增强(P<0.001),提示其TGF-β1蛋白表达量增加,而反义TGF-β1组TGF-β1表达减弱,正义、反义两组间差异非常显著(P<0.001),见表2,图1。
, http://www.100md.com
表2 不同转移基因细胞TGF-β1表达比较
Tab2 Comparison of TGF-β1 expression in different clones
NIH/3T3
NIH/3T3+
NIH/3T3-
MF1
66.50±2.258
75.33±4.926**△
63.33±1.367*
, 百拇医药
Tot%
23.37±2.246
32.77±2.370**△
16.67±1.283**
MFI:Mean fluorescence intensity;Tot%: Total precentage of the positive cells;*:P<0.05,**:P<0.01 vs NIH/3T3;△:P<0.001 vs NIH/3T3-

图1 FCM检测不同组细胞TGF-β1表达比较
, 百拇医药
Fig1 Comparison of TGF-β1 expression in different
clones by FCM
A:NIH/3T3-;B:NIH/3T3;C:NIH/3T3+
2.4 基因转移的分子生物学鉴定
2.4.1 Southernblot结果 转移有人TGF-β1正义和反义基因的克隆细胞组DNA在分子量大约6.0kb和2.4kb处有明显杂交带,而对照组均为阴性,阳性杂交带分子量与质粒表达载体中BamHI酶切点间片断长度一致,说明了外源TGF-β1基因已稳定整合入克隆细胞基因组中。
2.4.2 Northernblot结果 在转移有人TGF-β1正义和反义基因的克隆细胞总mRNA中,杂交出2.8kb的阳性杂交带,对照各组均为阴性,见图2。杂交带恰好与克隆表达载体的PMAMneoTGF-β1质粒的5′MMTV-LTR至插入片断另一端之间的长度相一致,故可以认为此条带为表达的外源人TGF-β1,但图像处理结果显示了正义杂交带比反义杂带强1.9倍。提示反义转录的mRNA有部分消耗,这可能与NIH/3T3细胞自身存在的鼠TGF-β1有关。

, http://www.100md.com
图2 对照和转染细胞mRNA Northern blot杂交分析
Fig2 Northern blot hybridization analysis of the
NIH/3T3 and transfection cells lines
A:Marker; B:3T3-; C:3T3+; D:3T3
2.4.3 PCR与RT-PCR NIH/3T3+、NIH/3T3-正反义克隆中分别扩增出相同长度的片断360bp,见图3、4,与人TGF-β1引物设计目的片段长度一致,可以认为在上述两组细胞基因组DNA及转录出胞核的mRNA中,分别含有重组的人TGF-β1正义和反义序列,说明了外源TGF-β1基因已整合入NIH/3T3靶细胞基因组中并被转录,且基因的重组没有造成人TGF-β1基因的缺失断裂或突变。对照组PCR、RT-PCR均为阳性,说明了动物品系NIH/3T3细胞基因组中不含有人TGF-β1基因序列。


, 百拇医药
图3 PCR检测对照和转染细胞TGF-β1 DNA
Fig3 DNA analysis of the NIH/3T3 and transfection
cell lines by PCR
A:Marker; B:3T3; C:3T3-; D:3T3+


图4 RT-PCR检测对照和转染细胞TGF-β1mRNA
, 百拇医药
Fig4 mRNA analysis of the NIH/3T3 and transfection
cell lines by RT-PCR
A:Marker; B:3T3; C:3T3-; D:3T3+
3 讨论
TGF-β1活性的维持有赖于严格的翻译后加工修饰,特别是双体分子的形成[6],原核表达系统是无法达到的,理想的重组人TGF-β1方案是真核细胞表达系统,此点已取得国内外学者共识。目前,国内仅有龙建银等[3]作了真核细胞(COS-7)内TGF-β1短暂表达研究,尚无人TGF-β1重组成功的报道。
成纤维细胞株作为载体细胞有许多优点[7],如易获取和体外扩增;易受外源基因的转染并能稳定地表达外源基因;携带外源性基因后仍能稳定地植回体内并表达分泌;回植的成纤维细胞很容易被取出;成纤维细胞致瘤性低,相对其它细胞安全等。基于已有的实验条件和经验,我们选择了脂质体介导方法转移人TGF-β1基因至NIH/3T3靶细胞内,目前已有数十种疾病相关基因和细胞因子基因转移以成纤维细胞作为靶细胞。因此,以NIH/3T3为靶细胞重组人TGF-β1,是今后开展TGF-β1体内表达研究的基础工作。
, 百拇医药
我们所开展的分子生物学鉴定工作证明了人TGF-β1基因随机整合NIH/3T3细胞基因组DNA中的稳定性和mRNA转录的完整性,结果同时还进一步证明了动物品系小鼠成纤维细胞NIH/3T3基因中不存在人TGF-β1基因序列,这就为在NIH/3T3细胞中重组人TGF-β1,提供了安全保障。文献[1]报道,人、鼠TGF-β1有相当高的同源性,本研究固相杂交中对照组阴性结果可能与内源TGF-β1基因通过BamHI酶切后,产生大小不同的碱基片段,导致与探针同源互补率更低,经不起严格的洗脱条件,致使杂交信号丢失有关[8]。Northern杂交结果显示正义比反义杂交带强,提示反义转录mRNA有部分消耗的事实也客观说明了NIH/3T3细胞基因组中存在一定量的鼠TGF-β1,且与人TGF-β1有部分同源性。
免疫标记流式细胞仪检测法,是检测细胞表达分泌蛋白最为灵敏的方法之一,本研究采用间接免疫标记法,结合统计学处理,比较客观反映了克隆重组人TGF-β1在靶细胞NIH/3T3中的有效表达,此结果与CCL-64细胞生长抑制法所测克隆细胞上清液TGF-β1蛋白活性结果完全一致,更进一步证明了克隆表达TGF-β1蛋白的事实。
, http://www.100md.com
TBF-β1功能广泛,它参与了胚胎的发育、损伤组织的修复、肿瘤的发生以及免疫系统自稳定和负调节作用[9];它在调控间质细胞分化、创伤愈合、肌肉、神经、骨骼、肝脏等组织器官的损伤修复方面具有较好的临床应用前景[10]。因此,我们克隆表达rhTGF-β1为进一步生产开发其重组产品及应用于基础和临床研究提供了资料。
作者简介:李勇(1966.3),男,河南省永城市人,博士,主治医师,讲师,主要从事移植免疫耐受方面的研究,发表论文7篇。电话:(023)68773110
李勇(第三军医大学附属西南医院肝胆外科中心,重庆 400038)
韩本立(第三军医大学附属西南医院肝胆外科中心,重庆 400038)
王会信(军事医学科学院基础医学研究所,北京 100850)
, http://www.100md.com
龙建银(军事医学科学院基础医学研究所,北京 100850)
李昆(第三军医大学附属西南医院肝胆外科中心,重庆 400038)
参考文献
[1]Roberts A B,Sporn M B.The transforming growth factor-beta[A].In:Sporn M B ed.Peptide growth factors and their receptors[M].Berlin:Springer-Verlag,1990.417-419.
[2]Assoian R K.Purification of type-B transforming growth factor from human platelets[J].Methods Enzymol,1987,146(13):153.
, 百拇医药
[3]龙建银,王会信,张宏权,等.人转化生长因子β1cDNA在COS-7细胞中的表达[J].生物化学杂志,1995,11(4):396-397.
[4]李勇,韩本立,李昆,等.细胞生长抑制测定TGF-β1生物活性[J].第三军医大学学报,1998,21(2):138-140.
[5]金冬雁,黎孟枫.分子克隆实验指南[M].第2版.北京:科学出版社,1993.350-353.
[6]Romeo D S,Park K,Roberts A B,et al.An element of the TGF-β1 5′ -untranslated region represses translation and specifically binds a cytosolic factor[J].Mol Endocrinol,1993,7(6):759-761.
, 百拇医药
[7]曹雪涛,章卫平,陈国友.肿瘤基因治疗的受体细胞研究进展[J].国外医学:肿瘤学分册,1995,28(2):174-175.
[8]从笑倩,夏顺汉,徐露霞,等.外源TGF-β1基因在小鼠Es细胞中的表达及其对细胞分化的影响[J].实验生物学报,1995,28(2):174-176.
[9]Border W A,Ruoslahti E.TGF-β1 in disease:the dark side of tissue repair[J].J Clin Invest,1992,90(1):1-3.
[10]Rowe P M.Clinical potential for TGF-β1[J].Lancet,1994,344(8915):72-74., 百拇医药