胃癌特异性转移因子诱导淋巴细胞表面IL-2受体表达
http://www.100md.com
37c医学网
胃癌特异性转移因子诱导淋巴细胞表面IL-2受体表达
杨敏 曹云新 刘智广 药立波 刘新平 苏成芝
摘 要:目的 观察胃癌特异性转移因子(GSTF)对淋巴细胞进行诱导刺激后,淋巴细胞表面的IL-2受体(IL-2R)表达的变化. 方法 应用流式细胞仪检测异硫氰基荧光素(FITC)标记的淋巴细胞表面IL-2R抗体的荧光强度,以观察其受刺激前后表面IL-2R的表达. 结果 GSTF在与其特异性抗原共同存在下诱导刺激淋巴细胞,可使其表面的IL-2R表达量增加,且GSTF的这种作用具有抗原特异性,GSTF或胃癌抗原单独存在时此作用则不明显. 结论 为肿瘤特异性转移因子的活性检测建立了一种新型快速、客观科学的检测方法,也为今后肿瘤特异性转移因子的分离纯化及进一步研究转移因子的作用机制打下了基础.
关键词:胃癌特异性转移因子;IL-2R;流式细胞仪
, 百拇医药
0 引言
自从1950年代发现转移因子(transfer factor, TF)以来,其作为免疫调节剂一直广泛应用 于临床,尤其是肿瘤的治疗. 但至今转移因子仍未被分离纯化,亦无明确的实验证明其作用机制. 因此 转移因子活性检测方法的研究依然为人们所重视,以期寻找突破口为进一步的深入研究提供稳定、敏感的 基础技术支持[1-3]. 我们应用流式细胞仪检测异硫氰基荧光素(FITC)标记的淋巴细胞表面白细胞介素-2受体(IL-2R)抗体的荧光强度,观察淋巴细胞受胃癌特异性转移因子(gastric carcinoma specific tran sfer factor, GSTF)刺激前后其表面IL-2R的表达变化,建立了一种新型快速、客观科学的肿瘤特异性转 移因子检测方法.
1 材料和方法
1.1 材料 健康成人当日新鲜全血取自本校附属一院血库,加肝素抗凝,RPM I-1640(美国Gibco公司),小牛血清(杭州四季清生物工程公司),FITC-IL-2R(鼠抗人单抗,美国Counter's公司), 红细胞破碎剂(ABC液,美国Counter's公司),紫外分光光度计(PE公司),GSTF由本室制 备,终浓度0.5×103 IU.L-1,胃癌、肺癌、直肠癌新鲜肿瘤标本取自本校附属一院外科.
, http://www.100md.com
1.2 肿瘤抗原的提取 取新鲜肿瘤组织约50 g,低温下无菌 生理盐水冲洗干净血迹,用剪刀剪碎后,放入无菌匀浆器中,加入10 mL 3 mol.L-1 KCl(冰浴冷),轻轻研磨(在冰浴中进行),取上 清液过滤后,紫外分光光度计做蛋白质浓度测定,稀释成0.5 g.L-1备用.
1.3 细胞培养及GSTF的诱导刺激 实验共6份样 品. 取当日新鲜全血800 μL及800 μL含100 mL.L-1小牛血清的RPMI-1640培养液加入6只无菌小瓶中. 样品Ⅰ中再加入GSTF及胃癌抗原各100 μL;样品Ⅱ 中再加入GSTF及肺癌抗原各100 μL;样品Ⅲ中再加入GSTF及直肠癌抗原各100 μL;样品Ⅳ中再加入GST F及1640培养液各100 μL;样品Ⅴ再加入胃癌抗原及1640培养液各100 μL;样品Ⅵ中只加200 μL 1640 培养液. 各组总体积均为1800 μL. 加样完毕后在恒温孵箱中于37℃, 50 mL.L-1 CO2条件下培 养24 h. 在培养过程中,由于重力作用,细胞会沉积,为使GSTF刺激充分,每隔3~4 h摇匀细胞1次.
, http://www.100md.com
1.4 淋巴细胞表面的IL-2R表达观测 各份样品 经24 h培养后,吸 去上清1000 μL,摇匀后取其中100 μl加入1∶20稀释的兔血清作用30 min以封闭细胞表面 的Fc受体;再加入红细胞破碎剂A液600 μL, B液250 μL, C液100 μL,使红细胞充分破 碎后加入10 μL FITC标记的鼠抗人IL-2R抗体,同时 再从样品Ⅰ中取出100 μL按上述同样方法破碎红细胞后加入FITC标记的鼠抗人IgG1(无关抗体,用于 机器调零);避光染色15 min后,用流式细胞仪检测淋巴细胞表面荧光强度,以观察受体表 达的变化情况.
2 结果
Fig 1~3为样品Ⅰ~Ⅵ的流式细胞仪检测结果,平均荧光强度(mean intensity of fluros cence, MIF)分别为17.9, 6.8, 6.5, 5.0, 8.9, 6.2. 根据以上样品Ⅰ,Ⅱ,Ⅲ的检测结果,提示 GSTF只有在胃癌特异性抗原存在下才能诱导淋巴细胞表面IL-2R的表达,即激活淋巴细胞发挥免疫调 节作用. 而在非特异性抗原存在下,淋巴细胞激活作用较弱. 样品Ⅳ,Ⅴ的检测结果提示,单纯胃癌特异性 转移因子或胃癌特异性抗原存在下,淋巴细胞表面的IL-2R的表达与阴性对照相比无明显差异.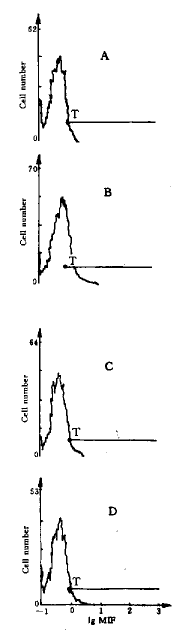
, http://www.100md.com
图1 胃癌特异性转移因子单独作用及其分别与胃癌抗原、 肺癌抗原、 直肠癌抗原共同作 用下淋巴细胞表面IL-2R表达的平均荧光强度
Fig 1 MIF of IL-2R on lymphocytes under the treatment of GSTF only (A), GSTF a nd ga stric carcinoma specific antigen (B), GSTF and lung carcinoma specific antigen ( C), GSTF and rectum carcinoma specific antigen (D)
MIF: mean intensity of fluroscence; T: The threshold of negative MIF valu es.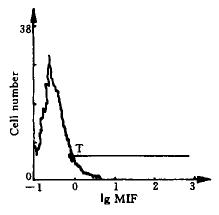
, http://www.100md.com
图2 胃癌抗原单独作用下淋巴细胞表面IL-2R表达的平均荧光强度
Fig 2 MIF of IL-2R on lymphocytes under the treatment of gastric carcinoma s pecific antigen only
MIF, B: The same as Fig 1.
图3 阴性对照组淋巴细胞表面IL-2R表达的平均荧光强度
Fig 3 MIF of IL-2R on lymphocytes without the treatment of GSTF and gastric carcinoma specific antigen
, http://www.100md.com
MIF: The same as Fig 1.
3 讨论
我们通过以上实验意在建立一种客观、科学的转移因子活性检测方法. 传统的检测转移 因子活性的方法多为白细胞粘附抑制实验(LAI). 应用LAI实验虽具有简便、价廉等优点,但最主要也是最 致命的缺点就是影响实验结果的主观因素较多,例如制备脾细胞过程中匀浆的力度,弃上清的动作等等都 会给实验结果以很大的影响[4,5]. 而用流式细胞仪检测淋巴细胞表面的IL-2R表达情况,结 合细胞数定量统计分析则可以弥补以往实验方法的不足. 流式细胞仪作为检测工具,仪器灵敏性高,得到的结果精确 、稳定、客观,但同以往的方法相比也有不足之处,即仪器昂贵,所用试剂价格较高,操作较复杂.
IL-2R表达量的增加是淋巴细胞激活的一个主要指标. 应用FITC标记的IL-2R抗 体,与体外培养的淋巴细胞表面IL-2R相结合,再用流式细胞仪检测淋巴细胞的荧光强度,便可以确定细胞表面 IL-2R表达量的变化,从而客观地反映了转移因子的活性[6]. 从实验结果可以看出,在阴性对 照组中,鼠抗人IL-2R抗体染色后阳性细胞百分率为6.5,而样品 I的阳性细胞百分率为17.9. 两者之间有较大差异 ,说明我们应用流式细胞仪进行荧光强度检测时,选取IL-2R作为观测指标是有效的.
, 百拇医药
以上实验结果提示,GSTF在胃癌抗原共存下可使淋巴细胞表面的IL-2R表达量增加且增加量 最为明显;而其作用同时也表现出抗原特异性;单纯转移因子及单纯的胃癌抗原可使淋巴细胞表面IL- 2R的表达轻度升高,考虑可能是由于转移因子本身为混合物,其中可能含非特异成分,是针对周围环境抗 原的. 这就要求我们对转移因子进行纯化分析,只有得到单一组分才有可能对转移因子进行更深入的研究 ,同时关于GSTF的特异性问题在今后也将成为转移因子研究的一个重点.
在实验过程中,还应注意以下问题. 所用的正常人外周全血,要非常新鲜,为肝素抗凝全 血,在实验前计数一下淋巴细胞,以确定实验所用转移因子及抗原的量. 如果血液不新鲜或在培养 过程中污染,就会导致红细胞不能完全破碎,流式细胞仪不能很好地将细胞分群,影响实验结果. 破碎后 的标本液应清澄、透明. 取细胞染色前,应尽量将细胞摇匀减少误差. 流式细胞仪计数的淋巴细胞数量越 多,得出的平均荧光强度越接近细胞的真实水平.
基金项目:国家自然科学基金杰出青年资助项目(39825113)
, 百拇医药
作者简介:杨 敏(1971-),女(汉族),四川省崇庆市人.助教,硕士生(导师苏成芝,药立波).Tel.(029)3374516 Email.ym999@263.net
杨敏(第四军医大学基础部:生物化学与分子生物学教研室,陕西 西安 710033)
曹云新(第四军医大学基础部:中心实验室,陕西 西安 710033)
刘智广(第四军医大学基础部:中心实验室,陕西 西安 710033)
药立波(第四军医大学基础部:生物化学与分子生物学教研室,陕西 西安 710033)
刘新平(第四军医大学基础部:生物化学与分子生物学教研室,陕西 西安 710033)
苏成芝(第四军医大学基础部:生物化学与分子生物学教研室,陕西 西安 710033)
, 百拇医药
参考文献
[1]Kirkpatrick CH. Structural nature and function of transfer factor [J]. Ann N Y Acad Sci,1993;685(3):362-368.
[2]QI HY, Wan ZF, Su CZ. Isolation and purification of HSV-1 specific transfer factor produced by HSV-1 immunized goat leukocyte dialysate [J]. Acta Virol,1992;36(3):231-238.
[3]Duyen JW. Transfer factor on age of molecular biology [J]. Bioth erapy,1996;9(1):7-11.
[4]余 贺,陈诗书,邵国英. 肿瘤生物学[M]. 上海:上海科学技术出版 社,1991:20-27.
[5]王 方. 甲胎蛋白特异性转移因子活性单体的分离片段及生物效应的分子机理 研究[D]. 西安: 第四军医大学,1994.
[6]Lawrence HS, Borkowskyw. Transfer factor current and future prospects [J]. Biotherapy,1996;9(1):1-5., 百拇医药
杨敏 曹云新 刘智广 药立波 刘新平 苏成芝
摘 要:目的 观察胃癌特异性转移因子(GSTF)对淋巴细胞进行诱导刺激后,淋巴细胞表面的IL-2受体(IL-2R)表达的变化. 方法 应用流式细胞仪检测异硫氰基荧光素(FITC)标记的淋巴细胞表面IL-2R抗体的荧光强度,以观察其受刺激前后表面IL-2R的表达. 结果 GSTF在与其特异性抗原共同存在下诱导刺激淋巴细胞,可使其表面的IL-2R表达量增加,且GSTF的这种作用具有抗原特异性,GSTF或胃癌抗原单独存在时此作用则不明显. 结论 为肿瘤特异性转移因子的活性检测建立了一种新型快速、客观科学的检测方法,也为今后肿瘤特异性转移因子的分离纯化及进一步研究转移因子的作用机制打下了基础.
关键词:胃癌特异性转移因子;IL-2R;流式细胞仪
, 百拇医药
0 引言
自从1950年代发现转移因子(transfer factor, TF)以来,其作为免疫调节剂一直广泛应用 于临床,尤其是肿瘤的治疗. 但至今转移因子仍未被分离纯化,亦无明确的实验证明其作用机制. 因此 转移因子活性检测方法的研究依然为人们所重视,以期寻找突破口为进一步的深入研究提供稳定、敏感的 基础技术支持[1-3]. 我们应用流式细胞仪检测异硫氰基荧光素(FITC)标记的淋巴细胞表面白细胞介素-2受体(IL-2R)抗体的荧光强度,观察淋巴细胞受胃癌特异性转移因子(gastric carcinoma specific tran sfer factor, GSTF)刺激前后其表面IL-2R的表达变化,建立了一种新型快速、客观科学的肿瘤特异性转 移因子检测方法.
1 材料和方法
1.1 材料 健康成人当日新鲜全血取自本校附属一院血库,加肝素抗凝,RPM I-1640(美国Gibco公司),小牛血清(杭州四季清生物工程公司),FITC-IL-2R(鼠抗人单抗,美国Counter's公司), 红细胞破碎剂(ABC液,美国Counter's公司),紫外分光光度计(PE公司),GSTF由本室制 备,终浓度0.5×103 IU.L-1,胃癌、肺癌、直肠癌新鲜肿瘤标本取自本校附属一院外科.
, http://www.100md.com
1.2 肿瘤抗原的提取 取新鲜肿瘤组织约50 g,低温下无菌 生理盐水冲洗干净血迹,用剪刀剪碎后,放入无菌匀浆器中,加入10 mL 3 mol.L-1 KCl(冰浴冷),轻轻研磨(在冰浴中进行),取上 清液过滤后,紫外分光光度计做蛋白质浓度测定,稀释成0.5 g.L-1备用.
1.3 细胞培养及GSTF的诱导刺激 实验共6份样 品. 取当日新鲜全血800 μL及800 μL含100 mL.L-1小牛血清的RPMI-1640培养液加入6只无菌小瓶中. 样品Ⅰ中再加入GSTF及胃癌抗原各100 μL;样品Ⅱ 中再加入GSTF及肺癌抗原各100 μL;样品Ⅲ中再加入GSTF及直肠癌抗原各100 μL;样品Ⅳ中再加入GST F及1640培养液各100 μL;样品Ⅴ再加入胃癌抗原及1640培养液各100 μL;样品Ⅵ中只加200 μL 1640 培养液. 各组总体积均为1800 μL. 加样完毕后在恒温孵箱中于37℃, 50 mL.L-1 CO2条件下培 养24 h. 在培养过程中,由于重力作用,细胞会沉积,为使GSTF刺激充分,每隔3~4 h摇匀细胞1次.
, http://www.100md.com
1.4 淋巴细胞表面的IL-2R表达观测 各份样品 经24 h培养后,吸 去上清1000 μL,摇匀后取其中100 μl加入1∶20稀释的兔血清作用30 min以封闭细胞表面 的Fc受体;再加入红细胞破碎剂A液600 μL, B液250 μL, C液100 μL,使红细胞充分破 碎后加入10 μL FITC标记的鼠抗人IL-2R抗体,同时 再从样品Ⅰ中取出100 μL按上述同样方法破碎红细胞后加入FITC标记的鼠抗人IgG1(无关抗体,用于 机器调零);避光染色15 min后,用流式细胞仪检测淋巴细胞表面荧光强度,以观察受体表 达的变化情况.
2 结果
Fig 1~3为样品Ⅰ~Ⅵ的流式细胞仪检测结果,平均荧光强度(mean intensity of fluros cence, MIF)分别为17.9, 6.8, 6.5, 5.0, 8.9, 6.2. 根据以上样品Ⅰ,Ⅱ,Ⅲ的检测结果,提示 GSTF只有在胃癌特异性抗原存在下才能诱导淋巴细胞表面IL-2R的表达,即激活淋巴细胞发挥免疫调 节作用. 而在非特异性抗原存在下,淋巴细胞激活作用较弱. 样品Ⅳ,Ⅴ的检测结果提示,单纯胃癌特异性 转移因子或胃癌特异性抗原存在下,淋巴细胞表面的IL-2R的表达与阴性对照相比无明显差异.

, http://www.100md.com
图1 胃癌特异性转移因子单独作用及其分别与胃癌抗原、 肺癌抗原、 直肠癌抗原共同作 用下淋巴细胞表面IL-2R表达的平均荧光强度
Fig 1 MIF of IL-2R on lymphocytes under the treatment of GSTF only (A), GSTF a nd ga stric carcinoma specific antigen (B), GSTF and lung carcinoma specific antigen ( C), GSTF and rectum carcinoma specific antigen (D)
MIF: mean intensity of fluroscence; T: The threshold of negative MIF valu es.

, http://www.100md.com
图2 胃癌抗原单独作用下淋巴细胞表面IL-2R表达的平均荧光强度
Fig 2 MIF of IL-2R on lymphocytes under the treatment of gastric carcinoma s pecific antigen only
MIF, B: The same as Fig 1.

图3 阴性对照组淋巴细胞表面IL-2R表达的平均荧光强度
Fig 3 MIF of IL-2R on lymphocytes without the treatment of GSTF and gastric carcinoma specific antigen
, http://www.100md.com
MIF: The same as Fig 1.
3 讨论
我们通过以上实验意在建立一种客观、科学的转移因子活性检测方法. 传统的检测转移 因子活性的方法多为白细胞粘附抑制实验(LAI). 应用LAI实验虽具有简便、价廉等优点,但最主要也是最 致命的缺点就是影响实验结果的主观因素较多,例如制备脾细胞过程中匀浆的力度,弃上清的动作等等都 会给实验结果以很大的影响[4,5]. 而用流式细胞仪检测淋巴细胞表面的IL-2R表达情况,结 合细胞数定量统计分析则可以弥补以往实验方法的不足. 流式细胞仪作为检测工具,仪器灵敏性高,得到的结果精确 、稳定、客观,但同以往的方法相比也有不足之处,即仪器昂贵,所用试剂价格较高,操作较复杂.
IL-2R表达量的增加是淋巴细胞激活的一个主要指标. 应用FITC标记的IL-2R抗 体,与体外培养的淋巴细胞表面IL-2R相结合,再用流式细胞仪检测淋巴细胞的荧光强度,便可以确定细胞表面 IL-2R表达量的变化,从而客观地反映了转移因子的活性[6]. 从实验结果可以看出,在阴性对 照组中,鼠抗人IL-2R抗体染色后阳性细胞百分率为6.5,而样品 I的阳性细胞百分率为17.9. 两者之间有较大差异 ,说明我们应用流式细胞仪进行荧光强度检测时,选取IL-2R作为观测指标是有效的.
, 百拇医药
以上实验结果提示,GSTF在胃癌抗原共存下可使淋巴细胞表面的IL-2R表达量增加且增加量 最为明显;而其作用同时也表现出抗原特异性;单纯转移因子及单纯的胃癌抗原可使淋巴细胞表面IL- 2R的表达轻度升高,考虑可能是由于转移因子本身为混合物,其中可能含非特异成分,是针对周围环境抗 原的. 这就要求我们对转移因子进行纯化分析,只有得到单一组分才有可能对转移因子进行更深入的研究 ,同时关于GSTF的特异性问题在今后也将成为转移因子研究的一个重点.
在实验过程中,还应注意以下问题. 所用的正常人外周全血,要非常新鲜,为肝素抗凝全 血,在实验前计数一下淋巴细胞,以确定实验所用转移因子及抗原的量. 如果血液不新鲜或在培养 过程中污染,就会导致红细胞不能完全破碎,流式细胞仪不能很好地将细胞分群,影响实验结果. 破碎后 的标本液应清澄、透明. 取细胞染色前,应尽量将细胞摇匀减少误差. 流式细胞仪计数的淋巴细胞数量越 多,得出的平均荧光强度越接近细胞的真实水平.
基金项目:国家自然科学基金杰出青年资助项目(39825113)
, 百拇医药
作者简介:杨 敏(1971-),女(汉族),四川省崇庆市人.助教,硕士生(导师苏成芝,药立波).Tel.(029)3374516 Email.ym999@263.net
杨敏(第四军医大学基础部:生物化学与分子生物学教研室,陕西 西安 710033)
曹云新(第四军医大学基础部:中心实验室,陕西 西安 710033)
刘智广(第四军医大学基础部:中心实验室,陕西 西安 710033)
药立波(第四军医大学基础部:生物化学与分子生物学教研室,陕西 西安 710033)
刘新平(第四军医大学基础部:生物化学与分子生物学教研室,陕西 西安 710033)
苏成芝(第四军医大学基础部:生物化学与分子生物学教研室,陕西 西安 710033)
, 百拇医药
参考文献
[1]Kirkpatrick CH. Structural nature and function of transfer factor [J]. Ann N Y Acad Sci,1993;685(3):362-368.
[2]QI HY, Wan ZF, Su CZ. Isolation and purification of HSV-1 specific transfer factor produced by HSV-1 immunized goat leukocyte dialysate [J]. Acta Virol,1992;36(3):231-238.
[3]Duyen JW. Transfer factor on age of molecular biology [J]. Bioth erapy,1996;9(1):7-11.
[4]余 贺,陈诗书,邵国英. 肿瘤生物学[M]. 上海:上海科学技术出版 社,1991:20-27.
[5]王 方. 甲胎蛋白特异性转移因子活性单体的分离片段及生物效应的分子机理 研究[D]. 西安: 第四军医大学,1994.
[6]Lawrence HS, Borkowskyw. Transfer factor current and future prospects [J]. Biotherapy,1996;9(1):1-5., 百拇医药