32P标记寡聚核苷酸探针检测胃癌组织中MUC5AC mRNA表达
32P标记寡聚核苷酸探针检测胃癌组织中MUC5AC mRNA表达
汪荣泉 房殿春 鲁荣 刘为纹
摘 要: 目的 揭示正常胃粘膜、癌前病变和胃癌组织中MUC5AC基因转录水平的表达及其临床病理意义。方法 应用32P标记寡聚核苷酸探针和原位杂交方法检测组织切片中的MUC5AC mRNA的表达。结果 人正常胃粘膜中的浅表1/3范围内广泛分布MUC5AC基因的mRNA,肠上皮化生和胃癌组织中的表达阳性率分别是15.4%和25%。胃癌组织中MUC5AC mRNA的表达与胃癌患者的性别、肿瘤的部位和大小、淋巴结转移、肿瘤的分化和浸润、临床分期无关(P>0.05),但MUC5AC阳性组和阴性组之间的胃癌Lauren'氏分型差别显著(P<0.05)。结论 MUC5AC mRNA在胃癌和肠上皮化生组织中呈下调表达,胃癌组织中MUC5AC mRNA的表达与其Lauren'氏分型之间有关。
, http://www.100md.com
关键词:MUC5AC基因;转录;同位素;胃癌;寡核苷酸探针
人胃肠道表面粘液的主要成份是粘蛋白,它是一种高分子量的富含糖链的糖蛋白,起重要的保护及润滑作用。MUC5AC(Mucin5AC, 粘蛋白5AC)基因是1990年由法国学者从人气管支气管cDNA文库中首次所克隆[1],以后在人胃cDNA文库中也克隆到该基因。我们应用32P标记的针对MUC5AC mRNA的寡聚核苷酸探针和原位杂交方法,对正常人胃粘膜,肠上皮化生粘膜,以及胃癌组织中MUC5AC转录水平的表达进行研究,以揭示该基因在胃上皮癌变过程中的表达规律及其意义。
1 材料和方法
1.1 实验标本 8例正常胃粘膜,取自胃癌手术切缘的组织,HE染色光镜观察,未见癌组织及癌前病变;2例十二指肠组织取自胃癌切除标本的十二指肠部分;40例胃癌组织取自本院手术切除标本,其中34例含癌旁胃粘膜,而其中26例含肠化粘膜。所有标本均经10%福尔马林固定,石蜡包埋,5μm连续切片,HE染色,病理确诊。40例胃癌患者中,男32例,女8例,年龄41~72岁,平均55.8岁。胃癌患者的临床分期以TNM国际分期法进行,胃癌患者的癌组织大小、淋巴结转移、浸润深度以术中所见,病理检查以及术前辅助检查为准。
, 百拇医药
1.2 试剂
针对MUC5AC基因转录表达的寡聚核苷酸探针序列为5'-AGGGGCAGAAGTTGTGCTCGTTGTGGGAGCAGAGGTTGTGCTGGT
TGT-3',由上海市中科院细胞所合成。多聚赖氨酸购自福州迈新生物技术公司,T4多聚核苷酸激酶购自Promega公司,核-4乳胶购自中国原子能研究所,DEPC、蛋白酶K、鲑精DNA、DTT、Ficoll400、硫酸葡聚糖购自Sigma公司,去离子甲酰胺购自北京中山公司,[r-32P]ATP购自北京亚辉公司,SG-50购自Pharmacia公司。
1.3 原位杂交
1.3.1探针的标记和纯化 MUC5AC探针42 pmol(3 μl)中加入T4多聚核苷酸激酶2μl、去离水25 μl、缓冲液5μl和15 μl的10 mCi/ml[r-32P]ATP,37℃水浴中置4 h,0.5 mol/L EDTA终止反应,自制SG-50柱层析分离。
, 百拇医药
1.3.2 原位杂交 切片脱蜡、水化后,经0.1 mol/L PBS, 0.1 mol/L甘氨酸/PBS和0.3% Triton X-100/PBS漂洗后,2 μg/ml蛋白酶K溶液消化30 min(37℃),4%多聚甲醛后固定5 min,0.1 mol/L PBS、0.25%乙酸酐和2×SSC分别漂洗后预杂交30 min(37℃),杂交37℃过夜,每张切片所加标记探针的量为1.2×105 min-1,杂交液由50%去离子甲酰胺、10×Denhardt's液,0.5 mg/ml变性鲑精DNA、10%硫酸葡聚糖、DTT等组成,经梯度SSC、0.05 mol/L PBS漂洗后,梯度酒精脱水、干燥,在暗室中浸融化的核-4乳胶,干燥后,暗盒内放射自显影7 d,D-19 b液显影、定影,甲基绿衬染,脱水,透明封片。实验中阴性对照采用不加同位素标记的探针和杂交前用RNA酶处理切片。
1.4 统计学处理
所得数据经χ2检验。
, 百拇医药
2 结果
2.1 正常胃肠道粘膜中MUC5AC mRNA的表达
正常胃粘膜的表层上皮及胃浅表粘膜(近胃粘膜厚度的1/3)均弥漫存在MUC5AC mRNA的表达,阳性表达细胞的胞浆内充满黑色银染颗粒,不均质性,核内缺如;胃粘膜的中下部无表达;阳性表达区域内的细胞亦存在阴性者,且多少不一,阳性表达细胞的黑色反应也强弱不一,深者,可呈深黑色,浅者,则呈浅灰黑色,见图1。人正常十二指肠粘膜组织内无MUC5AC mRNA的表达。
图1 正常胃粘膜中MUC5AC mRNA的表达 (原位杂交×200)
Fig 1 Expression of MUC5AC mRNA in the normalmucosa of stomach (ISH×200)
, http://www.100md.com
2.2 肠上皮生化粘膜中MUC5AC mRNA的表达
26例肠上皮化生粘膜中MUC5AC mRNA阳性表达4例,占15.4%。这4例阳性表达的肠化组织中,MUC5AC mRNA的表达强弱不一,部分肠化组织可为阴性,且比率多少不等。阳性的肠化组织中MUC5AC mRNA分布于杯状和柱状细胞的胞浆内,有一例以杯状细胞阳性为主,其它的杯状和柱状细胞之间无明显区别。杯状细胞内的mRNA主要位于粘液滴周的胞浆内,核周更明显,而柱状细胞的银染范围较小,较为均一,见图2。
图2 肠上皮化生粘膜中MUC5AC mRNA的表达 (原位杂交×200)
Fig 2 Expression of MUC5AC mRNA in the mucosa ofintestinal metaplasia (ISH×200)
, http://www.100md.com
2.3 胃癌及癌旁粘膜中MUC5AC mRNA的表达
40例胃癌组织中MUC5AC mRNA阳性表达10例,占25%。癌旁胃粘膜中MUC5AC mRNA的表达与正常胃粘膜类似,但强弱不一,存在阴性反应者,阳性表达主要局限于粘膜的浅表部分,包括表浅上皮及胃粘膜的浅表部分。胃癌组织中阳性反应的胃癌细胞分布呈散在、灶状和弥漫分布,黑色银染颗粒位于细胞的胞浆内,不同标本的阳性细胞数和反应强度不一,见图3。胃癌组织中MUC5AC mRNA的表达与患者的性别、肿瘤的部位和大小、淋巴结转移、分化类型、浸润深度、临床分期无关(P>0.05),与Lauren'氏分型之间有关(P<0.05),见表1。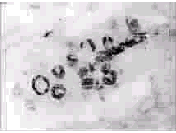
图3 胃癌组织中MUC5AC mRNA的表达 (原位杂交×400)
, 百拇医药
Fig 3 Expression of MUC5AC mRNA in the tissueof gastric cancer (ISH×400)
表1 胃癌组织中MUC5AC mRNA的表达与患者临床病理联系
Tab 1 Relationship between expression of MUC5AC mRNA in the tissues of gastric carcinoma and patients' clinicopathological features
Features
n
MUC5(-)
MUC5(+)
, http://www.100md.com
P
Sex
Male
32
22
10
>0.05
Female
8
8
0
Location
Fundus
, http://www.100md.com
7
4
3
Body
11
10
1
>0.05
Antrum
22
16
6
Size
, 百拇医药 ≤5 cm
26
21
5
>0.05
>5 cm
14
9
5
Metastasis of lymph nodes
23
1
6
, 百拇医药
Present
>0.05
Absent
17
13
4
Grades of differentiation
Poor
13
11
2
Well/moderate
, 百拇医药 23
17
6
>0.05
Mucoid
4
2
2
Serosal invasion
Absent
15
11
4
, http://www.100md.com
>0.05
Present
25
19
6
Clinical stages
Ⅰ-Ⅱ
19
15
4
>0.05
Ⅲ-Ⅳ
21
, 百拇医药
15
6
Types of gastric cancer
Intestinal
18
15
6
Diffuse
14
12
2
<0.05
Mixed
, 百拇医药
8
3
5
3 讨论
最近克隆到至少7种不同的人粘蛋白基因(MUC1-7),对这些基因表达的异质性、多态性和功能的了解具有重要的作用[2~4]。MUC5AC基因与其它粘蛋白基因一样,是由随机数目重复单位(VNTR)组成,每个重复单位的氨基酸序列是TTSTTSAP。
MUC5AC基因在胃癌发生过程中的研究国外不多,且多采用免疫组化方法和Northern印迹方法[5,6],原位杂交检测的报道很少。我们对正常胃粘膜、肠上皮化生和胃癌组织中MUC5AC基因转录水平的表达进行原位检测,检出率分别是100%、15.4%和25%。该结论与我们用MUC5AC核粘蛋白的单抗检测其核粘蛋白的表达结论类似,但检出率较之稍低,这可能与标本的前期处理过程中对组织中的mRNA破坏有关。该结果可能预示MUC5AC基因在正常胃粘膜向肠上皮化生及胃癌的转变过程中是下调表达的,涉及该基因表达的大量丢失。这说明胃癌的发生过程中涉及MUC5AC基因表达的改变。
, http://www.100md.com
应用同位素标记的探针作原位杂交在非放射性物质标记探针方法的研究成功之后,已应用的很少,虽然32P对人体具有危害性,但其标记探针进行组织原位杂交,具有很高的敏感性和特异性,这就是我们对石蜡切片进行mRNA检测采用该方法的主要原因。
本研究的另一个结果是胃癌患者胃癌组织中MUC5AC mRNA的表达与患者的性别、部位、大小、淋巴结转移、浸润深度、临床分期之间无关(P>0.05),而与Lauren'氏分型之间有关(P<0.05),MUC5AC(+)组与MUC5AC(-)组之间的肠型、胃型和混合型的发生率相差显著(P<0.05)。我们对MUC1核心肽的表达与这组患者临床病理参数之间的关系研究发现,MUC1核心肽的异常表达与患者的临床分期、淋巴结转移有明显的联系[7]。而MUC5AC mRNA的表达与患者的临床病理指标之间的关系不明显,可能提示MUC5AC基因产物的作用与MUC1相比有所不同。
解释这种现象可能是MUC5AC基因产物在粘蛋白的成熟过程中指导了粘蛋白的糖化模式,这种糖化结果影响了胃癌组织所分泌粘液的pH值,具体的机制尚需进一步研究。类似的结果也被其它的研究所证实,如MUC6基因指导细胞表达Lewis抗原,MUC5AC基因指导了细胞表达Lewis如Sialyl-Lewisa[8]。
, 百拇医药
基金项目:全军“九五”医药卫生科研基金资助项目(96M091)
作者简介:汪荣泉(1968-),男,浙江省常山县人,博士,讲师,主要从事胃癌和肝癌的发生机制方面的研究,发表论文35篇。电话:(023)65314116
汪荣泉(第三军医大学附属西南医院消化内科,重庆 400038)
房殿春(第三军医大学附属西南医院消化内科,重庆 400038)
鲁荣(第三军医大学附属西南医院消化内科,重庆 400038)
刘为纹(第三军医大学附属西南医院消化内科,重庆 400038)
参考文献:
, 百拇医药 [1] Aubert J P, Porchet N, Crepin M, et al. Evidence for different human tracheobronchial mucin peptides deduced from nucleotide cDNA sequences[J]. Am J Respir Cell Mol Biol,1991,5(2):178-185.
[2] Gum J R, Byrd J C, Hicks J W, et al. Molecular cloning of human intestinal mucin cDNAs: sequence analysis and evidence for genetic polymorphism[J]. J Biol Chem,1989,264(11):6 480-6 487.
[3] Uoribara N W, Roberton A M, Ho S B, et al. Human gastric mucin:identification of a unique species by expression cloning[J]. J Biol Chem,1993,268(8):5 879-5 885.
, 百拇医药
[4] Siddiqui J, Abe M, Hayes D, et al. Isolation and sequencing of a cDNA coding for the human DF3 breast carcinoma-associated antigen[J]. Proc Natl Acad Sci USA,1988,85(6):2 320-2 323.
[5] Balague C, Gambus G, Carrato C, et al. Altered expression of MUC2, MUC4 and MUC5 mucin genes in pancreas tissues[J]. Gastroenterology,1994,106(4):1 054-1 061.
[6] Samuel B Ho, Shekels L L, Toribara N W. Mucin gene expression in normal, preneoplastic and neoplastic human gastric epithelium[J]. Cancer Res,1995,55(15):2 681-2 690.
[7] 汪荣泉,房殿春,晋华源,等.胃癌及癌前病变组织中MUC1基因的表达及其意义[J].中华医学杂志,1999,79(6):443-444.
[8] Bolos C D, Garrido M, Real F X. MUC6 apomucin shows a distinct normal tissue distribution that correlates with Lewis antigen expression in the human stomach[J]. Gastroenterology,1995,109(3):723-734., 百拇医药(32P标记寡聚核苷酸探针检测胃癌组织中MUC5AC mRNA表达)
汪荣泉 房殿春 鲁荣 刘为纹
摘 要: 目的 揭示正常胃粘膜、癌前病变和胃癌组织中MUC5AC基因转录水平的表达及其临床病理意义。方法 应用32P标记寡聚核苷酸探针和原位杂交方法检测组织切片中的MUC5AC mRNA的表达。结果 人正常胃粘膜中的浅表1/3范围内广泛分布MUC5AC基因的mRNA,肠上皮化生和胃癌组织中的表达阳性率分别是15.4%和25%。胃癌组织中MUC5AC mRNA的表达与胃癌患者的性别、肿瘤的部位和大小、淋巴结转移、肿瘤的分化和浸润、临床分期无关(P>0.05),但MUC5AC阳性组和阴性组之间的胃癌Lauren'氏分型差别显著(P<0.05)。结论 MUC5AC mRNA在胃癌和肠上皮化生组织中呈下调表达,胃癌组织中MUC5AC mRNA的表达与其Lauren'氏分型之间有关。
, http://www.100md.com
关键词:MUC5AC基因;转录;同位素;胃癌;寡核苷酸探针
人胃肠道表面粘液的主要成份是粘蛋白,它是一种高分子量的富含糖链的糖蛋白,起重要的保护及润滑作用。MUC5AC(Mucin5AC, 粘蛋白5AC)基因是1990年由法国学者从人气管支气管cDNA文库中首次所克隆[1],以后在人胃cDNA文库中也克隆到该基因。我们应用32P标记的针对MUC5AC mRNA的寡聚核苷酸探针和原位杂交方法,对正常人胃粘膜,肠上皮化生粘膜,以及胃癌组织中MUC5AC转录水平的表达进行研究,以揭示该基因在胃上皮癌变过程中的表达规律及其意义。
1 材料和方法
1.1 实验标本 8例正常胃粘膜,取自胃癌手术切缘的组织,HE染色光镜观察,未见癌组织及癌前病变;2例十二指肠组织取自胃癌切除标本的十二指肠部分;40例胃癌组织取自本院手术切除标本,其中34例含癌旁胃粘膜,而其中26例含肠化粘膜。所有标本均经10%福尔马林固定,石蜡包埋,5μm连续切片,HE染色,病理确诊。40例胃癌患者中,男32例,女8例,年龄41~72岁,平均55.8岁。胃癌患者的临床分期以TNM国际分期法进行,胃癌患者的癌组织大小、淋巴结转移、浸润深度以术中所见,病理检查以及术前辅助检查为准。
, 百拇医药
1.2 试剂
针对MUC5AC基因转录表达的寡聚核苷酸探针序列为5'-AGGGGCAGAAGTTGTGCTCGTTGTGGGAGCAGAGGTTGTGCTGGT
TGT-3',由上海市中科院细胞所合成。多聚赖氨酸购自福州迈新生物技术公司,T4多聚核苷酸激酶购自Promega公司,核-4乳胶购自中国原子能研究所,DEPC、蛋白酶K、鲑精DNA、DTT、Ficoll400、硫酸葡聚糖购自Sigma公司,去离子甲酰胺购自北京中山公司,[r-32P]ATP购自北京亚辉公司,SG-50购自Pharmacia公司。
1.3 原位杂交
1.3.1探针的标记和纯化 MUC5AC探针42 pmol(3 μl)中加入T4多聚核苷酸激酶2μl、去离水25 μl、缓冲液5μl和15 μl的10 mCi/ml[r-32P]ATP,37℃水浴中置4 h,0.5 mol/L EDTA终止反应,自制SG-50柱层析分离。
, 百拇医药
1.3.2 原位杂交 切片脱蜡、水化后,经0.1 mol/L PBS, 0.1 mol/L甘氨酸/PBS和0.3% Triton X-100/PBS漂洗后,2 μg/ml蛋白酶K溶液消化30 min(37℃),4%多聚甲醛后固定5 min,0.1 mol/L PBS、0.25%乙酸酐和2×SSC分别漂洗后预杂交30 min(37℃),杂交37℃过夜,每张切片所加标记探针的量为1.2×105 min-1,杂交液由50%去离子甲酰胺、10×Denhardt's液,0.5 mg/ml变性鲑精DNA、10%硫酸葡聚糖、DTT等组成,经梯度SSC、0.05 mol/L PBS漂洗后,梯度酒精脱水、干燥,在暗室中浸融化的核-4乳胶,干燥后,暗盒内放射自显影7 d,D-19 b液显影、定影,甲基绿衬染,脱水,透明封片。实验中阴性对照采用不加同位素标记的探针和杂交前用RNA酶处理切片。
1.4 统计学处理
所得数据经χ2检验。
, 百拇医药
2 结果
2.1 正常胃肠道粘膜中MUC5AC mRNA的表达
正常胃粘膜的表层上皮及胃浅表粘膜(近胃粘膜厚度的1/3)均弥漫存在MUC5AC mRNA的表达,阳性表达细胞的胞浆内充满黑色银染颗粒,不均质性,核内缺如;胃粘膜的中下部无表达;阳性表达区域内的细胞亦存在阴性者,且多少不一,阳性表达细胞的黑色反应也强弱不一,深者,可呈深黑色,浅者,则呈浅灰黑色,见图1。人正常十二指肠粘膜组织内无MUC5AC mRNA的表达。

图1 正常胃粘膜中MUC5AC mRNA的表达 (原位杂交×200)
Fig 1 Expression of MUC5AC mRNA in the normalmucosa of stomach (ISH×200)
, http://www.100md.com
2.2 肠上皮生化粘膜中MUC5AC mRNA的表达
26例肠上皮化生粘膜中MUC5AC mRNA阳性表达4例,占15.4%。这4例阳性表达的肠化组织中,MUC5AC mRNA的表达强弱不一,部分肠化组织可为阴性,且比率多少不等。阳性的肠化组织中MUC5AC mRNA分布于杯状和柱状细胞的胞浆内,有一例以杯状细胞阳性为主,其它的杯状和柱状细胞之间无明显区别。杯状细胞内的mRNA主要位于粘液滴周的胞浆内,核周更明显,而柱状细胞的银染范围较小,较为均一,见图2。

图2 肠上皮化生粘膜中MUC5AC mRNA的表达 (原位杂交×200)
Fig 2 Expression of MUC5AC mRNA in the mucosa ofintestinal metaplasia (ISH×200)
, http://www.100md.com
2.3 胃癌及癌旁粘膜中MUC5AC mRNA的表达
40例胃癌组织中MUC5AC mRNA阳性表达10例,占25%。癌旁胃粘膜中MUC5AC mRNA的表达与正常胃粘膜类似,但强弱不一,存在阴性反应者,阳性表达主要局限于粘膜的浅表部分,包括表浅上皮及胃粘膜的浅表部分。胃癌组织中阳性反应的胃癌细胞分布呈散在、灶状和弥漫分布,黑色银染颗粒位于细胞的胞浆内,不同标本的阳性细胞数和反应强度不一,见图3。胃癌组织中MUC5AC mRNA的表达与患者的性别、肿瘤的部位和大小、淋巴结转移、分化类型、浸润深度、临床分期无关(P>0.05),与Lauren'氏分型之间有关(P<0.05),见表1。

图3 胃癌组织中MUC5AC mRNA的表达 (原位杂交×400)
, 百拇医药
Fig 3 Expression of MUC5AC mRNA in the tissueof gastric cancer (ISH×400)
表1 胃癌组织中MUC5AC mRNA的表达与患者临床病理联系
Tab 1 Relationship between expression of MUC5AC mRNA in the tissues of gastric carcinoma and patients' clinicopathological features
Features
n
MUC5(-)
MUC5(+)
, http://www.100md.com
P
Sex
Male
32
22
10
>0.05
Female
8
8
0
Location
Fundus
, http://www.100md.com
7
4
3
Body
11
10
1
>0.05
Antrum
22
16
6
Size
, 百拇医药 ≤5 cm
26
21
5
>0.05
>5 cm
14
9
5
Metastasis of lymph nodes
23
1
6
, 百拇医药
Present
>0.05
Absent
17
13
4
Grades of differentiation
Poor
13
11
2
Well/moderate
, 百拇医药 23
17
6
>0.05
Mucoid
4
2
2
Serosal invasion
Absent
15
11
4
, http://www.100md.com
>0.05
Present
25
19
6
Clinical stages
Ⅰ-Ⅱ
19
15
4
>0.05
Ⅲ-Ⅳ
21
, 百拇医药
15
6
Types of gastric cancer
Intestinal
18
15
6
Diffuse
14
12
2
<0.05
Mixed
, 百拇医药
8
3
5
3 讨论
最近克隆到至少7种不同的人粘蛋白基因(MUC1-7),对这些基因表达的异质性、多态性和功能的了解具有重要的作用[2~4]。MUC5AC基因与其它粘蛋白基因一样,是由随机数目重复单位(VNTR)组成,每个重复单位的氨基酸序列是TTSTTSAP。
MUC5AC基因在胃癌发生过程中的研究国外不多,且多采用免疫组化方法和Northern印迹方法[5,6],原位杂交检测的报道很少。我们对正常胃粘膜、肠上皮化生和胃癌组织中MUC5AC基因转录水平的表达进行原位检测,检出率分别是100%、15.4%和25%。该结论与我们用MUC5AC核粘蛋白的单抗检测其核粘蛋白的表达结论类似,但检出率较之稍低,这可能与标本的前期处理过程中对组织中的mRNA破坏有关。该结果可能预示MUC5AC基因在正常胃粘膜向肠上皮化生及胃癌的转变过程中是下调表达的,涉及该基因表达的大量丢失。这说明胃癌的发生过程中涉及MUC5AC基因表达的改变。
, http://www.100md.com
应用同位素标记的探针作原位杂交在非放射性物质标记探针方法的研究成功之后,已应用的很少,虽然32P对人体具有危害性,但其标记探针进行组织原位杂交,具有很高的敏感性和特异性,这就是我们对石蜡切片进行mRNA检测采用该方法的主要原因。
本研究的另一个结果是胃癌患者胃癌组织中MUC5AC mRNA的表达与患者的性别、部位、大小、淋巴结转移、浸润深度、临床分期之间无关(P>0.05),而与Lauren'氏分型之间有关(P<0.05),MUC5AC(+)组与MUC5AC(-)组之间的肠型、胃型和混合型的发生率相差显著(P<0.05)。我们对MUC1核心肽的表达与这组患者临床病理参数之间的关系研究发现,MUC1核心肽的异常表达与患者的临床分期、淋巴结转移有明显的联系[7]。而MUC5AC mRNA的表达与患者的临床病理指标之间的关系不明显,可能提示MUC5AC基因产物的作用与MUC1相比有所不同。
解释这种现象可能是MUC5AC基因产物在粘蛋白的成熟过程中指导了粘蛋白的糖化模式,这种糖化结果影响了胃癌组织所分泌粘液的pH值,具体的机制尚需进一步研究。类似的结果也被其它的研究所证实,如MUC6基因指导细胞表达Lewis抗原,MUC5AC基因指导了细胞表达Lewis如Sialyl-Lewisa[8]。
, 百拇医药
基金项目:全军“九五”医药卫生科研基金资助项目(96M091)
作者简介:汪荣泉(1968-),男,浙江省常山县人,博士,讲师,主要从事胃癌和肝癌的发生机制方面的研究,发表论文35篇。电话:(023)65314116
汪荣泉(第三军医大学附属西南医院消化内科,重庆 400038)
房殿春(第三军医大学附属西南医院消化内科,重庆 400038)
鲁荣(第三军医大学附属西南医院消化内科,重庆 400038)
刘为纹(第三军医大学附属西南医院消化内科,重庆 400038)
参考文献:
, 百拇医药 [1] Aubert J P, Porchet N, Crepin M, et al. Evidence for different human tracheobronchial mucin peptides deduced from nucleotide cDNA sequences[J]. Am J Respir Cell Mol Biol,1991,5(2):178-185.
[2] Gum J R, Byrd J C, Hicks J W, et al. Molecular cloning of human intestinal mucin cDNAs: sequence analysis and evidence for genetic polymorphism[J]. J Biol Chem,1989,264(11):6 480-6 487.
[3] Uoribara N W, Roberton A M, Ho S B, et al. Human gastric mucin:identification of a unique species by expression cloning[J]. J Biol Chem,1993,268(8):5 879-5 885.
, 百拇医药
[4] Siddiqui J, Abe M, Hayes D, et al. Isolation and sequencing of a cDNA coding for the human DF3 breast carcinoma-associated antigen[J]. Proc Natl Acad Sci USA,1988,85(6):2 320-2 323.
[5] Balague C, Gambus G, Carrato C, et al. Altered expression of MUC2, MUC4 and MUC5 mucin genes in pancreas tissues[J]. Gastroenterology,1994,106(4):1 054-1 061.
[6] Samuel B Ho, Shekels L L, Toribara N W. Mucin gene expression in normal, preneoplastic and neoplastic human gastric epithelium[J]. Cancer Res,1995,55(15):2 681-2 690.
[7] 汪荣泉,房殿春,晋华源,等.胃癌及癌前病变组织中MUC1基因的表达及其意义[J].中华医学杂志,1999,79(6):443-444.
[8] Bolos C D, Garrido M, Real F X. MUC6 apomucin shows a distinct normal tissue distribution that correlates with Lewis antigen expression in the human stomach[J]. Gastroenterology,1995,109(3):723-734., 百拇医药(32P标记寡聚核苷酸探针检测胃癌组织中MUC5AC mRNA表达)