HDV/HBV体外感染原代培养人胎肝细胞的实验研究
HDV/HBV体外感染原代培养人胎肝细胞的实验研究
蒋业贵 李奇芬 毛青 王宇明 顾长海
摘 要 目的:建立HDV/HBV感染人胎肝细胞体外培养系统。方法:利用HDV/HBV阳性血清同时感染体外培养的人胎肝细胞;应用ELISA、免疫组化法、原位杂交法和斑点法检测上清液和细胞中HBsAg、HDAg、HBV DNA和HDV cDNA。结果:上清液和细胞中HBsAg、HDAg、HBV DNA和HDV cDNA在感染后第2天至第16天均可测出,其中上清液中HBsAg、HDAg以感染后第4天至第12天达高峰。结论:HDV在原代培养人胎肝细胞中能稳定复制和表达至少达12 d。
关键词:丁型肝炎病毒;HDV/HBV感染;人胎肝细胞;细胞培养
, 百拇医药
目前,有关HDV的研究,主要是利用HDV基因转染细胞株,但这些细胞株不能完全模拟人体内肝细胞的生物学功能,用于研究HDV时,不能完全代表体内的情况。用人胎肝细胞作为感染对象,建立HDV/HBV感染人胎肝细胞培养系统,可很好解决上述不足。本研究应用HDV/HBV同时感染的方式感染人胎肝细胞,初步建立了HDV/HBV感染人胎肝细胞体外培养系统。
1 材料与方法
1.1 人胎肝细胞
人工流产22周龄胎儿肝脏,经体外两步灌流法分离肝细胞,台盼蓝染色细胞成活率达90%以上。
1.2 HDV/HBV感染血清
HBV感染血清取自本科-慢性乙型肝炎患者,ELISA检测HBsAg(+)、HBeAg(+)、抗HBc(+),血清斑点杂交HBV DNA(+),甲、丙、丁、戊、庚型肝炎病毒标志均为阴性。HDV感染血清取自本科-丁型肝炎患者,ELISA检测HDAg(+)、抗HD(+),血清斑点杂交HDV cDNA(+)。
, 百拇医药
1.3 实验方法
采用王宇明等[1]设计的体外两步灌注法首先分离出总肝脏细胞悬液,再以差速离心方法分离、纯化肝细胞。将分离的人胎肝细胞用含10%小牛血清(FBS)的1640培养液调整细胞浓度为4×105/ml,接种于24孔塑料培养板内,每孔含培养液0.5 ml(即每孔含细胞数为2×105个),每24 h更换培养液。培养48 h后,于培养液中同时加入HBV、HDV感染血清(终浓度均为10%),并在培养液中加入4%聚乙二醇(PEG)。37°C培养16 h(过夜)后,弃去上清液,细胞用1640培养液洗涤3次后(最后一次洗涤液留样待检),加入含10%FBS和2%二甲基亚砜(DMSO)的新鲜1640培养液(不含PEG)。每48 h更换培养液(培养液组成同前)。每48 h收集上清液和肝细胞。实验分为HDV/HBV同时感染组和空白对照组(无HDV/HBV感染)。
1.4 检测指标及方法
, http://www.100md.com
培养人胎肝细胞于培养后每隔2 d以倒置生物相差显微镜观察细胞形态变化过程及贴壁生长情况。培养上清液中HBsAg、HDAg检测,采用ELISA法。细胞中HBsAg、HDAg检测,采用免疫组化S-P法。细胞中HBV DNA、HDV RNA检测,采用原位杂交法。培养上清液中HBV DNA HDV RNA检测,采用斑点杂交法。同时设阳性对照、阴性对照、空白对照和替代对照。
2 结果
2.1 培养人胎肝细胞形态的动态变化
实验前(即培养后48 h)人胎肝细胞生长良好,肝细胞体积大,形态为扁平不规则多角形,细胞核清晰可见,肝细胞增殖活跃,基本铺满培养板孔底。实验组和对照组人胎肝细胞在培养后第18天一直维持正常的形态结构,自培养后第20天开始,人胎肝细胞逐渐死亡,脱落于培养液中。
2.2 HDV、HBV在人胎肝细胞中稳定复制表达
, 百拇医药
留存洗涤液中HBsAg、HDAg均呈阴性,感染后所有留存系列上清液中HBsAg、HDAg均呈阳性,HBsAg、HDAg在感染后第2天至第16天均可测出,以第4天至第12天达高峰,见图1。免疫组化检测细胞中HBsAg、HDAg均呈阳性表达,见图2、3,空白对照组均呈阴性表达,双重染色显示HBsAg表达较HDAg稍广泛,HBsAg、HDAg可在同一肝细胞中表达。原位杂交HBV DNA、HDV cDNA均呈阳性表达。上清中HBV DNA和HDV cDNA斑点杂交也均呈阳性表达。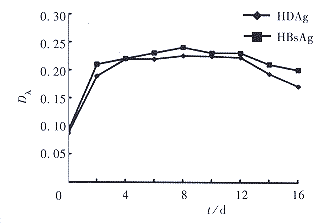
图1 HDV/HBV感染人胎肝细胞培养上清中HBsAg
和HDAg含量的动态曲线
Fig 1 Dynamic curves of HBsAg and HDAg
, 百拇医药
content in supernatant
图2 HDV/HBV感染后人胎肝细胞中有HBsAg表达(S-P×200)
Fig 2 Expression of HBsAg in the fetal hepatocytes after
HDV/HBV infection (S-P×200)
图3 HDV/HBV感染后人胎肝细胞中有HDAg表达(S-P×200)
, http://www.100md.com
Fig 3 Expression of HDAg in the fetal hepatocytes after
HDV/HBV infection (S-P×200)
3 讨论
由于丁型病毒性肝炎(HD)及其相关疾病的复杂性,对该病的多数研究必须借助体外实验进行。事实上,目前获得的有关HDV感染及复制机制、HDV基因调控、基因产物的功能、HDV与HBV相互作用机制等均得益于HDV基因转移或转染细胞株[2,3]。但有关研究尚存在许多不足,如细胞株不能完全模拟人体内肝细胞的生物学功能,用于研究HDV与肝细胞相互作用时,不能真实反映体内情况。用人胎肝细胞作为感染对象,建立HDV/HBV感染的人胎肝细胞体外培养系统,可很好解决上述不足。
要建立HDV/HBV感染人胎肝细胞体外培养系统,必须满足三个基本条件:①肝细胞体外培养达20 d以上;②肝细胞维持良好的增殖和分化功能;③HDV能在人胎肝细胞中稳定复制表达。肝细胞在体内受到来自门静脉血流的各种激素和细胞因子的调控,其中包括表皮生长因子、肝细胞生长因子、生长激素等,这些称为门脉嗜肝因子,能够促进和维持肝细胞的增殖和分化,有学者据此设计了一种条件培养液,添加各种激素、细胞因子和微量元素,称为激素限量培养液(Hormone defined medium,HDM),模拟肝细胞生长的环境,能够使原代培养的肝细胞维持良好的分化和增殖功能达50 d以上[4]。本研究采用该方法成功地培养人胎肝细胞达20 d以上。HBV体外感染肝细胞培养系统的建立,国内外有较多报道[5,6],而HDV/HBV体外感染肝细胞培养系统的建立,目前尚未见报道。本研究按照有关文献介绍的方法,成功地建立了HDV/HBV感染人胎肝细胞培养系统。鉴于长期体外培养人胎肝细胞有一定难度,故采用HBV、HDV同时感染方式感染人胎肝细胞,并在培养液中加入PEG以利HBV、HDV进入肝细胞。HDV的包装需HBsAg,故在培养液中加入DMSO以促进HBsAg的表达。
, 百拇医药
本研究发现,感染后第2天至第16天培养上清中可检出HBsAg,第4天至第12天达高峰,与国外有关文献报道一致,HDAg分泌与HBsAg相一致,以后HBsAg和HDAg分泌逐渐下降。分析其可能原因:培养早期细胞增殖较快,因细胞有接触抑制特性,细胞增殖到一定程度,增殖速度变慢,最后完全停止增殖,维持一定时间后,细胞开始死亡、脱落。
本研究认为HBV、HDV在人胎肝细胞中能稳定复制表达,其根据:①留存洗涤液标本中HBsAg和HDAg均呈阴性,斑点杂交示HBV DNA和HDV RNA也呈阴性,基本排除感染血清残留对实验造成的干扰;②细胞中HBsAg、HDAg、HBV DNA和HDV RNA均呈阳性,说明HBV和HDV已进入肝细胞;③由于每隔48 h更换培养液,系列培养上清中HBsAg、HDAg、HBV DNA和HDV RNA均呈阳性,且维持较前相同或稍高水平,有一分泌高峰,说明HBV和HDV及其表达的抗原持续分泌至培养液中。
HDV/HBV感染人胎肝细胞培养系统的建立虽是一初步研究,但却为HDV相关疾病的研究奠定了基础。
, 百拇医药
基金项目:国家自然科学基金资助项目(39570166)
作者简介:蒋业贵(1966.12),男,安徽省巢湖市人,博士研究生,住院医师, 主要从事病毒肝炎的发病机制及治疗,发表论文10篇。
蒋业贵(第三军医大学附属西南医院感染病科、全军传染病专科中心,重庆 400038)
李奇芬(第三军医大学附属西南医院感染病科、全军传染病专科中心,重庆 400038)
毛青(第三军医大学附属西南医院感染病科、全军传染病专科中心,重庆 400038)
王宇明(第三军医大学附属西南医院感染病科、全军传染病专科中心,重庆 400038)
顾长海(第三军医大学附属西南医院感染病科、全军传染病专科中心,重庆 400038)
, http://www.100md.com
参考文献
[1] 王宇明,陈国致,董家鸿,等.分离肝细胞的一种体外灌流法[J].中华消化杂志,1994,14(1):175-178.
[2] Wang C, Suny S Y, Chen D S, et al. Nlinked glycosylation of hepatitis B surface antigens is involved but not essential in the assembly of hepatitis delta virus[J]. Virology,1996, 220(1):28-36.
[3] Wu T T, Netter H J, Lazinski D W, et al. Effect of nucleotide changes on the ability of hepatitis delta virus to transcribe,process,and accumulate unitlength, circular RNA[J]. J Virol,1997,71(7):5 408-5 414.
, 百拇医药
[4] Rumin S, Gripon P, Seyec J L, et al. Longterm productive episomal hepatitis B virus replication in primary cultures of adult human hepatocytes infected in vitro[J]. J Virol Hepatol,1996,3(5):227-238.
[5] Jens H, Farideh F, Wolfgang S, et al. PHindependent uptake of hepatitis B virus in primary human hepatocytes[J].Virology,1997,229(2):292-294.
[6] Lu X, Block T M, Gerlich W H. Prolease induced infectivity of hepatitis B virus for a human hepatoblastoma cell line[J]. JVirol,1996,70(4):2 277-2 285., http://www.100md.com
蒋业贵 李奇芬 毛青 王宇明 顾长海
摘 要 目的:建立HDV/HBV感染人胎肝细胞体外培养系统。方法:利用HDV/HBV阳性血清同时感染体外培养的人胎肝细胞;应用ELISA、免疫组化法、原位杂交法和斑点法检测上清液和细胞中HBsAg、HDAg、HBV DNA和HDV cDNA。结果:上清液和细胞中HBsAg、HDAg、HBV DNA和HDV cDNA在感染后第2天至第16天均可测出,其中上清液中HBsAg、HDAg以感染后第4天至第12天达高峰。结论:HDV在原代培养人胎肝细胞中能稳定复制和表达至少达12 d。
关键词:丁型肝炎病毒;HDV/HBV感染;人胎肝细胞;细胞培养
, 百拇医药
目前,有关HDV的研究,主要是利用HDV基因转染细胞株,但这些细胞株不能完全模拟人体内肝细胞的生物学功能,用于研究HDV时,不能完全代表体内的情况。用人胎肝细胞作为感染对象,建立HDV/HBV感染人胎肝细胞培养系统,可很好解决上述不足。本研究应用HDV/HBV同时感染的方式感染人胎肝细胞,初步建立了HDV/HBV感染人胎肝细胞体外培养系统。
1 材料与方法
1.1 人胎肝细胞
人工流产22周龄胎儿肝脏,经体外两步灌流法分离肝细胞,台盼蓝染色细胞成活率达90%以上。
1.2 HDV/HBV感染血清
HBV感染血清取自本科-慢性乙型肝炎患者,ELISA检测HBsAg(+)、HBeAg(+)、抗HBc(+),血清斑点杂交HBV DNA(+),甲、丙、丁、戊、庚型肝炎病毒标志均为阴性。HDV感染血清取自本科-丁型肝炎患者,ELISA检测HDAg(+)、抗HD(+),血清斑点杂交HDV cDNA(+)。
, 百拇医药
1.3 实验方法
采用王宇明等[1]设计的体外两步灌注法首先分离出总肝脏细胞悬液,再以差速离心方法分离、纯化肝细胞。将分离的人胎肝细胞用含10%小牛血清(FBS)的1640培养液调整细胞浓度为4×105/ml,接种于24孔塑料培养板内,每孔含培养液0.5 ml(即每孔含细胞数为2×105个),每24 h更换培养液。培养48 h后,于培养液中同时加入HBV、HDV感染血清(终浓度均为10%),并在培养液中加入4%聚乙二醇(PEG)。37°C培养16 h(过夜)后,弃去上清液,细胞用1640培养液洗涤3次后(最后一次洗涤液留样待检),加入含10%FBS和2%二甲基亚砜(DMSO)的新鲜1640培养液(不含PEG)。每48 h更换培养液(培养液组成同前)。每48 h收集上清液和肝细胞。实验分为HDV/HBV同时感染组和空白对照组(无HDV/HBV感染)。
1.4 检测指标及方法
, http://www.100md.com
培养人胎肝细胞于培养后每隔2 d以倒置生物相差显微镜观察细胞形态变化过程及贴壁生长情况。培养上清液中HBsAg、HDAg检测,采用ELISA法。细胞中HBsAg、HDAg检测,采用免疫组化S-P法。细胞中HBV DNA、HDV RNA检测,采用原位杂交法。培养上清液中HBV DNA HDV RNA检测,采用斑点杂交法。同时设阳性对照、阴性对照、空白对照和替代对照。
2 结果
2.1 培养人胎肝细胞形态的动态变化
实验前(即培养后48 h)人胎肝细胞生长良好,肝细胞体积大,形态为扁平不规则多角形,细胞核清晰可见,肝细胞增殖活跃,基本铺满培养板孔底。实验组和对照组人胎肝细胞在培养后第18天一直维持正常的形态结构,自培养后第20天开始,人胎肝细胞逐渐死亡,脱落于培养液中。
2.2 HDV、HBV在人胎肝细胞中稳定复制表达
, 百拇医药
留存洗涤液中HBsAg、HDAg均呈阴性,感染后所有留存系列上清液中HBsAg、HDAg均呈阳性,HBsAg、HDAg在感染后第2天至第16天均可测出,以第4天至第12天达高峰,见图1。免疫组化检测细胞中HBsAg、HDAg均呈阳性表达,见图2、3,空白对照组均呈阴性表达,双重染色显示HBsAg表达较HDAg稍广泛,HBsAg、HDAg可在同一肝细胞中表达。原位杂交HBV DNA、HDV cDNA均呈阳性表达。上清中HBV DNA和HDV cDNA斑点杂交也均呈阳性表达。

图1 HDV/HBV感染人胎肝细胞培养上清中HBsAg
和HDAg含量的动态曲线
Fig 1 Dynamic curves of HBsAg and HDAg
, 百拇医药
content in supernatant

图2 HDV/HBV感染后人胎肝细胞中有HBsAg表达(S-P×200)
Fig 2 Expression of HBsAg in the fetal hepatocytes after
HDV/HBV infection (S-P×200)

图3 HDV/HBV感染后人胎肝细胞中有HDAg表达(S-P×200)
, http://www.100md.com
Fig 3 Expression of HDAg in the fetal hepatocytes after
HDV/HBV infection (S-P×200)
3 讨论
由于丁型病毒性肝炎(HD)及其相关疾病的复杂性,对该病的多数研究必须借助体外实验进行。事实上,目前获得的有关HDV感染及复制机制、HDV基因调控、基因产物的功能、HDV与HBV相互作用机制等均得益于HDV基因转移或转染细胞株[2,3]。但有关研究尚存在许多不足,如细胞株不能完全模拟人体内肝细胞的生物学功能,用于研究HDV与肝细胞相互作用时,不能真实反映体内情况。用人胎肝细胞作为感染对象,建立HDV/HBV感染的人胎肝细胞体外培养系统,可很好解决上述不足。
要建立HDV/HBV感染人胎肝细胞体外培养系统,必须满足三个基本条件:①肝细胞体外培养达20 d以上;②肝细胞维持良好的增殖和分化功能;③HDV能在人胎肝细胞中稳定复制表达。肝细胞在体内受到来自门静脉血流的各种激素和细胞因子的调控,其中包括表皮生长因子、肝细胞生长因子、生长激素等,这些称为门脉嗜肝因子,能够促进和维持肝细胞的增殖和分化,有学者据此设计了一种条件培养液,添加各种激素、细胞因子和微量元素,称为激素限量培养液(Hormone defined medium,HDM),模拟肝细胞生长的环境,能够使原代培养的肝细胞维持良好的分化和增殖功能达50 d以上[4]。本研究采用该方法成功地培养人胎肝细胞达20 d以上。HBV体外感染肝细胞培养系统的建立,国内外有较多报道[5,6],而HDV/HBV体外感染肝细胞培养系统的建立,目前尚未见报道。本研究按照有关文献介绍的方法,成功地建立了HDV/HBV感染人胎肝细胞培养系统。鉴于长期体外培养人胎肝细胞有一定难度,故采用HBV、HDV同时感染方式感染人胎肝细胞,并在培养液中加入PEG以利HBV、HDV进入肝细胞。HDV的包装需HBsAg,故在培养液中加入DMSO以促进HBsAg的表达。
, 百拇医药
本研究发现,感染后第2天至第16天培养上清中可检出HBsAg,第4天至第12天达高峰,与国外有关文献报道一致,HDAg分泌与HBsAg相一致,以后HBsAg和HDAg分泌逐渐下降。分析其可能原因:培养早期细胞增殖较快,因细胞有接触抑制特性,细胞增殖到一定程度,增殖速度变慢,最后完全停止增殖,维持一定时间后,细胞开始死亡、脱落。
本研究认为HBV、HDV在人胎肝细胞中能稳定复制表达,其根据:①留存洗涤液标本中HBsAg和HDAg均呈阴性,斑点杂交示HBV DNA和HDV RNA也呈阴性,基本排除感染血清残留对实验造成的干扰;②细胞中HBsAg、HDAg、HBV DNA和HDV RNA均呈阳性,说明HBV和HDV已进入肝细胞;③由于每隔48 h更换培养液,系列培养上清中HBsAg、HDAg、HBV DNA和HDV RNA均呈阳性,且维持较前相同或稍高水平,有一分泌高峰,说明HBV和HDV及其表达的抗原持续分泌至培养液中。
HDV/HBV感染人胎肝细胞培养系统的建立虽是一初步研究,但却为HDV相关疾病的研究奠定了基础。
, 百拇医药
基金项目:国家自然科学基金资助项目(39570166)
作者简介:蒋业贵(1966.12),男,安徽省巢湖市人,博士研究生,住院医师, 主要从事病毒肝炎的发病机制及治疗,发表论文10篇。
蒋业贵(第三军医大学附属西南医院感染病科、全军传染病专科中心,重庆 400038)
李奇芬(第三军医大学附属西南医院感染病科、全军传染病专科中心,重庆 400038)
毛青(第三军医大学附属西南医院感染病科、全军传染病专科中心,重庆 400038)
王宇明(第三军医大学附属西南医院感染病科、全军传染病专科中心,重庆 400038)
顾长海(第三军医大学附属西南医院感染病科、全军传染病专科中心,重庆 400038)
, http://www.100md.com
参考文献
[1] 王宇明,陈国致,董家鸿,等.分离肝细胞的一种体外灌流法[J].中华消化杂志,1994,14(1):175-178.
[2] Wang C, Suny S Y, Chen D S, et al. Nlinked glycosylation of hepatitis B surface antigens is involved but not essential in the assembly of hepatitis delta virus[J]. Virology,1996, 220(1):28-36.
[3] Wu T T, Netter H J, Lazinski D W, et al. Effect of nucleotide changes on the ability of hepatitis delta virus to transcribe,process,and accumulate unitlength, circular RNA[J]. J Virol,1997,71(7):5 408-5 414.
, 百拇医药
[4] Rumin S, Gripon P, Seyec J L, et al. Longterm productive episomal hepatitis B virus replication in primary cultures of adult human hepatocytes infected in vitro[J]. J Virol Hepatol,1996,3(5):227-238.
[5] Jens H, Farideh F, Wolfgang S, et al. PHindependent uptake of hepatitis B virus in primary human hepatocytes[J].Virology,1997,229(2):292-294.
[6] Lu X, Block T M, Gerlich W H. Prolease induced infectivity of hepatitis B virus for a human hepatoblastoma cell line[J]. JVirol,1996,70(4):2 277-2 285., http://www.100md.com