阵发性心房颤动的电生理机制及导管射频消融的初步研究
阵发性心房颤动的电生理机制及导管射频消融的初步研究
单其俊 曹克将 邹建刚 陈明龙 廖铭扬 李闻奇 黄元铸
摘 要 目的 探讨阵发性心房颤动(房颤)的电生理机制和右房峡部消融对房颤的影响。方法 1995年6月~1999年6月,15例药物治疗无效的阵发性房颤,男性8例,女性7例,年龄(56±9)岁,病程(7±4)年,消融前3个月平均每月发作6次至每日数十次不等,发作时均有明显症状;对照组15例房室结折返性室上性心动过速,男性5例,女性10例,年龄(57±6)岁。电生理检查及消融,房颤组和对照组均测量房室结正向和逆向传导文氏点(Wenckebach point)。程序电刺激诱发房颤;在右房峡部线性消融。结果 房颤组房室结正、逆向文氏点分别为(340±38)ms和(618±75) ms,两者差异具有显著性(P<0.001);对照组正、逆向文氏点分别为(345±52)ms和(338±48) ms,两者之间差异无显著性(P>0.05);两组间正、逆向文氏点离散度差异(正、逆向文氏点之差)具有显著性(P<0.001)。房颤组可用短阵快速刺激(burst)诱发房颤,9例房颤由心房扑动(房扑)蜕变而成,7例消融后即刻成功,随防3个月~4年,3例无房颤复发,1例随访时间最长达3年6个月;其余病例房颤发作频度较术前减少70%~95%。结论 部分阵发性房颤患者在右房内与房扑一样存在大折返环,这些患者房颤由房扑蜕变而来,右房内的大折返环及其特殊电生理特性及房室结正、逆向文氏点离散度增大可能在房颤和房扑的诱发及维持中起着重要作用。右房下后部峡部线性消融可防止部分阵发性房颤复发或减少其发作频度及改善症状。
, 百拇医药
关键词:心房颤动;心房扑动;导管射频消融
心房颤动(atrial fibrillation,AF)是临床上最常见的心律失常之一,临床AF诊断是基于体表心电图,而不是心内电图的特征,由于受现有标测技术限制,心内电图尚不能全面地观察AF究竟是单纯的多个子波折返,或大小折返并存,或是先由大折返然后再蜕变成多子波。临床实践发现心房扑动(atrial flutter,AFL,房扑)和AF之间存在着密切联系,AF和AFL之间的关系如何?即许多类型的AF发作前整个心房短时间内是否由单个“房扑波”所驱动的,然后蜕变成具有多个子波特征的AF?
资料和方法
临床资料 1995年6月~1999年6月共治疗15例阵发性AF,男性8例,女性7例,年龄(56±9)岁(45~68岁),病程(7±4)年(1.5~13.0年),导管射频消融前3个月发作每月6次至每天数十次不等,最快心室率(185±21)次/min(166~220次/min),均伴有明显症状,使用抗心律失常药物3~6(3.3±1.4)种不能控制发作。1例使用胺碘酮治疗出现严重的肺间质纤维化致肺功能障碍伴咯血和甲状腺肿大。对照组15例房室结折返性心动过速,男性5例,女性10例,年龄(57±6)岁,超声心动图和X线胸片检查正常。
, 百拇医药
电生理检查 术前停用抗心律失常药物5个半衰期,服用胺碘酮者停药6个月以上。术前6 h禁食。常规放置冠状静脉窦、高位右房、希氏束和右心室导管。多导生理仪为Mingograf 82或Quinton EP L ab。常规测量AH、HV间期和校正窦房结恢复时间,房室结正向和逆向文氏点(Wenckebach point)。采用右房程序刺激或短阵快速刺激(burst),观察AF的诱发方式。
导管射频消融 完成电生理检查后,经右侧股静脉插入7 F大头消融导管(Webster,消融电极4 mm),在窦性心律或持续AF(AF持续时间>30 s)时对三尖瓣环至下腔静脉口之间连线行线性消融。能量选择15~25 W,每次放电时间30~100 s。成功标准:上述线性消融3次,不再诱发AF或诱发AF持续时间<30 s;若仍能诱发,再消融3次,对于再诱发者,则消融“慢径”,至心室率减少>30%。术后复测AH、HV间期和校正窦房结恢复时间。
随访 每3个月随访1次,包括有无AF复发、发作频度、持续时间和是否需要用药物控制等,有条件者作动态心电图检查。随访方式:门诊、电话和信访。
, 百拇医药
统计学处理 采用均数±标准差和t检验,P<0.05为差异有显著性。
结 果
电生理检查和心律失常诱发情况 房颤组的AH和HV间期分别为(77.5±10.4) ms和(50.2±6.5) ms,校正窦房结恢复时间为(470.8±56.3) ms,正向和逆向文氏点分别为(340±38) ms和(618±75) ms(P<0.001)。对照组则正向和逆向文氏点分别为(345±52) ms和(338±48) ms(P>0.05);AF患者正、逆向文氏点的离散度(逆向和正向文氏点之差)与对照组相比差异具有显著性(P<0.001)。所有患者用程序刺激不易诱发AF,而用短阵快速刺激(脉冲周长200 ms和300 ms)可诱发AF,其中9例在诱发出右房峡部依赖的AFL后数秒至10余分钟后蜕变为AF,如图1所示。
导管射频消融 11例在窦性心律下消融,4例在持续AF下消融。7例消融即刻成功;8例未成功者均在窦性心律下行房室结慢径改良术,3例房颤时心室率减少>30%。平均使用能量(20±5) W,放电时间(1264±136) s,X线曝光时间(56±20) min。放电后AF终止如图2所示,同时发现终止前放电的过程中多次出现单个窦性夺获搏动的情况,如图3所示。所有患者消融后AH、HV间期和校正窦房结恢复时间与术前相比无明显变化,除靠近冠状窦口和下腔静脉口附近消融时有疼痛感觉外,无其它并发症。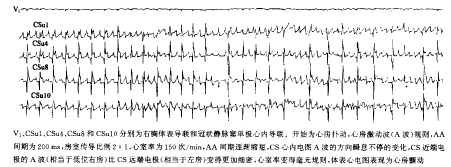
, 百拇医药
V1、CSu1、CSu4、CSu8和CSu10分别为右胸体表导联和冠状静脉窦单极心内导联。开始为心房扑动,心房激动波(A波)规则,AA间期为200 ms,房室传导比例2∶1,心室率为150次/min,AA间期逐渐缩短,CS心内电图A波的方向瞬息不停的变化,CS近端电极的A波(相当于低位右房)比CS远端电极(相当于左房)变得更加细密,心室率变得毫无规则,体表心电图表现为心房颤动
图1 心房扑动蜕变成心房颤动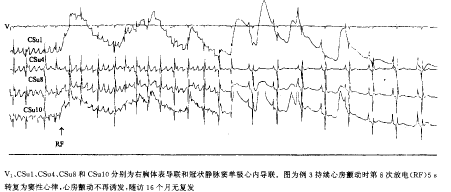
V1、CSu1、CSu4、CSu8和CSu10分别为右胸体表导联和冠状静脉窦单极心内导联。图为例3持续心房颤动时第8次放电(RF)5 s转复为窦性心律,心房颤动不再诱发,随访16个月无复发
, http://www.100md.com
图2 持续心房颤动射频消融转复为窦性节律
T为连续记录时间标记,V1、CSu1、CSu4、CSu8和CSu10分别为右胸体表导联和冠状静脉窦单极心内导联。 箭头所示为单个窦性夺获
图3 持续心房颤动消融时出现单个窦性夺获
随访结果 随访3个月~4年,3例无AF复发;其中1例随访长达3年6个月无房颤复发;1例消融后仍有房性心动过速且自行终止后有>1.5 s的长间歇,患者要求安装VVI起搏器;未成功者和复发者AF发作频度减少70%~95%,持续时间明显缩短。4例用Ic类抗心律失常药物治疗,1例术后用胺碘酮治疗。
, 百拇医药
讨 论
AF的机制包括:①多个子波折返;②单个异位灶(focus);③多个异位灶。Cox等[1,2]对AF电生理标测发现,从简单的AFL到复杂的AF,右房内的大折返AFL的原因,在AF患者同样存在。左房内未发现有大折返。AF可由单个折返引起,复杂的则由多折返引起,从而设计了迷宫手术,试图切断所有折返环并取得了成功。Swartz等[3]用仿迷宫术对34例房颤患者进行射频消融,80%成功。Haissaguerre等[4]射频消融15例AF,87%成功。但由于手术和消融的复杂性和并发症未能在临床上广泛应用。“Ic类抗心律失常药物房扑(class Ic atrial flutter,IcAFL)”是最近提出的新概念,是指AF患者用Ic类心律失常药物后,10%左右发生持续性AFL。Schumacher等[5]报道187例阵发性AF,用氟卡胺和普罗帕酮(心律平)治疗,24例发生AFL,19/20例典型AFL经射频消融成功,继续用药物治疗,平均随访11个月,7例无复发,8例发作明显减少,4例无效。Nabar等[6,7]报道14例IcAFL射频消融后药物治疗的结果,平均随访4个月,9例无复发,2例发作明显减少。Calkins等[8]对15例AF进行右房峡部线性消融前瞻性研究,14例即刻有效,短期随访12例复发。无论是外科迷宫术或仿迷宫术的射频消融术,右房峡部均需阻断。这说明右房内的AFL大折返在这一亚组患者AF维持机制中起重要作用。本研究发现15例临床上诊断为AF,9例电刺激先诱发AFL然后蜕变成AF。同时发现阵发性AF患者正向与逆向房室文氏点离散度明显增大,其组内和与房室结折返性心动过速组间差异均有显著性,其在阵发性AF机制中的作用尚不清楚,国内外文献检索未见报道。Yamashita等[9]、Olgin等[10] 和Sung等[11]研究表明房室结正、逆向文氏点除了房室结的作用外,还与右房下部和房间隔的房室结前上方纤维不应期有关,而心房肌离散度增大正是发生AF的一个重要因素。Saksena等[12]用右心耳和冠状静脉窦双心房电极起搏可防止部分患者阵发性AF的复发,分析认为可能是降低了这两个部位不应期的离散度。
, 百拇医药
Haissaguerre等[13]提出了局灶性AF概念。通过消融触发AF的房性早搏,防止阵发性AF发生,房早主要位于肺静脉入口处。Lau等[14]对44例持续性AF进行心内电除颤发现16例在2 min内复发,9例由房性早搏诱发,7例进行房性早搏成功的标测和消融,均在肺静脉口内(4例右上肺静脉,3例左上肺静脉),消融后平均随访(8±4)个月无AF复发,但心房刺激仍可诱发AF。说明AF的触发机制得到治疗但其维持机制仍然存在。目前局灶性AF的射频消融还存在一些问题如房性早搏的诱发、消融的终点、心包填塞、肺静脉狭窄及后继发生的房性早搏是否还会触发AF等。
消融右房峡部未成功的AF患者,其AF发作频度减少,机制尚不清楚,除峡部未形成双向阻滞或阻滞后又恢复传导外,可能与右房下部消融降低了迷走神经的张力有关;或是消融了右房下部,减少了其与房室结前上方房间隔部不应期离散度。
本研究不足之处有:①2/3消融后未验证峡部是否形成双向阻滞;②未对右房和左房其它可能存在折返环进行标测和消融;③未对AF触发因素如房性早搏和房性心动过速进行标测和消融。
, 百拇医药
结论 本研究结果提示,部分阵发性AF的患者与AFL一样与右房内大折返有关。AF可由AFL蜕变而来,AF和AFL可以相互转变,三尖瓣环上方心房肌特殊解剖结构和电生理特征及房室结正向与逆向文氏点的离散度增大,可能在AFL和AF的诱发和维持中起着重要的作用。部分阵发性AF患者可通过右房峡部的消融防止AF的复发或减少其发作频度而减轻症状。
作者单位:单其俊(南京医科大学第一附属医院心脏科 210029)
曹克将(南京医科大学第一附属医院心脏科 210029)
邹建刚(南京医科大学第一附属医院心脏科 210029)
陈明龙(南京医科大学第一附属医院心脏科 210029)
廖铭扬(南京医科大学第一附属医院心脏科 210029)
, http://www.100md.com
李闻奇(南京医科大学第一附属医院心脏科 210029)
黄元铸(南京医科大学第一附属医院心脏科 210029)
参考文献
1,Cox JL,Canavan TE,Schuessler RB,et al.The surgical treatment of atrial fibrillation.ll.Intraoperative electrophysiologic basis of atrial flutter and atrial fibrillation.Thorac Cadiovasc Surg,1991,101∶406-426.
2,Cox JL,Louis S.The surgical treatment of atrial fibrillation.IV.surgical technique.Thorac Cardiovasc Surg,1991,101∶584-592.
, http://www.100md.com
3,Swartz JF,Pellersels G,Silvers M,et al.A catheter based curative approach to atrial fibrillation in humans.Circulation,1994,90∶1-335.
4,Haissaguerre M,Shah DC,Jais P,et al.Role of catheter ablation for atrial fibrillation.Current Opinion in Cardiology,1997,12∶18-23.
5,Schumacher B,Jung W,Lewalter T,et al.Radiofrenquency ablation of atrial flutter due to administration of class Ic antiarrhythmic drugs for atrial fibrillation.Am J Cardiol,1999,83∶710-713.
, 百拇医药
6,Nabar A,Rodriguez LM,Timmermans C,et al.Radiofrequency ablation of “class Ic atrial flutter ” in patients with resistant atrial fibrillation.Am J Cardiol,1999,83∶785-787.
7,Nabar A,Rodriguez LM,Timmermans C,et al.Effect of right atrial isthmus ablation on the occurrence of atrial fibrillation.Circulation.1999,99∶1441-1445.
8,Calkins H,Hall J,Ellenbogen K,et al.A new system for catheter ablation of atrial fibrillation.Am J Cardiol,1999,83∶227D-236D.
, 百拇医药
9,Yamashita T,Oikswa N,Inoue H,et al.Slow abnormal conduction in the low right atrirm:its anatomic basis and relevance to atrial reentry.Am Heart J,1994,127∶353-359.
10,Olgin JE,Kalman JM,Saxon LA,et al.Mechanism of initiation of atrial flutter in human:site of unidirectional block and direction of rotation.J Am Coll Cardiol,1997,29∶376-384.
11,Sung RJ,Waxmax HL,Saksena S,et al.Sequence of retrograde atrial activation in patients with dual atrioventricular nodal pathways.Circulation,1981,64∶1059-1067.
, 百拇医药
12,Saksena S,Prakash A,Hill M,et al.Prevention of recurrent atrial fibrillation with chronic dual-site right atrial pacing.J Am Coll Cardiol,1996,28∶687-697.
13,Haissaguerre M,Jais P,Shah DC,et al.Spontaneous initiation of atral fibrillation by ectopic beats originating in the pulmonary veins.N Engl J Med,1998,339∶659-666.
14,Lau CK,Tse HF,Ayers GM,et al.Defibrillation-guided radiofrequency ablation of atrial fibrillation secondary to an atrial focus.J Am Coll Cardiol,1999,33∶1217-1226., 百拇医药
单其俊 曹克将 邹建刚 陈明龙 廖铭扬 李闻奇 黄元铸
摘 要 目的 探讨阵发性心房颤动(房颤)的电生理机制和右房峡部消融对房颤的影响。方法 1995年6月~1999年6月,15例药物治疗无效的阵发性房颤,男性8例,女性7例,年龄(56±9)岁,病程(7±4)年,消融前3个月平均每月发作6次至每日数十次不等,发作时均有明显症状;对照组15例房室结折返性室上性心动过速,男性5例,女性10例,年龄(57±6)岁。电生理检查及消融,房颤组和对照组均测量房室结正向和逆向传导文氏点(Wenckebach point)。程序电刺激诱发房颤;在右房峡部线性消融。结果 房颤组房室结正、逆向文氏点分别为(340±38)ms和(618±75) ms,两者差异具有显著性(P<0.001);对照组正、逆向文氏点分别为(345±52)ms和(338±48) ms,两者之间差异无显著性(P>0.05);两组间正、逆向文氏点离散度差异(正、逆向文氏点之差)具有显著性(P<0.001)。房颤组可用短阵快速刺激(burst)诱发房颤,9例房颤由心房扑动(房扑)蜕变而成,7例消融后即刻成功,随防3个月~4年,3例无房颤复发,1例随访时间最长达3年6个月;其余病例房颤发作频度较术前减少70%~95%。结论 部分阵发性房颤患者在右房内与房扑一样存在大折返环,这些患者房颤由房扑蜕变而来,右房内的大折返环及其特殊电生理特性及房室结正、逆向文氏点离散度增大可能在房颤和房扑的诱发及维持中起着重要作用。右房下后部峡部线性消融可防止部分阵发性房颤复发或减少其发作频度及改善症状。
, 百拇医药
关键词:心房颤动;心房扑动;导管射频消融
心房颤动(atrial fibrillation,AF)是临床上最常见的心律失常之一,临床AF诊断是基于体表心电图,而不是心内电图的特征,由于受现有标测技术限制,心内电图尚不能全面地观察AF究竟是单纯的多个子波折返,或大小折返并存,或是先由大折返然后再蜕变成多子波。临床实践发现心房扑动(atrial flutter,AFL,房扑)和AF之间存在着密切联系,AF和AFL之间的关系如何?即许多类型的AF发作前整个心房短时间内是否由单个“房扑波”所驱动的,然后蜕变成具有多个子波特征的AF?
资料和方法
临床资料 1995年6月~1999年6月共治疗15例阵发性AF,男性8例,女性7例,年龄(56±9)岁(45~68岁),病程(7±4)年(1.5~13.0年),导管射频消融前3个月发作每月6次至每天数十次不等,最快心室率(185±21)次/min(166~220次/min),均伴有明显症状,使用抗心律失常药物3~6(3.3±1.4)种不能控制发作。1例使用胺碘酮治疗出现严重的肺间质纤维化致肺功能障碍伴咯血和甲状腺肿大。对照组15例房室结折返性心动过速,男性5例,女性10例,年龄(57±6)岁,超声心动图和X线胸片检查正常。
, 百拇医药
电生理检查 术前停用抗心律失常药物5个半衰期,服用胺碘酮者停药6个月以上。术前6 h禁食。常规放置冠状静脉窦、高位右房、希氏束和右心室导管。多导生理仪为Mingograf 82或Quinton EP L ab。常规测量AH、HV间期和校正窦房结恢复时间,房室结正向和逆向文氏点(Wenckebach point)。采用右房程序刺激或短阵快速刺激(burst),观察AF的诱发方式。
导管射频消融 完成电生理检查后,经右侧股静脉插入7 F大头消融导管(Webster,消融电极4 mm),在窦性心律或持续AF(AF持续时间>30 s)时对三尖瓣环至下腔静脉口之间连线行线性消融。能量选择15~25 W,每次放电时间30~100 s。成功标准:上述线性消融3次,不再诱发AF或诱发AF持续时间<30 s;若仍能诱发,再消融3次,对于再诱发者,则消融“慢径”,至心室率减少>30%。术后复测AH、HV间期和校正窦房结恢复时间。
随访 每3个月随访1次,包括有无AF复发、发作频度、持续时间和是否需要用药物控制等,有条件者作动态心电图检查。随访方式:门诊、电话和信访。
, 百拇医药
统计学处理 采用均数±标准差和t检验,P<0.05为差异有显著性。
结 果
电生理检查和心律失常诱发情况 房颤组的AH和HV间期分别为(77.5±10.4) ms和(50.2±6.5) ms,校正窦房结恢复时间为(470.8±56.3) ms,正向和逆向文氏点分别为(340±38) ms和(618±75) ms(P<0.001)。对照组则正向和逆向文氏点分别为(345±52) ms和(338±48) ms(P>0.05);AF患者正、逆向文氏点的离散度(逆向和正向文氏点之差)与对照组相比差异具有显著性(P<0.001)。所有患者用程序刺激不易诱发AF,而用短阵快速刺激(脉冲周长200 ms和300 ms)可诱发AF,其中9例在诱发出右房峡部依赖的AFL后数秒至10余分钟后蜕变为AF,如图1所示。
导管射频消融 11例在窦性心律下消融,4例在持续AF下消融。7例消融即刻成功;8例未成功者均在窦性心律下行房室结慢径改良术,3例房颤时心室率减少>30%。平均使用能量(20±5) W,放电时间(1264±136) s,X线曝光时间(56±20) min。放电后AF终止如图2所示,同时发现终止前放电的过程中多次出现单个窦性夺获搏动的情况,如图3所示。所有患者消融后AH、HV间期和校正窦房结恢复时间与术前相比无明显变化,除靠近冠状窦口和下腔静脉口附近消融时有疼痛感觉外,无其它并发症。

, 百拇医药
V1、CSu1、CSu4、CSu8和CSu10分别为右胸体表导联和冠状静脉窦单极心内导联。开始为心房扑动,心房激动波(A波)规则,AA间期为200 ms,房室传导比例2∶1,心室率为150次/min,AA间期逐渐缩短,CS心内电图A波的方向瞬息不停的变化,CS近端电极的A波(相当于低位右房)比CS远端电极(相当于左房)变得更加细密,心室率变得毫无规则,体表心电图表现为心房颤动
图1 心房扑动蜕变成心房颤动

V1、CSu1、CSu4、CSu8和CSu10分别为右胸体表导联和冠状静脉窦单极心内导联。图为例3持续心房颤动时第8次放电(RF)5 s转复为窦性心律,心房颤动不再诱发,随访16个月无复发
, http://www.100md.com
图2 持续心房颤动射频消融转复为窦性节律

T为连续记录时间标记,V1、CSu1、CSu4、CSu8和CSu10分别为右胸体表导联和冠状静脉窦单极心内导联。 箭头所示为单个窦性夺获
图3 持续心房颤动消融时出现单个窦性夺获
随访结果 随访3个月~4年,3例无AF复发;其中1例随访长达3年6个月无房颤复发;1例消融后仍有房性心动过速且自行终止后有>1.5 s的长间歇,患者要求安装VVI起搏器;未成功者和复发者AF发作频度减少70%~95%,持续时间明显缩短。4例用Ic类抗心律失常药物治疗,1例术后用胺碘酮治疗。
, 百拇医药
讨 论
AF的机制包括:①多个子波折返;②单个异位灶(focus);③多个异位灶。Cox等[1,2]对AF电生理标测发现,从简单的AFL到复杂的AF,右房内的大折返AFL的原因,在AF患者同样存在。左房内未发现有大折返。AF可由单个折返引起,复杂的则由多折返引起,从而设计了迷宫手术,试图切断所有折返环并取得了成功。Swartz等[3]用仿迷宫术对34例房颤患者进行射频消融,80%成功。Haissaguerre等[4]射频消融15例AF,87%成功。但由于手术和消融的复杂性和并发症未能在临床上广泛应用。“Ic类抗心律失常药物房扑(class Ic atrial flutter,IcAFL)”是最近提出的新概念,是指AF患者用Ic类心律失常药物后,10%左右发生持续性AFL。Schumacher等[5]报道187例阵发性AF,用氟卡胺和普罗帕酮(心律平)治疗,24例发生AFL,19/20例典型AFL经射频消融成功,继续用药物治疗,平均随访11个月,7例无复发,8例发作明显减少,4例无效。Nabar等[6,7]报道14例IcAFL射频消融后药物治疗的结果,平均随访4个月,9例无复发,2例发作明显减少。Calkins等[8]对15例AF进行右房峡部线性消融前瞻性研究,14例即刻有效,短期随访12例复发。无论是外科迷宫术或仿迷宫术的射频消融术,右房峡部均需阻断。这说明右房内的AFL大折返在这一亚组患者AF维持机制中起重要作用。本研究发现15例临床上诊断为AF,9例电刺激先诱发AFL然后蜕变成AF。同时发现阵发性AF患者正向与逆向房室文氏点离散度明显增大,其组内和与房室结折返性心动过速组间差异均有显著性,其在阵发性AF机制中的作用尚不清楚,国内外文献检索未见报道。Yamashita等[9]、Olgin等[10] 和Sung等[11]研究表明房室结正、逆向文氏点除了房室结的作用外,还与右房下部和房间隔的房室结前上方纤维不应期有关,而心房肌离散度增大正是发生AF的一个重要因素。Saksena等[12]用右心耳和冠状静脉窦双心房电极起搏可防止部分患者阵发性AF的复发,分析认为可能是降低了这两个部位不应期的离散度。
, 百拇医药
Haissaguerre等[13]提出了局灶性AF概念。通过消融触发AF的房性早搏,防止阵发性AF发生,房早主要位于肺静脉入口处。Lau等[14]对44例持续性AF进行心内电除颤发现16例在2 min内复发,9例由房性早搏诱发,7例进行房性早搏成功的标测和消融,均在肺静脉口内(4例右上肺静脉,3例左上肺静脉),消融后平均随访(8±4)个月无AF复发,但心房刺激仍可诱发AF。说明AF的触发机制得到治疗但其维持机制仍然存在。目前局灶性AF的射频消融还存在一些问题如房性早搏的诱发、消融的终点、心包填塞、肺静脉狭窄及后继发生的房性早搏是否还会触发AF等。
消融右房峡部未成功的AF患者,其AF发作频度减少,机制尚不清楚,除峡部未形成双向阻滞或阻滞后又恢复传导外,可能与右房下部消融降低了迷走神经的张力有关;或是消融了右房下部,减少了其与房室结前上方房间隔部不应期离散度。
本研究不足之处有:①2/3消融后未验证峡部是否形成双向阻滞;②未对右房和左房其它可能存在折返环进行标测和消融;③未对AF触发因素如房性早搏和房性心动过速进行标测和消融。
, 百拇医药
结论 本研究结果提示,部分阵发性AF的患者与AFL一样与右房内大折返有关。AF可由AFL蜕变而来,AF和AFL可以相互转变,三尖瓣环上方心房肌特殊解剖结构和电生理特征及房室结正向与逆向文氏点的离散度增大,可能在AFL和AF的诱发和维持中起着重要的作用。部分阵发性AF患者可通过右房峡部的消融防止AF的复发或减少其发作频度而减轻症状。
作者单位:单其俊(南京医科大学第一附属医院心脏科 210029)
曹克将(南京医科大学第一附属医院心脏科 210029)
邹建刚(南京医科大学第一附属医院心脏科 210029)
陈明龙(南京医科大学第一附属医院心脏科 210029)
廖铭扬(南京医科大学第一附属医院心脏科 210029)
, http://www.100md.com
李闻奇(南京医科大学第一附属医院心脏科 210029)
黄元铸(南京医科大学第一附属医院心脏科 210029)
参考文献
1,Cox JL,Canavan TE,Schuessler RB,et al.The surgical treatment of atrial fibrillation.ll.Intraoperative electrophysiologic basis of atrial flutter and atrial fibrillation.Thorac Cadiovasc Surg,1991,101∶406-426.
2,Cox JL,Louis S.The surgical treatment of atrial fibrillation.IV.surgical technique.Thorac Cardiovasc Surg,1991,101∶584-592.
, http://www.100md.com
3,Swartz JF,Pellersels G,Silvers M,et al.A catheter based curative approach to atrial fibrillation in humans.Circulation,1994,90∶1-335.
4,Haissaguerre M,Shah DC,Jais P,et al.Role of catheter ablation for atrial fibrillation.Current Opinion in Cardiology,1997,12∶18-23.
5,Schumacher B,Jung W,Lewalter T,et al.Radiofrenquency ablation of atrial flutter due to administration of class Ic antiarrhythmic drugs for atrial fibrillation.Am J Cardiol,1999,83∶710-713.
, 百拇医药
6,Nabar A,Rodriguez LM,Timmermans C,et al.Radiofrequency ablation of “class Ic atrial flutter ” in patients with resistant atrial fibrillation.Am J Cardiol,1999,83∶785-787.
7,Nabar A,Rodriguez LM,Timmermans C,et al.Effect of right atrial isthmus ablation on the occurrence of atrial fibrillation.Circulation.1999,99∶1441-1445.
8,Calkins H,Hall J,Ellenbogen K,et al.A new system for catheter ablation of atrial fibrillation.Am J Cardiol,1999,83∶227D-236D.
, 百拇医药
9,Yamashita T,Oikswa N,Inoue H,et al.Slow abnormal conduction in the low right atrirm:its anatomic basis and relevance to atrial reentry.Am Heart J,1994,127∶353-359.
10,Olgin JE,Kalman JM,Saxon LA,et al.Mechanism of initiation of atrial flutter in human:site of unidirectional block and direction of rotation.J Am Coll Cardiol,1997,29∶376-384.
11,Sung RJ,Waxmax HL,Saksena S,et al.Sequence of retrograde atrial activation in patients with dual atrioventricular nodal pathways.Circulation,1981,64∶1059-1067.
, 百拇医药
12,Saksena S,Prakash A,Hill M,et al.Prevention of recurrent atrial fibrillation with chronic dual-site right atrial pacing.J Am Coll Cardiol,1996,28∶687-697.
13,Haissaguerre M,Jais P,Shah DC,et al.Spontaneous initiation of atral fibrillation by ectopic beats originating in the pulmonary veins.N Engl J Med,1998,339∶659-666.
14,Lau CK,Tse HF,Ayers GM,et al.Defibrillation-guided radiofrequency ablation of atrial fibrillation secondary to an atrial focus.J Am Coll Cardiol,1999,33∶1217-1226., 百拇医药