大鼠结缔组织生长因子部分cDNA序列的克隆及其mRNA在实验性肝纤维化中的表达
贾继东 Michael Bauer Gabriele Boigk Martin Ruelh Detlef Schuppan 王宝恩
摘 要 目的 克隆出大鼠结缔组织生长因子(connective tissue growth factor,CTGF)的部分cDNA序列,并观察在实验性肝纤维化大鼠肝脏中CTGF mRNA的表达改变。 方法 根据小鼠CTGF mRNA序列设计引物,用RT-PCR从大鼠肝脏总RNA中扩增出一段430bp的产物,并测定其序列。将16只雌性Wistar大鼠随机分为胆管堵塞组(n=8)及假手术组(n=8)。6周后取大鼠肝脏提取总RNA,利用多探针以核酸酶保护分析法测定CTGF及TGFβ1的mRNA水平。 结果 克隆出的大鼠CTGF cDNA序列在核酸水平与小鼠的同源性为95%。胆汁性肝硬化大鼠肝脏中TGFβ1及CTGF的mRNA水平分别为假手术组大鼠的4倍和7倍。 结论 在实验性肝纤维化大鼠肝脏中CTGF mRNA的表达水平明显上调。
, http://www.100md.com
关键词:肝纤维化;结缔组织;转化生长因子β1;生长因子
结缔组织生长因子(Connective tissue growth factor,CTGF)是一种新发现的细胞因子,在TGFβ1的诱导下由成纤维细胞等间质细胞产生,反过来又介导TGFβ1对间质细胞的作用,如促进其增殖及胶原合成[1]。CTGF已成为细胞外基质及纤维化领域新的研究热点。现在人们已经克隆出了小鼠、蛙、牛及人的CTGF mRNA 序列,并发现它在一些组织器发生纤维化时表达增加。但是,大鼠的CTGF核酸序列尚未克隆出来,亦无有关肝纤维化过程中CTGF表达改变的报道。为此,我们克隆出了大鼠CTGF cDNA的部分序列,并研究了其mRNA 水平在实验性肝纤维化中的变化。
材料与方法
1.大鼠部分CTGF cDNA序列的克隆:首先从胆管堵塞性肝纤维化大鼠之肝组织中提取总RNA,用oligo-dT作引物逆转录合成cDNA。根据小鼠CTGF (又称fisp-12)mRNA序列[2](GenBank accession number:M70642)设计PCR引物:正义引物, CAACCGCAAGATTGGAGTGT(第398-428核苷酸),反义引物,CTCCAGTCTGCAGAAGGTATTG(第827-805核苷酸)。经过预实验,选择57℃为退火温度,以热启动PCR经35个循环扩增出一个430bp的DNA片段。然后用T4连结酶把这一平末端DNA片段连接到pZErO-1(Invitrogen,NV leek, Netherlands)载体的EcoRⅤ位点上。将DNA的两条链直接测序后,用美国生物学信息中心的在线程序BLAST 2.0(http//:www.ncbi.nlm.nih.gov)将其与其它种属动物的cDNA序列进行比较。
, 百拇医药
2.胆管堵塞性肝纤维化模型的制备:取16只雌性 Wistar大鼠(250g左右),分为两组:胆管堵塞组8只,向大鼠胆总管内注入硬化剂(sodium amidotriazoate 0.2ml/kg),然后从远近端结扎并剪断之;假手术组8只,大鼠仅打开腹腔并游离胆总管,不注射硬化剂、也不结扎。6周后处死大鼠,取肝脏组织立即置于液氮中保存。
RNA酶保护分析测定肝脏TGFβ CTGF mRNA用体外转录方法合成[α32P]-UTP(NEN公司)标记的单链RNA探针:大鼠CTGF、TGFβ1和甘油醛3磷酸脱氢酶(GAPDH),以美国Ambion公司的RPAⅡ药盒进行RNA酶保护分析。其主要步骤为:取以一步法[3]提取的大鼠肝脏总RNA 20μl及上述三种探针各30000min-1加入20μl的杂交体系,45℃杂交16h;以RNase T1在37℃消化1h;将因杂交而被保护的放射性探针沉淀下来,于5%聚丙烯酰胺/8M尿素凝胶中电泳;将凝胶置于暗盒在-70℃进行放射自显影16h。冲洗X线片可见CTGF、TGFβ1和GAPDH三条带,其大小约为430,250,120碱基。用扫描仪将放射自显影片扫描进计算机,以美国NIH Image软件(美国国立卫生研究所研制)进行信号的光密度分析。 将CTGF mRNA及TGFβ1 mRNA的信号用GAPDH 校正得到其mRNA的相对丰度,用分组t检验分析肝纤维化组和假手术组的差别有无显著性。
, http://www.100md.com
结 果
1.大鼠CTGF cDNA序列与其它种属的同源性:用根据小鼠CTGF mRNA序列设计的引物,我们以RT-PCR法从大鼠肝脏RNA中扩增出一个430bp的 cDNA。去除引物区42bp的小鼠序列,这一大鼠cDNA与小鼠CTGF在mRNA水平有95%的同源性,在氨基酸水平有97%的同源性,说明它就是大鼠的CTGF序列。而且在推算的氨基酸水平,我们克隆的大鼠CTGF与人、猪CTGF有95%以上的同源性,与牛和蛙的CTGF有82%以上的同源性。
2.实验性大鼠肝纤维化是肝脏CTGF mRNA水平的改变:由图1和图2可见,在胆管堵塞性肝纤维化大鼠肝脏中,TGFβ1和CTGF mRNA的相对水平分别为0.34±0.09和0.22±0.08,显著高于正常对照组水平(0.09±0.02和0.03±0.01)t值分别为7.60和6.67,P值均<0.001)。
, 百拇医药
图1 核糖核酸酶保护分析测定结果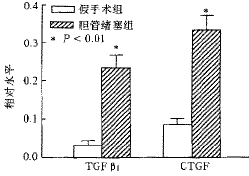
图2 CTGF和TGFβ1 mRNA表达水平的定量改变
讨 论
CTGF是富含半胱氨酸的多肽,最早从人的脐静脉内皮细胞中发现。在体内外TGFβ1可以特异性地诱导CTGF的表达,其它细胞因子如PDGF、EGF和 FGF[1]等无此作用。CTGF具有TGFβ1的一些生物学活性如刺激正常大鼠肾脏成纤维化细胞增殖并促进前胶原α1(Ⅰ)、纤维连接蛋白及整合素的α5 mRNA表达。但是,CTGF并不具备TGFβ1的所有功能,如刺激大鼠肾脏成纤维细胞的悬浮性生长及抑制貂肺上皮细胞的生长[1,4]。提示CTGF可能是TGFβ1部分生物学功能(如促进成纤维细胞的增殖及细胞外间质产生)的下游介质[5],它在组织器官纤维化的发生中可能起重要作用。我们克隆出了大鼠CTGF的部分cDNA序列并首次观察了CTGF mRNA在实验性肝维化中的变化。经直接测序后与其它种属动物的cDNA相比较,发现大鼠CTGF与小鼠及其它种属动物的CTGF有很高的同源性,说明其在进化中较为保守,也提示它在生物体内有较为重要的功能。我们采用非常敏感、特异而且更适于定量测定mRNA的水平的RNA酶保护分析技术发现,胆管堵塞性肝纤维化大鼠肝脏之TGFβ1水平为假手术组大鼠的4倍,CTGF mRNA为7倍,这与在皮肤、血管、肾及肺纤维化时表达增加一致[6,7]。
, 百拇医药
本实验结果不仅再次证明了CTGF在器官纤维化发生中起重要作用,也为探索抗纤维化治疗策略提供了新的思路。一般认为TGFβ1是促进纤维化发展的最重要的细胞因子之一,它既可促进细胞外基质的合成又可抑制其降解。但是,TGFβ1作用的靶细胞种类多、效应复杂,因此完全阻断其表达或活性的后果是难以预料的。例如,去除TGFβ1基因的小鼠因失去对炎症过程的抑制而在出生后很快死于全身性炎症[8]。与此相反,在正常状态下CTGF表达水平很低,而且主要在间质细胞中表达[7],其作用也限于结缔组织[1]。推论阻断CTGF的表达或抑制其生物活性可能是更特异、更有效的治疗纤维化的手段。因此,进一步深入研究CTGF在正常及纤维化肝脏中的细胞来源、表达调控具有重要意义。
贾继东,男,38岁,博士,副教授,肝病研究中心主任,主要从事慢性肝病肝纤维化的临床及基础研究,发表论文20余篇,曾获北京市、卫生部用国家科技进步奖各一项
贾继东(100050 北京,北京友谊医院肝病研究中心)
, http://www.100md.com
Michael Bauer(德国爱兰根大学医院内科)
Gabriele Boigk(德国爱兰根大学医院内科)
Martin Ruelh(德国爱兰根大学医院内科)
Detlef Schuppan(德国爱兰根大学医院内科)
王宝恩(100050 北京,北京友谊医院肝病研究中心)
参考文献
[1]Frazier K,Williams S,Kothapalli D,et al. Stimulation of fibroblast cell growth,matrix production,and granulation tissue formation by connective tissue growth factor. J Invest Dermatol,1996,107: 404-411.
, http://www.100md.com
[2]Ryseck RP,Macdonald-Bravo H,Mattei MG,et al. Structure,mapping,and expression of fisp-12,a growth factor-inducible gene encoding a secreted cysteine-rich protein. Cell Growth Differ,1991,2: 225-233.
[3]Chomczynski P,Sacchi N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Anal Biochem,1987,162: 156-159.
[4]Kothapalli D,Frazier KS,Welply A,et al. Transforming growth factor beta induces anchorage-independent growth of NRK fibroblasts via a connective tissue growth factor-dependent signaling pathway. Cell Growth Differ,1997,8: 61-68.
, http://www.100md.com
[5]Grotendorst GR. Connective tissue growth factor: a mediator of TGF-beta action on fibroblasts. Cytokine Growth Factor Rev,1997,8: 171-179.
[6]Haustein UF,Anderegg U. Pathophysiology of scleroderma: an update. J Eur Acad Dermatol Venereol,1998,11: 1-8.
[7]Ito Y,Aten J,Bende RJ,et al. Expression of connective tissue growth factor in human renal fibrosis. Kidney Int,1998,53: 853-861.
[8]Letterio JJ,Bottinger EP. TGF-beta knockout and dominant-negative receptor transgenic mice. Miner Electrolyte Metab,1998,24: 161-167., http://www.100md.com
摘 要 目的 克隆出大鼠结缔组织生长因子(connective tissue growth factor,CTGF)的部分cDNA序列,并观察在实验性肝纤维化大鼠肝脏中CTGF mRNA的表达改变。 方法 根据小鼠CTGF mRNA序列设计引物,用RT-PCR从大鼠肝脏总RNA中扩增出一段430bp的产物,并测定其序列。将16只雌性Wistar大鼠随机分为胆管堵塞组(n=8)及假手术组(n=8)。6周后取大鼠肝脏提取总RNA,利用多探针以核酸酶保护分析法测定CTGF及TGFβ1的mRNA水平。 结果 克隆出的大鼠CTGF cDNA序列在核酸水平与小鼠的同源性为95%。胆汁性肝硬化大鼠肝脏中TGFβ1及CTGF的mRNA水平分别为假手术组大鼠的4倍和7倍。 结论 在实验性肝纤维化大鼠肝脏中CTGF mRNA的表达水平明显上调。
, http://www.100md.com
关键词:肝纤维化;结缔组织;转化生长因子β1;生长因子
结缔组织生长因子(Connective tissue growth factor,CTGF)是一种新发现的细胞因子,在TGFβ1的诱导下由成纤维细胞等间质细胞产生,反过来又介导TGFβ1对间质细胞的作用,如促进其增殖及胶原合成[1]。CTGF已成为细胞外基质及纤维化领域新的研究热点。现在人们已经克隆出了小鼠、蛙、牛及人的CTGF mRNA 序列,并发现它在一些组织器发生纤维化时表达增加。但是,大鼠的CTGF核酸序列尚未克隆出来,亦无有关肝纤维化过程中CTGF表达改变的报道。为此,我们克隆出了大鼠CTGF cDNA的部分序列,并研究了其mRNA 水平在实验性肝纤维化中的变化。
材料与方法
1.大鼠部分CTGF cDNA序列的克隆:首先从胆管堵塞性肝纤维化大鼠之肝组织中提取总RNA,用oligo-dT作引物逆转录合成cDNA。根据小鼠CTGF (又称fisp-12)mRNA序列[2](GenBank accession number:M70642)设计PCR引物:正义引物, CAACCGCAAGATTGGAGTGT(第398-428核苷酸),反义引物,CTCCAGTCTGCAGAAGGTATTG(第827-805核苷酸)。经过预实验,选择57℃为退火温度,以热启动PCR经35个循环扩增出一个430bp的DNA片段。然后用T4连结酶把这一平末端DNA片段连接到pZErO-1(Invitrogen,NV leek, Netherlands)载体的EcoRⅤ位点上。将DNA的两条链直接测序后,用美国生物学信息中心的在线程序BLAST 2.0(http//:www.ncbi.nlm.nih.gov)将其与其它种属动物的cDNA序列进行比较。
, 百拇医药
2.胆管堵塞性肝纤维化模型的制备:取16只雌性 Wistar大鼠(250g左右),分为两组:胆管堵塞组8只,向大鼠胆总管内注入硬化剂(sodium amidotriazoate 0.2ml/kg),然后从远近端结扎并剪断之;假手术组8只,大鼠仅打开腹腔并游离胆总管,不注射硬化剂、也不结扎。6周后处死大鼠,取肝脏组织立即置于液氮中保存。
RNA酶保护分析测定肝脏TGFβ CTGF mRNA用体外转录方法合成[α32P]-UTP(NEN公司)标记的单链RNA探针:大鼠CTGF、TGFβ1和甘油醛3磷酸脱氢酶(GAPDH),以美国Ambion公司的RPAⅡ药盒进行RNA酶保护分析。其主要步骤为:取以一步法[3]提取的大鼠肝脏总RNA 20μl及上述三种探针各30000min-1加入20μl的杂交体系,45℃杂交16h;以RNase T1在37℃消化1h;将因杂交而被保护的放射性探针沉淀下来,于5%聚丙烯酰胺/8M尿素凝胶中电泳;将凝胶置于暗盒在-70℃进行放射自显影16h。冲洗X线片可见CTGF、TGFβ1和GAPDH三条带,其大小约为430,250,120碱基。用扫描仪将放射自显影片扫描进计算机,以美国NIH Image软件(美国国立卫生研究所研制)进行信号的光密度分析。 将CTGF mRNA及TGFβ1 mRNA的信号用GAPDH 校正得到其mRNA的相对丰度,用分组t检验分析肝纤维化组和假手术组的差别有无显著性。
, http://www.100md.com
结 果
1.大鼠CTGF cDNA序列与其它种属的同源性:用根据小鼠CTGF mRNA序列设计的引物,我们以RT-PCR法从大鼠肝脏RNA中扩增出一个430bp的 cDNA。去除引物区42bp的小鼠序列,这一大鼠cDNA与小鼠CTGF在mRNA水平有95%的同源性,在氨基酸水平有97%的同源性,说明它就是大鼠的CTGF序列。而且在推算的氨基酸水平,我们克隆的大鼠CTGF与人、猪CTGF有95%以上的同源性,与牛和蛙的CTGF有82%以上的同源性。
2.实验性大鼠肝纤维化是肝脏CTGF mRNA水平的改变:由图1和图2可见,在胆管堵塞性肝纤维化大鼠肝脏中,TGFβ1和CTGF mRNA的相对水平分别为0.34±0.09和0.22±0.08,显著高于正常对照组水平(0.09±0.02和0.03±0.01)t值分别为7.60和6.67,P值均<0.001)。

, 百拇医药
图1 核糖核酸酶保护分析测定结果

图2 CTGF和TGFβ1 mRNA表达水平的定量改变
讨 论
CTGF是富含半胱氨酸的多肽,最早从人的脐静脉内皮细胞中发现。在体内外TGFβ1可以特异性地诱导CTGF的表达,其它细胞因子如PDGF、EGF和 FGF[1]等无此作用。CTGF具有TGFβ1的一些生物学活性如刺激正常大鼠肾脏成纤维化细胞增殖并促进前胶原α1(Ⅰ)、纤维连接蛋白及整合素的α5 mRNA表达。但是,CTGF并不具备TGFβ1的所有功能,如刺激大鼠肾脏成纤维细胞的悬浮性生长及抑制貂肺上皮细胞的生长[1,4]。提示CTGF可能是TGFβ1部分生物学功能(如促进成纤维细胞的增殖及细胞外间质产生)的下游介质[5],它在组织器官纤维化的发生中可能起重要作用。我们克隆出了大鼠CTGF的部分cDNA序列并首次观察了CTGF mRNA在实验性肝维化中的变化。经直接测序后与其它种属动物的cDNA相比较,发现大鼠CTGF与小鼠及其它种属动物的CTGF有很高的同源性,说明其在进化中较为保守,也提示它在生物体内有较为重要的功能。我们采用非常敏感、特异而且更适于定量测定mRNA的水平的RNA酶保护分析技术发现,胆管堵塞性肝纤维化大鼠肝脏之TGFβ1水平为假手术组大鼠的4倍,CTGF mRNA为7倍,这与在皮肤、血管、肾及肺纤维化时表达增加一致[6,7]。
, 百拇医药
本实验结果不仅再次证明了CTGF在器官纤维化发生中起重要作用,也为探索抗纤维化治疗策略提供了新的思路。一般认为TGFβ1是促进纤维化发展的最重要的细胞因子之一,它既可促进细胞外基质的合成又可抑制其降解。但是,TGFβ1作用的靶细胞种类多、效应复杂,因此完全阻断其表达或活性的后果是难以预料的。例如,去除TGFβ1基因的小鼠因失去对炎症过程的抑制而在出生后很快死于全身性炎症[8]。与此相反,在正常状态下CTGF表达水平很低,而且主要在间质细胞中表达[7],其作用也限于结缔组织[1]。推论阻断CTGF的表达或抑制其生物活性可能是更特异、更有效的治疗纤维化的手段。因此,进一步深入研究CTGF在正常及纤维化肝脏中的细胞来源、表达调控具有重要意义。
贾继东,男,38岁,博士,副教授,肝病研究中心主任,主要从事慢性肝病肝纤维化的临床及基础研究,发表论文20余篇,曾获北京市、卫生部用国家科技进步奖各一项
贾继东(100050 北京,北京友谊医院肝病研究中心)
, http://www.100md.com
Michael Bauer(德国爱兰根大学医院内科)
Gabriele Boigk(德国爱兰根大学医院内科)
Martin Ruelh(德国爱兰根大学医院内科)
Detlef Schuppan(德国爱兰根大学医院内科)
王宝恩(100050 北京,北京友谊医院肝病研究中心)
参考文献
[1]Frazier K,Williams S,Kothapalli D,et al. Stimulation of fibroblast cell growth,matrix production,and granulation tissue formation by connective tissue growth factor. J Invest Dermatol,1996,107: 404-411.
, http://www.100md.com
[2]Ryseck RP,Macdonald-Bravo H,Mattei MG,et al. Structure,mapping,and expression of fisp-12,a growth factor-inducible gene encoding a secreted cysteine-rich protein. Cell Growth Differ,1991,2: 225-233.
[3]Chomczynski P,Sacchi N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Anal Biochem,1987,162: 156-159.
[4]Kothapalli D,Frazier KS,Welply A,et al. Transforming growth factor beta induces anchorage-independent growth of NRK fibroblasts via a connective tissue growth factor-dependent signaling pathway. Cell Growth Differ,1997,8: 61-68.
, http://www.100md.com
[5]Grotendorst GR. Connective tissue growth factor: a mediator of TGF-beta action on fibroblasts. Cytokine Growth Factor Rev,1997,8: 171-179.
[6]Haustein UF,Anderegg U. Pathophysiology of scleroderma: an update. J Eur Acad Dermatol Venereol,1998,11: 1-8.
[7]Ito Y,Aten J,Bende RJ,et al. Expression of connective tissue growth factor in human renal fibrosis. Kidney Int,1998,53: 853-861.
[8]Letterio JJ,Bottinger EP. TGF-beta knockout and dominant-negative receptor transgenic mice. Miner Electrolyte Metab,1998,24: 161-167., http://www.100md.com