乙酰胆碱对大鼠头端延髓腹外侧区前交感神经元放电的作用
 |
 |
 |
 |
安徽省卫生职工培训中心;合肥 230000 王伟忠;汪雪梅;戎伟芳;王继江;袁文俊
关键词:头端延髓腹外侧区;前交感神经元;细胞外记录;微电泳;乙酰胆碱
摘要:实验采用细胞外记录和微电泳等电生理方法, 研究乙酰胆碱(ACh)对氨基甲酸乙酯麻醉的大鼠头端延髓腹外侧区(RVLM)前交感神经元放电频率的影响。在RVLM共记录到35个前交感神经元, 微电泳ACh能增加其放电(P<0.05), 并且具有剂量依赖性。其中22个神经元微电泳M型胆碱受体阻断剂阿托品(ATR)后能明显降低前交感神经元的基础放电(P<0.05)和完全阻断ACh引起的神经元兴奋作用; 分别向其余7和6个单位微电泳筒箭毒(ACh N1和N2型受体阻断剂)或六烃季铵(ACh N1型受体阻断剂)后均不能影响神经元的基础放电和ACh引起的神经元兴奋作用。结果提示, RVLM前交感神经元存在以M型受体介导的胆碱能纤维的紧张性兴奋投射。
, 百拇医药
头端延髓腹外侧区(rostral ventrolateral medulla, RVLM)是交感神经和心血管功能的一个重要整合中枢。RVLM内存在一组向脊髓投射的神经元(前交感神经元, presympathetic neurons), 其紧张性活动是交感神经紧张活动的基础; 它们还接受广泛的传入性联系, 在应激、防御反应时的交感神经活动和心血管功能调控中起重要作用[1,2]。向RVLM微注射胆碱能激动剂或引起神经末梢释放乙酰胆碱(acet~y~lcholine, ACh)的药物, 可升高血压; 向RVLM微注射ACh阻断剂或抑制乙酰胆碱合成的药物可使血压降低。因此, ACh对RVLM神经元有紧张性兴奋作用, 对于正常的基础血压的维持有重要的作用[3,4]。免疫细胞化学研究表明RVLM中存在胆碱能纤维的投射[5]。但由于微量注射等方法的局限性, 无法证明ACh对交感心血管活动调节是直接还是间接作用。因此本研究从电生理学方面研究ACh对功能性质明确的RVLM前交感神经元活动的影响, 探讨胆碱能投射在RVLM交感心血管活动调节中的作用。
, 百拇医药
1 材料和方法
1.1 手术处理 25只雄性SD大鼠(250~350 g), 腹腔注射戊巴比妥钠60 mg/kg作诱导麻醉, 作气管插管和右股动脉、股静脉插管, 动脉导管连接压力传感器, 用计算机监测血压。动物取俯卧位, 头部固定于脑立体定位仪(Narishige)上, 静脉推注1%三碘季铵酚(10 mg/kg, 每隔半小时注射3 mg/kg)制动, 人工通气(10~12 ml/kg, 60~70次/min), 静脉注射20%氨基甲酸乙酯(静脉注射1 g/kg, 间隔至少10 min, 根据动物血压、心率的平稳状况以及刺激后肢血压变化等情况适当补充)维持麻醉。切开颅顶至背部正中皮肤, 分离主动脉神经(aortic nerve, AN), 吸除部分小脑, 充分暴露延髓背面, 调整延髓背面呈水平位, 第1、2胸椎做椎板切开术, 以备脊髓刺激。以琼脂生理盐水棉球将创面围成一池状, 再将AN挂在银丝刺激电极上, 池中倒入温液状石蜡。整个实验过程中终末潮气的CO2浓度维持在4%~5%, 肛温维持在37℃左右。
, 百拇医药
1.2 细胞外记录 自制五管玻璃微电极, 其中一管为记录电极, 灌入2%滂胺天蓝(pontamine sky blue, PSB)-0.5 mol/L醋酸钠溶液, 尖端直径3~5 μm, 阻抗为4~10 MΩ。另外三管分别灌入药物: 0.1 mol/L谷氨酸钠(glutamate, Glu, pH 6.8)、 0.1 mol/L氯化ACh (pH 6.5)和2 mol/L NaCl。最后一管灌入以下药物的一种, 0.1 mol/L硫酸阿托品(atropine, ATR, pH 6.8)、 0.1 mol/L氯化筒箭毒(d-tubocurarine, d-TC, pH 6.8)或0.1 mol/L溴化六烃季铵(hexamethonium, C6, pH 6.9)。以上微电泳阻抗为40~60 MΩ。以延髓闩部(obex)为参考点, 在RVLM(向前2.6~3.0 mm, 旁开1.6~2.0 mm, 延髓表面向下2.8~3.4 mm)记录神经元的自发放电活动, 信号经放大器(Nihon Kohden, MEZ-8210)放大(频率响应100~3?000 Hz)后用时程-幅度窗口鉴别器(中国科学院上海生理研究所, TAWA-94)鉴别单一神经元的动作电位, 使之整形成1 ms的标准方波, 输入计算机进行频率积分。
, 百拇医药
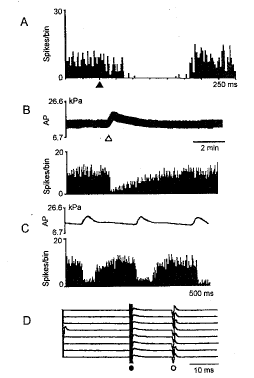
1.3 RVLM前交感神经元的鉴定标准与方法[6] (1) 刺激AN时神经元的放电被抑制。通过电生理刺激器(Nihon Kohden, SEN-7103)对AN进行低频短串刺激(波宽200 μs, 间隔5 ms, 串长3, 1 Hz), 刺激的电流强度为0.2~0.8 mA, 经过计算机叠加处理后观察刺激AN前后神经元放电频率的变化(图1A); (2) 神经元活动可被升高血压所抑制。静脉一次性注射苯肾上腺素(10 μg/kg), 同步观察血压和神经元放电的变化(图1B); (3) 神经元自发放电活动呈心性节律。用心电图的R波触发计算机分别对动脉脉搏波和神经信号作平均和叠加处理, 观察神经元在一个或数个心动周期内放电频率的变化(图1C); (4)电刺激脊髓胸段逆行激活神经元的放电。将单极钨丝电极插入胸2段脊髓背外侧索(中线外侧0.5~1.0 mm, 背侧向下1.0~1.5 mm), 参考电极置于脊椎旁的肌肉上, 方波刺激参数: 0.2 ms, 0.1~1 mA, 1.5 Hz (图1D)。
图 1. RVLM前交感神经元的鉴定
, 百拇医药
Fig. 1. Electrophysiological identification of presympathetic neu~rons in the RVLM. A. Inhibition of ongoing activity by short train pulse stimulation of aortic nerve (indicated by a filled triangle). The recording is a summation of 300 sweeps. Bin width=1 ms. B. Inhibition of ongoing activity by intravenous injection of phenylephrine (10 μg/kg, marked by an open triangle), which elevated blood pressure. Bin width=1 s. C. R-wave (of ECG) triggered average of blood pressure pulse and neural activity. The recording is a summation of 300 sweeps. Bin width=1 ms. D. The constant onset latency of action potentials (marked by an open circle) evoked by spinal cord stimulation (marked by a filled circle).
, 百拇医药
1.4 微电泳 在确定了神经元的性质(前交感神经元)后, 通过微电泳系统(中国科学院上海生理研究所, MIS9400)观察微电泳不同药物对神经元自发放电活动的影响。Glu用负电流, ATR、ACh、d-TC和C6用正电流。当记录到一个RVLM自发放电神经元单位后, 首先微电泳Glu (0~60 nA), 如果神经元自发放电增加, 说明记录的可能是神经元胞体的动作电位, 进一步观察微电泳不同药物后这些神经元放电的变化; 如果自发放电没有变化, 则可能记录在离胞体较远的部位[7], 放弃这种神经元, 不再作进一步的观察。电泳时间一般为1 min左右, 两次电泳的间隔约2 min, 电泳间隔期药物管均给予保持电流(8 nA, 极性与电泳电流相反), 防止药物外溢。
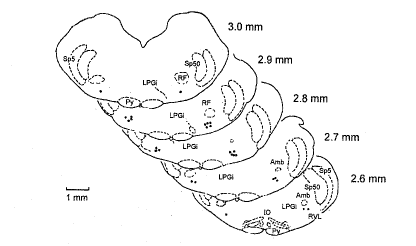
1.5 前交感神经元在RVLM中的组织学定位分布 向被记录的35个前交感神经元部位微电泳PSB (-15 μA, 10 min), 先后用生理盐水100 ml和10%福尔马林溶液300 ml经左心室灌流。取脑并将其浸泡于10%福尔马林溶液中, 用冰冻切片机将延髓作50 μm的冠状切片, 在显微镜下寻找染点。 根据Paxinos and Watson图谱[8], 看到这些神经元均分布在面神经核尾极的后端, 疑核的下方(腹侧), 靠近延髓的腹侧面(图2)。
, 百拇医药
1.6 统计学处理 神经元放电频率用平均数±标准差表示, 微电泳后的放电频率变化超过20%被认为有意义, 单位放电变化用配对t检验, P<0.05为相差显著。
1.7 药品 Glu、 ACh、 ATR、 d-TC、 C6均购自Sigma公司。
2 结果
2.1 微电泳ACh对RVLM前交感神经元放电频率的影响
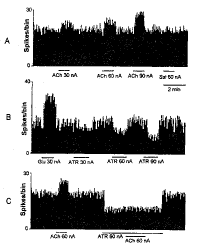
在RVLM共记录了35个前交感神经元, 基础放电频率为4.5~25.8次/s (15.1±4.3次/s, n=35), 以30、60和90 nA电流微电泳ACh, 神经元放电频率在1~10 s内迅速增加, 分别增加至21.6±6.6(P<0.05)、 27.0±8.7 (P<0.01) 和 34.9±14.4次/s (P<0.01), 平均增加了28.1%、80.0%和131.1.% (表1, 图3A), 微电泳停止后放电频率迅速恢复至对照水平。微电泳ACh后, 放电频率的变化不伴有动作电位波形或幅度的变化。在这些神经元中, 对照电流不能使神经元放电频率发生明显变化。
, 百拇医药
图 2. 被记录神经元在RVLM中的分布
Fig. 2. Location of the recorded neurons in the RVLM. Recording sites (marked by black circles) of presympathetic neurons plotted on each cross section through the rat medulla 2.6~3.0 mm rostral to the obex. Amb, neucleus ambiguus; IO, inferior olivary nucleus; LPGi, lateral paragigantocellular nucleus; Py, pyramidal tract; RF, retrofacial nucleus; RVL, nucleus reticularis rostroventrolateralis; Sp5O, spinal trigeminal tract nucleus, oral.
, 百拇医药
表 1. 微电泳ACh及其受体阻断剂对RVLM前交感神经元自发放电的影响
Table 1. Effects of microiontophoresis of ACh and its receptor blockers on the discharge of presympathetic neurons in the RVLM
n
Spikes/s (change: %)
Control
30 nA
60 nA
90 nA
ACh
, http://www.100md.com
35
15.1±4.3
21.6±6.6 (+28.1%)*
27.0±8.7 (+80.0%)* *
34.9±14.4 (+131.1.%)* *
Atropine
22
14.2±6.1
11.4±5.7 (-20.1%)*
9.3±3.9 (-34.5%)* *
, 百拇医药
7.3±3.4 (-48.6%)* *
d-TC
7
15.5±6.1
14.7±4.6 (-5.2%)
15.6±5.2 (+0.5%)
14.9±4.6 (-3.8%)
C6
6
13.9±5.7
14.2±4.6 (+2.1%)
, 百拇医药
14.6±5.5 (+2.5%)
13.7±4.6 (-1.7%)
~* P<0.05,~* * P<0.01 vs control.
2.2 微电泳M型ACh受体阻断剂对ACh引起RVLM前交感神经元兴奋作用的影响
向22个RVLM前交感神经元 (基础放电频率为 14.2±6.1次/s, n=22), 以30、 60和90 nA电流微电泳ATR, 放电频率分别降低至11.4±5.7 (P<0.05)、 9.3±3.9 (P<0.01) 和 7.3±3.4次/s (P<0.01), 平均降低了 20.1%、 34.5%和 48.6% (表1, 图3B), 微电泳停止后放电频率迅速恢复至对照水平。
图 3. 微电泳ACh和 阿托品对RVLM前交感神经元的作用
, 百拇医药
Fig. 3. Responses of presympathetic neurons in the RVLM to microiontophoretic application of ACh or ATR. A. Excitatory effects of presympathetic neurons during repeated micro~ionto~phoretic application of ACh. B. Inhibition of ongoing activity of the neuron during repeated micro~ionto~phoretic application of ATR. C. ATR completely blocked the excitatory effect induced by microiontophoresis of ACh on the presympathetic neuron. Saline=2 mol/L NaCl. Bin width=1 s in A, B and C.
, http://www.100md.com
同时观察到此22个单位微电泳ACh (60 nA)后RVLM前交感神经元的放电频率平均增加了75.5%; 以90 nA电流微电泳阿托品1~2 min后同时微电泳ACh (60 nA), 微电泳ACh前后RVLM前交感神经元的放电频率变化为3.5% (P>0.05), 阿托品能完全阻断ACh引起前交感神经元的兴奋作用(图3C)。
2.3 微电泳N1和N2型ACh受体阻断剂对ACh引起RVLM前交感神经元兴奋作用的影响
分别向7和6个RVLM前交感神经元(基础放电频率分别为15.5±6.1和13.9±5.7次/s), 以30、60、90 nA电流分别微电泳d-TC和C6, 放电频率没有明显的变化, 分别为14.7±5.6、15.6±5.2、14.9±4.6(P>0.05, n=7)和14.2±4.2、14.6±5.6、13.7±4.6次/s (P>0.05, n=6)(表1); 以上单位分别微电泳 90 nA的d-TC和C6后1~2 min同时微电泳ACh (60 nA), ACh引起的神经元放电分别为26.5±7.4(P<0.05)和25.1±6.8次/s (P<0.05), d-TC和C6均不能阻断ACh (60 nA)对RVLM前交感神经元的兴奋作用(图4A、 B)。
, 百拇医药
图 4. 微电泳d-TC和 C6对RVLM前交感神经元的影响
Fig. 4. Responses of presympathetic neurons in the RVLM to mi~cro~ionto~phoretic application of d-TC or C6. A. The discharge of presympathetic neuron was not affected by microiontophoretic application of d-TC, and the excitatory effect of ACh on the neurons was not blocked by d-TC. B. Microiontophoretic application of C6 did not change the baseline discharge of the presympathetic neurons and did not block the excitatory effect of ACh on presympathetic neurons. Sal=control, Bin=1 s in both A and B.
, 百拇医药
3 讨论 本研究结果提示, 在大鼠RVLM中存在一些神经元, 它们具有自发的放电活动, 同时能被电刺激AN和升高血压所抑制, 它们的放电活动与心动周期有关, 且大部分神经元能被胸2脊髓逆行激活; 这些特点提示RVLM的压力敏感性神经元直接投射到脊髓, 与交感节前神经元(sympathetic preganglionic neuron, SPN)形成单突触的联系[9]。这些压力敏感性神经元的活动直接影响SPN的活动, 从而调节交感心血管活动, 因此这些神经元被称为前交感神经元[1,2]。
采用微量注射等方法的研究显示, 在RVLM内存在ACh能纤维传入, 微量注射ACh激动剂能引起交感心血管活动的变化[3,4]。近来也有学者报道, ACh能传入RVLM神经元的作用可能通过M2型受体介导[10]。但以往微量注射等的研究方法存在一定的局限性, 即无法确定这种作用的方式, 是直接还是间接影响RVLM前交感神经元的活动。本研究以功能明确的RVLM前交感神经元为研究对象, 微电泳ACh能迅速兴奋RVLM前交感神经元的活动, 同时具有剂量依赖性, 提示RVLM前交感神经元存在胆碱能受体。微电泳ACh M型受体拮抗剂阿托品能迅速抑制前交感神经元的基础放电, 同时也能完全阻断ACh引起的神经元活动变化; 而微电泳N型ACh受体阻断剂d-TC和C6均不能影响前交感神经元的基础放电, 也不能阻断ACh对前交感神经元的兴奋作用。提示在RVLM前交感神经元存在以M受体为主的胆碱能纤维的投射, 紧张地释放胆碱能递质影响前交感神经元的活动, 在交感心血管功能活动的调节中起十分重要的作用。
, http://www.100md.com
Project supported by National Basic Program (No.G2000056905) of China and the Research Foundation for Medical Sciences of PLA (the 9th Five-Year Program No.96M072)
袁文俊,Corresponding author. Tel: 021-25070262; E-mail:yuanwj@smmu.edu.cn
王伟忠(第二军医大学基础医学部生理学教研室, 上海 200433)
戎伟芳(第二军医大学基础医学部生理学教研室, 上海 200433)
王继江(第二军医大学基础医学部生理学教研室, 上海 200433)
, 百拇医药
袁文俊(第二军医大学基础医学部生理学教研室, 上海 200433)
汪雪梅(安徽省卫生职工培训中心, 合肥 230000)
参 考 文 献
[1] Dampney RAL. The subretrofacial vasomotor nucleus: anato~mical, chemical and pharmacological properties and role in cardiovascular regulation. Prog Neurobiol, 1994, 42: 197~227.
[2] Pyner S, Coote JH. Rostroventrolateral medulla neurons pre~fe~rentially project to target specified sympathetic preganglionic neurons. Neuroscience, 1998; 83 (2): 617~631.
, 百拇医药
[3] Zhu DN, Xie GZ, Li P. The cardiovascular responses to medul~lary cholinergic and corticoid stimulation is calcium channel dependent in rats. Blood Pressure, 1997, 6 (3): 171~179.
[4] Lee SB, Krieger AJ, Punnen S et al. Cardiovascular re~gula~tion by cholinergic mechanisms in rostral ventrolateral medulla of spontaneously hypertensive rats. Eur J Pharmacol, 1991, 205: 117~123.
[5] Armstrong DM, Saperm CB, Levey BH et al. Distribution of cholinergic neurons in rat brain: demonstrated by the immunocytochemical localization of choline acetyltransferase. J Comp Neurol, 1983, 216: 53~68.
, http://www.100md.com
[6] Lipski J, Kanjhan R, Kruszewska B et al. Properties of pre~sym~pathetic neurons in the rostral ventrolateral medulla in the rat: an intracellular study in vivo. J Physiol, 1996, 699: 729~744.
[7] Goodchild AK, Dampney RAL. A method for evoking phy~siol~ogical responses by stimulation of cell bodies but not axons of passage within localized regions of the central nervous system. J Neurosci Meth, 1982, 6: 351~364.
[8] Paxinos G, Watson C. The Rat Brain in Stereotaxic Co~or~di~nates. 2nd ed. Sydney: Academic Press, 1986.
, 百拇医药
[9] Zagon A, Smith AD. Monosynaptic projections from the rostral ventrolateral medulla oblongata to identified sym~pathetic preganglionic neurons. Neuroscience, 1993, 54: 729~743.
[10] Arneric SPR, Giuliano P, Reis DJ et al. Synthesis, release and receptor binding of acetylcholine in the C1 area of rostral ventrolateral medulla: contributions in regulation arterial pressure. Brain Res, 1990, 511: 98~112.
Received2000-04-24,Accepted 2000-06-08, 百拇医药