尾加压素增加血管平滑肌细胞粘着斑激酶
 |
 |
 |
 |
 |
北京医科大学第一医院心内科;北京 100034 彭旭;尹航;汪丽蕙;柴三葆;苏加林;唐朝枢
关键词:粘着斑激酶;尾加压素;信号转导
摘要:在体外培养的血管平滑肌细胞上, 采用蛋白印迹杂交免疫沉淀的方法, 研究尾加压素Ⅱ(UⅡ)与粘着斑激酶(FAK)介导的信号传导之间的关系。结果表明, UⅡ在10-8、 10-7和10-6 mol/L的浓度时, 可分别使FAK活力增加2.2、 3.04和0.73倍; 加入UⅡ(10-7 mol/L) 5 min后, FAK活力增加95%, 但与对照组相比无显著性差异(P>0.05), 刺激10 min后, FAK活力升高3.7倍, 和对照组相比有显著性差异(P<0.05)。至30 min时活力显著升高, 较对照组增加4.8倍(P<0.01)。UⅡ刺激平滑肌细胞30 min内, FAK的蛋白含量无明显变化; 在UⅡ作用2 h后, FAK的含量增加36%, 至4 h达高峰, 与对照组相比增加53%, 6 h后降低; 细胞松弛素B不能抑制UⅡ对FAK的激活; 丝裂素活化蛋白激酶的抑制剂PD98059 (50 μmol/L), 钙调素依赖性蛋白激酶的抑制剂W7 (50 μmol/L), 对FAK的激活无影响(P>0.05); 蛋白激酶C的阻断剂H7 (50 μmol/L), 可与UⅡ发生协同作用, 使FAK活力较单纯UⅡ组增加1.98倍。因此, UⅡ与FAK介导的信号转导途径之间存在着密切的关系, 且这种关系不依赖于细胞骨架的完整性, 与蛋白激酶C介导的信号转导途径有密切的关系。
, 百拇医药
尾加压素Ⅱ(urotensinⅡ, UⅡ)是迄今被发现的人体内最强的缩血管活性肽, 能刺激血管平滑肌细胞增殖, 在动脉粥样硬化、高血压和血管成形术后再狭窄等疾病的发生中起重要作用[1,2]。粘着斑激酶(focal adhesion kinase, FAK)是一种非受体型的酪氨酸激酶, 主要参与整合素介导的信号传导, 对细胞的迁移和增殖具有重要影响[3~5]。UⅡ与FAK介导的信号转导途径之间的关系, 目前尚不清楚。本实验拟在体外培养的大鼠主动脉血管平滑肌细胞上, 采用蛋白印迹杂交和免疫沉淀的方法, 研究UⅡ对FAK含量与活力作用, 以探讨UⅡ对血管平滑肌细胞内信号转导的影响。
1 材料和方法
1.1 实验动物 兔源性FAK多克隆抗体与小鼠源性PY20单克隆抗体购自Santa Cruz公司, UⅡ由美国Phoenix公司惠赠, Wistar大鼠购自北京医科大学实验动物中心。
, 百拇医药
1.2 大鼠主动脉血管平滑肌细胞培养 参照文献[6]加以改进, 将体重150~200 g的Wistar大鼠经乙醚麻醉后, 在严格无菌条件下, 迅速取出胸主动脉, 放入Hanks液中冲洗。然后用弯头镊刮除血管内外膜, 转入盛有1 ml RPMI 1640培养液的青霉素小瓶中剪碎(约1 mm2), 加入细胞培养瓶中。再将细胞瓶反置于CO2培养箱中贴壁4 h后, 加入4 ml含20%胎牛血清的1640培养液。细胞长满后, 传代培养。本实验选用10代以内的细胞, 采用倒置相差显微镜和α肌动蛋白染色, 对平滑肌细胞进行鉴定。发现细胞呈梭形排列, 且α肌动蛋白染色呈阳性。
1.3 蛋白印迹杂交[7] 加入不同浓度的UⅡ, 在不同时间弃除培养液, 细胞用生理盐水冲洗3遍。然后加0.3 ml改良的RIPA裂解缓冲液(Tris.HCl, 50 mmol/L, pH 7.5; NaCl, 150 mmol/L; NP-40,1%; 脱氧胆酸钠, 0.5%; SDS, 0.1%; EDTA, 1 mmol/L; PMSF, 1 mmol/L; Leupeptin, 2 μg/ml), 用细胞刮子收集细胞。4℃静置15 min, 10?000 g离心10 min, 弃除沉淀, 用考马斯亮蓝方法对上清进行蛋白定量。取10 μg蛋白, 加入上样缓冲液, 煮沸3 min后进行SDS-PAGE, 转膜, 用1∶1000的抗FAK多克隆抗体进行杂交, 二抗为辣根过氧化酶标记的羊抗兔多克隆抗体, 用1∶10?000稀释, 利用化学发光试剂盒法进行显色反应, 最后对杂交条带进行光密度扫描。
, 百拇医药
1.4 免疫沉淀[7] 组织匀浆后取100 μg总蛋白, 加入10 μl PY99抗体, 4℃反应1 h后加入50 μl蛋白A琼脂糖珠进行沉淀, 用裂解缓冲液洗涤3次。加入上样缓冲液, 煮沸3 min, 进行SDS-PAGE, 转膜, 用1∶1?000的抗FAK抗体进行杂交, 二抗采用1∶10?000稀释, 利用化学发光法进行显色反应。
1.5 统计学处理 结果以均数±标准差表示, 采用单因素方差分析和均数间两两比较方法, 以P<0.05为差异有显著性。
2 结果
2.1 时效关系
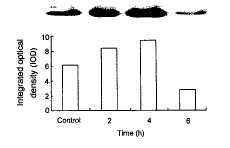
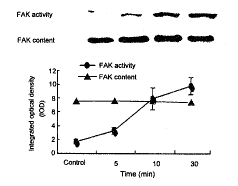
FAK是一种酪氨酸磷酸激酶, 可通过自身磷酸化激活, 通常以它的磷酸化水平反映其活力。FAK活力的检测在国际上多采用免疫沉淀的方法。先利用酪氨酸激酶的磷酸化抗体, 如PY99, 对蛋白进行沉淀, 再以FAK抗体进行蛋白印迹杂交。加入UⅡ(10-7 mol/L) 5 min后, FAK活力增加95%, 但与对照组相比无显著性差异(P>0.05); 刺激10 min后, FAK活力升高3.7倍, 和对照组相比有显著性差异(P<0.05)。至30 min活力显著升高, 较对照组增加4.8倍(P<0.01)。UⅡ刺激平滑肌细胞30 min内, FAK的蛋白含量无明显变化(图1); 在UⅡ作用2 h后, FAK的含量增加36%; 至4 h达高峰, 与对照组相比增加53%; 6 h后降低, 与对照组相比降低54%(图2)。
, http://www.100md.com
图 1. UⅡ短时间刺激FAK含量和活力的影响
Fig. 1. Effect of UⅡ stimulation on FAK expression and ac~tivity in vascular smooth muscle cell.
图 2. UⅡ长时间刺激对FAK含量的影响
Fig. 2. UⅡ stimulation of a long time induces the expression of FAK (n=1).
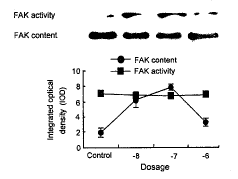
2.2 量效关系
加入不同浓度UⅡ刺激细胞30 min后, 发现10-8、10-7和10-6 mol/L的浓度均可刺激FAK活力增加, 较对照组分别增加2.2、3.04和0.73倍, 但对FAK蛋白含量无明显影响(图3)。
, 百拇医药
图 3. 不同浓度UⅡ对平滑肌细胞FAK含量(n=1)和活力(n=3)的影响
Fig. 3. Dosage dependence of UⅡ-stimulation FAK expression and activity in vascular smooth muscle cells.
图 4. 细胞骨架蛋白完整性对FAK磷酸化的影响
Fig. 4. Effect of cytochalasin B on UⅡ-stimulation tyrosine pho~sphorylation of FAK.
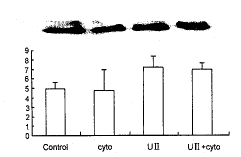
2.3 细胞骨架蛋白完整性对FAK活力的影响
在加入UⅡ(10-7 mol/L), 作用细胞30 min后, 发现UⅡ使FAK的活力升高147%; 同时加入UⅡ(10-7 mol/L)和细胞松弛素(12.5 μmol/L), 可使FAK的活力升高144%, 两组间差异无显著性(P>0.05)(图4)。
, http://www.100md.com
2.4 与其它信号转导通路的关系
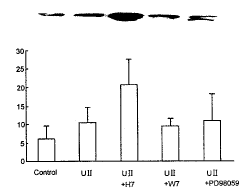
在加入UⅡ的同时, 分别加入丝裂素活化蛋白激酶的抑制剂PD98059 (50 μmol/L), 钙调素依赖性蛋白激酶的抑制剂W7 (50 μmol/L)和蛋白激酶C的抑制剂H7 (50 μmol/L), 作用细胞30 min后, 发现PD98059和W7组与单纯加入UⅡ组之间的FAK的活力无显著性差异(P>0.05)。H7组与UⅡ组相比, FAK活力增高1.98倍(图5)。
图 5. 不同信号转导通路对FAK活化的影响
Fig. 5. Effect of different signal transduction pathway on the activition of FAK induced by UⅡ (n=3).
3 讨论 UⅡ是一种环型结构的调节肽, 最初从鱼的脊髓尾部下垂体中分离出来。新近的研究发现, 在人体内也存在UⅡ, 除神经组织外, 血管, 尤其是粥样硬化的脂质沉着区富含UⅡ。UⅡ受体是一种孤儿性G蛋白耦联受体GPR14, 亦主要分布在心血管组织中, 推测其在心血管疾病的发生中起重要作用[1]。FAK是细胞内多条信号转导通路的交汇点, 在高血压、血管成形术后再狭窄的发生中起重要作用[8]。当FAK活化以后, 第397位的酪氨酸发生自身磷酸化, 成为与Src家族激酶具有高亲和力的结合位点。Src与FAK结合, 形成FAK/Src复合体, 促使第925位酪氨酸磷酸化, 产生与接头蛋白(adaptor)Grb2的结合位点, 通过Grb2的SH3功能域与鸟嘌呤核苷酸交换因子Sos结合, Sos将Ras蛋白从无活性的Ras-ADP转变为有活性的Ras-ATP。另外, Grb2还可通过与Shc的结合, 激活Ras, 然后活化丝裂原活化蛋白激酶, 作用于转录因子c-fos和c-jun, 最终影响基因的表达, 促进细胞的增殖、迁移[9]。本实验发现, UⅡ在10-8至10-6 mol/L的浓度范围内, 均可激活FAK。UⅡ作用于细胞5 min后, FAK活力增加, 至30 min时达高峰。 但30 min内FAK的蛋白含量无明显变化, 直至作用后2 h, FAK蛋白含量增加, 4 h达高峰, 6 h时FAK蛋白含量减少。因此, 这种早期FAK活力的增加与蛋白的含量无关, 主要是通过自身酪氨酸磷酸化的增加实现的, 而晚期活力的增加与蛋白含量的增加有关。UⅡ与FAK介导的信号转导通路之间存在着密切的关系, 可能是通过对FAK的激活, 促进细胞的增殖。
, http://www.100md.com
FAK在整合素介导的信号转导通路中起重要作用。 当整合素聚集后, FAK活力增高, 整合素激活的FAK活化, 需要依赖完整细胞骨架蛋白的存在, 加入细胞松弛素D, 细胞骨架蛋白完整性被破坏后, 整合素的聚集不能激活FAK[10]。本实验发现, 加入细胞松弛素B, 细胞骨架蛋白完整性被破坏后, UⅡ仍然可激活FAK, 说明UⅡ活化FAK与整合素介导的FAK激活之间存在着不同的机制, 这可能与文献报道的肝细胞生长因子不依赖于骨架蛋白的完整活化FAK的机制相似[11]。
丝裂源活化蛋白激酶是一类广泛存在于真核细胞中具有丝氨酸和酪氨酸双重磷酸化能力的蛋白激酶, 钙调素依赖性蛋白激酶是一类依赖于钙调素的丝氨酸/苏氨酸激酶, 两者在受到胞外信号刺激后可通过核转位, 对基因转录进行调控, 影响细胞增殖。本研究发现, 丝裂源活化蛋白激酶的抑制剂PD98059和钙调素依赖性蛋白激酶的抑制剂W7, 对UⅡ激活FAK无抑制作用。说明MAPK和钙调素依赖性蛋白激酶与UⅡ激活FAK的信号转导无关, 或位于FAK介导的信号转导通路的下游。相反, 在使用蛋白激酶C的抑制剂H7后, 可增加UⅡ激活FAK的能力, 其作用机制不清, 可能与蛋白激酶C受到抑制后反馈性增加FAK的活力有关。
, 百拇医药
总之, UⅡ作用于血管平滑肌细胞后, 可刺激 FAK 的活化, 且这种作用不依赖于细胞骨架蛋白的完整性, 与蛋白激酶C介导的信号转导有密切的关系。
Supported by the Grant of National Dorctorate Education (No.96024014)
尹航,Corresponding author. Tel: 010-66511764; Fax: 010-66511764; E-mail: yinhang@mail.bjmu.edu.cn
彭旭(北京医科大学第一医院心内科, 北京 100034)
尹航(北京医科大学第一医院心内科, 北京 100034)
汪丽蕙(北京医科大学第一医院心内科, 北京 100034)
, 百拇医药
柴三葆(北京医科大学第一医院心内科, 北京 100034)
苏加林(北京医科大学第一医院心内科, 北京 100034)
唐朝枢(北京医科大学第一医院心内科, 北京 100034)
参 考 文 献
[1] Ames RS, Sarau HM, Chambers JK et al. Human urotensinⅡ is a potent vasoconstrictor and agonist for the orphan receptor GPR14. Nature, 1999, 401: 282~286.
[2] Xia CF (夏春芳), Xu SP (徐少平), Zhang YG (张勇刚) et al. The alteration of urotensinⅡ receptors in rat artery after balloon angioplasty injury. Chin J Pathophysiol (中国病理生理杂志), (in press).
, 百拇医药
[3] Gilmore AP, Romer LH. Inhibition of focal adhesion kinase (FAK) signaling in focal adhesion decreases cell motility and proliferation. Mol Biol Cell, 1996, 7: 1209~1224.
[4] Cary L, Chang J, Guan JL. Stimulation of cell migration by overexpression of focal adhesion kinase and its association with Src and Fyn. J Cell Sci, 1996, 109: 1787~1794.
[5] Ilic D, Furuta Y, Kanazawa S et al. Reduced cell motility and enhanced focal adhesion contact formation in cells from FAK deficient mice. Nature, 1995, 377: 539~544.
, 百拇医药
[6] Hirata Y, Takagi Y, Takata S et al. CGRP receptor in cul~tured vascular smooth muscle and endothelial cells. Biochem Biophys Res Commu, 1988, 151: 1113~1121.
[7] Zheng CH, Zheng X, Bian ZC et al. Differential regulation of Pyk2 and focal adhesion kinase (FAK). J Biol Chem, 1998, 273: 2384~2389.
[8] Peng X (彭 旭), Wang LH (汪丽蕙, Tain HS (田洪森)et al. The changes of aortic focal adhesion kinase in hypertensive rats induced by nω-nitro-L-arginine. J Beijing Med Univ (北京医科大学学报), 1999, 31: 509~511 (in Chinese with English abstract).
, 百拇医药
[9] Clak EA, Brugge JS. Integrin and signal transduction path~ways: The road taken. Science, 1995, 268: 233~239.
[10] Burridge K, Turner CE, Romer LH. Tyrosine phos~pho~ry~la~tion of paxillin and pp125 FAK accompanies cell adhesion to extracellular matrix: a role in cytoskeletal assembly. J Cell Biol, 1992, 893~903.
[11] Chen HC, Chan PC, Tang MJ et al. Tyrosine phos~phory~la~tion of focal adhesion kinase stimulated by hepatocyte growth factor leads to mitogen activated protein kinase activation. J Biol Chem, 1998, 273: 25777~25782.
Received 2000-03-07 Accepted 2000-04-29, 百拇医药