褪黑素对大鼠下丘脑薄片视交叉上核神经元放电昼夜节律性的调制
 |
 |
 |
苏州医学院神经生物学研究室; 苏州 215007 周先举;蒋星红;俞光第;印其章
关键词:视交叉上核;松果腺切除;褪黑素;下丘脑薄片;昼夜节律;luzindole;哌唑嗪
摘要:先用持续光照和松果腺切除预处理大鼠, 然后制成下丘脑薄片, 记录其视交叉上核(SCN)神经元的自发放电, 观察其昼夜变化和褪黑素(MEL)对它的影响。实验结果表明: (1)在正常光照(光照∶黑暗=12∶12)条件下, SCN神经元自发放电频率呈现昼高夜低的节律性。在昼夜时间(CT)6~8出现放电高峰, 频率约为8.3 Hz; 在CT18~20出现低谷, 频率约为3.8 Hz。松果腺切除后, SCN神经元自发放电的昼夜节律性基本保持, 但在持续光照条件下, 昼夜节律基本消失。(2) SCN神经元对MEL反应以抑制为主。在正常光照条件下, 在白昼SCN神经元对MEL反应性较高, 最大抑制率在CT8~10, 约为42%; 在黑夜较低, 最大抑制率在CT22~24, 约为26%。在持续光照和松果腺切除条件下, SCN神经元都失去对MEL反应的昼夜节律性,且反应性增高。(3) ML-1受体拮抗剂luzindole能阻断由MEL引起的SCN神经元自发放电抑制, 而ML-2受体拮抗剂哌唑嗪却不能阻断。实验结果提示, 松果腺作为大鼠昼夜节律组构的一个调整器, 通过MEL作用于SCN中的高亲和性ML-1受体, 在反应的两个时间窗口(CT8~10和CT22~24)调节SCN的昼夜节律活动。
, 百拇医药
下丘脑视交叉上核(suprachiasmatic nucleus, SCN)是哺乳动物昼夜节律组构中的最重要的起博器[1], 控制着机体的生理和行为节律。在体或离体实验均已证实, SCN神经元放电活动呈现周期约为24 h的昼夜节律性[2]。光照信号和某些化学物质[3](如5-羟色胺、褪黑素)可导引SCN的节律性活动。松果腺分泌褪黑素(melatonin, MEL)具有明显的昼夜节律性, 白昼血中浓度极低, 黑夜显著升高。MEL这种节律性的分泌受到环境光照信号的调节, 即光照信号经过包括SCN在内的一个多突触通路, 调控MEL的合成和分泌。研究资料还表明, MEL经血运途径反馈作用于SCN, 从而调节机体的昼夜节律活动[4]。以往的研究显示, 持续光照可使血浆中MEL水平昼低夜高的节律丧失[5], 改变SCN对MEL的反应性[6]。然而, 仍不清楚的是, 这种反应性的改变是SCN神经元的内在特征, 还是受血浆MEL水平影响的结果。
我们在大鼠离体下丘脑薄片上, 观察在不同光照条件下松果腺切除(pinealectomy, PINX)后SCN神经元的自发放电和对MEL的反应, 并探讨MEL作用的受体机制。
, http://www.100md.com
1 材料和方法
1.1 实验动物的处理 实验采用雄性Wistar成年大鼠, 月龄2.0~2.5, 由苏州医学院实验动物中心提供。根据人工光照制, 通常以昼夜时间(circadian time, CT)来表示昼夜的划分。开始光照的时间06∶00被设为CT0, 一个光照周期结束时间设为CT24。实验动物被分成4组。(1)正常光照(light-dark cycle, LD)组: 06∶00~18∶00即CT0~12为光照期(白昼), 18∶00~06∶00即CT12~24为黑暗期(黑夜)。(2) 持续光照(constant light, LL)组: 48 h连续光照。(3)松果腺切除组: 根据Hoffman 和Reiter[7]的PINX方法, 将动物麻醉后置于立体定位仪上, 切开头皮, 在松果腺上方钻开颅骨, 在立体显微镜下用尖镊子通过窦汇快速切除松果腺。用肉眼检查摘出的松果腺是否完整, 并在处死大鼠时再检查摘除区, 以保证摘除手术的可靠性。术后置于LD条件下, 饲养1周后用于实验。(4)假手术(sham)组: 是PINX的对照组, 除不刺破硬脑膜, 也不取出松果腺外, 其余手术步骤和光照条件与PINX组相同。本实验中所有人工光照强度均为200 lx, 自由摄食饮水, 室温为20~25℃, 实验前动物至少习服2周。
, http://www.100md.com
1.2 下丘脑薄片的制备 每组大鼠经不同光照处理后, 在光照周期的不同时间用水合氯醛(400 mg/kg, ip, 上海白鹤化工厂)麻醉, 断头, 迅速取出全脑, 置于预先用95% O2和5% CO2充分饱和的低温(0~4℃)人工脑脊液(ACSF)中, 将其修成约5 mm×5 mm×5 mm含双侧SCN的下丘脑脑块。将脑块腹侧朝前、视交叉朝上, 用502胶水粘在切片机底槽上, 用振动切片机缓慢切出厚约450 μm含SCN的脑薄片。脑薄片在25℃室温下的ACSF中孵育1~2 h后移入记录槽内, 用双层尼龙网将脑薄片固定。记录槽位于恒温浴槽中央, 容量约为1 ml, 采用全浸式灌流。用输液器将ACSF灌入记录槽内, 流速为3 ml/min。灌流液的温度由恒温仪控制在33±1℃。ACSF成分采用Yamatomo[8]配方(10-3 mol/L)(以下试剂均购自上海化学试剂采购供应站): NaCl 124, KCl 5, NaH2PO4 1.24, MgSO4 1.3, CaCl2 2.4, NaHCO3 26, glucose 10, pH 7.35~7.40。
, http://www.100md.com
1.3 神经元自发放电单位的记录 用玻璃微电极细胞外记录SCN神经元的自发单位放电。将记录到的信号经微电极放大器、前置放大器、后置放大器多级放大后输入计算机, 采用上海医科大学生理教研室Smup-PC 生物信号处理系统软件, 绘制序列密度直方图, 计算出单位时间内的放电次数。
1.4 药品及给药方式 melatonin(Sigma公司)和luzindole (Sigma公司)在给药前先用100%二甲亚砜(DMSO)溶解; 盐酸哌唑嗪(常州制药厂)用无水乙醇溶解。给药时用ACSF配制成各自所需要的浓度。实验中用灌流和电泳两种方法给药: 灌流给药时将药物直接经三通活塞灌流入记录槽; 电泳给药时将上述配好的药物直接注入玻璃微电极内, 电泳电极在手术显微镜下插入SCN内, 使电泳电极与记录电极的距离保持小于100 μm。电泳药物均采用正向电流0~100 nA, 滞留电流为-30 nA。
1.5 数据处理 根据临界比值标准(CR)确定SCN神经元对melatonin的反应性质。将相同时间内给药前(S)和给药后(E)自发放电数, 按公式CR=(E-S)/S+E计算出比值, 若CR大于1.96, 则认为有兴奋作用; 如果CR小于-1.96, 则认为有抑制作用; 如果CR不满足上述条件, 则认为没有作用[9]。所有实验数据均以均数±标准差( ±s)表示, 并进行t检验、χ2检验、单因素方差分析。
, http://www.100md.com
2 结果
2.1 SCN神经元自发放电的昼夜节律
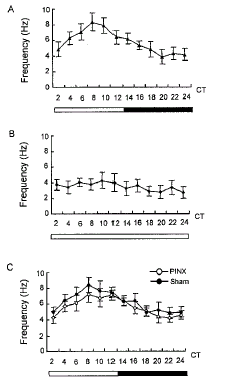
从每只大鼠可制作1~2张脑薄片, 从每张脑薄片上一般可记录到3~6个SCN神经元, 实验从109只大鼠共记录SCN神经元612个。其中在LD条件下从35只大鼠记录到214个, 在LL条件下从33只大鼠记录到189个, PINX条件下从25只大鼠记录到115个, 作为PINX对照组从16只大鼠记录到94个。在本实验条件下记录到的SCN神经元自发放电有三种类型: 规则型、不规则型和爆发型放电, 这与文献报道一致[10]。将每张脑薄片上记录到的自发放电, 按24 h昼夜周期每2 h计算其放电频率, 将不同脑薄片相同昼夜时间段的放电频率进行统计处理, 并作单因素方差分析。结果发现, 在LD条件下, 昼夜时间对2 h平均放电频率有明显的影响(P<0.001), 放电频率呈现白昼高黑夜低的节律,其高峰出现在CT6~8, 平均频率约为8.3 Hz, 低谷在CT18~20, 频率约为3.8 Hz(图1A)。在LL条件下, SCN神经元自发放电的昼夜节律基本消失(P>0.05), 无论在白昼或黑夜, 放电频率均在3.5 Hz左右(图1B)。在PINX后和假手术后, SCN神经元放电频率仍保持白昼高黑夜低的节律(P<0.05, P<0.01, 图1C), 高峰在CT6~8, 低谷在CT18~20。
, http://www.100md.com
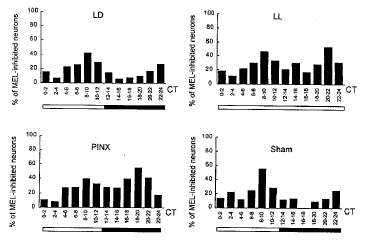
图 1. 从LD组(A, 214个单位)、LL组(B, 189个单位)、PINX组(C, 115个单位)和sham组(C, 94个单位)中记录到的SCN神经元自发放电的昼夜变化
Fig.1. Circadian changes in the spontaneous discharges of SCN neurons from LD (A, 214 units), LL (B, 189 units), PINX (C, 115 units) and sham groups (C, 94 units). The lighting cycle is shown at the bottom of the graph, the bright and the black bar represent respectively the light and the dark phases.
2.2 SCN神经元对MEL的反应性
, 百拇医药
采用灌流给药的方式观察MEL的作用。在CT8~10时相用不同浓度(10-7、 10-6、 10-5、10-4 mol/L)的MEL进行观察, 发现浓度为10-5 mol/L时MEL对SCN神经元自发放电的影响最为明显, 易于判断。故选此浓度作为观察MEL作用的适宜剂量。实验中观察到SCN神经元对MEL的反应呈抑制、兴奋和无反应三种。表1列出了各组SCN神经元对MEL发生反应的情况。大多数神经元(约占60%)对MEL不起反应, 发生抑制反应的占20%~30%, 兴奋反应的只占13%左右。可见SCN神经元对MEL的反应以抑制为主。因此,分析MEL效应的昼夜节律及其受体机制均以发生抑制反应的神经元为准。
表 1. SCN神经元对MEL各反应类型细胞的数量和百分比
Table 1. Number and percentage (in parenthese) of three types of SCN neurons responding to MEL
, 百拇医药
n
Inhibited
Excited
Non-responsive
LD
214
44 (20.6)
29 (13.6)
141 (65.8)
LL
189
57 (30.2)
, 百拇医药
25 (13.2)
107 (56.6)
Sham
94
18 (19.1)
12 (12.8)
64 (68.1)
PINX
115
32 (27.8)
15 (13.0)
68 (59.2)
, 百拇医药
Total
612
151
81
380
实验中观察一个昼夜周期内每2 h SCN神经元对MEL的反应情况。在LD条件下, SCN神经元对MEL反应在白昼敏感性高(指SCN有更多的神经元对MEL发生抑制反应), 最大反应在CT8~10, 被MEL抑制的比例为42.3%; 在黑夜敏感性低, 最大反应在CT22~24, 约为26%(图2, LD)。在LL条件下, SCN神经元被MEL抑制的比例在黑夜不是降低而是升高(P<0.01, χ2-test), 而且昼夜节律基本消失(图2, LL)。在PINX条件下, 在黑夜, 被MEL抑制的SCN神经元的比例也呈现升高(P<0.05) (图2, PINX)。sham组SCN神经元对MEL反应所呈现的昼夜节律性, 与LD组无显著差异(P>0.05, χ2-test)(图2, sham)。
, 百拇医药
图 2. 在不同条件下MEL抑制SCN神经元的百分率分布
Fig.2. Percentage distribution of SCN neurons inhibited by MEL under various conditions.
2.3 MEL抑制SCN神经元放电的药理学分析
选取于LD条件下制备的脑薄片作药理学分析。MEL拮抗剂用电泳法给药, MEL用灌流法给药。记录到稳定的SCN神经元自发放电10 min后进行分析。先给MEL, 一般在3 min内发生抑制反应。随即停药, 经ACSF冲洗, 8 min内自发放电恢复。共观察了32个单独灌流10-5 mol/L MEL的神经元, 给药3 min后, 自发放电频率从7.6±1.6降到1.8±0.5 Hz (P<0.01, t-test), 随即停止灌流, 8 min内自发放电频率恢复到给药前水平(表2)。给25个对MEL起抑制反应的神经元先电泳ML-1受体拮抗剂luzindole (10-5 mol/L), 接着灌流MEL, 结果其中23个(88.5%)不再发生抑制反应(图3A, 表2)。另取13个神经元先电泳ML-2受体拮抗剂prazosin (10-5 mol/L), 再灌流MEL, 结果是仅1个(7.7%)发生部分抑制反应, 其余12个神经元仍被抑制(图3B, 表2), 分别单独电泳luzindole 和prazosin, 未见到它们对神经元自发放电频率有抑制或兴奋作用 (图3A, 3B)。
, 百拇医药
以上结果说明, MEL的抑制作用能被ML-1受体拮抗剂luzindole阻断, 而不被ML-2拮抗剂prazosin 阻断。
图 3. MEL受体拮抗剂对MEL抑制SCN神经元自发放电的影响
Fig.3. Effect of MEL receptor antagonist on the inhibitory effect of MEL on spontaneous discharge of SCN neurons. A. ML-1 receptor antagonist luzindole. B. ML-2 receptor antagonist prazosin. Scale bar, 1 min.
表 2. MEL受体拮抗剂对MEL抑制SCN神经元自发放电频率的影响
Table 2. Effect of MEL receptor antagonists on MEL-in~duced inhibition of spontaneous discharge rate (Hz) of SCN neurons
, 百拇医药
n
After MEL infusion
0
3
8 (min)
MEL
32
7.6±1.6
1.8±0.5* *
6.9±1.2
MEL+luzindole
23
, http://www.100md.com
8.2±1.9
7.9±1.7
8.1±1.6
MEL+prazosin
12
7.7±1.3
2.1±0.8* *
7.6±1.5
~* * P<0.01 vs 0 min.
3 讨论
实验采用24 h持续光照的方法, 抑制内源性MEL的分泌; 又用PINX消除内源性MEL的主要来源。两者虽然都可取消内源性MEL, 但对SCN神经元放电的昼夜节律的影响有所区别。前者SCN神经元放电的昼夜节律基本消失, 细胞放电频率处于低水平。这与在仓鼠上观察到的结果[11]相符。后者SCN神经元的放电昼夜节律并不因内源性MEL的消除而消失, 这与以往PINX并不影响大鼠行为活动昼夜节律的结果[12]相一致。从而进一步证实, 哺乳动物松果腺并不像鸟类和爬行动物那样是昼夜节律的起博器, 而是昼夜节律组构中的一个调整器。
, 百拇医药
在LD条件下, 在白昼被MEL所抑制的神经元比例比较高, 而在黑夜较低, 而且起反应的SCN神经元主要见于白昼的后期(CT8~10)和黑夜的末期(CT22~24)两个时间窗口。这提示, 很有可能MEL是在这两个时间窗口通过抑制SCN神经元的放电活动来调整昼夜节律的。关于MEL作用的第一个时间窗口(白昼后期), 以往也有一些报道。如皮下注射MEL抑制SCN摄取2-脱氧葡萄糖[13]; 灌流MEL使离体下丘脑SCN薄片放电活动的昼夜节律时相位移[14], 都见于白昼后期。至于在第二个时间窗口(黑夜末期)出现对MEL的第二个敏感期, 与McArthur等[4]报道的MEL在CT23显著激活蛋白激酶C从而改变SCN神经元的功能的结果基本相符。
SCN神经元对MEL的反应性与SCN内MEL受体有关。已知SCN内存在MEL受体, 而MEL受体密度有白昼高黑夜低的节律性[15]。在正常光照条件下, 在白昼内源性MEL水平极低, 而MEL受体密度较高, 因此SCN神经元对外源性MEL反应性高; 在黑夜则相反。但在LL和PINX条件下, 很可能取消了黑夜较高水平的内源性MEL, SCN神经元MEL受体密度上调, 从而导致对MEL反应增强。从药理学方面看, MEL受体有两型[16]: ML-1和ML-2。本实验的电生理结果显示, ML-1受体拮抗剂luzindole能阻断MEL对SCN神经元自发放电的抑制, 而ML-2受体拮抗剂则不能, 说明是高亲和性的ML-1受体而不是低亲和性的ML-2受体介导了MEL对SCN神经元自发放电的抑制作用。
, 百拇医药
Supported by the National Natural Science Foundation of China (No.39770246)
Corresponding author. Tel: 0512-5194367; E-mail: zxjsj@yahoo.com
周先举(苏州医学院神经生物学研究室, 苏州 215007)
蒋星红(苏州医学院神经生物学研究室, 苏州 215007)
俞光第(苏州医学院神经生物学研究室, 苏州 215007)
印其章(苏州医学院神经生物学研究室, 苏州 215007)
参 考 文 献
, 百拇医药
[1] Meijer JH, Rietveld WJ. Neurophysiology of the supra~chias~matic circadian pacemaker in rodents. Physiol Rev, 1989, 69: 671~699.
[2] Inouye ST, Kawamura H.Characteristics of a circadian pace~maker in the suprachiasmatic nucleus. J Comp Physiol, 1982, 146: 153~160.
[3] Starkey SJ. Melatonin and 5-hydroxytryptamine phase ad~vance the rat circadian clock by activation of nitric oxide synthesis. Neurosci Lett, 1996, 211: 199~202.
, 百拇医药
[4] McArthur AJ, Hunt AE, Gillette MU. Melatonin action and signal transduction in the rat suprachiasmatic circadian clock: activation of protein kinase C at dusk and dawn. Endocrinology, 1997, 138: 627~634.
[5] Tamarkin L, Reppert SM, Klein DC. Regulation of pineal melatonin in the Syrian hamster. Endocrinology, 1979, 104: 385~389.
[6] Yu GD, Rusak B. Regulation of melatonin-sensitivity and firing-rate rhythms of hamster suprachiasmatic nucleus neurons: constant light effects. Brain Res, 1993, 602: 191~199.
, http://www.100md.com
[7] Hoffman RA, Reiter RJ. Rapid pinealectomy in hamsters and other small rodents. Anat Rec, 1965, 153: 19~22.
[8] Okuya, S, Yamamoto H. Effects of atrial natriuretic poly~pep~tide on rat hypothalamic neurons in vitro. J Physiol, 1987, 338: 44~52.
[9] Feldman S, Dafny H. Effects of cortisol on unit activity in the hypothalamus of the rat. Exp Neurol, 1970, 27: 375~387.
[10] Shibata S, Liou SY, Oomura Y et al. Influence of envi~ron~ment light-dark cycle and enucleation on activity of suprachiasmatic neurons in slice preparations. Brain Res, 1984, 302 (1): 75~81.
, http://www.100md.com
[11] Mason R. The effects of continuous light exposure on Syrian hamster suprachiasmatic (SCN) neuronal discharge activity in vitro. Neurosci Lett, 1991, 123: 160~163.
[12] Cheung PW, McCormace. Failure of pinealectomy or mela~tonin to alter circadian activity rhythms of rat. Endocrinology, 1980, 107: 1525~1529.
[13] Cassone VM, Roberts MH, Moore RY. Melatonin inhibits metabolic activity in the rat suprachiasmatic nuclei. Neurosci Lett, 1987, 81: 29~34.
, 百拇医药
[14] Starkey SJ, Walker MP, Beresford IJM et al. Modulation of the rat suprachiasmatic circadian clock by melatonin in vitro. NeuroReport, 1995, 6: 1947~1951.
[15] Laitinen JT,Castren E,Vakkuri O et al. Diurnal rhythm of melatonin binding in the rat suprachiasmatic nucleus. Endocrinology, 1989, 124: 1585~1587.
[16] Dubocovich ML. Pharmacology and function of melatonin re~ceptors. FASEB J, 1988, 2: 2765~2773.
Received 1999-10-10 Revised 2000-01-14, 百拇医药