白介素-2 促进RC-4B/C垂体瘤细胞系增殖
 |
 |
 |
 |
第四军医大学基础部生理学教研室; 西安 710032 王高峰;朱运龙;陈健康;张万会;钟延清;胡玉珍;王复周
关键词:白细胞介素-2;垂体瘤;细胞增殖;tyrphostin;H-9;tamoxifen
摘要:采用细胞培养方法, 以3H-TdR掺入率反映细胞增殖水平, 研究了白介素-2 (IL-2)对大鼠源的RC-4B/C垂体瘤细胞系增殖的影响, 并初步分析了IL-2的作用机制。结果表明: (1) IL-2 (10~1000 U/ml) 剂量依赖性地显著提高RC-4B/C细胞3H-TdR掺入率。 (2) 特异性酪氨酸蛋白激酶(PTK)抑制剂tyrphostin (1 μmol/L)可明显降低RC-4B/C细胞3H-TdR掺入率, 并可部分阻断IL-2的促细胞增殖作用。 (3) 特异性蛋白激酶A (PKA)抑制剂H-9 (1 μmol/L) 作用后, 3H-TdR掺入率明显升高; H-9还可加强IL-2的促细胞增殖作用。 (4) 在本实验中未观察到抗雌激素tamoxifen (1 μmol/L) 对IL-2促RC-4B/C细胞增殖效应有明显影响。上述结果表明, IL-2参与调节垂体瘤细胞的增殖活动, 并且IL-2的作用与PTK及PKA信号传导途径有关。
, http://www.100md.com
白细胞介素-2 (IL-2) 是主要由辅助性T淋巴细胞分泌的含有 133个氨基酸残基的多肽。目前已知, IL-2的生理功能是在免疫系统内发挥调节效应, 尤其是作为生长因子促进淋巴细胞的增殖与分化[1]。 近年来有作者报道, 人垂体瘤及啮齿类动物垂体瘤细胞系可以表达并分泌IL-2。用促肾上腺皮质激素释放因子(CRF)或佛波酯(PMA)刺激后, 可在小鼠源AtT-20垂体瘤细胞系中检测到IL-2 mRNA; 人促皮质激素垂体瘤细胞IL-2 mRNA的表达及IL-2的基础分泌均可以被PMA加强[2]。在人促皮质激素垂体瘤和AtT-20、 GH3细胞系上, 既检测到IL-2Rα mRNA, 也有成熟的IL-2Rα分布于细胞膜上[2, 3]。有人从AtT-20细胞中克隆出三个相互有重叠的IL-2Rβ cDNA, 测序结果与淋巴细胞中IL-2Rβ cDNA序列基本相同[4]。由于IL-2及其受体在垂体瘤中的存在, IL-2可能作为旁分泌或自分泌因子调节垂体瘤细胞的增殖与分化。1993年Arzt等报道, IL-2 (1~100 U/ml) 显著提高GH3细胞系3H-TdR掺入率[3]。我室的研究显示, IL-2参与调节大鼠垂体前叶细胞的增殖活动, 该调节活动受性激素等生理因素的影响[5]。本工作采用细胞培养方法, 研究IL-2对RC-4B/C垂体瘤细胞系增殖的影响, 并初步分析了IL-2的作用机制。
, 百拇医药
1 材料和方法
1.1 材料 采用RC-4B/C垂体瘤细胞系(美国 ATCC), DMEM培养基和非必需氨基酸混合添加剂(美国GIBCO), 新生小牛血清(杭州四季青生物工程材料研究所), 胰蛋白酶 (Difco), IL-2 (本校寄生虫教研室薛采芳教授惠赠), tyrphostin和tamoxifen (Sigma), H-9 (日本生化株式会社), 3H-TdR (上海原子核研究所), ZT-Ⅲ型微量细胞收集仪 (浙江绍兴东埔医疗仪器厂), 以及L-50液闪计数仪(Backman)。
1.2 RC-4B/C细胞系培养方法 按照ATCC提供的程序复苏RC-4B/C细胞系, 将RC-4B/C细胞培养于混合培养基(DMEM 45%、 α-MEM 45%、 小牛血清10%、 青霉素 100 U/ml、 链霉素100 U/ml、 7.425 mmol/L葡萄糖、 6.75 mmol/L HEPES、 0.09 g/L BSA、 2.5 mg/L EGF和非必需氨基酸补充物), 置于37℃ 5% CO2的培养箱中。培养的RC-4B/C细胞为单层生长, 每2~3 d换液。传代时, 移去培养基, 加入新鲜配制的胰酶液体 (0.05% 胰酶, 0.9% NaCl, 0.02% EDTA和0.1% 葡萄糖), 室温下培养约5~10 min至细胞分散。传代率为1∶2到1∶3。
, 百拇医药
1.3 3H-TdR掺入 检查细胞生长良好后, 在传代时以无血清混合培养液轻柔冲洗2~3次, 将RC-4B/C细胞以每孔1.2~1.5×105细胞的密度种植于96孔培养板。对照组每孔加入无血清混合培养液。 实验分10组, 每组分别加入1、 10、 100、 1000 U/ml的IL-2, 以及tyrphostin (1 μmol/L)、 tyrphostin (1 μmol/L)+IL-2 (100 U/ml)、 H-9 (1 μmol/L)、 H-9 (1 μmol/L)+IL-2 (100 U/ml)、 tamoxifen (1 μmol/L)、 tamoxifen (1 μmol/L)+IL-2 (100 U/ml)。置于CO2孵箱中培养24 h后, 每孔分别加入0.37 MBq 3H-TdR, 继续培养24 h。每孔加入2.5%的胰蛋白酶液20 μl及1 mmol/L EDTA液20 μl, 使两者终浓度分别为0.25%及0.1 mmol/L。10 min后, 用ZT-Ⅲ型微量细胞收集仪收集各培养孔里的细胞于G49型玻璃纤维滤纸上, 经烘干后, 移入液体闪烁计数瓶内。每瓶加入1 ml闪烁液(TP 4 g, PoPop 0.1 g, 乙醇 20 ml, 二甲苯加至1000 ml), 而后进行液体闪烁计数, 确定cpm值。
, 百拇医药
1.4 统计学处理 将各实验组的3H-TdR掺入率cpm值换算为相应对照组cpm值均数的百分数。实验所得数据均以平均值标准差 (x±s) 表示, 每组一般为5孔, 实验重复3次, 以t检验判断两组数值间差别的显著性。
2 结果
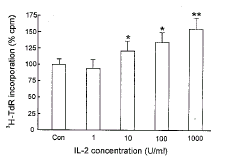
2.1 IL-2对RC-4B/C垂体瘤细胞系增殖的剂量效应
与正常对照组比较, IL-2 (10~1000 U/ml) 可剂量依赖性地提高RC-4B/C细胞3H-TdR掺入率, 但其最高值可达到对照组的1.7倍左右。1 U/ml的IL-2对AP细胞3H-TdR掺入率没有明显影响(见图1)。
图 1. IL-2对培养的RC-4B/C细胞增殖的影响
Fig.1. Effect of IL-2 on 3H-TdR incorporation into RC-4B/C cells. Data are the mean±SD (n=5). * P<0.05; * * P<0.01 compared with control.
, 百拇医药
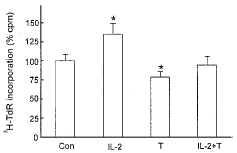
2.2 Tyrphostin对IL-2促RC-4B/C细胞增殖效应的影响
图2表示, 酪氨酸蛋白激酶(PTK)的特异性抑制剂tyrphostin (1 μmol/L)单独作用可显著性抑制RC-4B/C细胞的3H-TdR掺入率。提示RC-4B/C细胞的增殖活动与PTK信号传导途径密切相关。Tyrphostin (1 μmol/L)与IL-2 (100 U/ml)合用时, 与对照组比较, RC-4B/C细胞的3H-TdR掺入率没有明显变化, 但并不是tyrphostin与IL-2作用的简单的叠加; 与IL-2组比较, 3H-TdR掺入率显著性降低。这表明, tyrphostin与IL-2的效应紧密相关, tyrphostin可以抑制IL-2的促增殖作用, 因而IL-2的促RC-4B/C细胞增殖作用可能是通过PTK介导的。
图 2. Tyrphostin对IL-2促进RC-4B/C细胞增殖效应的影响
, 百拇医药
Fig.2. Effect of tyrphostin (T, 1 μmol/L) on the action of IL-2 (100 U/ml) on 3H-TdR incorporation into RC-4B/C cells. Data are the mean±SD (n=5). * P<0.05 compared with control.
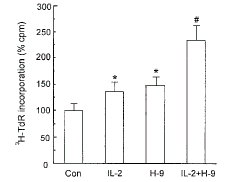
图 3. H-9对IL-2促进RC-4B/C细胞增殖效应的影响
Fig.3. Effect of H-9 (1 μmol/L) on the action of IL-2 (100 U/ml) on 3H-TdR incorporation into RC-4B/C cells.Data are the mean±SD (n=5).* P<0.05 compared with control; # P<0.05 compared with IL-2 group.
, 百拇医药
2.3 H-9对IL-2促RC-4B/C细胞增殖效应的影响
由图3可见, 特异性蛋白激酶A (PKA)抑制剂H-9 (1 μmol/L)单独作用可显著升高RC-4B/C细胞的3H-TdR掺入率, 提示RC-4B/C细胞的增殖活动与PKA密切相关, PKA信号传导途径激活可能抑制RC-4B/C细胞增殖。H-9 (1 μmol/L)与IL-2 (100 U/ml)合用时, 与对照组比较, RC-4B/C细胞的3H-TdR掺入率显著升高; 与IL-2组比较, 3H-TdR掺入率显著升高, 提示在对RC-4B/C细胞增殖调节过程中, H-9和IL-2之间有一定的相互增强作用。
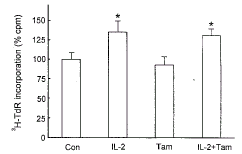
2.4 Tamoxifen对IL-2促RC-4B/C细胞增殖效应的影响
抗雌激素tamoxifen (1 μmol/L) 单独作用时, 对RC-4B/C细胞3H-TdR掺入率没有显著影响。Tamoxifen (1 μmol/L) 与IL-2 (100 U/ml) 合用时, 与对照组比较, RC-4B/C细胞的3H-TdR掺入率显著升高; 但与单独IL-2 (100 U/ml) 的作用相比, 两者没有显著差异(见图4)。这提示tamoxifen对IL-2调节RC-4B/C细胞增殖效应没有明显的影响。
, 百拇医药
图 4. Tamoxifen对IL-2促进RC-4B/C细胞增殖效应的影响
Fig.4. Effect of tamoxifen (Tam, 1 μmol/L) on the action of IL-2 (100 U/ml) on 3H-TdR incorporation into RC-4B/C cells. Data are the mean±SD (n=5). * P<0.05 compared with control.
3 讨论
自从1976年 Morgen发现IL-2后, 人们对IL-2 的作用及其机制进行了详细的研究。IL-2的主要生理作用是刺激活化的T细胞克隆性生长, 促进B细胞的增殖与分化等[1]。随着神经-内分泌-免疫网络概念的提出, 近十年来, IL-2对垂体及神经内分泌的作用日益受到重视。近来有人报道, 人垂体瘤及啮齿类动物垂体瘤细胞系既可表达IL-2R, 又可分泌IL-2。如在小鼠源垂体瘤细胞系AtT-20细胞中检测到IL-2 mRNA; 人促皮质激素垂体瘤既有IL-2 mRNA的表达, 也有一定的IL-2的基础分泌[2]。在人促皮质激素垂体瘤和AtT-20及GH3细胞系上, 既检测到IL-2Rα mRNA, 也有成熟的IL-2Rα分布于细胞膜上[2, 3]。有人从AtT-20细胞中克隆出IL-2Rβ cDNA序列[4]。由于IL-2及其受体在垂体瘤的存在, 推测IL-2可能作为旁分泌或自分泌因子调节垂体细胞的增殖与分化。IL-2作为一种生长因子, 在免疫系统之外的多种非淋巴细胞上存在IL-2R, 但普遍认为IL-2对它并不具生长刺激作用[6]。随着一些实验事实的出现, 这种观点很快受到挑战, 如IL-2促进大鼠和鸡胚交感神经轴突的生长[7]。 有关报道及我室研究显示, IL-2对垂体瘤细胞和正常大鼠垂体前叶细胞增殖活动有明显的调控作用。
, http://www.100md.com
RC-4B/C垂体瘤细胞系是1977年从一个3年龄的F1雄性大鼠垂体前叶腺瘤中获得的。该细胞系可产生LH、 GH、 FSH、 PRL和ACTH。该细胞系LH-β细胞百分率为19.9%, 高于正常雄性大鼠垂体, 而生长激素细胞 (12.2%) 则较正常低; FSH-β、 PRL和ACTH细胞百分率与正常相当[8]。本研究结果表明, IL-2 (10~1000 U/ml)可剂量依赖性地提高RC-4B/C细胞3H-TdR掺入率, 最高值可达到其对照组的1.7倍左右, IL-2对RC-4B/C的促增殖效应与对GH3细胞的效应相比, 没有报道的那样强烈, 这可能是由二者的细胞组成差别所致, GH3细胞系主要由GH细胞和PRL细胞组成。
IL-2对淋巴细胞的促增殖效应主要表现为使细胞由细胞周期G0期进入S期, 但目前对IL-2及IL-2R复合体如何将增殖信号传递到细胞核并调控其基因表达, 引起细胞增殖, 还知之甚少。IL-2R的特征是胞浆区缺少固有的酪氨酸蛋白激酶(PTK)功能区, IL-2R的3个亚单位都不含与PTK的ATP结合位点相一致的氨基酸顺序, 而这恰是其它生长因子受体的标志[9]。从大多数细胞因子受体超家族成员中得到的证据表明, 信号传导起始过程中快速的PTK活化为关键因素, 因此IL-2R传导增殖信号的机制可能有别于其它生长因子受体所采用的“经典”机制。虽然IL-2R本身缺乏PTK功能区, 但活化的IL-2R复合物中存在酪氨酸激酶活性, 因而IL-2可快速诱导细胞内蛋白质酪氨酸磷酸化, 包括IL-2Rβγ链和γ链本身[10]。例如在小鼠细胞中发现有与IL-2R复合物结合的PTK, PTK可能以非共价键与IL-2R中的一个或更多的亚单位结合在一起[11]。在本实验中, PTK抑制剂 tyrphostin (1 μmol/L) 单独作用即可显著性抑制RC-4B/C细胞的3H-TdR掺入率, 表明RC-4B/C细胞的增殖活动与PTK密切相关。进一步研究显示, tyrphostin可抑制IL-2的促RC-4B/C细胞增殖作用, 提示IL-2的促RC-4B/C细胞增殖的部分作用可能是通过PTK信号传导途径介导的。
, http://www.100md.com
一般认为, 细胞内cAMP水平升高使PKA信号传导途径激活后, 多种细胞增殖水平会下降, 如以cAMP拟似物、 PKA 激动剂forskolin作用24 h后, 可显著降低培养A-172神经胶质瘤细胞系3H-TdR掺入率, 促进A-172细胞系分化并可诱发细胞凋亡[12]。在本实验中PKA抑制剂H-9 (1 μmol/L) 可明显升高RC-4B/C细胞的3H-TdR掺入率, 表明RC-4B/C细胞的增殖活动与PKA也密切相关; 与A-172细胞系类似, PKA信号传导途径抑制后, 细胞的增殖活动旺盛。同时H-9还可加强IL-2对RC-4B/C细胞的增殖效应, 这可能与RC-4B/C细胞本身IL-2的表达增加有关。CD4+辅助性T细胞内PKA激活后, PKA作用于IL-2启动子的κ-B位点导致IL-2的诱导表达被抑制[13], 推测PKA激活对RC-4B/C细胞中IL-2的表达有类似的作用, 这还需要进一步研究。
我室以前的工作表明, IL-2明显促进雌性大鼠垂体前叶细胞的增殖, 卵巢切除2周后, IL-2的促增殖效应反转为抑制性; 补充雌二醇后, IL-2的促增殖效应基本恢复, 提示机体雌激素水平变化可调控IL-2对垂体前叶细胞增殖的效应[5]。雌激素受体阻断剂 ZM 182780可以阻断IL-2对GH3细胞促增殖作用, 提示IL-2的信号传递与雌激素受体有关[14]。我室研究还发现, 一定浓度的雌二醇显著提高培养垂体瘤细胞IL-2R阳性率 (未发表资料)。但本实验未观察到抗雌激素Tamoxifen对IL-2促进RC-4B/C细胞增殖效应有明显影响。推测可能的原因是: (1) tamoxifen和ZM 182780作用途径及效应有所不同; (2) RC-4B/C细胞和GH3细胞组成不同。由此, 还需用新的工具药和实验方法进一步研究IL-2与雌激素受体在垂体前叶的相互作用。
, 百拇医药
Supported by the National Natural Science Foundation of China (No.39670281)
Corresponding author. Tel: (029)-3374521; Fax: (029)-3374533; E-mail: wanggf@fmmu.edu.cn
王高峰(第四军医大学基础部生理学教研室, 西安 710032)
朱运龙(第四军医大学基础部生理学教研室, 西安 710032)
陈健康(第四军医大学基础部生理学教研室, 西安 710032)
张万会(第四军医大学基础部生理学教研室, 西安 710032)
, 百拇医药 钟延清(第四军医大学基础部生理学教研室, 西安 710032)
胡玉珍(第四军医大学基础部生理学教研室, 西安 710032)
王复周(第四军医大学基础部生理学教研室, 西安 710032)
参 考 文 献
[1] Robb RJ. Interleukin-2: the molecule and its function. Immunol Today, 1984, 5: 203~209.
[2] Arzt E, Stelzer G, Renner U et al. Interleukin-2 and inter~leukin-2 receptor expression in human corticotropic adenoma and murine pituitary cell cultures. J Clin Invest, 1992, 90: 1944~1951.
, 百拇医药
[3] Arzt E, Buric R, Stelzer G et al. Interleukin involvement in anterior pituitary cell growth regulation: effect of IL-2 and IL-6. Endocrinology, 1993, 132: 459~467.
[4] Petitto JM, Huang Z, Rinker CM et al. Isolation of IL-2 re~cep~tor-beta cDNA clones from AtT-20 pituitary cells: constitutive expression and role in signal transduction. Neuropsychopharmacology, 1997, 17: 57~66.
[5] Wang GF, Zhu YL, Hu YZ et al. Effect of interleukin-2 on proliferation of cultured rat anterior pituitary cells. Chin J Physiol Sci, 1997, 13: 129~136.
, 百拇医药
[6] 吕宝璋, 田英主编. 受体学概论. 北京: 科学出版社. 1991年, 213~223.
[7] Haugen PK, Letourneau PC. Interleukin-2 enhances chick and rat sympathetic, but not sensory, neurite outgrowth. J Neurosci Res, 1990, 25: 443~452.
[8] Hurbain KI, Berault A, Noel N et al. Gonadotropes in a novel rat pituitary tumor cell line, RC-4B/C. Establishment and partial characterization of the cell line. In Vitro Cell Dev Biol, 1990, 26: 431~440.
, 百拇医药
[9] Taniguchi T, Minami Y. The IL-2/IL-2 receptor system: a current overview. Cell, 1993, 73: 5~8.
[10] Taniguchi T, Miyazaki T, Minami Y et al. IL-2 signaling involves recruitment and activation of multiple protein tyrosine kinases by the IL-2 receptor. Ann NY Acad Sci, 1995, 766: 235~244.
[11] Howard OM, Kirken RA, Garcia GG et al. Structural do~mains of interleukin-2 receptor beta critical for signal transduction: kinase association and nuclear complex formation. Biochem J, 1995, 306: 217~224.
, 百拇医药
[12] Chen TC, Hinton DR, Zidovetzki R et al. Up-regulation of the cAMP/PKA pathway inhibits proliferation, induces differentiation, and leads to apoptosis in malignant gliomas. Lab-Invest, 1998, 78: 165~174.
[13] Neumann M, Grieshammer T, Chuvpilo S et al. RelA/p65 is a molecular target for the immunosuppressive action of protein kinase A. EMBO J, 1995, 14: 1991~2004.
[14] Newton CJ, Arzt E, Stalla GK. Involvement of the estrogen receptor in the growth response of pituitary tumor cells to interleukin-2. Biochem Biophy Res Commun, 1994, 205: 1930~1937.
Received 1999-09-09 Revised 2000-01-17, 百拇医药