新生大鼠心室成纤维细胞条件培养液的促心肌细胞肥大作用
 |
 |
 |
 |
 |
中山医科大学生理教研室;广州;510089 龚素珍;刘培庆;鲁伟;符史干;潘敬运
关键词:成纤维细胞;心肌细胞;肥大;细胞培养;心脏
摘要:
利用新生大鼠心室成纤维细胞条件培养液孵育心肌细胞,证实成纤维细胞条件培养液能明显增大心肌细胞的表面积, 增加心肌细胞的蛋白含量和[3H]-亮氨酸([3H]-Leu)的掺入, 上述作用以第3天的条件培养液作用最强, 具有剂量依赖性。ETA受体拮抗剂BQ123能部分阻断成纤维细胞条件培养液促进心肌细胞肥大的作用, 而AT1受体拮抗剂CV11974和α-肾上腺素受体拮抗剂regitin却无此效果。 结果提示: 成纤维细胞条件培养液中含有促使心肌细胞肥大的物质, 这些物质可能是内皮素(ET-1)等。 百日咳毒素(PTX)和staurosporine也能部分阻断成纤维细胞条件培养液促进心肌细胞肥大作用, 表明培养液的促肥大作用可能与PTX敏感的G蛋白及PKC有关。
, 百拇医药
心脏由心肌细胞和非心肌细胞组成。 非心肌细胞包括成纤维细胞、内皮细胞、平滑肌细胞和巨噬细胞等, 其中成纤维细胞占绝大部分。 心肌细胞收缩能力强, 出生后无分化能力, 占心脏细胞总数的30%; 而非心肌细胞中除平滑肌细胞外均无收缩能力, 但有很强的分化能力, 占心脏细胞的70%。 过去, 人们一直认为非心肌细胞对心肌细胞仅具有结构上的支持、保护作用。 近年来, 人们逐渐了解到非心肌细胞还具有自分泌和旁分泌功能, 能产生某些可溶性物质, 影响心肌细胞的结构和生理功能, 对心脏具有重塑作用[1~4]。 我们利用新生大鼠心脏成纤维细胞无血清条件培养液(fibroblast conditioned growth medium, FCGM), 探讨成纤维细胞是否分泌活性物质以影响心肌细胞结构和功能, 并研究这些物质作用可能的信号传导途径。
1 材料和方法
1.1 心肌细胞和心脏成纤维细胞的分离和培养 取1~3 d龄的SD大鼠(雌雄不限, 中山医科大学实验动物中心提供), 在无菌条件下开胸剪取心室肌。 在胰蛋白酶消化液消化后, 加入含10%血清的DMEM培养液制成细胞悬液, 分种于25 ml玻璃培养瓶中, 置于37℃、5% CO2培养箱内, 根据心肌细胞和成纤维细胞贴壁时间的不同, 采用差速贴壁1 h, 分别获得心肌细胞和成纤维细胞。 培养的前48 h, 在心肌细胞的培养液中加入Brdu 0.1 mmol/L, 以抑制成纤维细胞的增殖。
, 百拇医药
1.2 成纤维细胞条件培养液(FCGM)的获取 将成纤维细胞传代, 接种于50 ml的玻璃培养瓶至融合状态, 在含1%血清DMEM培养液中孵育24 h, 然后置入8 ml/瓶的无血清培养液(DMEM、胰岛素10 μg/ml、转铁蛋白10 μg/ml、Vit C 100 μmol/L、Vit B12 1.5 μmol/L、青霉素100 U/ml、链霉素100 μg/ml)。 同一批成纤维细胞, 在第3天收集全部条件培养液后, 再加入新鲜的无血清条件培养液8 ml, 培养48 h (第5天)后收集全部条件培养液。 以此类推, 在第7天和第9天分别收集成纤维细胞的条件培养液, 用0.45 μm 滤膜过滤, 贮于-20℃, 待实验时使用。 传代后的成纤维细胞采用α-actin免疫细胞化学染色鉴别, 纯度达95%。
1.3 心肌细胞表面积测定 贴壁生长的心肌细胞被消化脱落后, 用图像处理系统测定心肌细胞的周径和表面积, 每瓶测5个视野, 每个视野测15~20个细胞, 取其平均值。
, 百拇医药
1.4 心肌细胞蛋白质测定 差速贴壁后, 吸出未贴壁的心肌细胞悬液, 配成约4×105个细胞/ml, 将细胞接种于25 ml的玻璃培养瓶中, 每瓶4 ml。 48 h后换为含1%血清的DMEM培养液, 72 h换为FCGM, 同时加入多种干预因素, 培养72 h后收集细胞, 用Bradford法[5]测定心肌细胞蛋白质含量, 并根据各瓶细胞数, 计算出每瓶细胞的总蛋白质含量和每个心肌细胞的蛋白质含量。 实验均重复3次。
1.5 心肌细胞的[3H]-Leu掺入测定 将含有0.1 mmol/L Brdu、细胞浓度为4×105个/ml的心肌细胞接种于24孔培养板上, 每孔1 ml, 每4孔为一组。 48 h换为含1%血清DMEM培养液, 72 h换为含有[3H]-Leu 3.7×104 Bq/孔(北京原子能研究所)以及各种干扰因素的FCGM, 继续培养72 h, 用D-Hanks液充分冲洗, 以洗去游离的同位素, 将细胞收集于玻璃纤维滤膜上, 然后用10%三氯乙酸和无水乙醇再冲洗。 滤膜烘干后置于含4 ml闪烁液的液闪杯中, 用FJ-2107P液体闪烁仪(国营二六二厂制造)测定放射性强度。 实验均重复3次。
, 百拇医药
1.6 统计学处理 所有数据均以±s表示, 组间数据处理根据处理方差齐性分析结果, 采用非配对t检验, P<0.05被认为有意义。
2 结果
2.1 FCGM对培养新生大鼠心肌细胞表面积、蛋白质含量及 [3H]-Leu掺入的影响
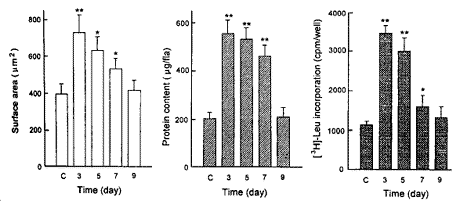
用无血清DMEM培养液培养成纤维细胞, 分别在不同的时间间隔中(第3、5、7、9天)收集FCGM, 心肌细胞经FCGM培养72 h后, 分别测定细胞表面积、蛋白质含量和[3H]-Leu掺入。 与未经成纤维细胞培养过的无血清DMEM培养液(C)相比, 第3、5天和第7天的FCGM明显增加心肌细胞表面积、蛋白质含量和[3H]-Leu掺入(图1), 而心肌细胞的数目无明显变化(4×105个/ml)。
图 1. 不同时间收集的FCGM对培养新生大鼠心肌细胞表面积、蛋白质含量和[3H]-Leu掺入的影响
, 百拇医药
Fig.1. Effect of collected FCGM at different times on cell surface area, protein content and [3H]-Leu incorporation in cultured neonatal rat cardiomyocytes. C: control. *P<0.05, **P<0.01 compared with control group.
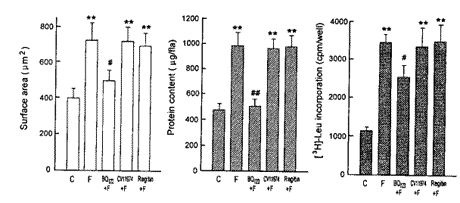
用第3天收集的FCGM与无血清DMEM培养液混合, 配成含不同百分比(100%、80%、60%、40%和20%)的培养液培养心肌细胞72 h, 然后测定心肌细胞表面积、蛋白质含量和[3H]-Leu掺入。 与无血清DMEM培养液(C)相比, 含40%以上的FCGM的培养液, 能增加心肌细胞表面积、蛋白质含量和[3H]-Leu掺入(图2)。 心肌细胞的数目无明显变化(4×105个/ml)。
图 2. 不同浓度的FCGM对培养新生大鼠心肌细胞表面积、蛋白质含量和[3H]-Leu掺入的影响
, 百拇医药
Fig.2. Effect of FCGM of different concentrations on cell surface area, protein content and [3H]-Leu incorporation in cultured neonatal rat cardiomyocytes. C: control. *P<0.05,**P<0.01 compared with control group.
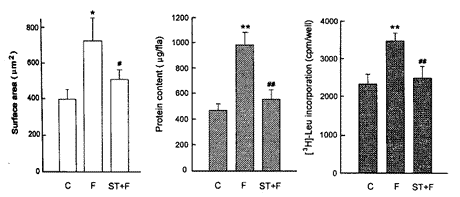
2.2 BQ123、CV11974和regitin对FCGM促进心肌细胞表面积、蛋白质含量和[3H]-Leu掺入的影响
第3天收集的FCGM与无血清DMEM培养液(C)比较, FCGM能明显增加心肌细胞的表面积、蛋白质含量和[3H]Leu-掺入。 ETA受体拮抗剂BQ123 (1×10-6 mol/L)可以阻断FCGM的这种作用, 血管紧张素Ⅱ AT1受体拮抗剂CV11974 (1×10-4 mol/L)和α-肾上腺素受体拮抗剂regitin (1×10-6 mol/L)无阻断作用(图3)。 心肌细胞数目为1×106个/ml。
, http://www.100md.com
图 3. BQ123、CV11974和regitin对FCGM增加心肌细胞表面积、蛋白质含量和[3H]-Leu掺入的影响
Fig.3. Effect of BQ123, CV11974 and regitin on FCGM promotion of cell surface area, protein content and [3H]-Leu incorporation in cultured neonatal rat cardiomyocytes. C: control. F: FCGM.* P<0.05,**P<0.01 compared with free-serum DMEM group;#P<0.05,##P<0.01 compared with FCGM group.
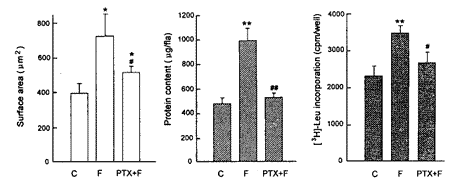
2.3 百日咳毒素(pertussis toxin, PTX)对FCGM促进心肌细胞表面积、细胞蛋白质含量和[3H]Leu-掺入的影响
, 百拇医药
实验用第3天收集的FCGM, 在无血清DMEM培养液中用PTX (1×10-6 mol/L)预处理1 h, 再换为含有PTX (1×10-6 mol/L) 的FCGM培养心肌细胞72 h, PTX能明显抑制FCGM促进心肌细胞表面积、蛋白质含量和[3H]-Leu的掺入(图4)。 心肌细胞数目为1×106个/ml。
图4. 百日咳毒素对FCGM促进新生鼠心肌细胞表面积、蛋白质含量和[3H]-Leu掺入的影响
Fig.4. Effect of PTX on FCGM promotion of cell surface area, protein content and [3H]-Leu incorporation in cultured neonatal rat cardiomyocytes. C: control. F: FCGM.* P<0.05,**P<0.01 compared with free-serum DMEM group,#P<0.05,##P<0.01 compared with FCGM group.
, http://www.100md.com
2.4 蛋白激酶C 对FCGM促进心肌细胞表面积、蛋白质含量和[3H]-Leu掺入的影响
实验用第3天收集的FCGM, 在无血清DMEM培养液中用蛋白激酶C (PKC)抑制剂staurosporine (ST, 1×10-6 mol/L)预处理1 h, 再换为含有ST (1×10-6 mol/L) 的FCGM培养心肌细胞72 h。 ST能明显抑制FCGM促进心肌细胞表面积、 蛋白质含量和[3H]-Leu掺入的增加(图5)。 心肌细胞数目为1×106个/ml。
图 5. 蛋白激酶C对FCGM增加新生鼠心肌细胞表面积、蛋白质含量和[3H]-Leu掺入的影响
Fig.5. Effect of protein kinase C on FCGM promotion of cell surface area, protein content and [3H]-Leu incorporation in cultured neonatal rat cardiomyocytes. C: control. F: FCGM.* P<0.05,**P<0.01 compared with free-serum DMEM group;#P<0.05,##P<0.01 compared with FCGM group.
, http://www.100md.com
3 讨论
研究表明, FCGM能明显促进心肌细胞表面积增大、蛋白质含量增多和[3H]-Leu掺入增加, 但对心肌细胞的数目无影响, 即FCGM促进心肌细胞肥大而不引起心肌细胞增生。 ETA受体阻断剂BQ123能部分阻断FCGM所致的心肌细胞的肥大作用, 而血管紧张素Ⅱ的 AT1受体阻断剂CV11974和α-肾上腺素受体阻断剂regitin却无明显的影响, 提示FCGM具有促进心肌细胞肥大作用, 其成分可能含ET-1。 PTX和PKC抑制剂ST也能部分阻断FCGM促心肌细胞肥大的作用, 提示此作用可能与PTX敏感的G蛋白和PKC有关。
越来越多的资料显示, 在心脏局部存在自分泌和旁分泌的调节通路, 成纤维细胞除了对其周围的心肌细胞具有支持、保护作用外, 在无刺激物和机械牵拉刺激时也能分泌某些可溶性物质, 对心肌细胞具有营养作用[3,6]。 我们的结果也显示, FCGM能够促进新生大鼠心肌细胞表面积增大、蛋白质合成速率增加以及蛋白质总量增多, 但对心肌细胞的数目没有影响, 表明成纤维细胞可以分泌生物活性物质促进心肌细胞肥大。
, 百拇医药
成纤维细胞不仅是心肌细胞的支持细胞, 而且本身有分泌功能, 影响自身和周围心肌细胞的结构和功能[1~4]。 Suzuki[7]等发现, 在成纤维细胞的条件培养液中含有分子量为2.5 kDa、 能促进心肌细胞搏动的内皮素(ET)。 Harada等[6]采用放射免疫测定法也发现, 在成纤维细胞的条件培养液中含有相当量的ET-1, 同时用Northen blot 技术检测到ET-1 mRNA在成纤维细胞表达, 而在心肌细胞未发现ET-1 mRNA的表达, 说明ET-1是由成纤维细胞分泌, 而不是心肌细胞分泌的。 我们观察到ETA受体拮抗剂BQ123能部分阻断FCGM的促心肌细胞肥大作用, 而血管紧张素Ⅱ 的AT1受体拮抗剂CV11974和α-肾上腺素受体拮抗剂 regitin无此作用。 这些结果表明, FCGM中含有促进心肌细胞肥大的物质可能是ET-1。 由于心肌细胞也具有分泌功能, Ang Ⅱ促心肌细胞肥大作用是通过心肌细胞本身分泌ET-1来实现的[8], 因此, 在我们的实验中, FCGM所含的ET-1是来自成纤维细胞还是心肌细胞, 尚需进一步实验研究。 另外, BQ123仅能部分阻断FCGM的促心肌细胞肥大作用, 表明FCGM还可能含有其它促心肌细胞肥大的因子。
, 百拇医药
我们观察到, 用百日咳毒素预处理心肌细胞可部分抑制FCGM增大细胞表面积、增加细胞蛋白质含量和促进[3H]-Leu掺入的作用, 表明FCGM诱导的心肌细胞肥大反应涉及百日咳毒素敏感的G蛋白。 我们的结果还表明, PKC在FCGM促心肌细胞肥大反应中也起了重要作用, 因为用PKC抑制剂ST能阻断FCGM诱导的心肌细胞肥大反应, 这些或许与ET-1促心肌细胞肥大的信号转导途径有关。
*Corresponding author. Tel: (020)87330647; E-mail: SZGong@163.net
作者单位:龚素珍(中山医科大学生理教研室, 广州 510089)
刘培庆(中山医科大学生理教研室, 广州 510089)
鲁伟(中山医科大学生理教研室, 广州 510089)
, http://www.100md.com
符史干(中山医科大学生理教研室, 广州 510089)
潘敬运(中山医科大学生理教研室, 广州 510089)
参考文献
[1] Yu H, Gallagher AM, Garfin PM, et al. Prostacyclin re~lease by rat cardiac fibroblasts. Hypertension, 1997, 30: 1047~1053.
[2] Nishida M, Springhorn JP, Kelly RA, et al. Cell-cell signa~ling between adult rat ventricular myocytes and cardiac microvascular endothelial cells in heterotypic primary culture. J Clin Invest, 1993, 91: 1934~1941.
, 百拇医药
[3] Guo WN, Kamiya K, Kada KJ, et al. Regulation of cardiac kv 1.5 K+ channel expression by cardiac fibroblasts and mechanical load in cultured newborn rat ventricular myocytes. J Mol Cell Cardiol, 1998, 30: 157~166.
[4] Long CS, Henrich CJ, Simpson PC. A growth factor for car~diac myocytes is produced by cardiac nonmyocytes. Cell Reg, 1991, 2: 1081~1095.
[5] Bradford MM. A rapid and sensitive method for the quanti~ta~tion of microgram quantities of protein utilizing the principle of protein-dye binding. Anzl Biochem, 1976, 72: 248~254.
, 百拇医药
[6] Harada M, Itoh H, Nakagawa O, et al. Significance of ven~tri~cular myocytes and nonmyocytes interaction during cardiocyte hypertrophy. Circulation, 1997, 96: 3737~3744.
[7] Suzuki T, Tsuruda A, Katah SH, et al. Purification of endothelin from a conditioned medium of cardiac fibroblastic cells using beating rate assay of myocytes cultured in a serum-free medium. J Mol Cell Cardiol, 1997, 9: 2087~2093.
[8] Ito H, Hirata Y, Adachi S, et al. Endothelin-1 an autoc~rine/paracrine factor in the mechanism of angiotensin Ⅱ-induced hypertrophy in cultured rat cardiomyocytes. J Clin Invest, 1993, 92: 398~403.
Received 1999-04-18 Revised 1999-07-24, 百拇医药