缺血预处理减轻在体家兔心肌细胞凋亡
 |
 |
 |
河北医科大学基础医学研究所生理室; 石家庄 050017 丁延峰;张蔓蔓;何瑞荣
关键词:缺血-再灌注;缺血预处理;心脏;细胞凋亡;流式细胞术;基因
摘要:
在麻醉家兔心肌缺血-再灌注(ischemia-reperfusion,IR)模型上, 观察IR和缺血预处理(ischemic pre~con~ditioning, IP)对血流动力学、 心外膜电图、 心肌梗塞范围、 心肌细胞凋亡和凋亡相关调控基因蛋白(Fas、 Bcl-2、 Bax等)的影响。所得结果如下: (1) 在IR过程中, 动脉血压、 心率和心肌耗氧量进行性降低; 心外膜电图ST段在缺血期明显抬高(P<0.001), 再灌注时逐渐恢复至基础对照值。(2) 单纯IR组的梗塞心肌占缺血心肌的57.7±2.0%, IP组的梗塞心肌为27.7±1.5%(P<0.01)。(3) 凝胶电泳显示, 单纯IR组的缺血组织DNA呈云梯状, IP组则无明显云梯状; 原位末端标记表明, IP组缺血未坏死心肌的凋亡细胞较IR组稀少; 流式细胞术测得IR和IP组中缺血心肌的细胞凋亡率分别为11.2±0.4%和6.35±0.2%(P<0.01)。(4) 与非缺血心肌相比, IR和IP组缺血心肌的Fas和Bax蛋白表达均明显增高(P<0.05), 且IR组的Fas蛋白表达较IP组的明显(P<0.05)。IR组缺血心肌Bcl-2/Bax较非缺血心肌组织明显减小(P<0.01)。以上结果表明, IP减少IR引发的心肌细胞凋亡, 并减少IR心肌组织中Fas蛋白的表达。
, http://www.100md.com
缺血预处理(ischemic preconditioning, IP)的心肌保护作用由Murry等[1]首次报道后, 已被大量实验证实, 但其作用机制尚未阐明[2]。我们以前的实验表明, IP可减轻麻醉家兔缺血-再灌注(ischemia-re~per~fusion, IR)心肌的损伤, 并提出一氧化氮在这一保护效应中不起重要作用[3], 而ATP敏感性钾通道可能参与此保护机制[4]。近年研究发现, IR除引发心肌细胞坏死外, 也可诱发心肌细胞的凋亡[5~7]。Gottlieb等[8]和Piot等[9]观察到, IP可减少缺氧或IR所致的心肌细胞凋亡。据现有资料, 细胞凋亡受多种因素调控, 其中以细胞凋亡相关基因蛋白(如Bcl-2、 Bax和Fas等)的作用较为重要[10,11]。但IP对心肌保护时是否调控这些基因的表达, 目前尚未明确。本实验旨在家兔IR模型上验证IP是否减少IR所致的心肌细胞凋亡, 并观察IP对上述凋亡相关调控基因的影响。
1 材料和方法
, 百拇医药
1.1 家兔心脏IR模型的制备 24只雄性家兔(2.5~3.5 kg)用氨基甲酸乙酯静脉麻醉, 开胸暴露心脏, 胸膜保持完好, 动物行自主呼吸。在冠状动脉左室支的上1/3处穿线, 进行心肌IR。右颈动脉插管以监测血压、 心率, 以血压-心率指数反映心肌耗氧量[3,4]。
1.2 实验分组和程序 待动物的血压、 心率和心外膜电图稳定后, 记录结果作为正常对照值。 然后分为两组: (1) 单纯IR组(n=12): 缺血45 min-再灌注180 min, 分别测记缺血和再灌注过程的心外膜电图、 血压和心率; 最后有6只家兔用于确定心肌梗塞范围, 另有6只作心肌细胞凋亡及基因蛋白表达的分析。(2)IP组(n=12): 重复两次缺血5 min-再灌注10 min后, 随即进行(1)组的实验程序, 以确定IP对IR心肌的作用。
1.3 心肌缺血和心肌梗塞范围的确定 缺血时心脏表面青紫, 再灌注明显充血, 并以心外膜ST段反映心肌缺血的程度和范围。实验结束后, 结扎冠状动脉, 左心室注入伊文思蓝确定未缺血与缺血心肌, 用氯化硝基四氮唑蓝确定心肌梗塞范围[3,6,7]。
, 百拇医药
1.4 以原位组织化学方法确定细胞凋亡 分别取正常和缺血区心肌组织, 浸入10%中性福尔马林磷酸缓冲液中, 4℃固定24 h。应用Boehringer Mannheim公司提供的细胞凋亡试剂盒, 采用末端探针标记(Tdt-mediated dUTP nick end labeling, TUNEL)方法检测心肌凋亡细胞[7]。
1.5 组织DNA的提取和凝胶电泳 取正常或缺血心肌组织500 mg, 低温下将组织匀浆, 按Itoh等的方法进行DNA抽提和分离[12]。取DNA液于1.6% 琼脂糖凝胶中进行电泳, 经溴化乙锭染色, 紫外灯下观察、 照相。
1.6 以流式细胞方法测定细胞凋亡率 用机械法分散心肌组织, 收集单细胞悬液, 经300目尼龙网过滤离心沉淀2 min后, 加生理盐水洗涤, 再次离心沉淀后, 置于70%乙醇中备用。用溴化乙锭一步插入法进行DNA染色, 由流式细胞仪(FACS420, Becton-Dicinson)测定。仪器事先用鸡红细胞标定, 使其变异系数<5%。将所得数据输入计算机, 经Bioconsort专用软件处理, 分析细胞凋亡率[13,14]。
, 百拇医药
1.7 以流式细胞方法测定基因蛋白表达 用以上制备好的单细胞悬液, 通过间接荧光方法进行标记。将1∶100的鼠抗兔Bcl-2、 Bax和Fas蛋白抗体100 μl分别加入到含6×105细胞的离心管中混匀, 37℃水浴孵育30 min,以PBS离心洗涤2次除去未结合抗体, 加入1∶20羊抗鼠FITC-IgG(军事医学科学院微生物研究所)100 μl, 37℃温育30 min,用PBS冲洗未结合抗体, 同时以PBS代替第一抗体作为阴性对照。在制备好的样品中加PBS 1 ml, 并各取1滴涂片, 荧光显微镜下观察。有Bcl-2、 Bax蛋白存在的细胞浆内呈绿色荧光, 有Fas蛋白表达的细胞膜则有绿色荧光。将样品上机进行流式细胞测定Bcl-2、 Bax和Fas蛋白, 将采集的数据输入计算机进行处理, 以荧光指数(Fluorescence index, FI)表示蛋白的相对含量[13,15]。
1.8 主要药品和试剂 氨基甲酸乙酯( 上海化学试剂采购供应站分装),氯化硝基四氮唑蓝(上海前进化学试剂厂), TUNEL检测试剂盒(德国Boehringer Mannheim公司), DNA Ladder标品(华美生物工程公司), 兔Bcl-2、 Bax和Fas多抗(美国Santa Cruz公司), FIFC-IgG(军事医学科学院微生物研究所), 其他试剂均为国产分析纯。
, http://www.100md.com
1.9 统计学处理 所有数据用x±s 表示, 组内数据应用配对t检验, 两组间比较采用Student′s t检验,以P<0.05为有统计学意义。
2 结果
2.1 心率、 血压、 心肌耗氧量和心外膜电图
两组动物在IR过程中, 心率、 血压和心肌耗氧量呈持续性下降, 但两组间无明显差异。心外膜电图ST段抬高的平均值和ST段抬高大于或等于2 mV 的点数在缺血时均明显增加, 再灌注后又逐渐恢复到基础对照值(表1)。
表 1. 麻醉家兔缺血-再灌注过程中心率、 血压、 心肌耗氧量和心外膜电图的变化
Table 1. Changes in heart rate, blood pressure, myo~cardial oxygen consumption and epicardial electrography during myocardial ischemia-reperfusion in anesthetized rabbits
, http://www.100md.com
Group
Control
Ischemia
(45 min)
Reperfusion
(180 min)
HR (bpm)
IR
317±14
298±15* *
265±16* *
, 百拇医药
IP
311±20
301±20* *
268±21* * *
MAP (kPa)
IR
12.11±0.60
10.34±0.59*
7.94±0.67* * *
IP
, http://www.100md.com
12.23±0.71
10.00±0.54*
7.29±0.25* * *
PRI (kPa/min*1000-1)
IR
3.98±0.19
3.06±0.41*
2.11±0.26* * *
IP
3.82±0.36
, http://www.100md.com
3.05±0.33*
1.97±0.21* * *
MST (mV)
IR
3.68±0.25
32.45±8.04* * *
2.33±0.36
IP
3.42±0.42
28.17±5.34* * *
, 百拇医药
1.83±0.34
NST (n)
IR
0.50±0.22
4.00±0.26* * *
0.33±0.21
IP
0.33±0.21
4.17±0.17* * *
0.33±0.21
n=12. IR: ischmia-reperfusion; IP: ischemic preconditioning; HR: heart rate;MAP: mean arterial pressure; PRI: pressure-rate index;MST: mean elevation of epicardial electrographic ST-segment;NST: numbers of point with the ST-segment elevation beyond 2 mV. ~* P<0.05, ~* * P<0.05, ~* * * P<0.001 compared with control.
, 百拇医药
2.2 心肌梗塞范围
经伊文思蓝染色确定, IR组中缺血心肌组织占左心室的59.6±2.3%, IP组为59.4±3.4%,两组相比无明显差别。应用硝基四氮唑蓝染色法显示, IR组坏死心肌占缺血心肌的57.7±2.0%, 占左心室的34.3±1.9%;IP组坏死心肌占缺血心肌的27.7±1.5%,占左心室的15.8±0.91%,两组相比有明显差别(P<0.01)。
2.3 心肌细胞凋亡
DNA凝胶电泳显示, 非缺血心肌组织的DNA电泳呈一条整齐的条带,IR组6只动物的缺血心肌组织中均有DNA云梯状条带, IP组缺血心肌组织的DNA未见明显的云梯状条带(图1)。经TUNEL染色, 可见凋亡细胞的核染成深棕色, 非凋亡细胞的胞核不着色。在正常心肌组织和坏死心肌组织无凋亡细胞; 在缺血未坏死的心肌中, IR组有大量凋亡细胞, IP组的凋亡细胞分布稀疏(图2)。由流式细胞仪测得缺血/再灌注区的心肌细胞凋亡率,IR组为11.2±0.4%, IP组为6.35±0.2%,两组间存在明显差异(P<0.01),而非缺血心肌组织的凋亡率为0.8±0.1%(图3)。
, http://www.100md.com
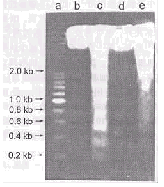
图 1. 家兔心室肌组织DNA的凝胶电泳
Fig.1. DNA agarose gel electrophoresis from rabbit ven~tri~cular myocardium.a. DNA ladder marker; b. Non-ischemic myocardium following IR; c. Ischemic myocardium following IR with ladder pattern of DNA; d. Non-ischemic myocardium following IP; e. Ischemic myocardium following IP.
2.4 Fas、 Bcl-2和Bax蛋白表达的变化
与非缺血心肌组织相比, IR组和IP组缺血心肌中的Fas和Bax蛋白表达均显著增高,且IR组的Fas蛋白表达较IP组增高明显(P<0.05); 两组缺血心肌中Bcl-2的蛋白表达与非缺血心肌相比无明显变化(P>0.05)。在IR组缺血心肌中的Bcl-2/Bax较非缺血心肌显著减小, 而在IP组缺血心肌中则无明显变化(表2)。
, http://www.100md.com
表 2. 心室肌组织中Fas、 Bcl-2和Bax蛋白表达的变化
Table 2. Changes in Fas, Bcl-2 and Bax protein ex~pres~sion in ventricular myocardium
Fluorescence index
Bcl-2/Bax
Fas
Bcl-2
Bax
NI
1.00
1.00
, 百拇医药
1.00
1.00
IR
1.87±0.25* *
0.95±0.04
1.50±0.06* *
0.63±0.11* *
IP
1.21±0.21* #
1.15±0.09
, 百拇医药
1.43±0.11*
0.80±0.10
n=6. NI: non-ischemia; IR: ischemia-reperfusion; IP: ischemic preconditioning. ~* P<0.05, ~* * P<0.01 compared with NI; ~# P<0.05 compared with IR.
图 2. 家兔心室肌的TUNEL染色(×100)
Fig.2. Staining of ventricular myocardium by TUNEL in rabbits (×100).A. Non-ischemic myo~cardium. B. Necrotic myocardium. C. Ischemic myocardium following IR (numerous apoptotic cells). D. Ischemic myocardium following IP (sparse apoptotic cells).
, 百拇医药
图 3. 心肌细胞凋亡率的流式细胞术测定
Fig.3. Measurement of cardiomyocytic apoptosis rate by flow cytometry.A. Non-ischemic myocardium. B. Is~che~mic myocardium following IR with a large apoptosis peak. C. Ischemic myocardium following IP with a small apoptosis peak.a: apoptosis peak.
3 讨论
本实验在家兔心脏IR模型上证实, IP可减少IR所致的心肌坏死, 这与我们先前的研究结果一致[3,4]。我们通过琼脂糖凝胶电泳显示的典型梯状图谱、 TUNEL法原位检测的DNA断裂片段以及流式细胞术测定的凋亡率等综合技术, 定性和定量地证实IR可诱发心肌细胞凋亡。已知缺血[16]、 缺氧[17]均能引发心肌细胞凋亡。在急性心肌梗塞病人的心肌中, 也检测到凋亡细胞[12,18]。研究表明, 细胞凋亡是不同于细胞坏死的一种死亡形式, 是在基因调控下进行的主动有序的生理性死亡过程。然而, 细胞凋亡在心脏疾病的病理生理意义目前尚未被阐明。不难设想, 对心肌细胞凋亡及时防治, 将有利于心肌细胞的存活和心脏功能的改善。我们在实验中对心脏予以缺血预处理后, IR所致的心肌细胞凋亡明显减少。Gottlieb等在培养的家兔心肌细胞上观察到, IP可使缺氧引发的心肌细胞凋亡减少[8]。Piot等在大鼠心脏上发现, IP也减少IR所致的心肌细胞凋亡[9]。这些资料提示, IP具有减少心肌细胞凋亡的作用。
, 百拇医药
业已证实, 有许多因素参与细胞凋亡的调控, 其中Bcl-2、 Bax和Fas基因对凋亡的调控倍受重视。Tanaka等提出,在缺氧引起培养新生大鼠心肌细胞发生凋亡的同时,Fas蛋白mRNA过量表达[17]。Kajstura等观察到单纯缺血可诱发大鼠心肌细胞凋亡, 且有Fas和Bcl-2蛋白过量表达[16]。据Yue等报道,IR能使家兔心肌细胞发生凋亡, 并有Fas蛋白表达显著升高[19]。Fas是一种跨膜蛋白,属于肿瘤坏死因子受体家族的成员,它通过在细胞膜上的表达致使细胞凋亡[10,17,19]。Bcl-2是细胞凋亡的抑制者, 其过量表达可阻止细胞凋亡的发生。Bax虽与Bcl-2有较高的同源性, 但可促进细胞凋亡, 而Bcl-2/Bax的比值将决定细胞是否发生凋亡[11]。本实验的结果表明: IR时心肌组织中Fas蛋白表达增多, Bcl-2/Bax降低, 心肌细胞出现凋亡; 而在IP后, Fas蛋白表达较单纯IR心肌显著减少, Bcl-2/Bax与非缺血心肌组织相比无明显变化, 且减少IR时的心肌细胞凋亡。至于这些激活的基因诱发细胞凋亡的具体机制, 尚有待于进一步探讨。
, 百拇医药
综上所述,IR可使家兔心肌细胞发生凋亡; IP减少IR所致的心肌细胞凋亡,并可能通过减少心肌组织中Fas基因蛋白的表达而起作用。
Correspondence to Prof. HE Rui-Rong. Phn: 86-311-6044121, ext. 5566; Fax: 86-311-6048177; E-mail: syho@263.net
丁延峰(河北医科大学基础医学研究所生理室, 石家庄 050017)
张蔓蔓(河北医科大学基础医学研究所生理室, 石家庄 050017)
何瑞荣(河北医科大学基础医学研究所生理室, 石家庄 050017)
参 考 文 献
[1] Murry CE, Jennings RB, Reimer KA. Preconditioning with ischemia: a delay of lethal cell injury in ischemic myocardium. Circulation, 1986, 74: 1124~1136.
, 百拇医药
[2] Lawson CE, Downey JM. Preconditioning: state of the rat myocardial protection. Cardiovasc Res, 1993, 27: 542~545.
[3] Ding YF(丁延峰), Li YL(李玉龙), Ho SY(何瑞荣). Ischemic preconditioning and exogenous L-arginine reduce infarct size in rabbit heart. Acta Physiol Sin (生理学报), 1996, 48 (6): 564~570 (in Chinese with English abstract).
[4] Ding YF (丁延峰), He RR (何瑞荣). Role of KATP channels in the cardioprotection provided by ischemic preconditioning in anesthetized rabbits. Acta Physiol Sin (生理学报), 1997, 49 (1): 105~109 (in Chinese with English abstract).
, 百拇医药
[5] Gottlieb RA, Burleson KD, Kloner RA et al. Reperfusion injury induces apoptosis in rabbit cardiomyocytes. J Clin Invest, 1994, 94: 1621~1628.
[6] Fliss H, Gatlinger D. Apoptosis in ischemic and reperfused rat myocardium. Circ Res, 1996, 79: 949~956.
[7] Yaoita H, Ogawa K, Maehara K et al. Attenuation of is~che~mia/reperfusion injury in rats by a caspase inhibitor. Circulation, 1998, 97: 276~281.
, http://www.100md.com
[8] Gottlieb RA, Gruol DL, Zhu JY et al. Preconditioning in rabbit cardiomyocytes: role of pH, vacuolar proton ATPase, and apoptosis. J Clin Invest, 1996, 97: 2391~2398.
[9] Piot CA, Padmanaban D, Ursell PC et al. Ischemic pre~con~di~tioning de~creases apoptosis in rat hearts in vivo. Circulation, 1997, 96: 1598~1604.
[10] Nagata S, Golistein P. The Fas death factor. Science, 1995, 267: 1449~1456.
, 百拇医药
[11] Oltvai ZN, Millimau CL, Karsmeyer SJ. Bcl-2 heterodi~merizes in vivo with a conserved homolog, Bax, that accelerates programmed cell death. Cell, 1993, 74: 609~174.
[12] Itoh G, Tamura J, Suzuki M et al. DNA fragmentation of human infarcted myocardial cell demonstrated by the nick end labeling method and DNA agrose gel electrophoresis. Am J Pathol, 1995, 146: 1325~1331.
[13] 左连富. 流式细胞术与生物医学. 沈阳: 辽宁科学技术出版社, 1996, 213~267.
, 百拇医药
[14] Darzynkiewicz Z, Bruno S, Del Bino G et al. Features of apoptotic cells measured by flow cytometry. Cytometry, 1992, 13: 795~808.
[15] Aiello A, Delia D, Borrello MG et al. Flow cytometric de~tec~tion of the mitochondrial BCL-2 protein in normal and neoplastic human lymphoid cells. Cytometry, 1992, 13: 502~509.
[16] Kajstura J, Cheng W, Reiss K et al. Apoptotic and necrotic myocyte cell deaths are independent contributing variables of infarct size in rats. Lab Invest, 1996, 74: 86~107.
, 百拇医药
[17] Tanak M, Ito H, Adachi S et al. Hypoxia induces apoptosis with enhanced expression of Fas antigen messenger RNA in cultured neonatal rat cardiomyocytes. Circ Res, 1994, 75: 426~431.
[18] Olivetti G, Quaini F, Sala R et al. Acute myocardial in~farction in humans is associated with activation of programmed myocyte cell death in the surviving portion of the heart. J Mol Cell Cardiol, 1994, 28: 2005~2016.
[19] Yue TL, Ma XL, Wang XK et al. Possible involvement of stress-activated protein kinase signaling pathway and Fas receptor expression by carvediol. Circ Res, 1998, 82: 166~174.
Received 1999-10-02 Revised 1999-11-27, 百拇医药