高压培养对猪离体主动脉内皮细胞功能的影响
作者:王云开 苏海 程晓曙
单位:江西医学院第二附属医院心内科 南昌 330006
关键词:高压培养;猪主动脉内皮细胞;增殖;一氧化氮;内皮素
高血压杂志000127 摘 要:目的:观察高压培养对猪离体主动脉血管内皮细胞(PAEC)增殖,分泌一氧化 氮(NO)、内皮素(ET)的影响。方法:胶原酶和胰蛋白酶消化猪主动脉内膜,制备3~6代血管内皮 细胞的单细胞悬液。分正常压力组,高压状态(24 kPa)组,每组八孔,0.5×104个细胞/ 孔。1.细胞生长试验:正常压力组, 高压力(24 kPa)组, 均放在37℃,5%CO2 孵箱中培养1,3,5天后进行细胞计数。2.PAEC分泌NO及ET含量,正常压力组、 高压力组均放在37℃,5%CO2孵箱中培养48小时后取培养液测定。结果:1.细胞生长试验: 高压组与正常压力组相比,第一天细胞数明显增加,呈促进增长作用, 第三、五天细胞数明 显减少,呈抑制生长作用。2.PAEC分泌NO及ET含量:高压组与正常压力组相比,分泌NO降低 ,ET升高。结论:高压培养PAEC早期促进增殖,稍后抑制其生长,使其分泌ET增加,NO降低。
, http://www.100md.com
分类号:R544.1;Q2-33;R446.1;N33 文献标识码:A
文章编号:1006-2866(2000)01-0081-04
The Effects of High Pressure Culture and Drug Intervention on
Functi ons of Porcine Aorta Endothelial Cells in vitro
WANG Yunkai SU Hai CHENG Xiaoshu
(Department of Cardiology, The first Affiliated Hospital, Jan Xi Medica l College, Nanchan 330006)
, 百拇医药
ABSTRACT:Objective: In this study,we investig ated the release of nitr ic oxide(NO) and endothelin(ET) from porcine aorta endothelial cells(PAEC) in vitro and its proliferation affected by high pressure.Methods:PAEC was isolated by collagenase and pancreatin digestion and was put into 0.5×104 cells per well. The experiment consisted of 2 groups: normal pressure and high pressure(24 kPa).Results:(1)High pressure stim ulates proliferation of PAEC in vitro in the first day, and inhibits in the third day and the fifth day, compared with the n ormal pressure control group(P<0.01);(2)High pressure culture incre ase ET and decrease NO production from PAEC in vitro in 48 hours, compared wi th the normal pressure control group(P<0.01).Conclusions:(1) Culture under high pressure stimulate P AEC proliferation at the beginning, and then inhibit its pro liferation;(2)Culture at high pressure decrease the secretion of NO and increase the secretion of ET in PAEC.
, http://www.100md.com
Key Words:high pressure; porcine aorta; endothelial c ells; proliferation; nitric oxide; endothelin▲
建立高压培养猪离体主动脉血管内皮细胞(Porcine aorta endothelial cells, PAEC)的实验模型,研究高压状态对血管内皮细胞增殖及分泌一氧化氮(Nitric Oxide,NO)、内皮素(Endothelin, ET)的影响,为临床上研究高压状态对血管内皮细胞功能的损害机理提供实验依据。
MATERIALS AND METHODS
1 实验材料与仪器:
动物为健康成年公猪。1640培养粉,胶原酶与胰蛋白酶(均为Sigma公司),CO2细胞培养箱,YJ-1300s医用超净工作台,SW-682型放射免疫γ计数器,自行设计的带压力表及加压气囊的高压锅(由江西压力锅厂产品改造)。
, http://www.100md.com
2 PAEC培养:
2.1PAEC的取材:参照文献方法[1~3],在无菌条件下分离并取出公猪主动脉血管;用胰蛋白酶和胶原酶消化血管内膜,用含20%小牛血清(cs)-1640终止消化,并收集PAEC。
2.2PAEC的原代、传代培养:将收集的PAEC悬液移入培养瓶,置5%CO2、37℃的培养箱内培养。细胞在接近长满时,然后每瓶中加入胰蛋白酶和EDTA混合液中消化后,加入适量新鲜培养液,将细胞悬液调整细胞密度为5.0×106.ml-1进行1:5传代,取3~6代的细胞用于实验。结果表明:高压培养PAEC早期促进增殖,稍后抑制其生长(见表1)。
表1正常压力、高压下及药物干预后对PAEC增殖的影响
(PAEC数(1×104), ±s,n=8)
±s,n=8)
, 百拇医药
1d
3d
5d
正压对照7
0.71±0.10
1.89±0.08
4.80±0.12
L-Arg(10μmol/L)
0.51±0.12
0.75±0.18
1.01±0.08
L-NAME(10-2μmol/L)
, 百拇医药
0.85±0.08
2.26±0.10
7.70±0.11
茶色素(10μg/ml)
0.68±0.14
1.35±0.05
2.76±0.16
茶色素(50μg/ml)
0.63±0.08
1.12±0.07
2.12±0.06
, 百拇医药 茶色素(100μg/ml)
0.58±0.10
1.01±0.06
1.86±0.07
高压组
1.25±0.03*
1.72±0.01
3.04±0.12*
L-Arg(10μmol/L)
1.01±0.13*
1.11±0.08*
, 百拇医药
1.22±0.02*
L-NAME(10-2μmol/L)
1.51±0.08*
2.43±0.12
5.37±0.16*
茶色素(10μg/ml)
1.21±0.02*
1.70±0.02
1.90±0.12*
茶色素(50μg/ml)
, 百拇医药
1.19±0.06*
1.58±0.10
1.71±0.10*
茶色素(100μg/ml)
1.12±0.10*
1.48±0.12
1.57±0.11
*:P<0.01 vs normal tension each corresponding group
2.3 PAEC分泌一氧化氮(NO)及内皮素(ET)含量:在正常压力、高压下培养二天后取培养液测定结果(见表2)。用细胞培养板,根据正常压力、高压状态下各分6组,每组8孔,每孔加细胞数为1.0×104/ml0.5ml,分别将正常压力组放在孵育箱中、高压组放在高压锅中(不加盖)再放进孵育箱中一起培养6小时后,弃20%小牛血清(cs)1640培养液,改无血清培养24小时后,依据实验目的加入不同药物及不同浓度干预。在正常压力下、高压状态下(24kPa),37℃,5%CO2的培养箱中培养48小时后收集各组份的条件培养液,待测NO,ET含量。
, 百拇医药
表2正常压力、高压下及药物干预后对PAEC分泌NO、ET的影响
(PAEC培养二天, ±s,n=8)
±s,n=8)
NO(μmol/L)
ET(Pg/ml)
正压对照
40.20±2.10
350.10±12.01
L-Arg(10μmol/L)
63.03±5.20
221.01±25.01
, http://www.100md.com
L-NAME(10-2μmol/L
27.07±3.20
408.02±10.02
茶色素(10μg/ml)
45.10±4.21
325.02±14.05
茶色素(50μg/ml)
48.10±4.07
298.12±13.20
茶色素(100μg/ml)
53.01±7.63
, 百拇医药
279.05±15.02
高压对照
36.03±4.08*
410.06±12.12*
L-Arg(10μmol/L)
57.12±5.06*
290.28±26.81*
L-NAME(10-2μmol/L)
20.01±5.01*
467.15±20.21*
, http://www.100md.com
茶色素(10μg/ml)
39.60±5.89*
385.01±16.5*
茶色素(50μg/ml)
43.05±4.61*
362.07±13.30*
茶色素(100μg/ml)
48.16±4.02*
348.03±16.51*
*:P<0.01 vs normal tension corresponding group
, 百拇医药
3 猪主动脉内皮细胞的形态学及条件培养液中NO,ET的测定方法:
3.1 猪主动脉内皮细胞的形态学观察:各实验组的PAEC的形态特征用倒置显微镜观察比较,观察到猪主动脉内皮细胞呈典型的鹅卵石状态。
3.2 一氧化氮(酶法)浓度的测定,一氧化氮试剂盒(酶法)购自南京建成生物工程研究所,利用NO化学性质活泼,在体内代谢很快转为NO2-、NO3-,NO2-进一步转化为NO3-,本法用硝酸还原酶特异性将NO3-还原为NO2-,通过显色深浅在550nm浓度0.5光径,测样品吸收值。(样品管吸光度-空白管吸光度)×100×样品稀释倍数=标准管吸光度-空白管吸光度公式算出待测样品的NO浓度。
3.3内皮素浓度的测定(ET):
, 百拇医药
内皮素放免试剂盒购自解放军总医院东亚免疫技术研究所。采用特异性RIA测定,试剂配制和操作步骤按说明书进行。ET抗体与心钠素、降钙素基因相关肽、血管紧张素Ⅰ、Ⅱ及舒血管肠肽均无交叉反应。批内变异系数CV<10%;批间变异系数CV<15%。
4数据统计:
所有的数据均以 ±s,均数之间差别检验以t检验分析,P<0.05有显著统计学意义。
±s,均数之间差别检验以t检验分析,P<0.05有显著统计学意义。
RESULTS
1 细胞生长试验:
用培养的细胞分为12组,每组8孔,分别加入三种不同浓度的茶色素,L-Arg,L-N-nitro-arginine-metyhlester(L-NAME),在正常压力、高压下培养1天、3天、5天分别作细胞计数(见表1及图1)。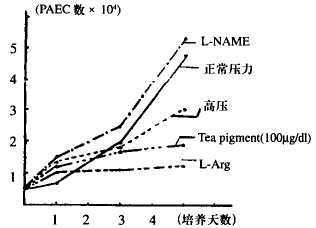
, http://www.100md.com
图1正常压力,高压力下及药物干预后PAEC生长曲线
2 PAEC分泌一氧化氮(NO)及内皮素(ET)含量:用培养的细胞分为12组,每组8孔。分别加入三种不同浓度的茶色素及L-Arg,L-NAME在正常压力、高压下培养二天后取培养液测定一氧化氮(NO)及内皮素(ET)含量,结果见表2及图2,3。
图2 正常压力、高压力及药物干预后NO分泌情况ET浓度(Pg/ml)
图3 正常压力、高压力下及药物干预ET分泌情况比较
DISCUSSION
血管内皮功能障碍(endothelial dysfunction)是血管内皮细胞对非适应性功能状态所作的有限调整,通常是内皮细胞功能特性的改变或功能的部分缺失[4,5]。内皮细胞(EC)不仅是全身血管内膜的屏障结构,而且是一个重要的内分泌器官,具有多方面的生理功能,主要为调节血管张力,维持凝血和纤溶系统之间的平衡,调节炎症细胞聚集于血管壁内,抑制血小板的聚集和活性等[6~8]。内皮功能障碍是动脉粥样硬化、高血压、高脂血症等常见病的始发事件[5,9]。深入研究血管内皮细胞及高压培养对其功能及机理的研究,将为揭示心血管疾病的发病机理及防治提供理论依据。
, 百拇医药
1 高压培养对血管内皮细胞生长的影响及可能机理
高压培养,是压力这种损害因素对血管内皮细胞的影响作用。实际上,各种理化因素均可能损伤血管内皮细胞。
Ross[10]的损伤应答学说认为,血管内皮细胞的机能失调是动脉粥样硬化病变发生的首发环节,从而引起的细胞间相互作用和影响可导致动脉粥状硬化病变的形成。早期病变处内皮细胞可保持其形态的完整性,但可出现正常生理机能的种种失调,包括产生和分泌生长调节因子的失调。在体内,内皮细胞的增殖率(更新率)是非常缓慢的,可能在血流动力学压力高处如血管的分支处要高些,当然在损伤情况下,内皮细胞可以增殖[3]。体外培养发现,内皮细胞能分泌血小板源性生长因子(PDGF)、碱性成纤维母细胞生长因子(bFGF)、内皮细胞生长因子(ECGF)、肝素结合生长因子(HBGF)和内皮素(ET)等促有丝分裂原,并且一些刺激因素包括机械损伤等可使其分泌增加。
, http://www.100md.com
本研究结果发现高压培养组的离体PAEC同正常压力组培养的PAEC相比,早期(第1、2天)细胞增长迅速,后期(第3、4、5天)呈抑制趋势。这种现象表明,内皮细胞在遭到损伤因素作用下,内皮细胞可能分泌内皮细胞因子旺盛,刺激内皮细胞增殖,起着代偿作用。根据细胞骨架在大创伤和单个细胞创伤模型的研究[3],可假设一个EC开始内皮重建是一个两部分的过程,当有必要时紧接的是细胞的增殖。起初EC试图通过快速侵入薄层脂后,并扩散来修复受伤的区域,这需要未受损的微丝系统来执行,包括“致密外周束”(DPB)在内。如果修复完成,便无其它情况出现。如果修复未完成的话,接着会发生为细胞移动,即EC伸长和中心体在细胞前部的再分布,随后发生DPB破坏的方向迁移。小的创伤就是按这种方式重建内皮的。然而细胞增殖作用是相当重要,它是迁移开始后发生的。很少创伤不需要细胞增殖就能修复,而大的创伤则需要靠细胞增殖作为提供细胞以重新建立单层的手段来进行修复。当修复完毕后,或内皮细胞长满了单层形成了稳定骨架,细胞生长适应了高压环境,进而使细胞生长呈抑制状态。
, 百拇医药
2 高压培养对血管内皮细胞分泌一氧化氮(NO)、内皮素(ET)的影响及机理探讨
正常情况下,血管内皮细胞可释放多种生物活性物质,如前列环素(PGI2),内皮衍生性松弛因子(EDRF)及ET等在调节血管壁张力,维持血液在血管内的流动性等方面起着重要作用,一旦血管内皮细胞受到一些损伤因素如高压、缺氧、药物等损害,很多内源性物质如凝血酶、ADP、ATP和5-HT等的舒血管作用转变缩血管效应[11,12]。使ET/NO协调状态受到影响。1987年,Palmar等[13],用生物化学分析法认为内皮衍生性松弛因子就是NO。NO合成与释放的生理调节机制仍不清楚。
本研究表明,高压培养组的离体PAEC较正常压力组培养的PAEC释放NO减少,可能的机制是通过损伤血管内皮细胞使L-Arg转运系统障碍,内皮细胞膜损伤时可能出现L-Arg转运功能障碍,和或者NO合成酶活性抑制时,则使内皮细胞NO合成释放减少,也可能还有其它机制,尚需进一步研究和探讨。
, 百拇医药
本研究表明,高压培养组的离体PAEC较正常压力组培养的PAEC分泌ET增加。其可能机制为血管内皮细胞在损害因素作用下,致使细胞通透性增加,激活细胞内信息传递途径,产生一系列生化反应,最终导致收缩装置的收缩[14]。可刺激磷酯酶C(PLC)及磷酯酶A2(PLA2),同时还可刺激电压依赖型钙通道(VDC)及受体调控型钙通道(ROC)。由二磷酸磷酰肌醇(PIP2)形成三磷酸肌醇(IP3),使钙离子从钙贮备部位释放,二酰甘油(DG)激活蛋白酶C(PKC)后使细胞内游离钙离子浓度增高,产生和分泌ET增加。使得细胞内钙离子浓度增加;促进原癌基因C-fos和C-myc表达,并使得细胞内碱化。此外,ET还可促进其它生长因子如PDGF等产生和释放 增多,协同促进血管型平滑肌细胞(VSMC)增生,加速内皮损伤后内膜病变的发展[15,16]。
3 L-NAME、L-Arg、茶色素对高压培养血管内皮细胞功能的影响及可能的机制N-硝基-L-精氨酸甲基酯(N-nitro-arginine methylester,L-NAME)是一种新的NO生成的抑制剂。研究证实,L-NAME可以抑制大鼠主动脉环内皮依赖性血管扩张,并可增加大鼠体循环平均压[17]。Persson等[18]研究发现,L-NAME可明显增加麻醉兔急性缺氧时的肺动脉平均压及肺血管阻力,其作用可为L-Arg所逆转。L-NAME水溶性,长期给大鼠口服则导致持续性全身血压升高,L-Arg不能逆转L-NAME抑制NOS的作用[19]。曹氏[20]应用L-NAME一小时后,股动脉血浆ET1水平明显升高,并持续至用药后3小时;并同时进行体外实验也发现,L-NAME10-11及10-7mol/L均能显著增加人脐静脉EC分泌ET。在细胞水平进一步证实,NO合成抑制可增加ET1的分泌,也说明NO具有抑制ET1分泌的作用。近来,Farly等亦发现内皮源性舒张因子的抑制剂L-NAME可减弱转换酶抑制剂对血管平滑肌细胞增殖的抑制作用。提示内皮源性舒张因子可能对血管新生内膜的形成有抑制作用。
, 百拇医药
实验结果显示,L-NAME对高压培养离体PAEC受损及增殖具有促进作用,还发现促使PAEC分泌ET增高,抑制NO分泌。可能是由于L-NAME作用于血管内皮细胞激活细胞内Ca2+、钙调素,抑制内皮源性舒张因子,也就是NO的分泌,激活内皮源性收缩因子,尤其是ET的分泌。L-Arg是体内NO合成的前体,由细胞内NOS催化生成NO,体内许多器官组织都有NO合成系统。NO是嗜脂性物质,极易通过细胞膜进入靶细胞,使细胞内的环磷酸鸟苷(cGMP)水平增高而介导血管扩张。有报道长期给予L-Arg可减轻家兔动脉粥样硬化(AS)的程度[21],提示补充L-Arg可能有利于AS的防治。L-Arg输入高胆固醇血症患者和兔的冠状动脉后,可逆转NO释放的减少[22],也可减轻猪心肌缺血再灌注损伤。Candipan等[23]的动物实验也表明,给具内膜损伤的动物口服L-Arg能增强血管NO的生成和减少超氧阴离子的形成,并且,口服L-Arg和损伤表面积减少呈相关性,因而说明NO活性的恢复能导致内膜损伤的消退,所以用L-Arg治疗具有潜在的临床意义。本研究发现,L-Arg对高压培养离体PAEC是抑制其增殖,使其功能或形态免受损害,对其起保护作用,分泌ET较正常压力对照组降低,分泌NO较之增多,其结果同L-NAME相反。其可能机制是合成NO的底物L-Arg增多,使Ca2+钙调素依赖的NO合成酶激活,L-ArgN端胍基脱氨氧化生成NO和L-瓜氨酸增多,并在自体活性物、P物质、组胺、凝血酶等可启动,激活NO进一步的释放。
, http://www.100md.com
本研究发现,茶色素对高压培养离体PAEC具有抑制其增殖,保护其免受损害的作用,并呈剂量依赖性关系。抑制血管内皮细胞分泌ET、促进血管内皮细胞分泌NO。细胞损伤的主要原因之一,可能是脂质过氧化过程中生成的氧自由基,对生物膜磷脂中多不饱和脂肪酸细胞中的酶和其它成分造成破坏。茶色素中的茶多酚是一种十分有效的抗氧化剂,其清除活性自由基的有效率达92%~98%[24]。茶色素可能通过其清除自由基的作用而导致LPO含量降低,保护血管内皮细胞免遭损伤,使Ca2+钙调素依赖的NO合成酶激活,也可能还有象L-Arg一样的其它机制存在,升高NO,降低ET,值得进一步探讨。茶色素的作用将有利于临床上高血压病对靶器官损害的早期逆转,延缓高血压病的进展,其抑制内膜细胞增生,从而利于减轻血管的病理性狭窄,改善心肌缺血,有益于冠心病的防治。总之,茶色素在临床上应用于心血管疾病有一定的治疗价值,值得进一步研究。
(致谢:研究工作承蒙导师苏海、程晓曙教授在选题、科研设计、实验、论文修改等方面给予严谨指导。省妇幼保健院黄学明医师和二附院习为民主任在实验方面的大力协助与支持。谨此一并表示崇高敬意和衷心的感谢)■
, 百拇医药
*:现在江西医学院第一附属医院心内科
REFERENCES:
[1]尹小川,刘建康,周序珑,等. 三七总皂甙对培养的猪主动脉内皮细胞释放一氧化氮的影响[ J] China J Arteriosclero 1996;4(1):21-23
[2]鄂征主编. 组织培养技术[M] 第二版.北京:人民卫生出版社
[3]盛民立主编. 血管内皮细胞与疾病[M] 第一版.上海:上海医科大学出版社, 1993,37-38,63-165.5
[4]Gimbrone MA. Vascular endothelium:an integrator of pathphysiologic stimuli i n atherosclerosis[J] Am J Cardiol 1995;75:67B-70B
, http://www.100md.com
[5]Henning B, Alvarado A. Nutrition and endothelial cell integrity:implicatio ns in atherosclerosis[J] Prog Food Nutr Sci 1993;17(2):119-157
[6]Levine GN, Keaney JF,Vita JA. Cholesterol reduction in cardiovascular diseas e[J] N Engl J med 1995, 332(8):512-521
[7]Flavahan NA. Atherosclerosis or lipoproptein-induced endothelial dys function[J] Circulation 1992;85(5):1 927-938
[8]Ware JA, Heistad DD. Platelet-endotheliu m interactions[J] N Engl J Med 1993, 328(9):628-635
, 百拇医药
[9]Anderison JJ,Gerhard MD,Meredith IT, et al. Systemic nature of endothelial dy sfunction in atherosclerosis[J] Am J Cardiol 1995;75:71B-74B
[10]Ross R. The pathogenesis of atherosclerosis:a perspective for 1990s[J] Nature 1993;362(29): 801-809
[11]Lin PJ,Pearson PJ,Cartier R, Schaff HV. Superoxide anion mediates the endot helium dependent contractions to serotonin by regenerated endothelium[J] J Thorac Cardiovasc Surg 1991;102(3):378-385
, 百拇医药
[12]Steinbrecher UP,Zhang HF,lougheed M. Role of oxidatively modified LDL in at herosclerosis[J] Free Radic Biol Med 1990;9(2):155-168
[13]Palmer RMJ,Terrige AG,Moncada S. Nitric oxide release accounts for the b iological activity of endothelium-derived relaxing factor[J] Nature 1987;327:524-526.
[14]Tamirisa P,Frishman WH,Kumar AT.Endothelin and endothelin antagonism:Ro les in cardiovascular health and disease[J] Am heart J 1995;130(3,pt I) :601-610
, 百拇医药
[15]Battistini B,Chailler P. D'orleans P,et al . Growth regulatory properties o f endothelins[J] Peptides 1993:14:385
[16]Hahn AWA,Resink TJ,Scott-Burden J,et al. Stimulation of endothlin mRNA and secretion in rat smooth muscle cells:a novel autocrine function[J] Cells Re gulation 1990;1:649
[17]Rees DD, Palmer RMJ, Schulz R, et al. Characterization of three inhibito rs of endothelial nitric oxide synthase in vitro and in vivo[J] Br J Pharmacol 1990;101:746
, 百拇医药
[18]Liu S,Crawley DE, Barnes PJ, et al. Endothelium-derived relaxing facto r inhibits hypoxic vasoconstriction in rats[J] Am Rev Respir Dis 1991;1 43:32
[19]Boger RH, Boda-Boger SM, Gerecke U, et al. Long term administration of L-argin ine, L-NAME and the exogenous NO doner molsidomine modulates urinary ni trate and cGMP excretion in rats[J] Cardivovasc Res 1994;28:494
[20]曹伟标等. NO合成抑制剂对犬体外ET分泌的影响[J] 中华医学杂志 19 95;75:164
, 百拇医药
[21]Cooke JP, et al. Antiatherogenic affects of Larginine in the hyperchole sterolemic rabbit[J] J Clin Invest 1992;90:1168
[22]Warren JB, Pons F, Brady AJB. Nitric oxide biology: Implications for cardiovascular therapeuties[J] Cardiovasc Res 1994;28:25-30
[23]Candipan RC, Wang BY,Buitrago R, et al. Regression or progression, depe ndency on vascular nitric oxide[J] Arterioscler Thromb Vasc Biol 1996; 16:44-50
[24]杨贤强,等.茶多酚生物学活性的研究[J]茶叶科学 1993;13:51
收稿日期:1999-03-09 , 百拇医药
单位:江西医学院第二附属医院心内科 南昌 330006
关键词:高压培养;猪主动脉内皮细胞;增殖;一氧化氮;内皮素
高血压杂志000127 摘 要:目的:观察高压培养对猪离体主动脉血管内皮细胞(PAEC)增殖,分泌一氧化 氮(NO)、内皮素(ET)的影响。方法:胶原酶和胰蛋白酶消化猪主动脉内膜,制备3~6代血管内皮 细胞的单细胞悬液。分正常压力组,高压状态(24 kPa)组,每组八孔,0.5×104个细胞/ 孔。1.细胞生长试验:正常压力组, 高压力(24 kPa)组, 均放在37℃,5%CO2 孵箱中培养1,3,5天后进行细胞计数。2.PAEC分泌NO及ET含量,正常压力组、 高压力组均放在37℃,5%CO2孵箱中培养48小时后取培养液测定。结果:1.细胞生长试验: 高压组与正常压力组相比,第一天细胞数明显增加,呈促进增长作用, 第三、五天细胞数明 显减少,呈抑制生长作用。2.PAEC分泌NO及ET含量:高压组与正常压力组相比,分泌NO降低 ,ET升高。结论:高压培养PAEC早期促进增殖,稍后抑制其生长,使其分泌ET增加,NO降低。
, http://www.100md.com
分类号:R544.1;Q2-33;R446.1;N33 文献标识码:A
文章编号:1006-2866(2000)01-0081-04
The Effects of High Pressure Culture and Drug Intervention on
Functi ons of Porcine Aorta Endothelial Cells in vitro
WANG Yunkai SU Hai CHENG Xiaoshu
(Department of Cardiology, The first Affiliated Hospital, Jan Xi Medica l College, Nanchan 330006)
, 百拇医药
ABSTRACT:Objective: In this study,we investig ated the release of nitr ic oxide(NO) and endothelin(ET) from porcine aorta endothelial cells(PAEC) in vitro and its proliferation affected by high pressure.Methods:PAEC was isolated by collagenase and pancreatin digestion and was put into 0.5×104 cells per well. The experiment consisted of 2 groups: normal pressure and high pressure(24 kPa).Results:(1)High pressure stim ulates proliferation of PAEC in vitro in the first day, and inhibits in the third day and the fifth day, compared with the n ormal pressure control group(P<0.01);(2)High pressure culture incre ase ET and decrease NO production from PAEC in vitro in 48 hours, compared wi th the normal pressure control group(P<0.01).Conclusions:(1) Culture under high pressure stimulate P AEC proliferation at the beginning, and then inhibit its pro liferation;(2)Culture at high pressure decrease the secretion of NO and increase the secretion of ET in PAEC.
, http://www.100md.com
Key Words:high pressure; porcine aorta; endothelial c ells; proliferation; nitric oxide; endothelin▲
建立高压培养猪离体主动脉血管内皮细胞(Porcine aorta endothelial cells, PAEC)的实验模型,研究高压状态对血管内皮细胞增殖及分泌一氧化氮(Nitric Oxide,NO)、内皮素(Endothelin, ET)的影响,为临床上研究高压状态对血管内皮细胞功能的损害机理提供实验依据。
MATERIALS AND METHODS
1 实验材料与仪器:
动物为健康成年公猪。1640培养粉,胶原酶与胰蛋白酶(均为Sigma公司),CO2细胞培养箱,YJ-1300s医用超净工作台,SW-682型放射免疫γ计数器,自行设计的带压力表及加压气囊的高压锅(由江西压力锅厂产品改造)。
, http://www.100md.com
2 PAEC培养:
2.1PAEC的取材:参照文献方法[1~3],在无菌条件下分离并取出公猪主动脉血管;用胰蛋白酶和胶原酶消化血管内膜,用含20%小牛血清(cs)-1640终止消化,并收集PAEC。
2.2PAEC的原代、传代培养:将收集的PAEC悬液移入培养瓶,置5%CO2、37℃的培养箱内培养。细胞在接近长满时,然后每瓶中加入胰蛋白酶和EDTA混合液中消化后,加入适量新鲜培养液,将细胞悬液调整细胞密度为5.0×106.ml-1进行1:5传代,取3~6代的细胞用于实验。结果表明:高压培养PAEC早期促进增殖,稍后抑制其生长(见表1)。
表1正常压力、高压下及药物干预后对PAEC增殖的影响
(PAEC数(1×104),
 ±s,n=8)
±s,n=8), 百拇医药
1d
3d
5d
正压对照7
0.71±0.10
1.89±0.08
4.80±0.12
L-Arg(10μmol/L)
0.51±0.12
0.75±0.18
1.01±0.08
L-NAME(10-2μmol/L)
, 百拇医药
0.85±0.08
2.26±0.10
7.70±0.11
茶色素(10μg/ml)
0.68±0.14
1.35±0.05
2.76±0.16
茶色素(50μg/ml)
0.63±0.08
1.12±0.07
2.12±0.06
, 百拇医药 茶色素(100μg/ml)
0.58±0.10
1.01±0.06
1.86±0.07
高压组
1.25±0.03*
1.72±0.01
3.04±0.12*
L-Arg(10μmol/L)
1.01±0.13*
1.11±0.08*
, 百拇医药
1.22±0.02*
L-NAME(10-2μmol/L)
1.51±0.08*
2.43±0.12
5.37±0.16*
茶色素(10μg/ml)
1.21±0.02*
1.70±0.02
1.90±0.12*
茶色素(50μg/ml)
, 百拇医药
1.19±0.06*
1.58±0.10
1.71±0.10*
茶色素(100μg/ml)
1.12±0.10*
1.48±0.12
1.57±0.11
*:P<0.01 vs normal tension each corresponding group
2.3 PAEC分泌一氧化氮(NO)及内皮素(ET)含量:在正常压力、高压下培养二天后取培养液测定结果(见表2)。用细胞培养板,根据正常压力、高压状态下各分6组,每组8孔,每孔加细胞数为1.0×104/ml0.5ml,分别将正常压力组放在孵育箱中、高压组放在高压锅中(不加盖)再放进孵育箱中一起培养6小时后,弃20%小牛血清(cs)1640培养液,改无血清培养24小时后,依据实验目的加入不同药物及不同浓度干预。在正常压力下、高压状态下(24kPa),37℃,5%CO2的培养箱中培养48小时后收集各组份的条件培养液,待测NO,ET含量。
, 百拇医药
表2正常压力、高压下及药物干预后对PAEC分泌NO、ET的影响
(PAEC培养二天,
 ±s,n=8)
±s,n=8)NO(μmol/L)
ET(Pg/ml)
正压对照
40.20±2.10
350.10±12.01
L-Arg(10μmol/L)
63.03±5.20
221.01±25.01
, http://www.100md.com
L-NAME(10-2μmol/L
27.07±3.20
408.02±10.02
茶色素(10μg/ml)
45.10±4.21
325.02±14.05
茶色素(50μg/ml)
48.10±4.07
298.12±13.20
茶色素(100μg/ml)
53.01±7.63
, 百拇医药
279.05±15.02
高压对照
36.03±4.08*
410.06±12.12*
L-Arg(10μmol/L)
57.12±5.06*
290.28±26.81*
L-NAME(10-2μmol/L)
20.01±5.01*
467.15±20.21*
, http://www.100md.com
茶色素(10μg/ml)
39.60±5.89*
385.01±16.5*
茶色素(50μg/ml)
43.05±4.61*
362.07±13.30*
茶色素(100μg/ml)
48.16±4.02*
348.03±16.51*
*:P<0.01 vs normal tension corresponding group
, 百拇医药
3 猪主动脉内皮细胞的形态学及条件培养液中NO,ET的测定方法:
3.1 猪主动脉内皮细胞的形态学观察:各实验组的PAEC的形态特征用倒置显微镜观察比较,观察到猪主动脉内皮细胞呈典型的鹅卵石状态。
3.2 一氧化氮(酶法)浓度的测定,一氧化氮试剂盒(酶法)购自南京建成生物工程研究所,利用NO化学性质活泼,在体内代谢很快转为NO2-、NO3-,NO2-进一步转化为NO3-,本法用硝酸还原酶特异性将NO3-还原为NO2-,通过显色深浅在550nm浓度0.5光径,测样品吸收值。(样品管吸光度-空白管吸光度)×100×样品稀释倍数=标准管吸光度-空白管吸光度公式算出待测样品的NO浓度。
3.3内皮素浓度的测定(ET):
, 百拇医药
内皮素放免试剂盒购自解放军总医院东亚免疫技术研究所。采用特异性RIA测定,试剂配制和操作步骤按说明书进行。ET抗体与心钠素、降钙素基因相关肽、血管紧张素Ⅰ、Ⅱ及舒血管肠肽均无交叉反应。批内变异系数CV<10%;批间变异系数CV<15%。
4数据统计:
所有的数据均以
 ±s,均数之间差别检验以t检验分析,P<0.05有显著统计学意义。
±s,均数之间差别检验以t检验分析,P<0.05有显著统计学意义。RESULTS
1 细胞生长试验:
用培养的细胞分为12组,每组8孔,分别加入三种不同浓度的茶色素,L-Arg,L-N-nitro-arginine-metyhlester(L-NAME),在正常压力、高压下培养1天、3天、5天分别作细胞计数(见表1及图1)。

, http://www.100md.com
图1正常压力,高压力下及药物干预后PAEC生长曲线
2 PAEC分泌一氧化氮(NO)及内皮素(ET)含量:用培养的细胞分为12组,每组8孔。分别加入三种不同浓度的茶色素及L-Arg,L-NAME在正常压力、高压下培养二天后取培养液测定一氧化氮(NO)及内皮素(ET)含量,结果见表2及图2,3。

图2 正常压力、高压力及药物干预后NO分泌情况ET浓度(Pg/ml)

图3 正常压力、高压力下及药物干预ET分泌情况比较
DISCUSSION
血管内皮功能障碍(endothelial dysfunction)是血管内皮细胞对非适应性功能状态所作的有限调整,通常是内皮细胞功能特性的改变或功能的部分缺失[4,5]。内皮细胞(EC)不仅是全身血管内膜的屏障结构,而且是一个重要的内分泌器官,具有多方面的生理功能,主要为调节血管张力,维持凝血和纤溶系统之间的平衡,调节炎症细胞聚集于血管壁内,抑制血小板的聚集和活性等[6~8]。内皮功能障碍是动脉粥样硬化、高血压、高脂血症等常见病的始发事件[5,9]。深入研究血管内皮细胞及高压培养对其功能及机理的研究,将为揭示心血管疾病的发病机理及防治提供理论依据。
, 百拇医药
1 高压培养对血管内皮细胞生长的影响及可能机理
高压培养,是压力这种损害因素对血管内皮细胞的影响作用。实际上,各种理化因素均可能损伤血管内皮细胞。
Ross[10]的损伤应答学说认为,血管内皮细胞的机能失调是动脉粥样硬化病变发生的首发环节,从而引起的细胞间相互作用和影响可导致动脉粥状硬化病变的形成。早期病变处内皮细胞可保持其形态的完整性,但可出现正常生理机能的种种失调,包括产生和分泌生长调节因子的失调。在体内,内皮细胞的增殖率(更新率)是非常缓慢的,可能在血流动力学压力高处如血管的分支处要高些,当然在损伤情况下,内皮细胞可以增殖[3]。体外培养发现,内皮细胞能分泌血小板源性生长因子(PDGF)、碱性成纤维母细胞生长因子(bFGF)、内皮细胞生长因子(ECGF)、肝素结合生长因子(HBGF)和内皮素(ET)等促有丝分裂原,并且一些刺激因素包括机械损伤等可使其分泌增加。
, http://www.100md.com
本研究结果发现高压培养组的离体PAEC同正常压力组培养的PAEC相比,早期(第1、2天)细胞增长迅速,后期(第3、4、5天)呈抑制趋势。这种现象表明,内皮细胞在遭到损伤因素作用下,内皮细胞可能分泌内皮细胞因子旺盛,刺激内皮细胞增殖,起着代偿作用。根据细胞骨架在大创伤和单个细胞创伤模型的研究[3],可假设一个EC开始内皮重建是一个两部分的过程,当有必要时紧接的是细胞的增殖。起初EC试图通过快速侵入薄层脂后,并扩散来修复受伤的区域,这需要未受损的微丝系统来执行,包括“致密外周束”(DPB)在内。如果修复完成,便无其它情况出现。如果修复未完成的话,接着会发生为细胞移动,即EC伸长和中心体在细胞前部的再分布,随后发生DPB破坏的方向迁移。小的创伤就是按这种方式重建内皮的。然而细胞增殖作用是相当重要,它是迁移开始后发生的。很少创伤不需要细胞增殖就能修复,而大的创伤则需要靠细胞增殖作为提供细胞以重新建立单层的手段来进行修复。当修复完毕后,或内皮细胞长满了单层形成了稳定骨架,细胞生长适应了高压环境,进而使细胞生长呈抑制状态。
, 百拇医药
2 高压培养对血管内皮细胞分泌一氧化氮(NO)、内皮素(ET)的影响及机理探讨
正常情况下,血管内皮细胞可释放多种生物活性物质,如前列环素(PGI2),内皮衍生性松弛因子(EDRF)及ET等在调节血管壁张力,维持血液在血管内的流动性等方面起着重要作用,一旦血管内皮细胞受到一些损伤因素如高压、缺氧、药物等损害,很多内源性物质如凝血酶、ADP、ATP和5-HT等的舒血管作用转变缩血管效应[11,12]。使ET/NO协调状态受到影响。1987年,Palmar等[13],用生物化学分析法认为内皮衍生性松弛因子就是NO。NO合成与释放的生理调节机制仍不清楚。
本研究表明,高压培养组的离体PAEC较正常压力组培养的PAEC释放NO减少,可能的机制是通过损伤血管内皮细胞使L-Arg转运系统障碍,内皮细胞膜损伤时可能出现L-Arg转运功能障碍,和或者NO合成酶活性抑制时,则使内皮细胞NO合成释放减少,也可能还有其它机制,尚需进一步研究和探讨。
, 百拇医药
本研究表明,高压培养组的离体PAEC较正常压力组培养的PAEC分泌ET增加。其可能机制为血管内皮细胞在损害因素作用下,致使细胞通透性增加,激活细胞内信息传递途径,产生一系列生化反应,最终导致收缩装置的收缩[14]。可刺激磷酯酶C(PLC)及磷酯酶A2(PLA2),同时还可刺激电压依赖型钙通道(VDC)及受体调控型钙通道(ROC)。由二磷酸磷酰肌醇(PIP2)形成三磷酸肌醇(IP3),使钙离子从钙贮备部位释放,二酰甘油(DG)激活蛋白酶C(PKC)后使细胞内游离钙离子浓度增高,产生和分泌ET增加。使得细胞内钙离子浓度增加;促进原癌基因C-fos和C-myc表达,并使得细胞内碱化。此外,ET还可促进其它生长因子如PDGF等产生和释放 增多,协同促进血管型平滑肌细胞(VSMC)增生,加速内皮损伤后内膜病变的发展[15,16]。
3 L-NAME、L-Arg、茶色素对高压培养血管内皮细胞功能的影响及可能的机制N-硝基-L-精氨酸甲基酯(N-nitro-arginine methylester,L-NAME)是一种新的NO生成的抑制剂。研究证实,L-NAME可以抑制大鼠主动脉环内皮依赖性血管扩张,并可增加大鼠体循环平均压[17]。Persson等[18]研究发现,L-NAME可明显增加麻醉兔急性缺氧时的肺动脉平均压及肺血管阻力,其作用可为L-Arg所逆转。L-NAME水溶性,长期给大鼠口服则导致持续性全身血压升高,L-Arg不能逆转L-NAME抑制NOS的作用[19]。曹氏[20]应用L-NAME一小时后,股动脉血浆ET1水平明显升高,并持续至用药后3小时;并同时进行体外实验也发现,L-NAME10-11及10-7mol/L均能显著增加人脐静脉EC分泌ET。在细胞水平进一步证实,NO合成抑制可增加ET1的分泌,也说明NO具有抑制ET1分泌的作用。近来,Farly等亦发现内皮源性舒张因子的抑制剂L-NAME可减弱转换酶抑制剂对血管平滑肌细胞增殖的抑制作用。提示内皮源性舒张因子可能对血管新生内膜的形成有抑制作用。
, 百拇医药
实验结果显示,L-NAME对高压培养离体PAEC受损及增殖具有促进作用,还发现促使PAEC分泌ET增高,抑制NO分泌。可能是由于L-NAME作用于血管内皮细胞激活细胞内Ca2+、钙调素,抑制内皮源性舒张因子,也就是NO的分泌,激活内皮源性收缩因子,尤其是ET的分泌。L-Arg是体内NO合成的前体,由细胞内NOS催化生成NO,体内许多器官组织都有NO合成系统。NO是嗜脂性物质,极易通过细胞膜进入靶细胞,使细胞内的环磷酸鸟苷(cGMP)水平增高而介导血管扩张。有报道长期给予L-Arg可减轻家兔动脉粥样硬化(AS)的程度[21],提示补充L-Arg可能有利于AS的防治。L-Arg输入高胆固醇血症患者和兔的冠状动脉后,可逆转NO释放的减少[22],也可减轻猪心肌缺血再灌注损伤。Candipan等[23]的动物实验也表明,给具内膜损伤的动物口服L-Arg能增强血管NO的生成和减少超氧阴离子的形成,并且,口服L-Arg和损伤表面积减少呈相关性,因而说明NO活性的恢复能导致内膜损伤的消退,所以用L-Arg治疗具有潜在的临床意义。本研究发现,L-Arg对高压培养离体PAEC是抑制其增殖,使其功能或形态免受损害,对其起保护作用,分泌ET较正常压力对照组降低,分泌NO较之增多,其结果同L-NAME相反。其可能机制是合成NO的底物L-Arg增多,使Ca2+钙调素依赖的NO合成酶激活,L-ArgN端胍基脱氨氧化生成NO和L-瓜氨酸增多,并在自体活性物、P物质、组胺、凝血酶等可启动,激活NO进一步的释放。
, http://www.100md.com
本研究发现,茶色素对高压培养离体PAEC具有抑制其增殖,保护其免受损害的作用,并呈剂量依赖性关系。抑制血管内皮细胞分泌ET、促进血管内皮细胞分泌NO。细胞损伤的主要原因之一,可能是脂质过氧化过程中生成的氧自由基,对生物膜磷脂中多不饱和脂肪酸细胞中的酶和其它成分造成破坏。茶色素中的茶多酚是一种十分有效的抗氧化剂,其清除活性自由基的有效率达92%~98%[24]。茶色素可能通过其清除自由基的作用而导致LPO含量降低,保护血管内皮细胞免遭损伤,使Ca2+钙调素依赖的NO合成酶激活,也可能还有象L-Arg一样的其它机制存在,升高NO,降低ET,值得进一步探讨。茶色素的作用将有利于临床上高血压病对靶器官损害的早期逆转,延缓高血压病的进展,其抑制内膜细胞增生,从而利于减轻血管的病理性狭窄,改善心肌缺血,有益于冠心病的防治。总之,茶色素在临床上应用于心血管疾病有一定的治疗价值,值得进一步研究。
(致谢:研究工作承蒙导师苏海、程晓曙教授在选题、科研设计、实验、论文修改等方面给予严谨指导。省妇幼保健院黄学明医师和二附院习为民主任在实验方面的大力协助与支持。谨此一并表示崇高敬意和衷心的感谢)■
, 百拇医药
*:现在江西医学院第一附属医院心内科
REFERENCES:
[1]尹小川,刘建康,周序珑,等. 三七总皂甙对培养的猪主动脉内皮细胞释放一氧化氮的影响[ J] China J Arteriosclero 1996;4(1):21-23
[2]鄂征主编. 组织培养技术[M] 第二版.北京:人民卫生出版社
[3]盛民立主编. 血管内皮细胞与疾病[M] 第一版.上海:上海医科大学出版社, 1993,37-38,63-165.5
[4]Gimbrone MA. Vascular endothelium:an integrator of pathphysiologic stimuli i n atherosclerosis[J] Am J Cardiol 1995;75:67B-70B
, http://www.100md.com
[5]Henning B, Alvarado A. Nutrition and endothelial cell integrity:implicatio ns in atherosclerosis[J] Prog Food Nutr Sci 1993;17(2):119-157
[6]Levine GN, Keaney JF,Vita JA. Cholesterol reduction in cardiovascular diseas e[J] N Engl J med 1995, 332(8):512-521
[7]Flavahan NA. Atherosclerosis or lipoproptein-induced endothelial dys function[J] Circulation 1992;85(5):1 927-938
[8]Ware JA, Heistad DD. Platelet-endotheliu m interactions[J] N Engl J Med 1993, 328(9):628-635
, 百拇医药
[9]Anderison JJ,Gerhard MD,Meredith IT, et al. Systemic nature of endothelial dy sfunction in atherosclerosis[J] Am J Cardiol 1995;75:71B-74B
[10]Ross R. The pathogenesis of atherosclerosis:a perspective for 1990s[J] Nature 1993;362(29): 801-809
[11]Lin PJ,Pearson PJ,Cartier R, Schaff HV. Superoxide anion mediates the endot helium dependent contractions to serotonin by regenerated endothelium[J] J Thorac Cardiovasc Surg 1991;102(3):378-385
, 百拇医药
[12]Steinbrecher UP,Zhang HF,lougheed M. Role of oxidatively modified LDL in at herosclerosis[J] Free Radic Biol Med 1990;9(2):155-168
[13]Palmer RMJ,Terrige AG,Moncada S. Nitric oxide release accounts for the b iological activity of endothelium-derived relaxing factor[J] Nature 1987;327:524-526.
[14]Tamirisa P,Frishman WH,Kumar AT.Endothelin and endothelin antagonism:Ro les in cardiovascular health and disease[J] Am heart J 1995;130(3,pt I) :601-610
, 百拇医药
[15]Battistini B,Chailler P. D'orleans P,et al . Growth regulatory properties o f endothelins[J] Peptides 1993:14:385
[16]Hahn AWA,Resink TJ,Scott-Burden J,et al. Stimulation of endothlin mRNA and secretion in rat smooth muscle cells:a novel autocrine function[J] Cells Re gulation 1990;1:649
[17]Rees DD, Palmer RMJ, Schulz R, et al. Characterization of three inhibito rs of endothelial nitric oxide synthase in vitro and in vivo[J] Br J Pharmacol 1990;101:746
, 百拇医药
[18]Liu S,Crawley DE, Barnes PJ, et al. Endothelium-derived relaxing facto r inhibits hypoxic vasoconstriction in rats[J] Am Rev Respir Dis 1991;1 43:32
[19]Boger RH, Boda-Boger SM, Gerecke U, et al. Long term administration of L-argin ine, L-NAME and the exogenous NO doner molsidomine modulates urinary ni trate and cGMP excretion in rats[J] Cardivovasc Res 1994;28:494
[20]曹伟标等. NO合成抑制剂对犬体外ET分泌的影响[J] 中华医学杂志 19 95;75:164
, 百拇医药
[21]Cooke JP, et al. Antiatherogenic affects of Larginine in the hyperchole sterolemic rabbit[J] J Clin Invest 1992;90:1168
[22]Warren JB, Pons F, Brady AJB. Nitric oxide biology: Implications for cardiovascular therapeuties[J] Cardiovasc Res 1994;28:25-30
[23]Candipan RC, Wang BY,Buitrago R, et al. Regression or progression, depe ndency on vascular nitric oxide[J] Arterioscler Thromb Vasc Biol 1996; 16:44-50
[24]杨贤强,等.茶多酚生物学活性的研究[J]茶叶科学 1993;13:51
收稿日期:1999-03-09 , 百拇医药