国产异丁司特缓释胶囊的人体相对生物利用度研究
作者:杨毅梅 陈淑娟 顾世芬 张斌 代宗顺 曾繁典
单位:同济医科大学临床药理研究所,武汉430030
关键词:异丁司特相对生物利用度药代动力学
中国临床药理学与治疗学000412 目的考察国产异丁司特缓释胶囊的人体相对生物利用度。方法12名男性健康受试者随机分为3组,分别口服单剂量日本产异丁司特缓释胶囊20mg、国产异丁司特缓释胶囊20mg、异丁司特原料药10mg,交叉自身对照。于服药后取静脉血,用HPLC法测定血清异丁司特浓度。结果三种制剂的Cmax分别为(54.9±9.7)、(60.7±9.1)、(62.2±11.5)μg·L-1,tmax分别为(3.8±0.8)、(3.9±0.8)、(1.75±0.34)h,t1/2(ke)为(11.5±1.4)、(12.1±1.0)、(3.5±0.5)h,AUC(0~t)为(618.1±57.7)、(588.2±66.6)、(233.0±46.4)μg·h·L-1。以日本杏林公司产品作为参比制剂,国产异丁司特缓释胶囊的人体相对生物利用度为(95.6±11.0)%。结论经双向单侧t检验,国产和进口缓释胶囊具有生物等效性,与原料药相比具有明显的缓释特性。
, 百拇医药
中图分类号R969,1
Pharmacokinetics and relative bioavailability of domestic ibudilast sustained release capsules in healthy volunteers
YANG Yi_Mei CHEN Shu_Juan GU Shi_Fen ZHANG Bin DAI Zong_Shun ZENG Fan_Dian
(Department of Clinical Pharmacology,Tongji Medical University, Wuhan, 430030)
Aim The relative bioavailability of domestic ibudilast sustained release capsules in healthy volunteers was observed.Methods A single oral dose of 20 mg of imported and domestic ibudilast sustained release capsules and 10 mg of ibudilast raw material was separately given to 12 healthy volunteers in a randomized crossover study. Ibudilast concentration in plasma was determined by HPLC method.Results The Cmax were (54.9± 9.7),(60.7± 9.1) and (62.2± 11.5) μ g· L-1; the tmax were (3.8± 0.8),(3.9± 0.8) and (1.8± 0.3) h;the t1/2(ke) were (1.5± 1.4),(12.1± 1.0) and (3.5± 0.5) h,and the AUC(0~ t) were (618.1± 57.7),(588.1± 66.6) and (233.0± 46.4) μ g· h· L-1 in imported capsule group, domestic capsule group and raw material group respectively. The relative bioavailability of domestic sustained release capsules of ibudilast is (95.6± 11.0)% . Conclusion The results of statistical analysis demonstrate that the imported and domestic sustained capsules have significant character of significantly sustained release and are bioequivalent.
, 百拇医药
Key words ibudilast; relative bioavailabity; pharmacokinetics
异丁司特(ibudilast)通过抑制白三烯等炎性反应介质的释放[1],从而抑制过敏性支气管收缩[2],抗变态反应[3],增加脑血流量[4],激活脑代谢等,临床主要用于支气管哮喘和脑血管障碍的治疗。本文采用HPLC方法测定血清中异丁司特的浓度,以进口缓释胶囊为对照品,评价国产胶囊的相对生物利用度,为国产胶囊的研制开发和临床应用提供依据。
1 材料和方法
1.1药品与试剂试验药品:异丁司特缓释胶囊,规格:10mg/片,批号:19970622,深圳海王药业有限公司研制;参比药品:异丁司特缓释胶囊,规格:10mg/片,批号:970902,日本杏林制药有限公司生产;原料药胶囊:深圳海王药业有限公司的异丁司特标准品10mg装入空心胶囊,自备;标准品:异丁司特,含量:99.7%,批号:950705,深圳海王药业有限公司提供。甲醇为色谱纯,北京昌化精细化工厂生产;无水乙醇,分析纯,上海试剂总厂生产;磷酸二氢钾,分析纯,Sigma公司产品。
, 百拇医药
1.2仪器Hitachi高效液相色谱仪,包括L_6000泵,日本岛津SPD_6A型紫外检测器;日本岛津C_R3A自动积分仪;ODS_C18色谱柱(250mm×4.6mm,10μm),大连依利特科学仪器有限公司生
1.3对象12名健康男性志愿者,年龄(21.1±1.1)岁,体重(60.0±7.3)kg,身高(169.4±6.8)cm。受试前经一般体格体检、实验室检查(血、尿常规,肝、肾功能)和心电图等项检查均未见异常。受试者签署知情同意书。所有受试者试验前2wk及受试期间均不服用任何其它药物,受试期间禁烟、酒。
1.4给药方法[5]和标本采集12名受试者随机分为3组,分别空腹口服国产、进口异丁司特缓释胶囊20mg、异丁司特原料药10mg,200ml温开水送服。服药后2h和4h分别进统一食谱的清淡早餐和午餐。1wk间隔期后,按同样程序交叉服药。口服两种缓释胶囊组于给药前及给药后1、2、3、4、5、7、9、12、24、36h取静脉血2ml,原料药胶囊组于给药前及给药后0.5、1、1.5、2、2.5、3、4、6、8、12h取血2ml,离心10min,分离血清,密封后于-20℃保存。
, 百拇医药
1.5血清中异丁司特浓度的测定
1.5.1色谱条件色谱柱:ODS_C18色谱柱(250mm×4.6mm,10μm);柱温:室温;流动相:0.01mol.L-1KH2PO4水溶液∶甲醇=35∶65(pH6.0);流速:1.0ml.min-1;检测波长:318nm;灵敏度:0.01AUFS。
1.5.2血清样品处理取血清40μl,加入5mol.L-1NaOH100μl,碱化后,用正己烷2.5
1.5.3标准曲线精密称量异丁司特标准品,以无水乙醇溶解,配制10g.L-1原标准液以双蒸水稀释成应用液,浓度为0、0.02、0.05、0.1、0.2、0.5、1.0、2.0mg.L-1。在每份0.36ml空白血清中加入40μl不同浓度的标准品应用液,混匀,得终浓度为0、2、5、10、20、50、100、200μg.L-1的标准血清液,按血清样品处理方法提取测定,样品与杂质峰分离良好(分离度R=1.5),记录异丁司特峰面积,以峰面积(A)为纵坐标,浓度(C)为横坐标做直线回归,回归方程为A=-845.03+195.20C,r=0.9940。
, http://www.100md.com
1.5.4回收率、日内和日间变异系数的测定按上述方法分别测定2、50、200μg.L-1三个浓度标准血清的绝对回收率分别为(91.4±3.3)%、(82.0±5.0)%、(87.6±4.7)%;三个浓度标准血清的日内变异系数分别3.28%、4.97%、4.70%,日间变异系数分别5.97%、6.95%、7.35%。
1.6数据处理应用中国药理学会编制的3p97药代动力学软件处理异丁司特血清浓度数据,非房室模型估算药代动力学参数,其中Cmax、tmax为实测值,药_时曲线下面积AUC(0~t)以梯形法计算。
2 结果
2.1血药浓度测定方法的建立在本实验分析条件下,异丁司特的色谱保留时间为13.55min,且色谱峰与杂质峰分离良好,本方法取信噪比为3时,最低检出浓度为2μg.L-1。
, 百拇医药
2.2药代动力学结果12名健康志愿者分别口服进口和国产缓释胶囊及异丁司特原料药后,平均血药浓度_时间曲线见图1,主要药代动力学参数见表1。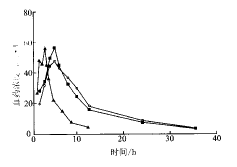
图112名受试者口服3种异丁司特制剂的平均血药浓度_时间曲线
—■—国产异丁司特缓释胶囊;—□—进口异丁司特缓释胶囊;
—△—异丁司特原料药
2.3国产异丁司特缓释胶囊相对生物利用度试验结果用SAS软件对药代动力学参数进行方差分析和q检验,检验水准α=0.05。结果表明,两种缓释胶囊的tmax、ke、t1/2(β)与原料药之间有显著性差异,而两种缓释胶囊之间无显著性差异。口服两种缓释胶囊20mg所达到的Cmax与口服原料药10mg后的Cmax相比,无显著性差异,两种缓释胶囊之间也无显著性差异。国产异丁司特缓释胶囊与进口胶囊相比,其生物利用度为(95.6±11.0)%。
, 百拇医药
表1 12名受试者口服异丁司特的药代动力学参数 参数
国产缓胶囊
进口缓胶囊
原料药
tmax/h
3.9
3.8±0.8
1.8±0.3
Cmax/μg.L-1
60.7
54.9±9.7
62.2±11.5
, 百拇医药
t1/2h
12.1
11.5±1.4
3.5±0.5
ke/h-1
0.058
0.061±0.010
0.201±0.025
AUC/μg.hL-1
588.1
618.1±57.7
233.0±46.4
, http://www.100md.com
Fr/%
95.6
-
-
国产和日本产缓释胶囊的AUC(0~t)分别为588.15μg.h.L-1和618.11μg.h.L-1,以AUC(0~t)对制剂间、周期间、个体间进行方差分析,ml提取,离心(4000r.min-1)15min,取2ml有机相,室温下吹干,100μl流动相复溶,取50μl进样。
采用SAS统计软件对两种缓释胶囊的药代动力学参数进行方差分析和q检验。以AUC(0~t)等值的对数值按80%~125%等效标准,采用双向单侧t检验对国产和进口缓释胶囊的生物等效性进行评价。
, 百拇医药
发现制剂间、周期间、个体间均无显著性差异(P>0.05)。AUC(0~t)、tmax、Cmax、ke的对数值经双单侧t检验,t1、t2均大于临界值,90%置信区间均位于FDA规定的允许范围(80%~125%)之内,说明两者为生物等效性制剂。
3 讨论
本试验的主要目的是考察国产异丁司特缓释胶囊的缓释特征。试验药品与该药的原料药胶囊比较,其tmax、t1/2(ke)显著延长,20mg口服剂量所达到的Cmax与口服10mg原料药后的Cmax相比无显著性差异,说明国产缓释制剂可延长药物作用时间,降低峰浓度,具有缓释动力学特性。试验药品与日本产缓释胶囊相比,AUC(0~t)、tmax、ke、t1/2(ke)等药动学参数无显著性差异,且具生物等效性,说明两制剂的缓释特征相同。
据文献报道[6],口服日本杏林制药公司生产异丁司特缓释胶10mg,其tpeak、t1/2分别为(4±1)、(12.0±3.4)h,与本试验的结果基本一致。
, 百拇医药
杨毅梅,女,28岁,博士,主要从事临床药理学研究。
曾繁典,男,博士生导师,中国药理学会副理事长,本刊副主编。
参 考 文 献
1,Nishino K.KC_404: a potential anti_allergic agent with antagonistic action against slow reacting sub_stance of anaphylaxis. Jpn J Pharmacol, 1983;33(2): 267
2,Hoshino K.Comparison of the effects on bronchial hyperresponsiveness of antiallergic agents and be_ clomethasone dipropionate in long_term bronchial asthma.Allergy,1993;48(3): 196
, 百拇医药
3,Niwa M.Ibudilast,an anti_allergic and cerebral va_ sodilator,modulates superoxide production in human neutrophils.Life Science, 1995; 56(2): 107
4,Fukuyama H.Pharmacological effects of ibudilast on cerebral circulation: a PET study. Neurol Res, 1993; 15(3): 169
5,《新药(西药)临床研究指导原则汇编》:药物制剂人体生物利用度指导原则中华人民共和国卫生部药政局编(1993)
6,Kohno T, Murasugi N, Sakurai H, et al. A sandwich transfer enzyme immunoassay for salmon calcitonin in human. J Clin Lab Anal, 1997; 11(6): 380
2000-05-30收稿,2000-07-07修回, 百拇医药
单位:同济医科大学临床药理研究所,武汉430030
关键词:异丁司特相对生物利用度药代动力学
中国临床药理学与治疗学000412 目的考察国产异丁司特缓释胶囊的人体相对生物利用度。方法12名男性健康受试者随机分为3组,分别口服单剂量日本产异丁司特缓释胶囊20mg、国产异丁司特缓释胶囊20mg、异丁司特原料药10mg,交叉自身对照。于服药后取静脉血,用HPLC法测定血清异丁司特浓度。结果三种制剂的Cmax分别为(54.9±9.7)、(60.7±9.1)、(62.2±11.5)μg·L-1,tmax分别为(3.8±0.8)、(3.9±0.8)、(1.75±0.34)h,t1/2(ke)为(11.5±1.4)、(12.1±1.0)、(3.5±0.5)h,AUC(0~t)为(618.1±57.7)、(588.2±66.6)、(233.0±46.4)μg·h·L-1。以日本杏林公司产品作为参比制剂,国产异丁司特缓释胶囊的人体相对生物利用度为(95.6±11.0)%。结论经双向单侧t检验,国产和进口缓释胶囊具有生物等效性,与原料药相比具有明显的缓释特性。
, 百拇医药
中图分类号R969,1
Pharmacokinetics and relative bioavailability of domestic ibudilast sustained release capsules in healthy volunteers
YANG Yi_Mei CHEN Shu_Juan GU Shi_Fen ZHANG Bin DAI Zong_Shun ZENG Fan_Dian
(Department of Clinical Pharmacology,Tongji Medical University, Wuhan, 430030)
Aim The relative bioavailability of domestic ibudilast sustained release capsules in healthy volunteers was observed.Methods A single oral dose of 20 mg of imported and domestic ibudilast sustained release capsules and 10 mg of ibudilast raw material was separately given to 12 healthy volunteers in a randomized crossover study. Ibudilast concentration in plasma was determined by HPLC method.Results The Cmax were (54.9± 9.7),(60.7± 9.1) and (62.2± 11.5) μ g· L-1; the tmax were (3.8± 0.8),(3.9± 0.8) and (1.8± 0.3) h;the t1/2(ke) were (1.5± 1.4),(12.1± 1.0) and (3.5± 0.5) h,and the AUC(0~ t) were (618.1± 57.7),(588.1± 66.6) and (233.0± 46.4) μ g· h· L-1 in imported capsule group, domestic capsule group and raw material group respectively. The relative bioavailability of domestic sustained release capsules of ibudilast is (95.6± 11.0)% . Conclusion The results of statistical analysis demonstrate that the imported and domestic sustained capsules have significant character of significantly sustained release and are bioequivalent.
, 百拇医药
Key words ibudilast; relative bioavailabity; pharmacokinetics
异丁司特(ibudilast)通过抑制白三烯等炎性反应介质的释放[1],从而抑制过敏性支气管收缩[2],抗变态反应[3],增加脑血流量[4],激活脑代谢等,临床主要用于支气管哮喘和脑血管障碍的治疗。本文采用HPLC方法测定血清中异丁司特的浓度,以进口缓释胶囊为对照品,评价国产胶囊的相对生物利用度,为国产胶囊的研制开发和临床应用提供依据。
1 材料和方法
1.1药品与试剂试验药品:异丁司特缓释胶囊,规格:10mg/片,批号:19970622,深圳海王药业有限公司研制;参比药品:异丁司特缓释胶囊,规格:10mg/片,批号:970902,日本杏林制药有限公司生产;原料药胶囊:深圳海王药业有限公司的异丁司特标准品10mg装入空心胶囊,自备;标准品:异丁司特,含量:99.7%,批号:950705,深圳海王药业有限公司提供。甲醇为色谱纯,北京昌化精细化工厂生产;无水乙醇,分析纯,上海试剂总厂生产;磷酸二氢钾,分析纯,Sigma公司产品。
, 百拇医药
1.2仪器Hitachi高效液相色谱仪,包括L_6000泵,日本岛津SPD_6A型紫外检测器;日本岛津C_R3A自动积分仪;ODS_C18色谱柱(250mm×4.6mm,10μm),大连依利特科学仪器有限公司生
1.3对象12名健康男性志愿者,年龄(21.1±1.1)岁,体重(60.0±7.3)kg,身高(169.4±6.8)cm。受试前经一般体格体检、实验室检查(血、尿常规,肝、肾功能)和心电图等项检查均未见异常。受试者签署知情同意书。所有受试者试验前2wk及受试期间均不服用任何其它药物,受试期间禁烟、酒。
1.4给药方法[5]和标本采集12名受试者随机分为3组,分别空腹口服国产、进口异丁司特缓释胶囊20mg、异丁司特原料药10mg,200ml温开水送服。服药后2h和4h分别进统一食谱的清淡早餐和午餐。1wk间隔期后,按同样程序交叉服药。口服两种缓释胶囊组于给药前及给药后1、2、3、4、5、7、9、12、24、36h取静脉血2ml,原料药胶囊组于给药前及给药后0.5、1、1.5、2、2.5、3、4、6、8、12h取血2ml,离心10min,分离血清,密封后于-20℃保存。
, 百拇医药
1.5血清中异丁司特浓度的测定
1.5.1色谱条件色谱柱:ODS_C18色谱柱(250mm×4.6mm,10μm);柱温:室温;流动相:0.01mol.L-1KH2PO4水溶液∶甲醇=35∶65(pH6.0);流速:1.0ml.min-1;检测波长:318nm;灵敏度:0.01AUFS。
1.5.2血清样品处理取血清40μl,加入5mol.L-1NaOH100μl,碱化后,用正己烷2.5
1.5.3标准曲线精密称量异丁司特标准品,以无水乙醇溶解,配制10g.L-1原标准液以双蒸水稀释成应用液,浓度为0、0.02、0.05、0.1、0.2、0.5、1.0、2.0mg.L-1。在每份0.36ml空白血清中加入40μl不同浓度的标准品应用液,混匀,得终浓度为0、2、5、10、20、50、100、200μg.L-1的标准血清液,按血清样品处理方法提取测定,样品与杂质峰分离良好(分离度R=1.5),记录异丁司特峰面积,以峰面积(A)为纵坐标,浓度(C)为横坐标做直线回归,回归方程为A=-845.03+195.20C,r=0.9940。
, http://www.100md.com
1.5.4回收率、日内和日间变异系数的测定按上述方法分别测定2、50、200μg.L-1三个浓度标准血清的绝对回收率分别为(91.4±3.3)%、(82.0±5.0)%、(87.6±4.7)%;三个浓度标准血清的日内变异系数分别3.28%、4.97%、4.70%,日间变异系数分别5.97%、6.95%、7.35%。
1.6数据处理应用中国药理学会编制的3p97药代动力学软件处理异丁司特血清浓度数据,非房室模型估算药代动力学参数,其中Cmax、tmax为实测值,药_时曲线下面积AUC(0~t)以梯形法计算。
2 结果
2.1血药浓度测定方法的建立在本实验分析条件下,异丁司特的色谱保留时间为13.55min,且色谱峰与杂质峰分离良好,本方法取信噪比为3时,最低检出浓度为2μg.L-1。
, 百拇医药
2.2药代动力学结果12名健康志愿者分别口服进口和国产缓释胶囊及异丁司特原料药后,平均血药浓度_时间曲线见图1,主要药代动力学参数见表1。

图112名受试者口服3种异丁司特制剂的平均血药浓度_时间曲线
—■—国产异丁司特缓释胶囊;—□—进口异丁司特缓释胶囊;
—△—异丁司特原料药
2.3国产异丁司特缓释胶囊相对生物利用度试验结果用SAS软件对药代动力学参数进行方差分析和q检验,检验水准α=0.05。结果表明,两种缓释胶囊的tmax、ke、t1/2(β)与原料药之间有显著性差异,而两种缓释胶囊之间无显著性差异。口服两种缓释胶囊20mg所达到的Cmax与口服原料药10mg后的Cmax相比,无显著性差异,两种缓释胶囊之间也无显著性差异。国产异丁司特缓释胶囊与进口胶囊相比,其生物利用度为(95.6±11.0)%。
, 百拇医药
表1 12名受试者口服异丁司特的药代动力学参数 参数
国产缓胶囊
进口缓胶囊
原料药
tmax/h
3.9
3.8±0.8
1.8±0.3
Cmax/μg.L-1
60.7
54.9±9.7
62.2±11.5
, 百拇医药
t1/2h
12.1
11.5±1.4
3.5±0.5
ke/h-1
0.058
0.061±0.010
0.201±0.025
AUC/μg.hL-1
588.1
618.1±57.7
233.0±46.4
, http://www.100md.com
Fr/%
95.6
-
-
国产和日本产缓释胶囊的AUC(0~t)分别为588.15μg.h.L-1和618.11μg.h.L-1,以AUC(0~t)对制剂间、周期间、个体间进行方差分析,ml提取,离心(4000r.min-1)15min,取2ml有机相,室温下吹干,100μl流动相复溶,取50μl进样。
采用SAS统计软件对两种缓释胶囊的药代动力学参数进行方差分析和q检验。以AUC(0~t)等值的对数值按80%~125%等效标准,采用双向单侧t检验对国产和进口缓释胶囊的生物等效性进行评价。
, 百拇医药
发现制剂间、周期间、个体间均无显著性差异(P>0.05)。AUC(0~t)、tmax、Cmax、ke的对数值经双单侧t检验,t1、t2均大于临界值,90%置信区间均位于FDA规定的允许范围(80%~125%)之内,说明两者为生物等效性制剂。
3 讨论
本试验的主要目的是考察国产异丁司特缓释胶囊的缓释特征。试验药品与该药的原料药胶囊比较,其tmax、t1/2(ke)显著延长,20mg口服剂量所达到的Cmax与口服10mg原料药后的Cmax相比无显著性差异,说明国产缓释制剂可延长药物作用时间,降低峰浓度,具有缓释动力学特性。试验药品与日本产缓释胶囊相比,AUC(0~t)、tmax、ke、t1/2(ke)等药动学参数无显著性差异,且具生物等效性,说明两制剂的缓释特征相同。
据文献报道[6],口服日本杏林制药公司生产异丁司特缓释胶10mg,其tpeak、t1/2分别为(4±1)、(12.0±3.4)h,与本试验的结果基本一致。
, 百拇医药
杨毅梅,女,28岁,博士,主要从事临床药理学研究。
曾繁典,男,博士生导师,中国药理学会副理事长,本刊副主编。
参 考 文 献
1,Nishino K.KC_404: a potential anti_allergic agent with antagonistic action against slow reacting sub_stance of anaphylaxis. Jpn J Pharmacol, 1983;33(2): 267
2,Hoshino K.Comparison of the effects on bronchial hyperresponsiveness of antiallergic agents and be_ clomethasone dipropionate in long_term bronchial asthma.Allergy,1993;48(3): 196
, 百拇医药
3,Niwa M.Ibudilast,an anti_allergic and cerebral va_ sodilator,modulates superoxide production in human neutrophils.Life Science, 1995; 56(2): 107
4,Fukuyama H.Pharmacological effects of ibudilast on cerebral circulation: a PET study. Neurol Res, 1993; 15(3): 169
5,《新药(西药)临床研究指导原则汇编》:药物制剂人体生物利用度指导原则中华人民共和国卫生部药政局编(1993)
6,Kohno T, Murasugi N, Sakurai H, et al. A sandwich transfer enzyme immunoassay for salmon calcitonin in human. J Clin Lab Anal, 1997; 11(6): 380
2000-05-30收稿,2000-07-07修回, 百拇医药