色氨酸酶基因工程菌酶法合成L-色氨酸
作者:韦平和 吴梧桐 王旻
单位:南京 210009 中国药科大学生物制药学院
关键词:色氨酸酶基因工程菌;L-色氨酸;L-丝氨酸;转化
中国现代应用药学990616
摘要 目的:以L-丝氨酸和吲哚为底物,用色氨酸酶基因工程菌酶法合成L-色氨酸。方法:以IPTG诱导工程菌色氨酸酶表达,将酶活最高时的工程菌游离细胞作为转化反应的酶源,通过纸层析分析并测定转化液中L-色氨酸的含量。结果:100ml反应液(L-丝氨酸3g,吲哚3g)37℃反应48h可积累L-色氨酸4.9g,L-丝氨酸转化率为84.2%,吲哚转化率为93.6%。经分离纯化所得的L-色氨酸晶体,在熔点、旋光性和红外吸收光谱等方面与标准品完全一致。结论:色氨酸酶基因工程菌能有效地催化L-丝氨酸和吲哚合成L-色氨酸,进一步证明了该酶在L-色氨酸酶法合成中的可行性和有效性。
, http://www.100md.com
Enzymatica synthesis of L-Tryptophan by tryptophanase expressed in genetic genetic engineering strain
Wei Pinghe(Wei PH),Wu Wutong(Wu WT),Wang Min(Wang M)
(School of Biological Pharmacetics,China Pharmaceutical University,Nanjing 210009)
ABSTRACT OBJECTIVE:L-Tryptophan was enzymatically synthesized by tryptophanase with the substrates of L-serine and indole in genetic engineering strain.METHOD:Tryptophanase was expressed in engineering strain which was induced by IPTG.The engineering strain free cells with the highest enzyme activity were used as enzyme source in the conversion reaction mixture.L-Tryptophan accumulated in the reaction mixture was analyzed and determined by paper chromatography.RESULTS:4.9g of L-Tryptophan was formed from 3g of L-serine and 3g of indole in 100ml reaction mixture shaken for 48h at 37℃.The conversion rate was 84.2% for L-serine and 93.6% for indole.After isolating and purificating,the crystals were identical to authentic L-Tryptophan,in respects of melting point,optical activity and IR-spectra.CONCLUSION:Tryptophanase expressed in genetic engineering strain could efficiently catalyze L-serine and indole to synthesize L-Tryptophan,and the feasibility and efficiency of tryptophanase in this enzymatic synthesis were confirmed.
, 百拇医药
KEY WORDS tryptophanase genetic engineering strain,L-tryptophan,L-serine,conversion
L-色氨酸是人体内的重要必需氨基酸,在医药上主要用于制造复方氨基酸营养输液,并可单独作为抗抑郁剂和催眠剂。色氨酸酶(EC4.1.99.1)是一种依赖磷酸吡哆醛的多功能酶,正常情况下催化L-色氨酸降解生成丙酮酸、吲哚和氨,但在高浓度的丙酮酸和氨条件下它也能有效地催化丙酮酸、吲哚和氨合成L-色氨酸[1]。此外,在一定条件下色氨酸酶还能催化L-丝氨酸和吲哚合成L-色氨酸[2,3]。本文根据这一反应原理,以L-丝氨酸和吲哚为底物,利用色氨酸酶基因工程菌酶促合成L-色氨酸,试图为工业化酶法生产L-色氨酸提供可行、合理的工艺路线。
1 材料与方法
1.1 材料
, http://www.100md.com
1.1.1 菌株和培养基 色氨酸酶基因工程菌株WW-4(本室构建),E. coli BL21(DE3)(南京军区医学研究所李光富先生惠赠),LB培养基(1%胰化蛋白胨,0.5%酵母抽提物和1%氯化钠)。
1.1.2 试剂 磷酸吡哆醛(PLP)、异丙基硫代半乳糖苷(IPTG)、还原型谷胱甘肽(GSH)和对二甲氨基苯甲醛(PDAB)分别购自Sigma公司、Promega公司、中国新兴医药保健品开发公司和上海试剂三厂,L-丝氨酸、L-色氨酸(上海伯奥生物科技公司),吲哚(上海双喜香料助剂厂),其它试剂均为国产分析纯。
1.1.3 仪器 Beckman高速冷冻离心机,DDHZ-300多用途台式恒温振荡器(江苏太仓实验设备厂),ZFQ85A旋转蒸发器(上海医械专机厂),差示扫描量热仪(Mettler公司),241MC旋光仪(PE公司),IMPACT410红外光谱仪(Nicolet公司)。
, 百拇医药 1.2 方法
1.2.1 工程菌色氨酸酶的诱导表达 取一个单菌落接种于LB培养基,37℃培养过夜以获得饱和培养物,将饱和培养物以1%接种于含Amp(100μg/ml)的LB培养基中,37℃继续培养2h后,添加IPTG至终浓度1mmol/L诱导表达色氨酸酶[4]。
1.2.2 色氨酸酶的活力测定 按Wood等(1947)[5]提出的酶活测定方法改进后进行。酶的一个活力单位定义为:在一定反应条件下,37℃、10min催化形成0.01μmol吲哚所需要的酶量。
1.2.3 L-色氨酸的酶法合成条件 在100ml 0.1mol/L磷酸钾缓冲液中,分别添加3g L-丝氨酸、3g吲哚、10mg PLP以及由300ml培养液离心后收集的细菌沉淀,调pH8.8后于37℃摇床振荡反应48h。
1.2.4 L-色氨酸的纸层析检测 将振摇一定时间后的反应液经适当稀释后以12000r/min离心2min,取上清液10μl进行纸层析检测(展开剂系统正丙醇-氨水-水20∶15∶3),用5ml 0.1mol/L HCl洗提色氨酸斑点,于280nm处进行吸光度测定[6]。
, 百拇医药
2 结 果
2.1 不同诱导时间色氨酸酶的活力测定
经IPTG诱导0.5,1,2,3和4h的色氨酸酶工程菌WW-4,其活力测定结果见图1。由图1可知:诱导1h左右的色氨酸酶活力最高,故选择诱导1h的细胞作为L-色氨酸酶法合成的酶源。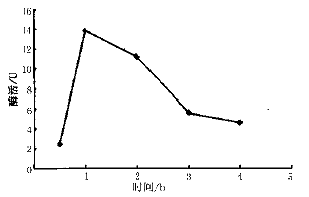
图1 不同诱导时间色氨酸酶的活力变化
2.2 L-色氨酸的酶法合成
将由色氨酸酶工程菌催化并振摇24h的反应液离心后取上清液10μl进行纸层析检测,其层析图谱见图2。根据图2中色氨酸标准品的斑点位置和大小,可初步认为宿主菌BL21(DE3)因含色氨酸酶活力太低,反应液中几乎不产生L-色氨酸,而由色氨酸酶工程菌催化的反应液中产生了约为标准品3倍量以上的转化产物L-色氨酸。100ml反应体积(L-丝氨酸3g,吲哚3g)37℃反应48h,可积累L-色氨酸4.9g,L-丝氨酸转化率为84.2%,吲哚转化率为93.6%,L-色氨酸随转化时间的浓度变化见图3。
, http://www.100md.com
图2 L-色氨酸的纸层析图谱
A-宿主菌;B-色氨酸酶工程菌;C-色氨酸标准品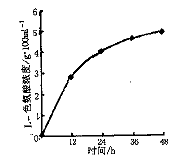
图3 不同转化时间L-色氨酸的浓度变化
2.3 L-色氨酸的分离纯化
反应液中L-色氨酸的分离纯化步骤如下:将反应液稀释10倍以溶解沉淀的色氨酸,5000r/min离心15min,弃细菌沉淀和残留吲哚,收集上清液并用2mol/L HCl调pH至6.5,添加1%活性炭搅拌、脱色20min(80℃)后过滤,滤液减压浓缩(50℃)得粗晶体,水中重结晶2次,真空抽滤、烘干得白色片状L-色氨酸晶体。
, http://www.100md.com
2.4 L-色氨酸产品的质量分析
2.4.1 熔点 差示扫描量热仪测定结果为274.6℃,与标准品276.3℃相差1.7℃,见图4。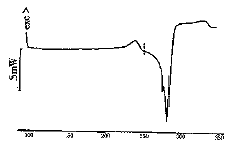
温度/℃
图4 L-色氨酸产品的熔点测定
2.4.2 旋光度 PE-241MC测定结果为[α]28D-31.34,符合《中国药典》(1990版附录)-30~-33°要求。
2.4.3 红外吸收图谱 与标准品图谱一致,见图5。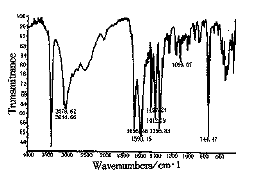
, http://www.100md.com
图5 L-色氨酸产品的红外光谱
3 讨 论
3.1 催化L-丝氨酸和吲哚合成L-色氨酸的酶,除了色氨酸酶外还有色氨酸合成酶[7]。在这一酶促反应中,尽管色氨酸合成酶的动力学特征明显优于色氨酸酶,但作为底物之一的吲哚对其抑制强烈,而色氨酸酶对吲哚则具有良好的稳定性[8]。因此,本文选择色氨酸酶催化L-丝氨酸和吲哚合成L-色氨酸,其研究结果进一步证明了该酶在L-色氨酸酶法合成中的可行性和有效性。
3.2 色氨酸酶能有效地催化L-丝氨酸和吲哚生成L-色氨酸,但它在工业化应用上的主要困难是底物L-丝氨酸价格几乎与L-色氨酸相当,克服这一困难的重要途径是:以廉价的甘氨酸和甲醛为底物,先在丝氨酸羟甲基转移酶(SHMT)催化下生成L-丝氨酸,再在色氨酸酶催化下,通过添加吲哚最终生成L-色氨酸[9]。本室已成功构建SHMT基因工程高产菌株[10]。以甘氨酸为底物,通过SHMT和色氨酸酶两步酶法合成L-色氨酸的有关工作正在进行之中。
, http://www.100md.com
3.3 Newton等(1965)报道,色氨酸酶晶体在55~65℃维持10min失活率达86%,在催化L-色氨酸的合成反应中其最适pH为8.8,故本文L-色氨酸酶法合成条件选择反应温度37℃、pH8.8,但在特定转化反应体系及用游离细胞作为酶源的情况下,色氨酸酶的最适温度、pH以及培养基成分、底物用量和转化时间等方面还需进一步的优化和完善。
参考文献
1 Watanabe T,Snell E.Reversibility of the tryptophanase reaction:synthesis of tryptophan from indole,pyruvate and ammonia.Proc Natl Acad Sci USA,1972,69(5)∶1086.
2 Newton WA,Morina Y,Snell E.Properties of crystalline tryptophanase.J Biol Chem,1965,240(3)∶1211.
, http://www.100md.com
3 Snell EE.Tryptophanase:structure,catalytic activities and mechanism of action.In Advances in Enzymology(A. Meister. Ed.),1975,42∶287.
4 金冬雁,黎孟枫译.分子克隆实验指南.第2版.北京:科学出版社,1995∶831.
5 Wood W,Gunsalus I,Umbreit W.Function of pyridoxal phosphate:resolution and purification of the tryptophanase enzyme of E. coli.J Biol Chem,1947,170∶313.
6 Nakazawa H,Enei H,Okumura S,et al.Synthesis of L-tryptophan from pyruvate,ammonia and indole.Agr Biol Chem,1972,36(13)∶2523.
, 百拇医药
7 Adachi O,Miles EW.A rapid method of preparing crystalline β2 subunit of tryptophan synthetase of E. coli in high yield.J Biol Chem,1974,249∶5430.
8 韦平和,吴梧桐.色氨酸生物工程研究进展.药物生物技术,1998,5(3)∶180.
9 Hamilton BK,Hsiao HY,Swann WE,et al.Manufacture of L-amino acid with bioreactors.Trends in Biotechnology,1985,3(3)∶64.
10 蔡宇阳,吴梧桐,史燕东.SHMT基因工程菌的构建及高效表达.生物工程学报,1996,12(增刊)∶28.
收稿日期:1998-10-30, 百拇医药
单位:南京 210009 中国药科大学生物制药学院
关键词:色氨酸酶基因工程菌;L-色氨酸;L-丝氨酸;转化
中国现代应用药学990616
摘要 目的:以L-丝氨酸和吲哚为底物,用色氨酸酶基因工程菌酶法合成L-色氨酸。方法:以IPTG诱导工程菌色氨酸酶表达,将酶活最高时的工程菌游离细胞作为转化反应的酶源,通过纸层析分析并测定转化液中L-色氨酸的含量。结果:100ml反应液(L-丝氨酸3g,吲哚3g)37℃反应48h可积累L-色氨酸4.9g,L-丝氨酸转化率为84.2%,吲哚转化率为93.6%。经分离纯化所得的L-色氨酸晶体,在熔点、旋光性和红外吸收光谱等方面与标准品完全一致。结论:色氨酸酶基因工程菌能有效地催化L-丝氨酸和吲哚合成L-色氨酸,进一步证明了该酶在L-色氨酸酶法合成中的可行性和有效性。
, http://www.100md.com
Enzymatica synthesis of L-Tryptophan by tryptophanase expressed in genetic genetic engineering strain
Wei Pinghe(Wei PH),Wu Wutong(Wu WT),Wang Min(Wang M)
(School of Biological Pharmacetics,China Pharmaceutical University,Nanjing 210009)
ABSTRACT OBJECTIVE:L-Tryptophan was enzymatically synthesized by tryptophanase with the substrates of L-serine and indole in genetic engineering strain.METHOD:Tryptophanase was expressed in engineering strain which was induced by IPTG.The engineering strain free cells with the highest enzyme activity were used as enzyme source in the conversion reaction mixture.L-Tryptophan accumulated in the reaction mixture was analyzed and determined by paper chromatography.RESULTS:4.9g of L-Tryptophan was formed from 3g of L-serine and 3g of indole in 100ml reaction mixture shaken for 48h at 37℃.The conversion rate was 84.2% for L-serine and 93.6% for indole.After isolating and purificating,the crystals were identical to authentic L-Tryptophan,in respects of melting point,optical activity and IR-spectra.CONCLUSION:Tryptophanase expressed in genetic engineering strain could efficiently catalyze L-serine and indole to synthesize L-Tryptophan,and the feasibility and efficiency of tryptophanase in this enzymatic synthesis were confirmed.
, 百拇医药
KEY WORDS tryptophanase genetic engineering strain,L-tryptophan,L-serine,conversion
L-色氨酸是人体内的重要必需氨基酸,在医药上主要用于制造复方氨基酸营养输液,并可单独作为抗抑郁剂和催眠剂。色氨酸酶(EC4.1.99.1)是一种依赖磷酸吡哆醛的多功能酶,正常情况下催化L-色氨酸降解生成丙酮酸、吲哚和氨,但在高浓度的丙酮酸和氨条件下它也能有效地催化丙酮酸、吲哚和氨合成L-色氨酸[1]。此外,在一定条件下色氨酸酶还能催化L-丝氨酸和吲哚合成L-色氨酸[2,3]。本文根据这一反应原理,以L-丝氨酸和吲哚为底物,利用色氨酸酶基因工程菌酶促合成L-色氨酸,试图为工业化酶法生产L-色氨酸提供可行、合理的工艺路线。
1 材料与方法
1.1 材料
, http://www.100md.com
1.1.1 菌株和培养基 色氨酸酶基因工程菌株WW-4(本室构建),E. coli BL21(DE3)(南京军区医学研究所李光富先生惠赠),LB培养基(1%胰化蛋白胨,0.5%酵母抽提物和1%氯化钠)。
1.1.2 试剂 磷酸吡哆醛(PLP)、异丙基硫代半乳糖苷(IPTG)、还原型谷胱甘肽(GSH)和对二甲氨基苯甲醛(PDAB)分别购自Sigma公司、Promega公司、中国新兴医药保健品开发公司和上海试剂三厂,L-丝氨酸、L-色氨酸(上海伯奥生物科技公司),吲哚(上海双喜香料助剂厂),其它试剂均为国产分析纯。
1.1.3 仪器 Beckman高速冷冻离心机,DDHZ-300多用途台式恒温振荡器(江苏太仓实验设备厂),ZFQ85A旋转蒸发器(上海医械专机厂),差示扫描量热仪(Mettler公司),241MC旋光仪(PE公司),IMPACT410红外光谱仪(Nicolet公司)。
, 百拇医药 1.2 方法
1.2.1 工程菌色氨酸酶的诱导表达 取一个单菌落接种于LB培养基,37℃培养过夜以获得饱和培养物,将饱和培养物以1%接种于含Amp(100μg/ml)的LB培养基中,37℃继续培养2h后,添加IPTG至终浓度1mmol/L诱导表达色氨酸酶[4]。
1.2.2 色氨酸酶的活力测定 按Wood等(1947)[5]提出的酶活测定方法改进后进行。酶的一个活力单位定义为:在一定反应条件下,37℃、10min催化形成0.01μmol吲哚所需要的酶量。
1.2.3 L-色氨酸的酶法合成条件 在100ml 0.1mol/L磷酸钾缓冲液中,分别添加3g L-丝氨酸、3g吲哚、10mg PLP以及由300ml培养液离心后收集的细菌沉淀,调pH8.8后于37℃摇床振荡反应48h。
1.2.4 L-色氨酸的纸层析检测 将振摇一定时间后的反应液经适当稀释后以12000r/min离心2min,取上清液10μl进行纸层析检测(展开剂系统正丙醇-氨水-水20∶15∶3),用5ml 0.1mol/L HCl洗提色氨酸斑点,于280nm处进行吸光度测定[6]。
, 百拇医药
2 结 果
2.1 不同诱导时间色氨酸酶的活力测定
经IPTG诱导0.5,1,2,3和4h的色氨酸酶工程菌WW-4,其活力测定结果见图1。由图1可知:诱导1h左右的色氨酸酶活力最高,故选择诱导1h的细胞作为L-色氨酸酶法合成的酶源。

图1 不同诱导时间色氨酸酶的活力变化
2.2 L-色氨酸的酶法合成
将由色氨酸酶工程菌催化并振摇24h的反应液离心后取上清液10μl进行纸层析检测,其层析图谱见图2。根据图2中色氨酸标准品的斑点位置和大小,可初步认为宿主菌BL21(DE3)因含色氨酸酶活力太低,反应液中几乎不产生L-色氨酸,而由色氨酸酶工程菌催化的反应液中产生了约为标准品3倍量以上的转化产物L-色氨酸。100ml反应体积(L-丝氨酸3g,吲哚3g)37℃反应48h,可积累L-色氨酸4.9g,L-丝氨酸转化率为84.2%,吲哚转化率为93.6%,L-色氨酸随转化时间的浓度变化见图3。

, http://www.100md.com
图2 L-色氨酸的纸层析图谱
A-宿主菌;B-色氨酸酶工程菌;C-色氨酸标准品

图3 不同转化时间L-色氨酸的浓度变化
2.3 L-色氨酸的分离纯化
反应液中L-色氨酸的分离纯化步骤如下:将反应液稀释10倍以溶解沉淀的色氨酸,5000r/min离心15min,弃细菌沉淀和残留吲哚,收集上清液并用2mol/L HCl调pH至6.5,添加1%活性炭搅拌、脱色20min(80℃)后过滤,滤液减压浓缩(50℃)得粗晶体,水中重结晶2次,真空抽滤、烘干得白色片状L-色氨酸晶体。
, http://www.100md.com
2.4 L-色氨酸产品的质量分析
2.4.1 熔点 差示扫描量热仪测定结果为274.6℃,与标准品276.3℃相差1.7℃,见图4。

温度/℃
图4 L-色氨酸产品的熔点测定
2.4.2 旋光度 PE-241MC测定结果为[α]28D-31.34,符合《中国药典》(1990版附录)-30~-33°要求。
2.4.3 红外吸收图谱 与标准品图谱一致,见图5。

, http://www.100md.com
图5 L-色氨酸产品的红外光谱
3 讨 论
3.1 催化L-丝氨酸和吲哚合成L-色氨酸的酶,除了色氨酸酶外还有色氨酸合成酶[7]。在这一酶促反应中,尽管色氨酸合成酶的动力学特征明显优于色氨酸酶,但作为底物之一的吲哚对其抑制强烈,而色氨酸酶对吲哚则具有良好的稳定性[8]。因此,本文选择色氨酸酶催化L-丝氨酸和吲哚合成L-色氨酸,其研究结果进一步证明了该酶在L-色氨酸酶法合成中的可行性和有效性。
3.2 色氨酸酶能有效地催化L-丝氨酸和吲哚生成L-色氨酸,但它在工业化应用上的主要困难是底物L-丝氨酸价格几乎与L-色氨酸相当,克服这一困难的重要途径是:以廉价的甘氨酸和甲醛为底物,先在丝氨酸羟甲基转移酶(SHMT)催化下生成L-丝氨酸,再在色氨酸酶催化下,通过添加吲哚最终生成L-色氨酸[9]。本室已成功构建SHMT基因工程高产菌株[10]。以甘氨酸为底物,通过SHMT和色氨酸酶两步酶法合成L-色氨酸的有关工作正在进行之中。
, http://www.100md.com
3.3 Newton等(1965)报道,色氨酸酶晶体在55~65℃维持10min失活率达86%,在催化L-色氨酸的合成反应中其最适pH为8.8,故本文L-色氨酸酶法合成条件选择反应温度37℃、pH8.8,但在特定转化反应体系及用游离细胞作为酶源的情况下,色氨酸酶的最适温度、pH以及培养基成分、底物用量和转化时间等方面还需进一步的优化和完善。
参考文献
1 Watanabe T,Snell E.Reversibility of the tryptophanase reaction:synthesis of tryptophan from indole,pyruvate and ammonia.Proc Natl Acad Sci USA,1972,69(5)∶1086.
2 Newton WA,Morina Y,Snell E.Properties of crystalline tryptophanase.J Biol Chem,1965,240(3)∶1211.
, http://www.100md.com
3 Snell EE.Tryptophanase:structure,catalytic activities and mechanism of action.In Advances in Enzymology(A. Meister. Ed.),1975,42∶287.
4 金冬雁,黎孟枫译.分子克隆实验指南.第2版.北京:科学出版社,1995∶831.
5 Wood W,Gunsalus I,Umbreit W.Function of pyridoxal phosphate:resolution and purification of the tryptophanase enzyme of E. coli.J Biol Chem,1947,170∶313.
6 Nakazawa H,Enei H,Okumura S,et al.Synthesis of L-tryptophan from pyruvate,ammonia and indole.Agr Biol Chem,1972,36(13)∶2523.
, 百拇医药
7 Adachi O,Miles EW.A rapid method of preparing crystalline β2 subunit of tryptophan synthetase of E. coli in high yield.J Biol Chem,1974,249∶5430.
8 韦平和,吴梧桐.色氨酸生物工程研究进展.药物生物技术,1998,5(3)∶180.
9 Hamilton BK,Hsiao HY,Swann WE,et al.Manufacture of L-amino acid with bioreactors.Trends in Biotechnology,1985,3(3)∶64.
10 蔡宇阳,吴梧桐,史燕东.SHMT基因工程菌的构建及高效表达.生物工程学报,1996,12(增刊)∶28.
收稿日期:1998-10-30, 百拇医药