壳聚糖调血脂活性研究概况
作者:田德峰 王彦辉 张景英 任慧霞
单位:田德峰(山东医科大学生化制药教研室,济南 250012);王彦辉 张景英(山东省泰安市第二人民医院药剂科,泰安 271000);任慧霞(山东医科大学生化制药教研室,济南 250012)
关键词:甲壳素,壳聚糖,结构修饰,调血脂
中国海洋药物000611 摘 要 本文介绍了壳聚糖(Chitosan)调血脂方面的研究进展。壳聚糖具有一定的调血脂作用,而且经结构修饰以后其调血脂作用更强。
THE RESEARCH STATUS OF LIPID-MEDIATING ACTION OF CHITOSAN
Tian Defeng,Wang Yanhui,Zhang Jingying,Ren Huixia
, 百拇医药
(Department of Biochemical Pharmaceutics, Shandong Medical University, Jinan 250012)
ABSTRACT This article introduces the progress about study of lipid-mdeiating action of chitosan. It was found that chitosan could mediate blood lipids and modification of chitosan could improve its lipid-mediating activity in animal and human.
KEY WORDS Chitin, Chitosan, Modificaton of chitosan, Lipid-mediating
, http://www.100md.com 甲壳素是一种天然的多糖类物质,广泛存在于虾蟹等甲壳类动物的壳中,其化学名称为N-乙酰氨基葡萄多聚体。壳聚糖是甲壳素脱乙酰基而得到的可溶于酸性水溶液的聚氨基葡萄糖,其产量大,具有较好的生物相容性,基本无毒副作用。壳聚糖及其衍生物除在环保、日用化工等方面应用外,其作为调脂药物的研究日益受到人们的重视。本文就壳聚糖及其衍生物的调血脂作用的研究情况作一综述。
1 壳聚糖的调血脂及其安全性实验研究
Jean[1]等给予小鼠一般饲料的同时加服1.0%胆固醇、0.2%胆酸这些固醇食物制成高胆固醇脂模型,用来研究壳聚糖对血浆胆
固醇、肝胆固醇、肝重及胆固醇合成关键酶
——HMG-CoA还原酶活性变化的影响。在给予固醇食物的同时分别加服5.0%壳聚糖、5.0%考来烯胺(Colestyramine,又名消胆胺),结果壳聚糖使血浆胆固醇的上升降低54%、肝胆固醇的上升降低64%,而考来烯胺完全阻断了血浆胆固醇、肝胆固醇的上升;考来烯胺组小鼠HMG-CoA还原酶的活性大大提高,而固醇组和壳聚糖组HMG-CoA还原酶活性大大降低,当固醇食物中分别加2.5%、5.0%、7.5%壳聚糖,则食物中随着壳聚糖浓度的增加,降低胆固醇的能力增强,当固醇食物中含7.5%壳聚糖,连用3周,则血浆高密度脂蛋白胆固醇(HDL-C)的降低、血浆胆固醇水平的上升及肝重的增加都完全受到了抑制。摄入固醇食物的量愈大,HMG-CoA还原酶活性愈小。结果表明,即使小鼠摄入更多的固醇,只要加入7.5%壳聚糖足以维持胆固醇外源吸收和内部合成的体内平衡。
, http://www.100md.com
国内王建中[2]对11名高血脂的志愿病人作了口服壳聚糖的实验研究,每日3次,每次2~3g,结果显示,壳聚糖能明显降低血胆固醇水平,而且对血小板粘附率和红血球沉降率都有降低作用。
Jennings[3]等对燕麦胶、壳聚糖、考来烯胺的降脂作用及对肠道的形态学的影响作了比较。把50只SD大鼠随机分为5组,第1组为空白组,给予基本饲料;第2组为纤维素组,在空白组食物基础上加服1.0%胆固醇、0.2%胆酸,第3、4、5组,分别为燕麦组、壳聚糖组、考来烯胺组。它们都是在纤维素组基础上分别加服5.0%燕麦、5.0%壳聚糖、5.0%考来烯胺(这3组都不含纤维素)。结果纤维素组肝脂增加3倍,肝胆固醇浓度增加10倍,考来烯胺组、壳聚糖组、燕麦胶组都明显降低肝胆固醇,与纤维素组相比,考来烯胺组、壳聚糖组降低血浆胆固醇作用较强,燕麦胶组作用较弱。除燕麦胶降低血清铁以外,考来烯胺、壳聚糖对血红蛋白、血清铁几乎无影响。小肠及大肠的病理学形态检查,发现考来烯胺组小肠和大肠的远端粘膜增厚,而燕麦胶组和壳聚糖组无此变化。结果表明,壳聚糖具有与考来烯胺同样的降脂活性,而不会引起小肠粘膜的增厚。
, 百拇医药
Shigehiro[4]等把壳聚糖作为家畜饲料的成分长期食用以观察壳聚糖的生物安全性、消化情况及其功能。按每天每公斤体重1.4g和0.8g壳聚糖分别给予母鸡和兔连续食用239d未见到异常症状;壳聚糖大部分能被小肠内细菌分泌的壳聚糖酶生物降解;在这些动物的饲料中添加胆固醇,则动物的血浆胆固醇、甘油三酯、游离脂肪酸升高,若同时按每天每公斤体重1.2~1.4g和0.7~0.8g壳聚糖分别添加到母鸡和兔子的饲料中,则血浆胆固醇、甘油三脂、游离脂肪酸上升受到抑制。但母鸡的下蛋率和食欲降低,可能因为母鸡长期食用壳聚糖,由壳聚糖的未完全消化所引起。实验结果表明,壳聚糖作为食物成分具有生物安全性。
维生素C与壳聚糖抑制脂肪的消化吸收有协同作用[5]。如果在给予SD大鼠高脂饮食的同时持续大量给予壳聚糖和维生素C钠盐,在脂肪消化吸收受到抑制的同时,矿物质如钙离子以及脂溶性维生素E吸收受到了抑制,因此在长期服用壳聚糖和维生素C时补充一定的钙质是非常必要的,但给予葡萄糖胺单体未见到维生素E吸收受到了抑制的情况[6]。
, http://www.100md.com
载脂蛋白-E缺陷的小鼠,血清胆固醇水平偏高,易患动脉粥样硬化,因此Ormrod[7]等选择了载脂蛋白-E缺陷小鼠来研究壳聚糖与血胆固醇和动脉粥样硬化的关系,给予小鼠含5.0%壳聚糖的饮食和对照组饮食20周,在整个研究过程中壳聚糖饮食组血胆固醇水平明显降低,在第20周血胆固醇水平是对照组胆固醇水平的64%,比较2组粥样硬化斑形成情况,壳聚糖饮食组动脉粥样硬化斑的形成受到明显抑制,结果表明,壳聚糖能明显降低血中胆固醇水平,抑制由于血中胆固醇升高所导致的动脉粥样硬化的形成。
在人体中HDL-C降低是产生动脉粥样硬化的一个危险信号。HDL-C可作为卵磷脂-转脂酰基酶的底物,担负着转运胆固醇和卵磷脂的作用,因此如果HDL-C减少就会影响血浆脂蛋白清除,在临床上被认为是一个危险因子,反之HDL-C高则被认为是有利的[8]。用不含胆固醇的饲料喂养大鼠较长的时间,在饲料里添加0.5%的壳聚糖虽然不能表现出降血胆固醇的作用,但发现有较多胆固醇分布在高密度脂蛋白,而极低密度脂蛋白则较少[9]。在给予固醇饲料的小鼠血浆HDL-C/TC比对照明显降低,当给予固醇食物的同时加服壳聚糖则HDL-C/TC值上升,7.5%的壳聚糖能使HDL-C/TC几乎恢复到空白对照组水平[1]。
, 百拇医药
2 壳聚糖结构修饰物调脂活性的研究
壳聚糖是一种弱的阴离子交换剂,有一定的降血脂作用,但口服用量太大,如果要把它制成药物,必须提高它的药理作用,减小口服用量,为此Jung[10]等人做了很多的工作,他们在壳聚糖基本结构上合成了下列化合物:
并通过反相HPLC检测了这几种化合物在NaCl溶液体外结合胆酸能力,Chitosan、DEAE-Chitosan、季铵化DEAE-Chitosan和考来烯胺对甘氨胆酸钠结合能力分别为1.42、3.12、4.06和2.78mmol*g-1;NH2-Chitosan、季铵化NH2-Chitosan和考来烯胺对甘氨胆酸钠结合能力分别为1.92、2.56、2.78mmol*g-1;Chitosan、NH2-Chitosan、DMAE-Chitosan、DMAIP-Chitosan、DEAE-Chitosan对甘氨胆酸钠结合能力分别为1.42、1.92、2.35、2.68、3.12mmol*g-1,从中看出季铵化DEAE-Chitosan对胆酸的结合能力比考来烯胺增加50%,季铵化NH2-Chitosan比Chitosan增加近80%,壳聚糖衍生物对胆酸的结合能力随着6-Ο-所联的烷基碳链增长而增大。表明壳聚糖骨架上正电荷及壳聚糖6-Ο-烷基的疏水性在与胆酸的结合能力方面起着重要的作用。
, 百拇医药
DEAE Chitosan: R=(CH2)2N(CH2CH3)2
DMAE Chitosan: R=(CH2)2N(CH3)2
DMAIP Chitosan: R=CH(CH3)CH2N(CH3)2
季铵化DEAE Chitosan: R=(CH2)2N(CH2CH3)2
, 百拇医药
季铵化DMAE Chitosan: R=(CH2)2N(CH3)2
季铵化DMAIP Chitosan: R=CH(CH3)CH2N(CH3)2
季铵化NH2-Chitosan
实验证明壳聚糖经结构修饰以后成为磺化壳聚糖,能增加脂蛋白脂肪酶的活性,降低VLDL-C,升高HDL-C[11、12]。
Hirano S[13]等人用烟酰基与壳聚糖的氨基相连接合成了下列化合物,酰化度为0.88,即每个葡萄糖胺单元含0.88个烟酰基和0.12个乙酰基,使降血脂作用时间比烟酸延长了10倍。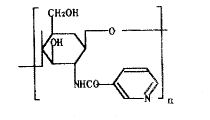
, http://www.100md.com
3 壳聚糖调脂机理的探讨
关于壳聚糖降脂作用的原理,目前尚无定论,有人认为,壳聚糖是一种弱的阴离子交换树脂[14],在肠内能与胆酸、胆固醇结合,随着粪便一起排出体外而起到降脂作用。但在服用了壳聚糖的动物粪便中查到中性固醇排出增加,并没有查到酸性固醇的排出[15]。壳聚糖也是一种粘性的多糖类纤维素,也可能有与燕麦胶、果冻等粘性纤维类似的通过胃的排空延迟而起到降脂作用的特性。为了阐明壳聚糖是否因增加胰脂肪酶的活性而起到降脂作用,Han[16]做了这样的研究,给予小鼠含卵磷脂、阿拉伯胶或Trix-100作为乳化剂的甘油三酯饮食,同时服用壳聚糖9周,用卵磷脂作乳化剂时,壳聚糖抑制甘油三酯的水解,但用阿拉伯胶或Trix-100作乳化剂时对甘油三酯无水解作用,说明壳聚糖的抑制作用位点不在胰脂肪酶而是在其底物。
Kanauchi[5]等对维生素C与壳聚糖抑制脂肪消化吸收的协同作用机理进行了探讨,壳聚糖在胃的酸性环境溶解而在肠的碱性环境形成溶胶结合脂肪,研究发现维生素C的协同作用不是依赖于维生素C的酸性而是依赖于自身的特殊性,因为维生素C钠盐同样有协同作用,协同作用的机理可能为:(1)在胃中维生素C使壳聚糖的黏度降低,这有可能使壳聚糖与脂类物质能更充分的混合。 (2)维生素C增加壳聚糖溶胶结合脂类物质的能力。(3)维生素C使壳聚糖与脂类物质结合的更牢固,在小肠中不易释出,而排除体外。
, http://www.100md.com
Kotze[17]等把N-三甲基壳聚糖氯化季铵盐(TMC)(季铵化度为12.88%)与不同的壳聚糖盐对小肠上皮细胞通透性的影响作了比较,盐酸壳聚糖、谷氨酸壳聚糖、TMC在pH6.2,浓度为0.25%时,能迅速明显的降低小肠跨膜电阻(TEER),降低值分别为84%、60%、24%;随着TMC浓度的增高,降低TEER的作用更强。在使用亲水性的放射标记物14C甘露糖和14CPEG-4000所作的跨膜转运研究中,观察到了同样的结果。盐酸壳聚糖、谷氨酸壳聚糖、TMC分别使14C甘露糖跨膜转运增加了34倍、25倍和11倍。TMC的浓度增加,两种标记物的通透性增加。由于TMC的季铵化结构,TMC的溶解性比其他壳聚糖盐好,它的高溶解性可弥补了在相同浓度情况下其作用弱的不足。在pH7.4时,TMC仍溶解,而其他壳聚糖盐是不溶的。结果表明,这些多聚物能增加大分子亲水性物质的跨膜转运,电荷、电荷密度以及壳聚糖的结构特点是影响亲水性物质吸收的重要因素。作者认为,TMC降低TEER,增加了亲水性物质的跨膜吸收,TMC也许以同样的机理,使甘油三酯、胆固醇等脂溶性物质的吸收减少,随之增加了排泄而达到调血脂作用。
, 百拇医药
影响壳聚糖调脂作用的因素也比较多,据报道3~5个葡萄糖单体的小分子壳聚糖无降低血浆胆固醇的作用[18];相对分子质量>75KD壳聚糖随相对分子质量的升高,降胆固醇的作用减弱,当相当分子质量大于750KD时几乎无降胆固醇的作用[1];Ikuo[19]等以相对分子质量50KD的壳聚糖作为原料,用酶解法降解为5~20KD的低相对分子质量的壳聚糖,同时对这些低相对分子质量的壳聚糖与50KD壳聚糖的调脂活性作了比较,结果5~20KD低分子壳聚糖干扰小鼠胆固醇的小肠吸收,增加中性固醇的粪便排泄,同时能降低甘油三酯与相对分子质量50KD壳聚糖有同样的调脂活性,表明低相对分子质量的壳聚糖也可作为降胆固醇的药物。另外粘度和脱乙酰度对脂类代谢也有影响,粘度越大脱乙酰程度越高,脂肪消化吸收越差,从粪便排除越多[20];还有碘化壳聚糖季铵盐结合胆酸的能力比氯化壳聚糖季铵盐要弱,可能因为碘离子与壳聚糖的结合能力比氯强,置换胆酸阴离子的能力比较弱[10]。
, 百拇医药
4 结束语
随着社会的进步,生活水平的改善,人平均寿命普遍提高,中国正进入一个老龄化社会,高血脂、动脉粥样硬化等心血管疾病正威胁着人类的健康,成为目前死亡率较高的原因之一。许多文献报道心脑血管系统疾病与血脂紊乱有关。因此对有调脂活性的壳聚糖这一无毒、无副作用的天然物质,进行结构修饰制成药理活性强的调血脂药物,对降低心脑血管系统疾病的发病率和死亡率,增进人类健康具有重要的意义。
参考文献
1,Jean GL, Francina G. Some effects of chitosan on liver function in the rat. Endocrinology, 1993,132(3):1078.
2,王建中.粘性甲壳素的降胆固醇作用及对血小板黏附率、红血球沉降率影响的初步观察.海洋药物杂志,1983,2(4):222.
, 百拇医药
3,Jennings CD, Boleyn K, Bridges S, et al. A comparision of the lipid-lowering and morphological of cholestyramine, chitosan, and oat gum in rats. Pro Soci Exp Bio Med,1988,189:13.
4,Shigehiro H, Chitoshi I, Haruyoshi S, et al. Chitosan as an ingredient for domestic animal feeds. J Agric Food Chem, 1990,38:1214.
5,Kanauchi O, Deuchi K, Imsato Y, et al. Mechenism for the inhibition of fat digestion by chitason and for the synergestic effect of ascorbate. Biosci Biotechnol Biochem, 1995,59(5):786.
, 百拇医药
6,Deuchi K O, Shizukuishi M, et al. Continuos and massive intake of chitosan affects mineral and fat soluble vitamin status in rats fed on a high-fat diet. Biosci Biotechnol Bicochem, 1995,59(7):1211.
7,Ormrod DJ, Holmes CC, Miller TE. Dietary chitosan inhibits hypercholesterolaemia and atherogenesis in the apolipoprotein E-deficicentmouse model of atherosclerosis. Atherosclerosis, 1998,138(2):329.
8,陈琼华.生物化学.第三版,北京:人民卫生出版社,1994,254.
, http://www.100md.com
9,Uchida K. Age-related changes in cholesterol and bile acid metablism in rats. J Lipid Res, 1978,19:544.
10,Jung KL. Soo U, Jung HK, et al. Modification of chitosan to improve its hypocholesterolemic capacity. Biosci Biotechnol Biochem, 1999,63(5):833.
11,Solov eva-MA, Gorbacheva IN, Vikhoreva GA, et al. Effects of chitosan sulfates on lipoprotein lipase activity. Vopr Med Khim, 1994,40(2):37.
, http://www.100md.com 12,Ryzhenkov VE, Solov eva-MA, Remezova OV, et al. Hypolipidemic effec of sulfated polycchsarides. Vopr Med Khim, 1996,42(2):115.
13,广兵,徐鸣夏.甲壳质衍生物与药物的偶联物研究概况.中国甲壳资源研究开发应用学术研讨会论文集(上册),1997,11:125.
14,Furda I. Aminopolysacchrides: their potential as dietary fiber. in: ACS Symposium series:unconventional properties Washington. DC: ACS Symposium Series. America Chemical Society, 1983,105.
15,Sugano M, Fujikawa T, Hiratsuji Y, et al. A novel use of chitosan as a Hypocholesterolemic agent in rats. Am J Clin Nutr,1980,33:787.
, http://www.100md.com
16,Han LK, Kimura Y, Okuda H. Reduction in fat storage during chitin-chitosan treatment in mice fed a high-fat diet. Int J Obes Relat Metab Disord, 1999,23(2):174.
17,Kotze AF, Luessen HL, De Leeuw BJ, et al. Comparison of the effect of different chitosan salts and N-trimethyl chitosan chloride on the permeability of intestinal epithelial cells (Caco-2). J Controled Release, 1998,51(1):35.
18,Sugano M, Watanabe S, Kishi A, et al. Hypocholesterolemic action of chitosan with different viscosity in rats. Lipids, 1988,23(3):187.
, 百拇医药
19,Ikuo I, Michihiro S, Katsuko Y, et al. Effects of chitosan hydrolysates on lipid absorption and on serum and liver lipid concentration in rats. J Agric Food Chem, 1993,41:431.
20,Deuchi K, Kanauchi O, Imasato Y, et al. Effect of the viscosity or deacetylation degree of chitosan on fecal fat excreted from rats fed on a high-fat diet. Applied Bioresearch Center, Kirin Brewery Co. Ltd., Gunma, Japan. Biosci Biotechnol Biochem,1995,59(5):781.
(收稿日期:2000-05-19), http://www.100md.com
单位:田德峰(山东医科大学生化制药教研室,济南 250012);王彦辉 张景英(山东省泰安市第二人民医院药剂科,泰安 271000);任慧霞(山东医科大学生化制药教研室,济南 250012)
关键词:甲壳素,壳聚糖,结构修饰,调血脂
中国海洋药物000611 摘 要 本文介绍了壳聚糖(Chitosan)调血脂方面的研究进展。壳聚糖具有一定的调血脂作用,而且经结构修饰以后其调血脂作用更强。
THE RESEARCH STATUS OF LIPID-MEDIATING ACTION OF CHITOSAN
Tian Defeng,Wang Yanhui,Zhang Jingying,Ren Huixia
, 百拇医药
(Department of Biochemical Pharmaceutics, Shandong Medical University, Jinan 250012)
ABSTRACT This article introduces the progress about study of lipid-mdeiating action of chitosan. It was found that chitosan could mediate blood lipids and modification of chitosan could improve its lipid-mediating activity in animal and human.
KEY WORDS Chitin, Chitosan, Modificaton of chitosan, Lipid-mediating
, http://www.100md.com 甲壳素是一种天然的多糖类物质,广泛存在于虾蟹等甲壳类动物的壳中,其化学名称为N-乙酰氨基葡萄多聚体。壳聚糖是甲壳素脱乙酰基而得到的可溶于酸性水溶液的聚氨基葡萄糖,其产量大,具有较好的生物相容性,基本无毒副作用。壳聚糖及其衍生物除在环保、日用化工等方面应用外,其作为调脂药物的研究日益受到人们的重视。本文就壳聚糖及其衍生物的调血脂作用的研究情况作一综述。
1 壳聚糖的调血脂及其安全性实验研究
Jean[1]等给予小鼠一般饲料的同时加服1.0%胆固醇、0.2%胆酸这些固醇食物制成高胆固醇脂模型,用来研究壳聚糖对血浆胆
固醇、肝胆固醇、肝重及胆固醇合成关键酶
——HMG-CoA还原酶活性变化的影响。在给予固醇食物的同时分别加服5.0%壳聚糖、5.0%考来烯胺(Colestyramine,又名消胆胺),结果壳聚糖使血浆胆固醇的上升降低54%、肝胆固醇的上升降低64%,而考来烯胺完全阻断了血浆胆固醇、肝胆固醇的上升;考来烯胺组小鼠HMG-CoA还原酶的活性大大提高,而固醇组和壳聚糖组HMG-CoA还原酶活性大大降低,当固醇食物中分别加2.5%、5.0%、7.5%壳聚糖,则食物中随着壳聚糖浓度的增加,降低胆固醇的能力增强,当固醇食物中含7.5%壳聚糖,连用3周,则血浆高密度脂蛋白胆固醇(HDL-C)的降低、血浆胆固醇水平的上升及肝重的增加都完全受到了抑制。摄入固醇食物的量愈大,HMG-CoA还原酶活性愈小。结果表明,即使小鼠摄入更多的固醇,只要加入7.5%壳聚糖足以维持胆固醇外源吸收和内部合成的体内平衡。
, http://www.100md.com
国内王建中[2]对11名高血脂的志愿病人作了口服壳聚糖的实验研究,每日3次,每次2~3g,结果显示,壳聚糖能明显降低血胆固醇水平,而且对血小板粘附率和红血球沉降率都有降低作用。
Jennings[3]等对燕麦胶、壳聚糖、考来烯胺的降脂作用及对肠道的形态学的影响作了比较。把50只SD大鼠随机分为5组,第1组为空白组,给予基本饲料;第2组为纤维素组,在空白组食物基础上加服1.0%胆固醇、0.2%胆酸,第3、4、5组,分别为燕麦组、壳聚糖组、考来烯胺组。它们都是在纤维素组基础上分别加服5.0%燕麦、5.0%壳聚糖、5.0%考来烯胺(这3组都不含纤维素)。结果纤维素组肝脂增加3倍,肝胆固醇浓度增加10倍,考来烯胺组、壳聚糖组、燕麦胶组都明显降低肝胆固醇,与纤维素组相比,考来烯胺组、壳聚糖组降低血浆胆固醇作用较强,燕麦胶组作用较弱。除燕麦胶降低血清铁以外,考来烯胺、壳聚糖对血红蛋白、血清铁几乎无影响。小肠及大肠的病理学形态检查,发现考来烯胺组小肠和大肠的远端粘膜增厚,而燕麦胶组和壳聚糖组无此变化。结果表明,壳聚糖具有与考来烯胺同样的降脂活性,而不会引起小肠粘膜的增厚。
, 百拇医药
Shigehiro[4]等把壳聚糖作为家畜饲料的成分长期食用以观察壳聚糖的生物安全性、消化情况及其功能。按每天每公斤体重1.4g和0.8g壳聚糖分别给予母鸡和兔连续食用239d未见到异常症状;壳聚糖大部分能被小肠内细菌分泌的壳聚糖酶生物降解;在这些动物的饲料中添加胆固醇,则动物的血浆胆固醇、甘油三酯、游离脂肪酸升高,若同时按每天每公斤体重1.2~1.4g和0.7~0.8g壳聚糖分别添加到母鸡和兔子的饲料中,则血浆胆固醇、甘油三脂、游离脂肪酸上升受到抑制。但母鸡的下蛋率和食欲降低,可能因为母鸡长期食用壳聚糖,由壳聚糖的未完全消化所引起。实验结果表明,壳聚糖作为食物成分具有生物安全性。
维生素C与壳聚糖抑制脂肪的消化吸收有协同作用[5]。如果在给予SD大鼠高脂饮食的同时持续大量给予壳聚糖和维生素C钠盐,在脂肪消化吸收受到抑制的同时,矿物质如钙离子以及脂溶性维生素E吸收受到了抑制,因此在长期服用壳聚糖和维生素C时补充一定的钙质是非常必要的,但给予葡萄糖胺单体未见到维生素E吸收受到了抑制的情况[6]。
, http://www.100md.com
载脂蛋白-E缺陷的小鼠,血清胆固醇水平偏高,易患动脉粥样硬化,因此Ormrod[7]等选择了载脂蛋白-E缺陷小鼠来研究壳聚糖与血胆固醇和动脉粥样硬化的关系,给予小鼠含5.0%壳聚糖的饮食和对照组饮食20周,在整个研究过程中壳聚糖饮食组血胆固醇水平明显降低,在第20周血胆固醇水平是对照组胆固醇水平的64%,比较2组粥样硬化斑形成情况,壳聚糖饮食组动脉粥样硬化斑的形成受到明显抑制,结果表明,壳聚糖能明显降低血中胆固醇水平,抑制由于血中胆固醇升高所导致的动脉粥样硬化的形成。
在人体中HDL-C降低是产生动脉粥样硬化的一个危险信号。HDL-C可作为卵磷脂-转脂酰基酶的底物,担负着转运胆固醇和卵磷脂的作用,因此如果HDL-C减少就会影响血浆脂蛋白清除,在临床上被认为是一个危险因子,反之HDL-C高则被认为是有利的[8]。用不含胆固醇的饲料喂养大鼠较长的时间,在饲料里添加0.5%的壳聚糖虽然不能表现出降血胆固醇的作用,但发现有较多胆固醇分布在高密度脂蛋白,而极低密度脂蛋白则较少[9]。在给予固醇饲料的小鼠血浆HDL-C/TC比对照明显降低,当给予固醇食物的同时加服壳聚糖则HDL-C/TC值上升,7.5%的壳聚糖能使HDL-C/TC几乎恢复到空白对照组水平[1]。
, 百拇医药
2 壳聚糖结构修饰物调脂活性的研究
壳聚糖是一种弱的阴离子交换剂,有一定的降血脂作用,但口服用量太大,如果要把它制成药物,必须提高它的药理作用,减小口服用量,为此Jung[10]等人做了很多的工作,他们在壳聚糖基本结构上合成了下列化合物:
并通过反相HPLC检测了这几种化合物在NaCl溶液体外结合胆酸能力,Chitosan、DEAE-Chitosan、季铵化DEAE-Chitosan和考来烯胺对甘氨胆酸钠结合能力分别为1.42、3.12、4.06和2.78mmol*g-1;NH2-Chitosan、季铵化NH2-Chitosan和考来烯胺对甘氨胆酸钠结合能力分别为1.92、2.56、2.78mmol*g-1;Chitosan、NH2-Chitosan、DMAE-Chitosan、DMAIP-Chitosan、DEAE-Chitosan对甘氨胆酸钠结合能力分别为1.42、1.92、2.35、2.68、3.12mmol*g-1,从中看出季铵化DEAE-Chitosan对胆酸的结合能力比考来烯胺增加50%,季铵化NH2-Chitosan比Chitosan增加近80%,壳聚糖衍生物对胆酸的结合能力随着6-Ο-所联的烷基碳链增长而增大。表明壳聚糖骨架上正电荷及壳聚糖6-Ο-烷基的疏水性在与胆酸的结合能力方面起着重要的作用。

, 百拇医药
DEAE Chitosan: R=(CH2)2N(CH2CH3)2
DMAE Chitosan: R=(CH2)2N(CH3)2
DMAIP Chitosan: R=CH(CH3)CH2N(CH3)2

季铵化DEAE Chitosan: R=(CH2)2N(CH2CH3)2
, 百拇医药
季铵化DMAE Chitosan: R=(CH2)2N(CH3)2
季铵化DMAIP Chitosan: R=CH(CH3)CH2N(CH3)2

季铵化NH2-Chitosan
实验证明壳聚糖经结构修饰以后成为磺化壳聚糖,能增加脂蛋白脂肪酶的活性,降低VLDL-C,升高HDL-C[11、12]。
Hirano S[13]等人用烟酰基与壳聚糖的氨基相连接合成了下列化合物,酰化度为0.88,即每个葡萄糖胺单元含0.88个烟酰基和0.12个乙酰基,使降血脂作用时间比烟酸延长了10倍。

, http://www.100md.com
3 壳聚糖调脂机理的探讨
关于壳聚糖降脂作用的原理,目前尚无定论,有人认为,壳聚糖是一种弱的阴离子交换树脂[14],在肠内能与胆酸、胆固醇结合,随着粪便一起排出体外而起到降脂作用。但在服用了壳聚糖的动物粪便中查到中性固醇排出增加,并没有查到酸性固醇的排出[15]。壳聚糖也是一种粘性的多糖类纤维素,也可能有与燕麦胶、果冻等粘性纤维类似的通过胃的排空延迟而起到降脂作用的特性。为了阐明壳聚糖是否因增加胰脂肪酶的活性而起到降脂作用,Han[16]做了这样的研究,给予小鼠含卵磷脂、阿拉伯胶或Trix-100作为乳化剂的甘油三酯饮食,同时服用壳聚糖9周,用卵磷脂作乳化剂时,壳聚糖抑制甘油三酯的水解,但用阿拉伯胶或Trix-100作乳化剂时对甘油三酯无水解作用,说明壳聚糖的抑制作用位点不在胰脂肪酶而是在其底物。
Kanauchi[5]等对维生素C与壳聚糖抑制脂肪消化吸收的协同作用机理进行了探讨,壳聚糖在胃的酸性环境溶解而在肠的碱性环境形成溶胶结合脂肪,研究发现维生素C的协同作用不是依赖于维生素C的酸性而是依赖于自身的特殊性,因为维生素C钠盐同样有协同作用,协同作用的机理可能为:(1)在胃中维生素C使壳聚糖的黏度降低,这有可能使壳聚糖与脂类物质能更充分的混合。 (2)维生素C增加壳聚糖溶胶结合脂类物质的能力。(3)维生素C使壳聚糖与脂类物质结合的更牢固,在小肠中不易释出,而排除体外。
, http://www.100md.com
Kotze[17]等把N-三甲基壳聚糖氯化季铵盐(TMC)(季铵化度为12.88%)与不同的壳聚糖盐对小肠上皮细胞通透性的影响作了比较,盐酸壳聚糖、谷氨酸壳聚糖、TMC在pH6.2,浓度为0.25%时,能迅速明显的降低小肠跨膜电阻(TEER),降低值分别为84%、60%、24%;随着TMC浓度的增高,降低TEER的作用更强。在使用亲水性的放射标记物14C甘露糖和14CPEG-4000所作的跨膜转运研究中,观察到了同样的结果。盐酸壳聚糖、谷氨酸壳聚糖、TMC分别使14C甘露糖跨膜转运增加了34倍、25倍和11倍。TMC的浓度增加,两种标记物的通透性增加。由于TMC的季铵化结构,TMC的溶解性比其他壳聚糖盐好,它的高溶解性可弥补了在相同浓度情况下其作用弱的不足。在pH7.4时,TMC仍溶解,而其他壳聚糖盐是不溶的。结果表明,这些多聚物能增加大分子亲水性物质的跨膜转运,电荷、电荷密度以及壳聚糖的结构特点是影响亲水性物质吸收的重要因素。作者认为,TMC降低TEER,增加了亲水性物质的跨膜吸收,TMC也许以同样的机理,使甘油三酯、胆固醇等脂溶性物质的吸收减少,随之增加了排泄而达到调血脂作用。
, 百拇医药
影响壳聚糖调脂作用的因素也比较多,据报道3~5个葡萄糖单体的小分子壳聚糖无降低血浆胆固醇的作用[18];相对分子质量>75KD壳聚糖随相对分子质量的升高,降胆固醇的作用减弱,当相当分子质量大于750KD时几乎无降胆固醇的作用[1];Ikuo[19]等以相对分子质量50KD的壳聚糖作为原料,用酶解法降解为5~20KD的低相对分子质量的壳聚糖,同时对这些低相对分子质量的壳聚糖与50KD壳聚糖的调脂活性作了比较,结果5~20KD低分子壳聚糖干扰小鼠胆固醇的小肠吸收,增加中性固醇的粪便排泄,同时能降低甘油三酯与相对分子质量50KD壳聚糖有同样的调脂活性,表明低相对分子质量的壳聚糖也可作为降胆固醇的药物。另外粘度和脱乙酰度对脂类代谢也有影响,粘度越大脱乙酰程度越高,脂肪消化吸收越差,从粪便排除越多[20];还有碘化壳聚糖季铵盐结合胆酸的能力比氯化壳聚糖季铵盐要弱,可能因为碘离子与壳聚糖的结合能力比氯强,置换胆酸阴离子的能力比较弱[10]。
, 百拇医药
4 结束语
随着社会的进步,生活水平的改善,人平均寿命普遍提高,中国正进入一个老龄化社会,高血脂、动脉粥样硬化等心血管疾病正威胁着人类的健康,成为目前死亡率较高的原因之一。许多文献报道心脑血管系统疾病与血脂紊乱有关。因此对有调脂活性的壳聚糖这一无毒、无副作用的天然物质,进行结构修饰制成药理活性强的调血脂药物,对降低心脑血管系统疾病的发病率和死亡率,增进人类健康具有重要的意义。
参考文献
1,Jean GL, Francina G. Some effects of chitosan on liver function in the rat. Endocrinology, 1993,132(3):1078.
2,王建中.粘性甲壳素的降胆固醇作用及对血小板黏附率、红血球沉降率影响的初步观察.海洋药物杂志,1983,2(4):222.
, 百拇医药
3,Jennings CD, Boleyn K, Bridges S, et al. A comparision of the lipid-lowering and morphological of cholestyramine, chitosan, and oat gum in rats. Pro Soci Exp Bio Med,1988,189:13.
4,Shigehiro H, Chitoshi I, Haruyoshi S, et al. Chitosan as an ingredient for domestic animal feeds. J Agric Food Chem, 1990,38:1214.
5,Kanauchi O, Deuchi K, Imsato Y, et al. Mechenism for the inhibition of fat digestion by chitason and for the synergestic effect of ascorbate. Biosci Biotechnol Biochem, 1995,59(5):786.
, 百拇医药
6,Deuchi K O, Shizukuishi M, et al. Continuos and massive intake of chitosan affects mineral and fat soluble vitamin status in rats fed on a high-fat diet. Biosci Biotechnol Bicochem, 1995,59(7):1211.
7,Ormrod DJ, Holmes CC, Miller TE. Dietary chitosan inhibits hypercholesterolaemia and atherogenesis in the apolipoprotein E-deficicentmouse model of atherosclerosis. Atherosclerosis, 1998,138(2):329.
8,陈琼华.生物化学.第三版,北京:人民卫生出版社,1994,254.
, http://www.100md.com
9,Uchida K. Age-related changes in cholesterol and bile acid metablism in rats. J Lipid Res, 1978,19:544.
10,Jung KL. Soo U, Jung HK, et al. Modification of chitosan to improve its hypocholesterolemic capacity. Biosci Biotechnol Biochem, 1999,63(5):833.
11,Solov eva-MA, Gorbacheva IN, Vikhoreva GA, et al. Effects of chitosan sulfates on lipoprotein lipase activity. Vopr Med Khim, 1994,40(2):37.
, http://www.100md.com 12,Ryzhenkov VE, Solov eva-MA, Remezova OV, et al. Hypolipidemic effec of sulfated polycchsarides. Vopr Med Khim, 1996,42(2):115.
13,广兵,徐鸣夏.甲壳质衍生物与药物的偶联物研究概况.中国甲壳资源研究开发应用学术研讨会论文集(上册),1997,11:125.
14,Furda I. Aminopolysacchrides: their potential as dietary fiber. in: ACS Symposium series:unconventional properties Washington. DC: ACS Symposium Series. America Chemical Society, 1983,105.
15,Sugano M, Fujikawa T, Hiratsuji Y, et al. A novel use of chitosan as a Hypocholesterolemic agent in rats. Am J Clin Nutr,1980,33:787.
, http://www.100md.com
16,Han LK, Kimura Y, Okuda H. Reduction in fat storage during chitin-chitosan treatment in mice fed a high-fat diet. Int J Obes Relat Metab Disord, 1999,23(2):174.
17,Kotze AF, Luessen HL, De Leeuw BJ, et al. Comparison of the effect of different chitosan salts and N-trimethyl chitosan chloride on the permeability of intestinal epithelial cells (Caco-2). J Controled Release, 1998,51(1):35.
18,Sugano M, Watanabe S, Kishi A, et al. Hypocholesterolemic action of chitosan with different viscosity in rats. Lipids, 1988,23(3):187.
, 百拇医药
19,Ikuo I, Michihiro S, Katsuko Y, et al. Effects of chitosan hydrolysates on lipid absorption and on serum and liver lipid concentration in rats. J Agric Food Chem, 1993,41:431.
20,Deuchi K, Kanauchi O, Imasato Y, et al. Effect of the viscosity or deacetylation degree of chitosan on fecal fat excreted from rats fed on a high-fat diet. Applied Bioresearch Center, Kirin Brewery Co. Ltd., Gunma, Japan. Biosci Biotechnol Biochem,1995,59(5):781.
(收稿日期:2000-05-19), http://www.100md.com