一个具有抗癌活性化合物的合成及其反应机理
作者:何菱 郑家骏
单位:何菱:华西医科大学药学院 成都 610041;郑家骏:堪萨斯大学医学中心药学系 堪城 66160
关键词:1,5-二氯-4,8-二硝基-9,10-蒽醌;1,8-双[(N,N-二甲氨乙基)氨基]-4-氯-5-氨基-9,10-蒽醌;N,N-二甲氨乙胺
华西药学杂志990402 提要 研究了1,5-二氯-4,8-二硝基-9,10-蒽醌与N,N-二甲氨乙基胺反应的两种产物产率比与反应条件的关系及其可能的反应机理,并获得了制备具抑制P388和L1210活性化合物1,8-双[(N,N-二甲氨乙基)氨基]-4-氯-5-氨基-9,10-蒽醌的有效方法。
SYNTHESIS OF AN ANTITUMOR COMPOUND AND STUDY
, 百拇医药
ON ITS REACTION MECHANISM
He Ling
(School of Pharmacy,West China University of Medical Sciences Chengdu 610041)
Cheng C.C
(Department of Pharmacology,University of Kansas Medical Center,Kansas City KS 66160 USA)
ABSTRACT In this paper, we reported relationship of yield with condition about reaction between 1,5-dichloro-4,8-dinitro-9,10-anthraquinone and N,N-dimethylaminoethylamine to give mainly 1,8-bis〔(N,N-dimethyl aminoethyl)amino〕-4-chloro-5-nitro-9,10-anthraquinone which the corresponding 5-amino compound possesses noticeable inhibitory activity against P388 and L1210.The possible reaction mechanism was suggested. Key Words 1,5-dichloro-4,8-diniro-9,10-anthraquinone 1,8-bis〔(N,N-dimethylaminoethyl)amino〕-4-chloro-5-nitro-9,10-anthraquinone 1,8-bis〔N,N-dimethylaminoethyl)amino〕-4-chloro-5-amino-9,10-anthraquinone N,N-dimethylamino ethylamine
, http://www.100md.com
研究抗癌药米托蒽醌结构修饰的同时,发现1,5-二氯-4,8-二硝基-9,10-蒽醌(1)与N,N-二甲氨乙基胺(2)反应时主要有两种产物,一种是两个氯原子被两个N,N-二甲氨乙氨基取代,得产物(3),另一个是一个氯原子和一个硝基分别被N,N-二甲氨乙氨基取代则得产物(4)。产物(4)经还原得1,8-双〔(N,N-二甲氨乙基)氨基〕-4-氯-5-氨基-9,10-蒽醌(5),经动物筛选,具较强的抑制P388和L1210活性。为此,加深对这一反应过程进行探讨,通过选择9种不同溶剂,多种温度条件下进行反应,从中找出了有效产品(5)合成的较优条件。如以1,4-二氧六环和二甲亚砜为溶剂,在(100~110)℃反应5 h所得(4),产率最高,结构经NMR,MS以及元素分析确证。并推测这一反应可能的反应历程是双分子亲核取代反应历程和自由基反应历程兼而有之的反应过程。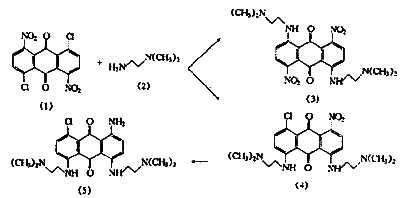
1 实验部分
, 百拇医药
1.1 1,8-双〔(N,N-二甲氨乙基)氨基〕-4-氯-5-硝基-9,10-蒽醌(4)的制备
1,5-二氯-4,8-二硝基-9,10-蒽醌(1)(27.24 mmol)被悬浮在1,4-二氧六环(55 ml)中,在室温搅拌下滴加N,N-二甲氨乙胺(2)(68.09 mmol)的1,4-二氧六环(5 ml)溶液,5 min内滴完,之后于(100~110)℃搅伴5 h。当反应混合物冷至室温时加入50 ml的丙酮,过滤,滤渣用丙酮(20 ml×4)洗涤后,合并滤液,经减压浓缩得粗品(4),以无水乙醇重结晶得紫色晶体(4),收率40%。滤渣用乙酸乙酯洗涤(30 ml×4),洗液在减压下去除溶剂得粉红色晶体(3),收率25%。
化合物(4) mp(214~215)℃,MS(m/z):460(M+)。元素分析(理论值/实测值)%:C 57.45/
57.57,H 5.70/5.50,N 15.23/15.00。1H NMR(CDCl3)δ:9.96(1H,NH-phCl),9.56(1H,NH-phNO2),7.78(d,1H,H-7,J=9.2Hz),7.43(d,1H,H-2,J=9.2Hz),6.90(d,1H,H-3,J=
, 百拇医药
9.2Hz),6.77(d,1H,H-6,J=9.2Hz),3.36(m,4H,NHCH2),2.65,(m,4H,NHCH2CH2N),2.35(S,12H,N
(CH3)2)。 13C NMR(CDCl3)δ:186.4(C-9),184.2(C-10),152.0(C-8),149.6(C-4),137.6
(C-2),136.9(C-5),134.0(C-14),132.3(C-11),130.3(C-7),119.5(C-1),117.9(C-3),114.2(C-12),113.7(C-6),113.6(C-13),57.7,57.4(C-16,20),45.5,45.4(C-17,18,21,22),41.2,41.0(C-15,19)。1H-1HCOSY cross peaks 7.78~6.77,7.43~6.90,9.96~
, 百拇医药
3.36,9.56~3.36,3.36~2.65。
化合物(3) mp(127~130)℃;MS(m/z):471(M+)。1H NMR(CDCl3)δ:9.55(m,2H,NH-phNO2),7.47(d,2H,H-2,H-6,J=9.56),6.91(d,2H,H-3,H-7,J=9.46),3.45(m,4H,NHCH2),2.65
(m,4H,NHCH2CH2N),2.35(S,12H,-N(CH3)2)。
1.2 1,8-双〔(N,N-二甲氨乙基)氨基〕-4-氯-5-氨基-9,10-蒽醌(5)的制备
, 百拇医药
1,8-双〔(N,N-二甲氨乙基)氨基〕-4-氯-5-硝基-9,10-蒽醌(4)(2 mmol)与二氯化锡(10 mmol)及40 ml无水乙醇的混合物被加热至60℃并搅拌1 h,硼氢化钠(5 mmol)的无水乙醇(10 ml)溶液被滴入反应混合物中,并于(60~70)℃搅拌反应1.5 h,放置过夜。过滤,滤渣分别用乙醇,石油醚洗涤后,被溶于80 ml (3 mol)盐酸及40 ml水中,过滤,滤液用氢氧化铵中和至pH 7.5,以氯仿提取(100 ml×1,50 ml×2),合并提取液,并用水洗条(50 ml×3),以无水硫酸钠干燥后,减压除去溶剂得0.8 g化合物(5),收率93%。mp(158~160)℃。元素分析(理论值/实测值)%:C 61.46/61.38,H 6.56/6.88,N 16.29/16.50。
2 结果与讨论
2.1 两种反应过程中,亲核取代反应历程的结果产物以(3)为主[1]。
, 百拇医药
负碳离子(Ⅰ)的形成,主要决定反应的总速率,当带有未用电子对的氨基物向对氯硝基蒽醌(1)作亲核进攻时,所形成的中间体负离子不仅仅是环上碳带负电荷的结构的杂化体(6),而且也是-NO2基中氧带负电荷的杂化体(7),由于氧的电负性很强,易于容纳负电荷,从而使负电荷得以更大的分散,使中间体更加稳定,故由-NO2基参加的共轭作用加强了仅仅由诱导效应所引起的亲核取代反应的活化作用。中间体(6),(7)形成之后,:Cl-很快离去而形成最终产物(3)。
自由基反应历程参予的结果产物以(4)为主。
由于反应产物的颜色很深,所以很难通过确证HNO2的存在来确定反应历程的可能性。因离去基的稳定性顺序是 即离去能力的顺序是F>NO2>OTs>SOph>Cl,Br,I[1,3],基于此,该反应过程还是可能的。
即离去能力的顺序是F>NO2>OTs>SOph>Cl,Br,I[1,3],基于此,该反应过程还是可能的。
, 百拇医药
2.2 在中间体(11)中,4位由于1位已有侧链,而使得(14)的进攻有一定的空间位阻;同时,由于5位氯原子除了与苯环具有Pπ共轭效应外,还存在诱导效应,因此,8位较4位易于断裂而形成自由基,故主要获得化合物(4)。
2.3 蒽醌分子中,由于两个吸电子羰基的存在使得相邻的两个苯环钝化[3],除了增强亲核取代反应的可能性外,同时,使得α位C-N键变得较脆弱,易受外界因素的影响而断裂。当选用对硝基氯苯作为原料,在同等条件下进行反应,却未能得到ClC6H4NH(CH2)2NMe2或C6H4[NH(CH2)2NMe2],而只得到D2NC6H4NH(CH2)2NMe2,说明这一反应过程的实施,与蒽醌分子的特定结构密切相关。
, 百拇医药
2.4 化合物(10)中,要断裂C-N键所需活化能比断裂C-Cl键所需活化能高,因此,提高反应温度将有利于C-N断裂。
总之,非极性溶剂或介质中或高温有利于自由基反应历程,所得产物(4)比率较大(表1中带*的一项)。极性溶剂或介质,较低温度或自由基抑制剂溶剂则有利于亲核反应,产物(3)的比率则较大(表1中其它条件)。温度增高除引发均裂反应外,也增高进攻自由基的活性[4],减小极性效应的影响,但某些条件下,溶剂效应不可忽视[3,4]。如在吡啶中反应时,缺电子的自由基易接受C5H5N∶中的电子而被溶剂化,从而降低自由基的活性。因此,产物(3)的比率比其它条件下为大;当加入碱和溴化亚铜时,有利于产物(3)的形成[1]。
Table 1 The ratio of product under various conditions Sol.
, http://www.100md.com
T
(℃)
t
(h)
Outcome(ratio of
yield)(3)∶(4)
Dioxane
R.T
5
2∶1
50~60
5
3∶1
, http://www.100md.com
100~110
5
1∶2*
Xylene
reflux
5
3∶1
Ethyl acetate
R.T
5
2∶1
Pyridine
130~140
, http://www.100md.com
5
4∶1
Acetonitrile
R.T
5
2∶1
DMSO
50~60
5
3∶1
R.T
5
1∶1
, 百拇医药
THF(CuBr)
100~110
5
1∶2*
100~110
5
2∶1
Dioxane(K2CO3)
80
5
2.5∶1
DMAC(CuBr/AcONa)
, 百拇医药
80~90
5
1∶1
碱B可除去中间体(6)中的一个质子,产生其共轭碱(15)和BH+,紧接着BH+催化(15)中Cl的离去,这一步是决定反应速率的步骤。
参考文献
1 Jerry March. Advanced organic chemistry. Second Edition. 1977.584,586,620,630,594
2 Morrison RT, Boyd RN,Organic chemistry. Fourth edition, 1983,59
3 张铸勇,祁国珍,庄莆.精细有机合成单元反应.上海:华东化工学院出版社,1993.54
4 李正化,龚康孙,金初 .有机药物合成原理.北京:人民卫生出版社,1985.736, 百拇医药
单位:何菱:华西医科大学药学院 成都 610041;郑家骏:堪萨斯大学医学中心药学系 堪城 66160
关键词:1,5-二氯-4,8-二硝基-9,10-蒽醌;1,8-双[(N,N-二甲氨乙基)氨基]-4-氯-5-氨基-9,10-蒽醌;N,N-二甲氨乙胺
华西药学杂志990402 提要 研究了1,5-二氯-4,8-二硝基-9,10-蒽醌与N,N-二甲氨乙基胺反应的两种产物产率比与反应条件的关系及其可能的反应机理,并获得了制备具抑制P388和L1210活性化合物1,8-双[(N,N-二甲氨乙基)氨基]-4-氯-5-氨基-9,10-蒽醌的有效方法。
SYNTHESIS OF AN ANTITUMOR COMPOUND AND STUDY
, 百拇医药
ON ITS REACTION MECHANISM
He Ling
(School of Pharmacy,West China University of Medical Sciences Chengdu 610041)
Cheng C.C
(Department of Pharmacology,University of Kansas Medical Center,Kansas City KS 66160 USA)
ABSTRACT In this paper, we reported relationship of yield with condition about reaction between 1,5-dichloro-4,8-dinitro-9,10-anthraquinone and N,N-dimethylaminoethylamine to give mainly 1,8-bis〔(N,N-dimethyl aminoethyl)amino〕-4-chloro-5-nitro-9,10-anthraquinone which the corresponding 5-amino compound possesses noticeable inhibitory activity against P388 and L1210.The possible reaction mechanism was suggested. Key Words 1,5-dichloro-4,8-diniro-9,10-anthraquinone 1,8-bis〔(N,N-dimethylaminoethyl)amino〕-4-chloro-5-nitro-9,10-anthraquinone 1,8-bis〔N,N-dimethylaminoethyl)amino〕-4-chloro-5-amino-9,10-anthraquinone N,N-dimethylamino ethylamine
, http://www.100md.com
研究抗癌药米托蒽醌结构修饰的同时,发现1,5-二氯-4,8-二硝基-9,10-蒽醌(1)与N,N-二甲氨乙基胺(2)反应时主要有两种产物,一种是两个氯原子被两个N,N-二甲氨乙氨基取代,得产物(3),另一个是一个氯原子和一个硝基分别被N,N-二甲氨乙氨基取代则得产物(4)。产物(4)经还原得1,8-双〔(N,N-二甲氨乙基)氨基〕-4-氯-5-氨基-9,10-蒽醌(5),经动物筛选,具较强的抑制P388和L1210活性。为此,加深对这一反应过程进行探讨,通过选择9种不同溶剂,多种温度条件下进行反应,从中找出了有效产品(5)合成的较优条件。如以1,4-二氧六环和二甲亚砜为溶剂,在(100~110)℃反应5 h所得(4),产率最高,结构经NMR,MS以及元素分析确证。并推测这一反应可能的反应历程是双分子亲核取代反应历程和自由基反应历程兼而有之的反应过程。

1 实验部分
, 百拇医药
1.1 1,8-双〔(N,N-二甲氨乙基)氨基〕-4-氯-5-硝基-9,10-蒽醌(4)的制备
1,5-二氯-4,8-二硝基-9,10-蒽醌(1)(27.24 mmol)被悬浮在1,4-二氧六环(55 ml)中,在室温搅拌下滴加N,N-二甲氨乙胺(2)(68.09 mmol)的1,4-二氧六环(5 ml)溶液,5 min内滴完,之后于(100~110)℃搅伴5 h。当反应混合物冷至室温时加入50 ml的丙酮,过滤,滤渣用丙酮(20 ml×4)洗涤后,合并滤液,经减压浓缩得粗品(4),以无水乙醇重结晶得紫色晶体(4),收率40%。滤渣用乙酸乙酯洗涤(30 ml×4),洗液在减压下去除溶剂得粉红色晶体(3),收率25%。
化合物(4) mp(214~215)℃,MS(m/z):460(M+)。元素分析(理论值/实测值)%:C 57.45/
57.57,H 5.70/5.50,N 15.23/15.00。1H NMR(CDCl3)δ:9.96(1H,NH-phCl),9.56(1H,NH-phNO2),7.78(d,1H,H-7,J=9.2Hz),7.43(d,1H,H-2,J=9.2Hz),6.90(d,1H,H-3,J=
, 百拇医药
9.2Hz),6.77(d,1H,H-6,J=9.2Hz),3.36(m,4H,NHCH2),2.65,(m,4H,NHCH2CH2N),2.35(S,12H,N
(CH3)2)。 13C NMR(CDCl3)δ:186.4(C-9),184.2(C-10),152.0(C-8),149.6(C-4),137.6
(C-2),136.9(C-5),134.0(C-14),132.3(C-11),130.3(C-7),119.5(C-1),117.9(C-3),114.2(C-12),113.7(C-6),113.6(C-13),57.7,57.4(C-16,20),45.5,45.4(C-17,18,21,22),41.2,41.0(C-15,19)。1H-1HCOSY cross peaks 7.78~6.77,7.43~6.90,9.96~
, 百拇医药
3.36,9.56~3.36,3.36~2.65。
化合物(3) mp(127~130)℃;MS(m/z):471(M+)。1H NMR(CDCl3)δ:9.55(m,2H,NH-phNO2),7.47(d,2H,H-2,H-6,J=9.56),6.91(d,2H,H-3,H-7,J=9.46),3.45(m,4H,NHCH2),2.65
(m,4H,NHCH2CH2N),2.35(S,12H,-N(CH3)2)。

1.2 1,8-双〔(N,N-二甲氨乙基)氨基〕-4-氯-5-氨基-9,10-蒽醌(5)的制备
, 百拇医药
1,8-双〔(N,N-二甲氨乙基)氨基〕-4-氯-5-硝基-9,10-蒽醌(4)(2 mmol)与二氯化锡(10 mmol)及40 ml无水乙醇的混合物被加热至60℃并搅拌1 h,硼氢化钠(5 mmol)的无水乙醇(10 ml)溶液被滴入反应混合物中,并于(60~70)℃搅拌反应1.5 h,放置过夜。过滤,滤渣分别用乙醇,石油醚洗涤后,被溶于80 ml (3 mol)盐酸及40 ml水中,过滤,滤液用氢氧化铵中和至pH 7.5,以氯仿提取(100 ml×1,50 ml×2),合并提取液,并用水洗条(50 ml×3),以无水硫酸钠干燥后,减压除去溶剂得0.8 g化合物(5),收率93%。mp(158~160)℃。元素分析(理论值/实测值)%:C 61.46/61.38,H 6.56/6.88,N 16.29/16.50。
2 结果与讨论
2.1 两种反应过程中,亲核取代反应历程的结果产物以(3)为主[1]。

, 百拇医药
负碳离子(Ⅰ)的形成,主要决定反应的总速率,当带有未用电子对的氨基物向对氯硝基蒽醌(1)作亲核进攻时,所形成的中间体负离子不仅仅是环上碳带负电荷的结构的杂化体(6),而且也是-NO2基中氧带负电荷的杂化体(7),由于氧的电负性很强,易于容纳负电荷,从而使负电荷得以更大的分散,使中间体更加稳定,故由-NO2基参加的共轭作用加强了仅仅由诱导效应所引起的亲核取代反应的活化作用。中间体(6),(7)形成之后,:Cl-很快离去而形成最终产物(3)。
自由基反应历程参予的结果产物以(4)为主。
由于反应产物的颜色很深,所以很难通过确证HNO2的存在来确定反应历程的可能性。因离去基的稳定性顺序是
 即离去能力的顺序是F>NO2>OTs>SOph>Cl,Br,I[1,3],基于此,该反应过程还是可能的。
即离去能力的顺序是F>NO2>OTs>SOph>Cl,Br,I[1,3],基于此,该反应过程还是可能的。
, 百拇医药
2.2 在中间体(11)中,4位由于1位已有侧链,而使得(14)的进攻有一定的空间位阻;同时,由于5位氯原子除了与苯环具有Pπ共轭效应外,还存在诱导效应,因此,8位较4位易于断裂而形成自由基,故主要获得化合物(4)。
2.3 蒽醌分子中,由于两个吸电子羰基的存在使得相邻的两个苯环钝化[3],除了增强亲核取代反应的可能性外,同时,使得α位C-N键变得较脆弱,易受外界因素的影响而断裂。当选用对硝基氯苯作为原料,在同等条件下进行反应,却未能得到ClC6H4NH(CH2)2NMe2或C6H4[NH(CH2)2NMe2],而只得到D2NC6H4NH(CH2)2NMe2,说明这一反应过程的实施,与蒽醌分子的特定结构密切相关。
, 百拇医药
2.4 化合物(10)中,要断裂C-N键所需活化能比断裂C-Cl键所需活化能高,因此,提高反应温度将有利于C-N断裂。
总之,非极性溶剂或介质中或高温有利于自由基反应历程,所得产物(4)比率较大(表1中带*的一项)。极性溶剂或介质,较低温度或自由基抑制剂溶剂则有利于亲核反应,产物(3)的比率则较大(表1中其它条件)。温度增高除引发均裂反应外,也增高进攻自由基的活性[4],减小极性效应的影响,但某些条件下,溶剂效应不可忽视[3,4]。如在吡啶中反应时,缺电子的自由基易接受C5H5N∶中的电子而被溶剂化,从而降低自由基的活性。因此,产物(3)的比率比其它条件下为大;当加入碱和溴化亚铜时,有利于产物(3)的形成[1]。

Table 1 The ratio of product under various conditions Sol.
, http://www.100md.com
T
(℃)
t
(h)
Outcome(ratio of
yield)(3)∶(4)
Dioxane
R.T
5
2∶1
50~60
5
3∶1
, http://www.100md.com
100~110
5
1∶2*
Xylene
reflux
5
3∶1
Ethyl acetate
R.T
5
2∶1
Pyridine
130~140
, http://www.100md.com
5
4∶1
Acetonitrile
R.T
5
2∶1
DMSO
50~60
5
3∶1
R.T
5
1∶1
, 百拇医药
THF(CuBr)
100~110
5
1∶2*
100~110
5
2∶1
Dioxane(K2CO3)
80
5
2.5∶1
DMAC(CuBr/AcONa)
, 百拇医药
80~90
5
1∶1
碱B可除去中间体(6)中的一个质子,产生其共轭碱(15)和BH+,紧接着BH+催化(15)中Cl的离去,这一步是决定反应速率的步骤。
参考文献
1 Jerry March. Advanced organic chemistry. Second Edition. 1977.584,586,620,630,594
2 Morrison RT, Boyd RN,Organic chemistry. Fourth edition, 1983,59
3 张铸勇,祁国珍,庄莆.精细有机合成单元反应.上海:华东化工学院出版社,1993.54
4 李正化,龚康孙,金初 .有机药物合成原理.北京:人民卫生出版社,1985.736, 百拇医药