胰高血糖素基因的合成、克隆与融合表达
作者:丁 敏 刘景晶 王朝晖 陈正兰
单位:中国药科大学生化教研室,南京210009
关键词:胰高血糖素;基因合成;克隆;融合表达
摘 要 选用E 摘 要 选用E.coli偏爱的密码子,用计算机辅助设计合成了四段寡核苷酸序列,通过二步PCR法构建胰高血糖素基因,总长124bp,并直接克隆在pUC18质粒中。序列分析证实合成与克隆的胰高血糖素基因序列与设计完全相符。将该基因引入质粒pKA,使胰高血糖素连在AnsB的C端,实现融合表达。用ELISA和SPR分别检测表达产物。
Synthesis,Cloning and Fusion Expression of Glucagon Gene
Ding Min Liu Jingjing, Wang Zhaohui, Chen Zhenglan
, 百拇医药
(Department of Biochemistry,China Pharmaceutical University,Nanjing 210009)
Abstract Computer programming was applied to the design of optimized Segments for the synthesis of the Glucagon gene using preferred codon for expression in E.Coli.Four segments were synthesized.After two PCR procedures,the entire geneconsisting of 124 base pairs was constructed,then cloned into plasmid vector pUC18.The DNA sequence of the cloned Glucagon gene was confirmed identical with the designed DNA sequence by auto-sequencing analysis.
, http://www.100md.com
The glucagon gene was inserted into plasmid vector pKA which contains L-AspsⅡ gene,and the fusion gene was expressed under the control of promotor trc.The fusion protein had been proved by enzyme labeled immunosorbent assay(ELISA) and surface plasmon resonance(SPR).
Key words Glucagon,Gene Cloning,Gene synthesis,Fusion expression
胰高血糖素(Glucagon)是胰岛α-细胞分泌的多肽激素,主要作用于肝脏,促进肝糖元分解,抑制肝糖元合成,促进葡萄糖异生、分解,间接促进脂肪分解,同时也是氨基酸调节的关键激素[1,2]。
, http://www.100md.com
临床上,胰高血糖素是一种疗效确切的低血糖休克急救药[3],也可以提高对胃肠进行X-射线检查的效果[4]。另外,对治疗某些中毒性心律不齐、深度心肌衰竭及分娩性高血压也有疗效[5]。Novo-Nordisk公司已上市该药[6],我国目前尚不能生产。国外曾有胰高血糖素与INF-γ进行融合表达的报道,每升发酵液可获得12mg重组胰高血糖素[7]。
本工作利用PCR技术合成Glucagon(1~29)全序列,并克隆至载体pUC18中,筛出正确的阳性转化子,并将目的基因引入质粒pKA使其在trc启动子下与AnsB基因实现融合表达。
1 材 料
1.1 质粒与菌株
pUC18购自华美生物工程公司;pKA为本室构建的含ansB基因的质粒[7];E.coli JM105为本实验室保藏菌。
, http://www.100md.com
1.2 DNA化学合成
此工作于中科院上海植生所Beckman oligo-1000DNA合成仪上完成,序列见图1。
1.3 酶与其他试剂
限制酶kpnⅠ、HindⅢ及T4DNA ligase购自promega公司;Taq酶、dNTP、x-gal、IPTG购自华美公司;Rb a Hu Glucagon购自DAKO;羊抗兔酶标二抗为南京农业大学惠赠;丙烯酰胺、N,N′-甲叉双丙烯酰胺购自Sigma公司;Tryptone及Yeast Extract购自Oxiod公司;LB培养基及其他buffer均按《分子克隆》的方法配制。
2 方 法
2.1 基因设计
以天然Glucagon的氨基酸序列为基础对氨基酸序列作以下补充。
, http://www.100md.com
在编码框架的5′端和3′端分别设置KpnⅠ-EcoRV,HindⅢ酶切位点,便于合成基因酶切后直接克隆到载体质粒中。在5′端KpnⅠ-EcoRV酶切位点和Glucagon(1~29)基因之间设计一个酸水解序列(Asp-pro)以及随后的二肽酶识别序列(pro-pro)对应的密码子,便于目的肽段的融合表达和加工。
根据模板、引物各自的设计要求用计算机检索以确定基因序列,将目的基因分成大小分别为38、54、50、49个碱基的四个寡核苷酸片段,分别进行化学合成,即序列D1、D2、D3、D4,见图1。
Fig 1 Designed sequence of the Glucagon gene and its corresponding
, http://www.100md.com
D1,D2,D3,D4 sequence
2.2 用PCR合成glucagon基因
PCR在GL applied research inc.产GTC-2型扩增仪上进行。第一轮PCRD1、D2、D3浓度比为10∶1∶10,共10个循环;第二轮PCR以第一轮PCR产物为模板,D1、D4为引物,共20个循环,过程如图2所示。两轮PCR操作程序均为94℃30″;50℃60″;72℃90″。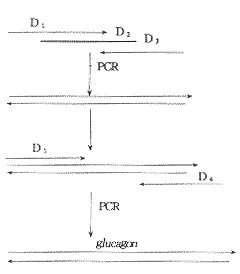
Fig 2 Schematic presentation of glucagon gene PCR synthesis
, 百拇医药
2.3 Glucagon基因的克隆
PCR反应产物和pUC18均用kpnI、HindⅢ双酶切后回收,在T4DNAligase反应体系中14℃连接过夜,转化E.coliJM105感受态细胞,涂布含100μg/mlAmp、40μg/mlx-gal和IPTG的LB平板,37℃培养不超过16h,挑取白色菌落。筛选含重组质粒pUG的阳性转化子,常规操作见《分子克隆》。
2.4 目的基因克隆至载体pKA。
KpnⅠ和HindⅢ双酶消化质粒pUG和pKA,并相应的用1.2%和0.6%的Agrose回收pUG的小片段和pKA的大片段,纯化后将以上两片段等摩尔混合,连接后转化感受态E.coliJM105并涂布带Amp抗性的平板。获取若干单克隆后,筛选出含重组载体pKAG1的阳性转化子,用EcoRV、KpnⅠ双酶消化pKAG1质粒,同时用ScaⅠ和KpnⅠ双酶消化pKA质粒,并用0.6%Agrose电泳回收大片段和小片段,纯化后将两片段等mol混合,连接后转化JM105,用含Amp的LB平板培养,筛选出含重组质粒pKAG2的阳性转化子(图3)。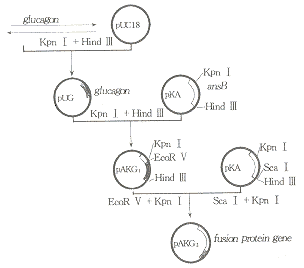
, 百拇医药
Fig 3 Construction of fusion expression plasmid pKAG2 for glucagon gene
2.5 AnsB-Glucagon基因的融合表达
接种转化了表达质粒pKAG2的工程菌于40mlLB培养基(氨苄青霉素100μg/ml)37℃,180r/min,培养至A600约为0.6时,加入IPTG至终浓度为0.1mmol/L,诱导表达2h。
2.6 SDS-PAGE
在含0.1%SDS的Laemmli不连续缓冲系统中进行。
2.7 表达产物的酶联免疫吸附实验[8]:
, 百拇医药
所用抗体为RbaHuGlucagon,二抗以辣根过氧化物酶为标记物,预处理后的工程菌发酵液直接包被微孔酶标检测板。
2.8 Glucagon的SPR检测
利用化学自组装技术,在金膜表面制备胰高组糖素的免疫敏感膜,并用SPR对溶液中不同浓度的胰高血糖素的响应作研究[9]。
3 结 果
3.1 用PCR合成Glucagon基因
图4为二步PCR扩增的结果,由此可见扩增片段大小分别为99bp和124bp与设计的基因大小相同。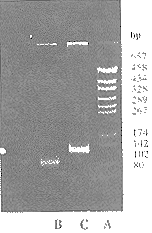
, 百拇医药
ApGEM-7zf(+)/Hae ⅢMarker
B PCR product of the first procedure
C PCR product of the second procedure
Fig 4. PCR products of the first and second procedure analyzed on a 12% polyacrylamide gel electrophoresis
3.2 克隆质粒分析
3.2.1 PCR法 pUC18两条普适引物P1、P2各100pmol,以纯化的重组质粒pUG作模板在50μl体系中作常规PCR操作,PAGE可见216bp条带(图5)。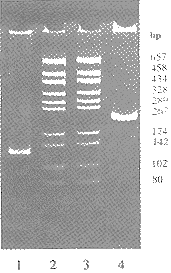
, 百拇医药
1.Fragment digested by kpnⅠ+HindⅢ
2.3. pGEM-7zf(+)/HaeⅢ DNA m arker
4. PCR product using P1,P2 as primers
Fig 5. Electrophoretic identification of pUG by
PCR and restriction enzyme digestion
3.2.2 限制酶分析 用KpnⅠ、HindⅢ双酶消化重组质粒,PAGE,EB染色后可见119bp条带(图5)。
3.2.3 DNA序列分析 此工作在ABI377PRISM DNA自动测序仪上完成,结果见图6。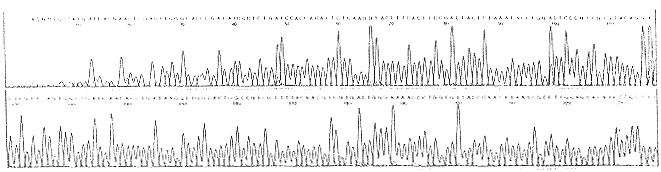
, 百拇医药
Fig 6. Sequencing result of glucagon gene cloned in to pUC18.
3.3 Glucagon基因融合表达质粒的构建
携带了目的基因的重组质粒pKAG2经限制性内切酶KpnⅠ、HindⅢ酶切处理,得到了4738bp和832bp两个片段;同时因在构建的pKAG2质粒中,既保留了pKA的trc启动子,又引入了来自pUG的目的基因片段,故可以采用与trc启动子互补的上游引物P1以及与目的基因互补的下游引物D8,对重组载体进行常规PCR反应,电泳可见1194bp的条带(图7)。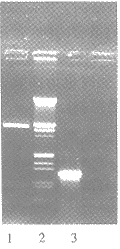
, http://www.100md.com
1. Fragments digested by KpnI+Hind Ⅲ
2. λDNA/EcoRI+Hind Ⅲ marker
3. PCR products using P1、D8 as primers
Fig 7. The restriction enzymes analysis and PCR analysis of pKAG2
3.4 表达产物的电泳分析
表达菌体全蛋白反复冻融后进行电泳分析,用JM105菌体全蛋白和pKA质粒的表达产物ansB作对照,电泳结果如图8。ansBMr约35000,由质粒pKAG2表达的ansB-Glucagon融合蛋白分子质量较ansB大,对照MrMarker约为38000,与理论值相同,融合蛋白表达量占菌体总蛋白的15%,其中胰高血糖素占融合蛋白表达量的1/10。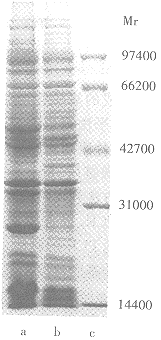
, http://www.100md.com
a. JM105 b. JM105 transformed with pKAG2
c. Protein marker
Fig 8. SDS-PAGE of total proteins of E.coli JM105
3.5 表达产物的酶联免疫吸附实验
以pKA质粒的表达产物作阴性对照,以Rb a Hu Glucagon直接包被微孔板作阳性对照,结果显示了pKAG2的表达产物中Glucagon蛋白抗原的存在。
3.6 表达产物的SPR检测[9]
XPS、AES及SPR图谱可见金膜上已经有序地组装上了半胱胺/戊二醛/免疫人Glucagon抗体,并且对溶液中的人胰高血糖素进行识别。溶液中的Glucagon浓度随SPR共振角最大变化速率成正比。见图9。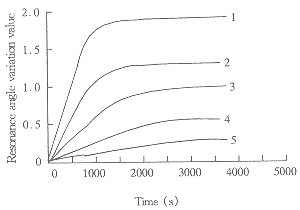
, http://www.100md.com
A:SPR dynamic detection curve of different concentration
glucagon fusion protein
Concentration 1:4320,2:2880,3:1440,4:432,5:144nmol/L
B:the curve of SPR resonance angle variation ratio to
glucagon fusion protein conce ntration
, 百拇医药 Concentration 1:4320,2:2880,3:1440,4:432,5:144nmol/L
Fig 9. The curve of SPR signal vs the concentration of glucagon
4 讨 论
由于化学合成的寡核苷酸长度有限,常规的klenow酶补平法难以合成较长的目的片段,而寡核苷酸片段两两退火后的连接法,对合成的寡核苷酸链质、量及操作有较高要求。本文所用的方法利用三段寡核苷酸进行一轮10个循环PCR,以合成延长的寡核苷酸片段作为第二轮PCR的模板,最终可合成长达数百个碱基的基因片段。整个克隆方案快捷、方便、经济。
胰高血糖素为29肽,在宿主细胞内表达很易被降解。我们在实现用大肠杆菌高效表达天冬酰胺酶的基础上,将胰高血糖素与天冬酰胺酶基因连接后进行融合表达,因在Glucagon的N端设计了酸敏感位点(Asp-Pro)和二肽酶识别序列(Pro-Pro-),表达得到的融合蛋白经酸和酶特异性切割后,即可获得天然的Glucagon激素多肽。在该方案中经实验证明,由于在融合蛋白中天冬酰胺酶占较大比例,且完整,故酶活依然存在,可用快速测定酶活的方法跟踪表达概况和决定提纯过程中的取舍,并为参用较成熟的天冬酰胺酶分离纯化方案进行融合蛋白提取研究提供了可能,同时也为高效表达类似的短肽提供了成功的范例。
, 百拇医药
*江苏省自然科学基金和国家自然科学基金资助,项目编号分别为:BK95092309、39870175。联系人:刘景晶
参考文献
1 Pharma Projects.1995,16
2 Schonfeld JV, Muller MK.The islet-acinar axis of the pancreas:Is there a ro le for glucagon or a glucagon-like peptide?Experientia(Basel),1994,50(5):44 2
3 USP Dictionary of USAN and international Drug Names.1995
4 British Approved Names.1990
, 百拇医药
5 Drug information for the health care professional.1989
6 Scrip.1993,1884:28
7 Ishizakie etal.Production of recombinant human glucagon in the form of a fus ion protein in Escherichia coli,Recovery of glucagon by sequence-specific digestion.Appl Microbial Biotechnol,1992,36:483
8 杨利国,胡少昶,魏平华,等.酶免疫测定技术,南京大学出版社,1998年,506
9 钟文英,顾建华,丁敏等.胰高血糖素敏感膜的组装及SPR检测.江苏医药,1998,24( 增刊)
10 Hermann Gram. A Novel Approach for High Level Production of a Recombina nt Human Parathyroid Hormone Fragment in Escherichia Coli.Bio/technology ,1994,12(10):1017
11 刘景晶,李晶,吴梧桐,等.大肠杆菌L-天门冬酰胺酶Ⅱ基因的高效表达.中国 药科大学学报,1996;27(11):696.
收稿日期:1998-11-20, http://www.100md.com
单位:中国药科大学生化教研室,南京210009
关键词:胰高血糖素;基因合成;克隆;融合表达
摘 要 选用E 摘 要 选用E.coli偏爱的密码子,用计算机辅助设计合成了四段寡核苷酸序列,通过二步PCR法构建胰高血糖素基因,总长124bp,并直接克隆在pUC18质粒中。序列分析证实合成与克隆的胰高血糖素基因序列与设计完全相符。将该基因引入质粒pKA,使胰高血糖素连在AnsB的C端,实现融合表达。用ELISA和SPR分别检测表达产物。
Synthesis,Cloning and Fusion Expression of Glucagon Gene
Ding Min Liu Jingjing, Wang Zhaohui, Chen Zhenglan
, 百拇医药
(Department of Biochemistry,China Pharmaceutical University,Nanjing 210009)
Abstract Computer programming was applied to the design of optimized Segments for the synthesis of the Glucagon gene using preferred codon for expression in E.Coli.Four segments were synthesized.After two PCR procedures,the entire geneconsisting of 124 base pairs was constructed,then cloned into plasmid vector pUC18.The DNA sequence of the cloned Glucagon gene was confirmed identical with the designed DNA sequence by auto-sequencing analysis.
, http://www.100md.com
The glucagon gene was inserted into plasmid vector pKA which contains L-AspsⅡ gene,and the fusion gene was expressed under the control of promotor trc.The fusion protein had been proved by enzyme labeled immunosorbent assay(ELISA) and surface plasmon resonance(SPR).
Key words Glucagon,Gene Cloning,Gene synthesis,Fusion expression
胰高血糖素(Glucagon)是胰岛α-细胞分泌的多肽激素,主要作用于肝脏,促进肝糖元分解,抑制肝糖元合成,促进葡萄糖异生、分解,间接促进脂肪分解,同时也是氨基酸调节的关键激素[1,2]。
, http://www.100md.com
临床上,胰高血糖素是一种疗效确切的低血糖休克急救药[3],也可以提高对胃肠进行X-射线检查的效果[4]。另外,对治疗某些中毒性心律不齐、深度心肌衰竭及分娩性高血压也有疗效[5]。Novo-Nordisk公司已上市该药[6],我国目前尚不能生产。国外曾有胰高血糖素与INF-γ进行融合表达的报道,每升发酵液可获得12mg重组胰高血糖素[7]。
本工作利用PCR技术合成Glucagon(1~29)全序列,并克隆至载体pUC18中,筛出正确的阳性转化子,并将目的基因引入质粒pKA使其在trc启动子下与AnsB基因实现融合表达。
1 材 料
1.1 质粒与菌株
pUC18购自华美生物工程公司;pKA为本室构建的含ansB基因的质粒[7];E.coli JM105为本实验室保藏菌。
, http://www.100md.com
1.2 DNA化学合成
此工作于中科院上海植生所Beckman oligo-1000DNA合成仪上完成,序列见图1。
1.3 酶与其他试剂
限制酶kpnⅠ、HindⅢ及T4DNA ligase购自promega公司;Taq酶、dNTP、x-gal、IPTG购自华美公司;Rb a Hu Glucagon购自DAKO;羊抗兔酶标二抗为南京农业大学惠赠;丙烯酰胺、N,N′-甲叉双丙烯酰胺购自Sigma公司;Tryptone及Yeast Extract购自Oxiod公司;LB培养基及其他buffer均按《分子克隆》的方法配制。
2 方 法
2.1 基因设计
以天然Glucagon的氨基酸序列为基础对氨基酸序列作以下补充。
, http://www.100md.com
在编码框架的5′端和3′端分别设置KpnⅠ-EcoRV,HindⅢ酶切位点,便于合成基因酶切后直接克隆到载体质粒中。在5′端KpnⅠ-EcoRV酶切位点和Glucagon(1~29)基因之间设计一个酸水解序列(Asp-pro)以及随后的二肽酶识别序列(pro-pro)对应的密码子,便于目的肽段的融合表达和加工。
根据模板、引物各自的设计要求用计算机检索以确定基因序列,将目的基因分成大小分别为38、54、50、49个碱基的四个寡核苷酸片段,分别进行化学合成,即序列D1、D2、D3、D4,见图1。

Fig 1 Designed sequence of the Glucagon gene and its corresponding
, http://www.100md.com
D1,D2,D3,D4 sequence
2.2 用PCR合成glucagon基因
PCR在GL applied research inc.产GTC-2型扩增仪上进行。第一轮PCRD1、D2、D3浓度比为10∶1∶10,共10个循环;第二轮PCR以第一轮PCR产物为模板,D1、D4为引物,共20个循环,过程如图2所示。两轮PCR操作程序均为94℃30″;50℃60″;72℃90″。

Fig 2 Schematic presentation of glucagon gene PCR synthesis
, 百拇医药
2.3 Glucagon基因的克隆
PCR反应产物和pUC18均用kpnI、HindⅢ双酶切后回收,在T4DNAligase反应体系中14℃连接过夜,转化E.coliJM105感受态细胞,涂布含100μg/mlAmp、40μg/mlx-gal和IPTG的LB平板,37℃培养不超过16h,挑取白色菌落。筛选含重组质粒pUG的阳性转化子,常规操作见《分子克隆》。
2.4 目的基因克隆至载体pKA。
KpnⅠ和HindⅢ双酶消化质粒pUG和pKA,并相应的用1.2%和0.6%的Agrose回收pUG的小片段和pKA的大片段,纯化后将以上两片段等摩尔混合,连接后转化感受态E.coliJM105并涂布带Amp抗性的平板。获取若干单克隆后,筛选出含重组载体pKAG1的阳性转化子,用EcoRV、KpnⅠ双酶消化pKAG1质粒,同时用ScaⅠ和KpnⅠ双酶消化pKA质粒,并用0.6%Agrose电泳回收大片段和小片段,纯化后将两片段等mol混合,连接后转化JM105,用含Amp的LB平板培养,筛选出含重组质粒pKAG2的阳性转化子(图3)。

, 百拇医药
Fig 3 Construction of fusion expression plasmid pKAG2 for glucagon gene
2.5 AnsB-Glucagon基因的融合表达
接种转化了表达质粒pKAG2的工程菌于40mlLB培养基(氨苄青霉素100μg/ml)37℃,180r/min,培养至A600约为0.6时,加入IPTG至终浓度为0.1mmol/L,诱导表达2h。
2.6 SDS-PAGE
在含0.1%SDS的Laemmli不连续缓冲系统中进行。
2.7 表达产物的酶联免疫吸附实验[8]:
, 百拇医药
所用抗体为RbaHuGlucagon,二抗以辣根过氧化物酶为标记物,预处理后的工程菌发酵液直接包被微孔酶标检测板。
2.8 Glucagon的SPR检测
利用化学自组装技术,在金膜表面制备胰高组糖素的免疫敏感膜,并用SPR对溶液中不同浓度的胰高血糖素的响应作研究[9]。
3 结 果
3.1 用PCR合成Glucagon基因
图4为二步PCR扩增的结果,由此可见扩增片段大小分别为99bp和124bp与设计的基因大小相同。

, 百拇医药
ApGEM-7zf(+)/Hae ⅢMarker
B PCR product of the first procedure
C PCR product of the second procedure
Fig 4. PCR products of the first and second procedure analyzed on a 12% polyacrylamide gel electrophoresis
3.2 克隆质粒分析
3.2.1 PCR法 pUC18两条普适引物P1、P2各100pmol,以纯化的重组质粒pUG作模板在50μl体系中作常规PCR操作,PAGE可见216bp条带(图5)。

, 百拇医药
1.Fragment digested by kpnⅠ+HindⅢ
2.3. pGEM-7zf(+)/HaeⅢ DNA m arker
4. PCR product using P1,P2 as primers
Fig 5. Electrophoretic identification of pUG by
PCR and restriction enzyme digestion
3.2.2 限制酶分析 用KpnⅠ、HindⅢ双酶消化重组质粒,PAGE,EB染色后可见119bp条带(图5)。
3.2.3 DNA序列分析 此工作在ABI377PRISM DNA自动测序仪上完成,结果见图6。

, 百拇医药
Fig 6. Sequencing result of glucagon gene cloned in to pUC18.
3.3 Glucagon基因融合表达质粒的构建
携带了目的基因的重组质粒pKAG2经限制性内切酶KpnⅠ、HindⅢ酶切处理,得到了4738bp和832bp两个片段;同时因在构建的pKAG2质粒中,既保留了pKA的trc启动子,又引入了来自pUG的目的基因片段,故可以采用与trc启动子互补的上游引物P1以及与目的基因互补的下游引物D8,对重组载体进行常规PCR反应,电泳可见1194bp的条带(图7)。

, http://www.100md.com
1. Fragments digested by KpnI+Hind Ⅲ
2. λDNA/EcoRI+Hind Ⅲ marker
3. PCR products using P1、D8 as primers
Fig 7. The restriction enzymes analysis and PCR analysis of pKAG2
3.4 表达产物的电泳分析
表达菌体全蛋白反复冻融后进行电泳分析,用JM105菌体全蛋白和pKA质粒的表达产物ansB作对照,电泳结果如图8。ansBMr约35000,由质粒pKAG2表达的ansB-Glucagon融合蛋白分子质量较ansB大,对照MrMarker约为38000,与理论值相同,融合蛋白表达量占菌体总蛋白的15%,其中胰高血糖素占融合蛋白表达量的1/10。

, http://www.100md.com
a. JM105 b. JM105 transformed with pKAG2
c. Protein marker
Fig 8. SDS-PAGE of total proteins of E.coli JM105
3.5 表达产物的酶联免疫吸附实验
以pKA质粒的表达产物作阴性对照,以Rb a Hu Glucagon直接包被微孔板作阳性对照,结果显示了pKAG2的表达产物中Glucagon蛋白抗原的存在。
3.6 表达产物的SPR检测[9]
XPS、AES及SPR图谱可见金膜上已经有序地组装上了半胱胺/戊二醛/免疫人Glucagon抗体,并且对溶液中的人胰高血糖素进行识别。溶液中的Glucagon浓度随SPR共振角最大变化速率成正比。见图9。

, http://www.100md.com
A:SPR dynamic detection curve of different concentration
glucagon fusion protein
Concentration 1:4320,2:2880,3:1440,4:432,5:144nmol/L

B:the curve of SPR resonance angle variation ratio to
glucagon fusion protein conce ntration
, 百拇医药 Concentration 1:4320,2:2880,3:1440,4:432,5:144nmol/L
Fig 9. The curve of SPR signal vs the concentration of glucagon
4 讨 论
由于化学合成的寡核苷酸长度有限,常规的klenow酶补平法难以合成较长的目的片段,而寡核苷酸片段两两退火后的连接法,对合成的寡核苷酸链质、量及操作有较高要求。本文所用的方法利用三段寡核苷酸进行一轮10个循环PCR,以合成延长的寡核苷酸片段作为第二轮PCR的模板,最终可合成长达数百个碱基的基因片段。整个克隆方案快捷、方便、经济。
胰高血糖素为29肽,在宿主细胞内表达很易被降解。我们在实现用大肠杆菌高效表达天冬酰胺酶的基础上,将胰高血糖素与天冬酰胺酶基因连接后进行融合表达,因在Glucagon的N端设计了酸敏感位点(Asp-Pro)和二肽酶识别序列(Pro-Pro-),表达得到的融合蛋白经酸和酶特异性切割后,即可获得天然的Glucagon激素多肽。在该方案中经实验证明,由于在融合蛋白中天冬酰胺酶占较大比例,且完整,故酶活依然存在,可用快速测定酶活的方法跟踪表达概况和决定提纯过程中的取舍,并为参用较成熟的天冬酰胺酶分离纯化方案进行融合蛋白提取研究提供了可能,同时也为高效表达类似的短肽提供了成功的范例。
, 百拇医药
*江苏省自然科学基金和国家自然科学基金资助,项目编号分别为:BK95092309、39870175。联系人:刘景晶
参考文献
1 Pharma Projects.1995,16
2 Schonfeld JV, Muller MK.The islet-acinar axis of the pancreas:Is there a ro le for glucagon or a glucagon-like peptide?Experientia(Basel),1994,50(5):44 2
3 USP Dictionary of USAN and international Drug Names.1995
4 British Approved Names.1990
, 百拇医药
5 Drug information for the health care professional.1989
6 Scrip.1993,1884:28
7 Ishizakie etal.Production of recombinant human glucagon in the form of a fus ion protein in Escherichia coli,Recovery of glucagon by sequence-specific digestion.Appl Microbial Biotechnol,1992,36:483
8 杨利国,胡少昶,魏平华,等.酶免疫测定技术,南京大学出版社,1998年,506
9 钟文英,顾建华,丁敏等.胰高血糖素敏感膜的组装及SPR检测.江苏医药,1998,24( 增刊)
10 Hermann Gram. A Novel Approach for High Level Production of a Recombina nt Human Parathyroid Hormone Fragment in Escherichia Coli.Bio/technology ,1994,12(10):1017
11 刘景晶,李晶,吴梧桐,等.大肠杆菌L-天门冬酰胺酶Ⅱ基因的高效表达.中国 药科大学学报,1996;27(11):696.
收稿日期:1998-11-20, http://www.100md.com