重组人Cu.Zn-SOD工程菌发酵工艺的研究
作者:陈长华 付水林 范立强 苏惠娟 魏东芝 袁勤生
单位:华东理工大学生物工程学院,上海200237
关键词:超氧化物歧化酶;发酵;重组大肠杆菌
摘 要 人Cu
摘 要 人Cu.Zn-SOD是一种重要的氧自由基清除剂,传统工艺是从动物血中提取得到,受原料来源的限制。从人胎肝中提取了hCu.Zn-SODcDNA构建了基因工程菌,同时对其表达产物的条件进行研究,着重探索了接种量、接种时机、pH、溶氧等因素,并优化了发酵条件。通过在5L全自动发酵罐上研究重组菌BL21的培养条件,确定了最适条件为:接种量2%,溶氧水平≥40%,初始pH6.5,培养过程中用3mol/LHCl调节pH在7.5。在此条件下,发酵最高水平达到酶活950U/ml,比活1400U/mg。
, 百拇医药
Studies on Fermentative Technology
of Human Cu.Zn-SOD in E.coli
Chen Changhua,Fu Shuilin,Fan Liqiang,Su Huijuan,Wei Dongzhi,Yuan Qin sheng
(East China University of Science and Technology,Shanghai 200237)
Abstract Human Cu.Zn-SOD is an important oxygen free radical scavenger. In the traditional technology, it was extracted from animal blood of which the re s ources were limited. In this experiment, hCu.Zn-SOD cDNA was extracted from foe talliver to form an recombinant E.coli and the conditions of product expressi on were also studied ,such as inoculum quantities, inoculum time, pH, dissolved oxygen,.Then the suitable technology was obtained. Being studied in 5L fermen tor, the optimal technology was found :inoculum 2%, dissolved oxygen≥40%, primary pH 6.5, regulating pH to 7.5 by 3mol/L HCl during the process of culture. Un der these conditions, the maximum expression of enzyme activity reached 950U/ml and the maximum specific activity reached 1400U/mg.
, 百拇医药
Key Words Superoxide dismutase, Fermentation, Recombinant E. coli
超氧化物歧化酶(Superoxidedismulate,SOD)是一种重要的氧自由基清除剂。超氧阴离子自由基(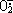 )是机体细胞正常代谢过程的产物,炎症、辐射、抗生素及抗肿瘤剂均能增加体内
)是机体细胞正常代谢过程的产物,炎症、辐射、抗生素及抗肿瘤剂均能增加体内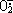 的产生,过量的
的产生,过量的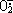 对机体有较强的毒性,已知
对机体有较强的毒性,已知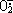 与许多病理性过程有关。SOD目前主要集中应用在抗肿瘤,抗辐射,抗衰老及自身免疫疾病[1]。
与许多病理性过程有关。SOD目前主要集中应用在抗肿瘤,抗辐射,抗衰老及自身免疫疾病[1]。
, http://www.100md.com
hCu.Zn-SOD基因位于人的21号染色体的与唐氏综合症有关的21q22区域[2]大约有530个碱基对,编码153个氨基酸残基。1982年以后,Hurwitz等[3~5]分别构建了质粒,并在大肠杆菌中得到了表达。
本课题是从胎肝提取了hCu.Zn-SODcDNA构建了基因工程菌,并着手基因表达的工艺研究。
1 材料与培养方法
1.1 实验材料
1.1.1 菌种 hCu.Zn-SOD基因工程菌由本课题组构建,宿主菌为E.coliBL21。
1.1.2 培养基 LB培养基。
, 百拇医药 1.2 培养方法
1.2.1 斜面种子培养 于37℃培养24h,待斜面长好后放4℃冰箱保藏。
1.2.2 摇瓶种子培养 在250ml摇瓶中装有100ml种子培养基及100μg/ml氨苄青霉素(简称Ap),接入斜面种子,于37℃,200r/min培养12h。
1.2.3 发酵罐培养 重组菌发酵培养在5L全自动发酵罐中进行。培养温度37℃,通气量1∶1,消后pH6.5左右,溶氧控制在25%以上,诱导剂为异丙基β-D-硫代半乳糖(IPTG)。
1.3 检测方法
1.3.1 菌浓度测定 发酵液于波长600nm处测吸光度(A值)。
1.3.2 蛋白浓度测定 Folin-Lowry法。
, 百拇医药
1.3.3 SOD活性测定 离心收集细胞,用超声波破碎细胞,冷冻高速离心,除去细胞碎片,得到上清液,用连苯三酚自氧化法测定SOD活性。
酶活性单位定义:25℃时,1ml反应液中每min抑制连苯三酚自氧化速率达50%时的酶量为一个活力单位。
2 结 果
2.1 接种量对发酵的影响
接种量对发酵的影响见表1、图1。
Tab 1 Effect of the inoculum on the fermentation
Inoculum
(%)
Time of adding inducer
, http://www.100md.com
(h)
Max.A600nm
2
2.0
1.393
5
1.5
1.362
10
1.0
1.330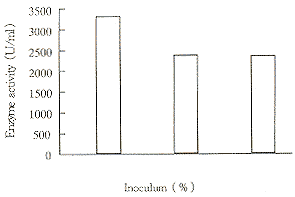
, 百拇医药
Fig 1 Effects of the inoculum on the expression
分别以2%,5%,10%接种量上罐发酵表明,以5%,10%接种量上罐,菌种繁殖迅速,延滞期缩短,很快进入对数生长期,但最终菌浓度却不高,且酶活力低于2%接种量的酶活力。所以本实验取2%接种量。
2.2 工程菌生长的曲线结果
由图2可见,工程菌接种后大约经过2h培养,进入对数生长期,半小时内A600nm从0.3增长到0.8,之后生长减慢。分别在对数生长期前期、中期、后期及稳定期进行诱导,得到以下结果。
Fig 2 Grown curve of recombinant E.coli
, 百拇医药
由表2可见,当工程菌处于对数生长期中期进行诱导,工程菌表达外源蛋白的效率高,酶活力达到最高;当菌体处于对数生长期后期或稳定期时进行诱导,表达效果变差。以上结果表明,对工程菌BL21来说,对数生长期中期诱导是最佳时机,即A600nm=0.4~0.6,尤以A600nm在0.5左右为最佳。
Tab 2 Effect of induced time
1
2
3
4
5
6
Induced time
, http://www.100md.com
(A600nm)
0.349
0.409
0.526
0.616
0 .704
0.960
Enzyme activity
(U/ml)
551.8
635.5
950.7
, 百拇医药
526.9
400.0
10 2.0
2.3 pH对工程菌表达的影响
pH对工程菌表达的影响见表3。Tab 3 pH Change and enzyme expression in the culture
Culture time
(h)
0
1
2
3
, http://www.100md.com
4
5
6
7
pH
6.50
7.22
7.63
7.91
8.10
8.24
8.34
8.39
, 百拇医药
Specific activity
(U/ml)
282.22
241.99
619.33
908.7 6
875.71
781.60
592.40
由表3可见,在工程菌培养过程中pH逐渐升高,当pH小于8.1时基因表达正常,大于8.1以后抑制了基因表达及酶的活性,酶的比活下降。这种情况对SOD的生产及提取都是不利的。为此对培养基初始pH和过程pH调节进行探索。
, http://www.100md.com
2.3.1 培养基初始pH的确定 培养基初始pH试验在摇瓶上进行,取三水平:pH6.5,70,7.5,每种条件做三个摇瓶,结果如下:pH为6.5,7.0,7.5,平均效价分别为1368,1227,990U/mg。
以上数据表明,培养基初始pH6.5对产物表达有利,酶的比活可达1368U/mg,随着pH升高,比活下降。当初始pH为7.5时,比活明显下降,只有990U/mg,因此确定培养基初始pH为6.5。
2.3.2 pH调节方法的确定 由于发酵过程中pH升得太高不利于表达,因此将pH控制在7.5左右,调节方法有两种,一种是在发酵后期用3mol/LHCl调节,另一种是用1mol/L葡萄糖调节pH,结果见表4。Tab 4 Effect of eregulating pH with 3mol/L HCl
Time(h)
, 百拇医药 1
2
3
4
5
6
A600nm
Proten
0.816
0.951
1.076
1.157
1.285
, http://www.100md.com
1.362
concentration(mg/ml)
Enzyme
3.43
5.01
5.47
5.53
7.30
9.66
activity(U/ml)
Specific
179.1
, 百拇医药
383.4
475 .1
544.8
531.4
950.7
activity(U/mg)
522.2
765.3
868.5
985.3
727.9
984.2
, http://www.100md.com 从表4可见用盐酸调节pH在7.5左右,重组菌的表达处于较合适的条件,酶活力不断上升达到950.7U/ml,比活达到990U/mg以上且维持较长时间,这对下一步酶的提取也是有利的。若用葡萄糖来调节pH,虽然pH可以稳定在7.5,产物表达却很不理想,酶活力只有用盐酸调pH的46.8%,比活只有用盐酸调pH的35.4%。从表5可以看出加入葡萄糖使菌体生长加快,菌浓度显著提高,杂蛋白量大大增加,但酶活力却明显下降。这可能是随着葡萄糖加入,发酵液中乙酸的浓度不断增长,乙酸对重组菌外源基因的表达有抑制作用[6]。此外,葡萄糖的加入,使菌体生长过快。随着生长速率增加,质粒丢失的频率增加。质粒一旦丢失,没有活性的蛋白表达增多。从以上分析可知,用盐酸调pH明显优于用葡萄糖的调节,其酶活高,副作用小。Tab 5 Effect of regulating pH with 1mol/L glucose
Time(h)
1
, 百拇医药
2
3
4
5
6
A600nm
Proten
0.842
1.062
1.140
1.330
1.434
1.510
, 百拇医药
concentration(mg/ml)
Enzyme
4.293
5.6 10
7.024
9.122
10.732
13.658
activity(U/ml)
Specific
51.24
69.54
, 百拇医药
204.6
290.3
3 73.9
459.8
activity(U/mg)
119.3
123.95
291.3
318.22
348.36
336.48
2.4 溶氧浓度对发酵的影响
, http://www.100md.com
溶氧浓度对菌体的生长和产物的影响很大,菌体在大量扩增过程中,消耗大量的氧,使溶氧浓度急剧下降,此时氧的供应十分重要。
2.4.1 不控制溶氧的培养 在培养过程中对溶氧不进行控制,结果见表6。Tab 6 Fermentation was out of control dissolved oxygen
Time(h)
0
1
2
3
4
5
6
, http://www.100md.com
7
8
Dissolved oxygen(%)
100
76
20
25
40
63
54
57
7 9
A600nm
, 百拇医药
0.07
0.29
0.51
0.63
0.78
0.92
1 .03
1.09
1.12
Protein concentration
(mg/ml)
3.49
, http://www.100md.com 4.97
5.02
5 .00
5.18
5.25
5.40
5.42
Enzyme activity (U/ml)
324.0
328.3
330.8
342.0
368.7
, 百拇医药
360.2
表6是该培养过程的菌体浓度、蛋白浓度、酶活力、溶氧的变化。从表中可以看到重组菌在发酵前期1-2h一般都有一个溶氧低谷。在此阶段菌体的摄氧率也呈现一高峰值与溶氧低谷相对应,说明这时菌处于对数生长期。A值增加明显。过了生长阶段需氧量略有减少,表现出溶氧随之上升。A值的增加趋于平缓。由于溶氧的限制,菌浓度为1.12,最高酶活达386.7U/ml。
2.4.2 控制溶氧的发酵条件 在培养过程中,通过改变搅拌转速对溶氧进行控制,其它条件同上,结果见表7。Tab 7 Fermentation was in control of dissolved oxygen
Time(h)
0
1
, 百拇医药
2
3
4
5
6
7
8
Dissolved oxygen(%)
100
76
43
45
55
, http://www.100md.com
67
71
75
80
A600nm
0.08
0.44
0.78
0.92
1.01
1.10
1 .19
1.30
, 百拇医药
1.35
Protein concentration
(mg/ml)
3.82
5.24
5.30
5.33
5.47
5.40
5.63
5.68
Enzyme activity (U/ml)
, http://www.100md.com
188.3
276.2
269.3
451,5
524 .7
539.3
通过调节搅拌转速使溶氧维持在40%以上能提高重组菌细胞生长和产物表达。从表7可以看到,提高溶氧后菌体浓度提高A600nm达到1.35,酶活力有显著增加,达到539.3U/ml。虽然目前还没有足够数据确定溶氧的临界值,但在溶氧低谷阶段加强供氧对发酵是十分有益的。3 讨 论
利用基因重组技术构建的生物工程菌的发酵不同于传统的发酵工艺。基因工程菌含有带外源基因的重组载体,其生长受到影响。重组菌的发酵不仅要考虑菌体的生长更重要的是希望能获得大量的外源基因表达的产物,即获得外源基因的高表达。在发酵过程中,菌体生长通常与外源基因表达无定量的数学关系,因此发酵工艺的研究不仅是考虑重组菌的生长条件,而且要考虑生长与表达的偶联。
, 百拇医药
本课题在对培养条件的探索中得到以下一些认识。
3.1 诱导时机对表达的影响
诱导剂加入改变环境条件,启动了基因的表达。诱导时机对基因表达效果影响很大。过早诱导,微生物还处于年轻时期,环境突然改变,干扰了微生物代谢,超出了菌的“承受”能力而降低了酶的表达;诱导太迟,菌体已成熟,菌体内各种酶的合成能力降低,表达量也减少。本实验发现在对数生长期的中、后期加入诱导剂对表达较为有利,可能是IPTG有一定毒性,对数生长期前期的菌对IPTG的耐受力还太小,所以诱导适当迟些为好。
3.2 pH对基因表达的影响
本实验所用培养基不含葡萄糖,在培养过程中不见pH下降,反而上升。当pH到达8.1以上就影响基因表达,抑制SOD的合成。那么是否有可能是SOD活性受抑制呢?有资料表明Cu.Zn-SOD对pH的变化不甚敏感,在pH5.3~9.5范围内Cu.Zn-SOD的催化反应速率不受pH的影响。只有在pH低于5.3或高于9.5才可能发生金属辅基的脱落和构象的转变。可见pH主要是影响Cu.Zn-SOD的生物合成。在比较二种调节pH方法时发现,葡萄糖虽能调节pH但Cu.Zn-SOD的酶活力却下降了,可能是(1)葡萄糖的加入,使菌体生长过快,随着生长速率的增大,质粒丢失的频率增大,丢失了质粒的大肠杆菌生长速率较带有质粒的工程菌占优势,没有活性的蛋白表达增多,产物表达减少。(2)随着葡萄糖的加入,发酵液中乙酸的浓度不断上升,乙酸对重组菌的外源基因表达有强的抑制作用[6],使有活力的外源蛋白的表达下降。
, 百拇医药
3.3 溶氧对发酵的影响
溶氧对微生物生长及产物形成都是重要的因素。由于氧在水中的溶解度很小,因此氧往往成为发酵过程的限制性因素。特别在微生物大量繁殖的对数生长期,摄氧率大,因此溶氧浓度急剧下降,当下降到临界氧浓度以下,则会抑制菌的生长及产物的形成。本实验表明,在对数生长期,溶氧浓度可以从76%下降到20%,这时不增加氧的供应就会抑制菌生长及产物表达,且重组hCu.Zn-SOD大肠杆菌对氧的需求大,溶氧低于25%就会产生抑制作用。通过改变搅拌转速,改善供氧条件使酶活从386.7U/ml上升到539.2U/ml酶活增加了39.4%。氧作为呼吸链电子最终受体,在产能代谢中起重要作用,重组菌带有外源基因,可能需要较大能量,所以对氧的需求大,临界氧浓度要求也较高。
4 结 论
用5L全自动发酵罐进行了19批hCu.Zn-SOD重组菌培养,得出较为合理的培养条件:培养温度37℃,溶氧控制在40%以上,接种量2%,初始pH6.5,表达阶段用3mol/LHCl调节pH在7.5,诱导剂加入时机控制在A600nm=0.4-0.6,诱导6h放罐,发酵最高水平达到酶活950U/ml,比活1400U/mg。
, http://www.100md.com
参考文献
1 方允中,李文杰.自由基和酶.北京:科学出版社,1989.71
2 Judy L H, Naomidafni V,Lered L,et al. Human cytoplasmic superoxide dismutase cDNA clone: A probe for studying the molecular biology of Down syndrome. Proc Natl Acad Sci USA,1982,79(9)∶2808
3 Harman J R ,Geller T,Yarin X,et al. High-level expression of enzymatic a ctive human Cu/Zn superoxide dismetase in E.coli. Proc Natl Acad Sci USA,1986, 83(19)∶7142
, 百拇医药
4 Tomic M,Macoto M,Kenji S,et al. Construction of runaway vector and its use for a high-level expression of cloned human superoxide dismutase gene.Appl Micro biol Biotechnol,1988,28(2)∶170
5 Cousens L S,Shuster J R,Galleyos C,et al. High level expression of proinsul in in the yeast.Saccharomyctes Corevisice Gne,1987,61(3)∶265
6 吴军,于公义,冯尔玲.乙酸积累对基因工程菌培养的影响及培养基pH的关系. 微生物学报,1996,36(6):433
收稿日期:1998-12-21, 百拇医药
单位:华东理工大学生物工程学院,上海200237
关键词:超氧化物歧化酶;发酵;重组大肠杆菌
摘 要 人Cu
摘 要 人Cu.Zn-SOD是一种重要的氧自由基清除剂,传统工艺是从动物血中提取得到,受原料来源的限制。从人胎肝中提取了hCu.Zn-SODcDNA构建了基因工程菌,同时对其表达产物的条件进行研究,着重探索了接种量、接种时机、pH、溶氧等因素,并优化了发酵条件。通过在5L全自动发酵罐上研究重组菌BL21的培养条件,确定了最适条件为:接种量2%,溶氧水平≥40%,初始pH6.5,培养过程中用3mol/LHCl调节pH在7.5。在此条件下,发酵最高水平达到酶活950U/ml,比活1400U/mg。
, 百拇医药
Studies on Fermentative Technology
of Human Cu.Zn-SOD in E.coli
Chen Changhua,Fu Shuilin,Fan Liqiang,Su Huijuan,Wei Dongzhi,Yuan Qin sheng
(East China University of Science and Technology,Shanghai 200237)
Abstract Human Cu.Zn-SOD is an important oxygen free radical scavenger. In the traditional technology, it was extracted from animal blood of which the re s ources were limited. In this experiment, hCu.Zn-SOD cDNA was extracted from foe talliver to form an recombinant E.coli and the conditions of product expressi on were also studied ,such as inoculum quantities, inoculum time, pH, dissolved oxygen,.Then the suitable technology was obtained. Being studied in 5L fermen tor, the optimal technology was found :inoculum 2%, dissolved oxygen≥40%, primary pH 6.5, regulating pH to 7.5 by 3mol/L HCl during the process of culture. Un der these conditions, the maximum expression of enzyme activity reached 950U/ml and the maximum specific activity reached 1400U/mg.
, 百拇医药
Key Words Superoxide dismutase, Fermentation, Recombinant E. coli
超氧化物歧化酶(Superoxidedismulate,SOD)是一种重要的氧自由基清除剂。超氧阴离子自由基(
, http://www.100md.com
hCu.Zn-SOD基因位于人的21号染色体的与唐氏综合症有关的21q22区域[2]大约有530个碱基对,编码153个氨基酸残基。1982年以后,Hurwitz等[3~5]分别构建了质粒,并在大肠杆菌中得到了表达。
本课题是从胎肝提取了hCu.Zn-SODcDNA构建了基因工程菌,并着手基因表达的工艺研究。
1 材料与培养方法
1.1 实验材料
1.1.1 菌种 hCu.Zn-SOD基因工程菌由本课题组构建,宿主菌为E.coliBL21。
1.1.2 培养基 LB培养基。
, 百拇医药 1.2 培养方法
1.2.1 斜面种子培养 于37℃培养24h,待斜面长好后放4℃冰箱保藏。
1.2.2 摇瓶种子培养 在250ml摇瓶中装有100ml种子培养基及100μg/ml氨苄青霉素(简称Ap),接入斜面种子,于37℃,200r/min培养12h。
1.2.3 发酵罐培养 重组菌发酵培养在5L全自动发酵罐中进行。培养温度37℃,通气量1∶1,消后pH6.5左右,溶氧控制在25%以上,诱导剂为异丙基β-D-硫代半乳糖(IPTG)。
1.3 检测方法
1.3.1 菌浓度测定 发酵液于波长600nm处测吸光度(A值)。
1.3.2 蛋白浓度测定 Folin-Lowry法。
, 百拇医药
1.3.3 SOD活性测定 离心收集细胞,用超声波破碎细胞,冷冻高速离心,除去细胞碎片,得到上清液,用连苯三酚自氧化法测定SOD活性。
酶活性单位定义:25℃时,1ml反应液中每min抑制连苯三酚自氧化速率达50%时的酶量为一个活力单位。
2 结 果
2.1 接种量对发酵的影响
接种量对发酵的影响见表1、图1。
Tab 1 Effect of the inoculum on the fermentation
Inoculum
(%)
Time of adding inducer
, http://www.100md.com
(h)
Max.A600nm
2
2.0
1.393
5
1.5
1.362
10
1.0
1.330

, 百拇医药
Fig 1 Effects of the inoculum on the expression
分别以2%,5%,10%接种量上罐发酵表明,以5%,10%接种量上罐,菌种繁殖迅速,延滞期缩短,很快进入对数生长期,但最终菌浓度却不高,且酶活力低于2%接种量的酶活力。所以本实验取2%接种量。
2.2 工程菌生长的曲线结果
由图2可见,工程菌接种后大约经过2h培养,进入对数生长期,半小时内A600nm从0.3增长到0.8,之后生长减慢。分别在对数生长期前期、中期、后期及稳定期进行诱导,得到以下结果。

Fig 2 Grown curve of recombinant E.coli
, 百拇医药
由表2可见,当工程菌处于对数生长期中期进行诱导,工程菌表达外源蛋白的效率高,酶活力达到最高;当菌体处于对数生长期后期或稳定期时进行诱导,表达效果变差。以上结果表明,对工程菌BL21来说,对数生长期中期诱导是最佳时机,即A600nm=0.4~0.6,尤以A600nm在0.5左右为最佳。
Tab 2 Effect of induced time
1
2
3
4
5
6
Induced time
, http://www.100md.com
(A600nm)
0.349
0.409
0.526
0.616
0 .704
0.960
Enzyme activity
(U/ml)
551.8
635.5
950.7
, 百拇医药
526.9
400.0
10 2.0
2.3 pH对工程菌表达的影响
pH对工程菌表达的影响见表3。Tab 3 pH Change and enzyme expression in the culture
Culture time
(h)
0
1
2
3
, http://www.100md.com
4
5
6
7
pH
6.50
7.22
7.63
7.91
8.10
8.24
8.34
8.39
, 百拇医药
Specific activity
(U/ml)
282.22
241.99
619.33
908.7 6
875.71
781.60
592.40
由表3可见,在工程菌培养过程中pH逐渐升高,当pH小于8.1时基因表达正常,大于8.1以后抑制了基因表达及酶的活性,酶的比活下降。这种情况对SOD的生产及提取都是不利的。为此对培养基初始pH和过程pH调节进行探索。
, http://www.100md.com
2.3.1 培养基初始pH的确定 培养基初始pH试验在摇瓶上进行,取三水平:pH6.5,70,7.5,每种条件做三个摇瓶,结果如下:pH为6.5,7.0,7.5,平均效价分别为1368,1227,990U/mg。
以上数据表明,培养基初始pH6.5对产物表达有利,酶的比活可达1368U/mg,随着pH升高,比活下降。当初始pH为7.5时,比活明显下降,只有990U/mg,因此确定培养基初始pH为6.5。
2.3.2 pH调节方法的确定 由于发酵过程中pH升得太高不利于表达,因此将pH控制在7.5左右,调节方法有两种,一种是在发酵后期用3mol/LHCl调节,另一种是用1mol/L葡萄糖调节pH,结果见表4。Tab 4 Effect of eregulating pH with 3mol/L HCl
Time(h)
, 百拇医药 1
2
3
4
5
6
A600nm
Proten
0.816
0.951
1.076
1.157
1.285
, http://www.100md.com
1.362
concentration(mg/ml)
Enzyme
3.43
5.01
5.47
5.53
7.30
9.66
activity(U/ml)
Specific
179.1
, 百拇医药
383.4
475 .1
544.8
531.4
950.7
activity(U/mg)
522.2
765.3
868.5
985.3
727.9
984.2
, http://www.100md.com 从表4可见用盐酸调节pH在7.5左右,重组菌的表达处于较合适的条件,酶活力不断上升达到950.7U/ml,比活达到990U/mg以上且维持较长时间,这对下一步酶的提取也是有利的。若用葡萄糖来调节pH,虽然pH可以稳定在7.5,产物表达却很不理想,酶活力只有用盐酸调pH的46.8%,比活只有用盐酸调pH的35.4%。从表5可以看出加入葡萄糖使菌体生长加快,菌浓度显著提高,杂蛋白量大大增加,但酶活力却明显下降。这可能是随着葡萄糖加入,发酵液中乙酸的浓度不断增长,乙酸对重组菌外源基因的表达有抑制作用[6]。此外,葡萄糖的加入,使菌体生长过快。随着生长速率增加,质粒丢失的频率增加。质粒一旦丢失,没有活性的蛋白表达增多。从以上分析可知,用盐酸调pH明显优于用葡萄糖的调节,其酶活高,副作用小。Tab 5 Effect of regulating pH with 1mol/L glucose
Time(h)
1
, 百拇医药
2
3
4
5
6
A600nm
Proten
0.842
1.062
1.140
1.330
1.434
1.510
, 百拇医药
concentration(mg/ml)
Enzyme
4.293
5.6 10
7.024
9.122
10.732
13.658
activity(U/ml)
Specific
51.24
69.54
, 百拇医药
204.6
290.3
3 73.9
459.8
activity(U/mg)
119.3
123.95
291.3
318.22
348.36
336.48
2.4 溶氧浓度对发酵的影响
, http://www.100md.com
溶氧浓度对菌体的生长和产物的影响很大,菌体在大量扩增过程中,消耗大量的氧,使溶氧浓度急剧下降,此时氧的供应十分重要。
2.4.1 不控制溶氧的培养 在培养过程中对溶氧不进行控制,结果见表6。Tab 6 Fermentation was out of control dissolved oxygen
Time(h)
0
1
2
3
4
5
6
, http://www.100md.com
7
8
Dissolved oxygen(%)
100
76
20
25
40
63
54
57
7 9
A600nm
, 百拇医药
0.07
0.29
0.51
0.63
0.78
0.92
1 .03
1.09
1.12
Protein concentration
(mg/ml)
3.49
, http://www.100md.com 4.97
5.02
5 .00
5.18
5.25
5.40
5.42
Enzyme activity (U/ml)
324.0
328.3
330.8
342.0
368.7
, 百拇医药
360.2
表6是该培养过程的菌体浓度、蛋白浓度、酶活力、溶氧的变化。从表中可以看到重组菌在发酵前期1-2h一般都有一个溶氧低谷。在此阶段菌体的摄氧率也呈现一高峰值与溶氧低谷相对应,说明这时菌处于对数生长期。A值增加明显。过了生长阶段需氧量略有减少,表现出溶氧随之上升。A值的增加趋于平缓。由于溶氧的限制,菌浓度为1.12,最高酶活达386.7U/ml。
2.4.2 控制溶氧的发酵条件 在培养过程中,通过改变搅拌转速对溶氧进行控制,其它条件同上,结果见表7。Tab 7 Fermentation was in control of dissolved oxygen
Time(h)
0
1
, 百拇医药
2
3
4
5
6
7
8
Dissolved oxygen(%)
100
76
43
45
55
, http://www.100md.com
67
71
75
80
A600nm
0.08
0.44
0.78
0.92
1.01
1.10
1 .19
1.30
, 百拇医药
1.35
Protein concentration
(mg/ml)
3.82
5.24
5.30
5.33
5.47
5.40
5.63
5.68
Enzyme activity (U/ml)
, http://www.100md.com
188.3
276.2
269.3
451,5
524 .7
539.3
通过调节搅拌转速使溶氧维持在40%以上能提高重组菌细胞生长和产物表达。从表7可以看到,提高溶氧后菌体浓度提高A600nm达到1.35,酶活力有显著增加,达到539.3U/ml。虽然目前还没有足够数据确定溶氧的临界值,但在溶氧低谷阶段加强供氧对发酵是十分有益的。3 讨 论
利用基因重组技术构建的生物工程菌的发酵不同于传统的发酵工艺。基因工程菌含有带外源基因的重组载体,其生长受到影响。重组菌的发酵不仅要考虑菌体的生长更重要的是希望能获得大量的外源基因表达的产物,即获得外源基因的高表达。在发酵过程中,菌体生长通常与外源基因表达无定量的数学关系,因此发酵工艺的研究不仅是考虑重组菌的生长条件,而且要考虑生长与表达的偶联。
, 百拇医药
本课题在对培养条件的探索中得到以下一些认识。
3.1 诱导时机对表达的影响
诱导剂加入改变环境条件,启动了基因的表达。诱导时机对基因表达效果影响很大。过早诱导,微生物还处于年轻时期,环境突然改变,干扰了微生物代谢,超出了菌的“承受”能力而降低了酶的表达;诱导太迟,菌体已成熟,菌体内各种酶的合成能力降低,表达量也减少。本实验发现在对数生长期的中、后期加入诱导剂对表达较为有利,可能是IPTG有一定毒性,对数生长期前期的菌对IPTG的耐受力还太小,所以诱导适当迟些为好。
3.2 pH对基因表达的影响
本实验所用培养基不含葡萄糖,在培养过程中不见pH下降,反而上升。当pH到达8.1以上就影响基因表达,抑制SOD的合成。那么是否有可能是SOD活性受抑制呢?有资料表明Cu.Zn-SOD对pH的变化不甚敏感,在pH5.3~9.5范围内Cu.Zn-SOD的催化反应速率不受pH的影响。只有在pH低于5.3或高于9.5才可能发生金属辅基的脱落和构象的转变。可见pH主要是影响Cu.Zn-SOD的生物合成。在比较二种调节pH方法时发现,葡萄糖虽能调节pH但Cu.Zn-SOD的酶活力却下降了,可能是(1)葡萄糖的加入,使菌体生长过快,随着生长速率的增大,质粒丢失的频率增大,丢失了质粒的大肠杆菌生长速率较带有质粒的工程菌占优势,没有活性的蛋白表达增多,产物表达减少。(2)随着葡萄糖的加入,发酵液中乙酸的浓度不断上升,乙酸对重组菌的外源基因表达有强的抑制作用[6],使有活力的外源蛋白的表达下降。
, 百拇医药
3.3 溶氧对发酵的影响
溶氧对微生物生长及产物形成都是重要的因素。由于氧在水中的溶解度很小,因此氧往往成为发酵过程的限制性因素。特别在微生物大量繁殖的对数生长期,摄氧率大,因此溶氧浓度急剧下降,当下降到临界氧浓度以下,则会抑制菌的生长及产物的形成。本实验表明,在对数生长期,溶氧浓度可以从76%下降到20%,这时不增加氧的供应就会抑制菌生长及产物表达,且重组hCu.Zn-SOD大肠杆菌对氧的需求大,溶氧低于25%就会产生抑制作用。通过改变搅拌转速,改善供氧条件使酶活从386.7U/ml上升到539.2U/ml酶活增加了39.4%。氧作为呼吸链电子最终受体,在产能代谢中起重要作用,重组菌带有外源基因,可能需要较大能量,所以对氧的需求大,临界氧浓度要求也较高。
4 结 论
用5L全自动发酵罐进行了19批hCu.Zn-SOD重组菌培养,得出较为合理的培养条件:培养温度37℃,溶氧控制在40%以上,接种量2%,初始pH6.5,表达阶段用3mol/LHCl调节pH在7.5,诱导剂加入时机控制在A600nm=0.4-0.6,诱导6h放罐,发酵最高水平达到酶活950U/ml,比活1400U/mg。
, http://www.100md.com
参考文献
1 方允中,李文杰.自由基和酶.北京:科学出版社,1989.71
2 Judy L H, Naomidafni V,Lered L,et al. Human cytoplasmic superoxide dismutase cDNA clone: A probe for studying the molecular biology of Down syndrome. Proc Natl Acad Sci USA,1982,79(9)∶2808
3 Harman J R ,Geller T,Yarin X,et al. High-level expression of enzymatic a ctive human Cu/Zn superoxide dismetase in E.coli. Proc Natl Acad Sci USA,1986, 83(19)∶7142
, 百拇医药
4 Tomic M,Macoto M,Kenji S,et al. Construction of runaway vector and its use for a high-level expression of cloned human superoxide dismutase gene.Appl Micro biol Biotechnol,1988,28(2)∶170
5 Cousens L S,Shuster J R,Galleyos C,et al. High level expression of proinsul in in the yeast.Saccharomyctes Corevisice Gne,1987,61(3)∶265
6 吴军,于公义,冯尔玲.乙酸积累对基因工程菌培养的影响及培养基pH的关系. 微生物学报,1996,36(6):433
收稿日期:1998-12-21, 百拇医药