膜蛋白交联对红细胞膜变形性及流动性的影响
作者:施岩 孙大公 陈凯 谢利德 姚伟娟 文宗曜
单位:施岩(承德医学院数学教研室 承德 067000);孙大公 陈凯 谢利德 姚伟娟 文宗曜(北京医科大学血液流变学研究中心 北京 100083)
关键词:戊二醛;膜蛋白;新激光衍射法;生物力学特性
北京生物医学工程000208 摘 要 本文通过不同浓度戊二醛作用于红细胞膜。用新型激光衍射法测量了这些红细胞样品的弹性模量E和膜粘度μm。同时通过DPH标记的萤光偏振法测定了这些红细胞膜的流动性,并采用MSL标记的电子自旋共振波谱技术(ESR)测量了红细胞膜蛋白运动性的变化,并取得了与新型激光衍射法一致的结果。发现膜蛋白构象发生改变,膜脂流动性下降,红细胞膜剪切弹性模量(E)和表面粘度(μm)均呈上升趋势,红细胞变形能力下降。并对上述红细胞膜结构改变所引起的微观流变特性的变化进行了初步探讨。
, http://www.100md.com
Effects of Membrane Proteins Cross-Linking on Biomechanical
Properties of The Erythrocyte Membrane
Sun Dagong,Shi Yan, Chen Kai, Xie Lide, Yao Weijuan, Wen Zhongyao
(Department of Medical physics, Beijing Medical University, Beijing 100083)
(Department of mathematics, Chengde Medical college,Chengde 067000)
Abstract
, 百拇医药
Coefficients of elastic modulus(E) and viscosity(μm) of RBCs were measured by new ektacymeatry after treatment of RBC with different doses of Glutaraldehyde. RBC membrane fluidity and dynamic changes of the protein-microstructure of RBC membrane were measured with fluorescence polarization using DPH as a marker, and with electron spin resonance (ESR)using MSL as a marker respectively. It was found that the protein-microstructure of RBC membrane had changed, and membrane lipid. fluidity had decreased with the increase of treament dose of Glutaraldehyde. Moreover, increase of E, and μm and decrease of membrane fluidity as well as RBC deformability, had been observed with the increase of Glutaraldehyde concentratrion.Here presented is also a preliminary discussion of change of micro-hemorheology, resulted from alteration of microstructure of RBC membrane.
, 百拇医药
Key words:Glutaraldehyde, Membrane protein, New ektacytometry, Biomechanical properties
0 前言
红细胞膜的力学性质主要由膜骨架的结构决定,如果构成膜骨架的各种蛋白相互之间的作用异常或某种蛋白有缺陷均可引起红细胞膜力学性质的改变,从而引发多种疾病。如遗传性球形红细胞增多症(HS),阵发性睡眠性血红蛋白尿症(PNH)等都是由于膜蛋白的缺陷或异常引起的。日本学者Manno[1]等人研究了骨架蛋白磷酸化和完整细胞膜的功能之间的关系,他们认为细胞膜力学稳定性受膜酪蛋白激酶I对beta-spectrin的磷酸化调控,beta-spectrin的磷酸化降低增加了细胞膜的力学稳定性;反之磷酸化程度的增加降低了细胞膜的力学稳定性。An XL和Takakuwa[2]等人研究了红细胞膜蛋白4.1和带3蛋白相互作用对膜力学性质的影响,他们发现随着蛋白4.1与带3蛋白的分离,带3蛋白与锚蛋白的相互作用增强,使细胞膜的变形性下降,机械稳定性增加。Gwozdzinski[3]等人利用电子共顺磁共振技术研究了慢性肾衰竭病人的红细胞膜性质,发现慢性肾衰竭病人的红细胞的渗透脆性比正常人有显著增加,而且膜蛋白的运动性下降。即便在正常生理过程中随红细胞的衰老,红细胞膜结构也在不断发生变化,导致红细胞刚性增加,最终被从血液循环系统中清除掉[4]。我们曾先后研究了缺铁性贫血[5]大分子吸附[6],白蛋白[7]对红细胞微观流变特性的影响及胰蛋白酶对红细胞膜的水解作用[8]。本文通过戊二醛作用于红细胞膜,通过DPH标记的萤光偏振法测定了这些红细胞膜的流动性,采用MSL标记的电子自旋共振波谱技术(ESR)测量了红细胞膜蛋白的构象的动态变化,并用新型激光衍射法[7,9,10]测量了这些红细胞样品的弹性模量E和膜粘度μm。获得对红细胞力学性质的定量描述。
, 百拇医药
1 材料与方法
1.1 实验动物、试剂与仪器
北京大白兔,由北京医科大学实验动物部供给;戊二醛(Glutaraldehyde);马来酰亚胺(MSL,Sigma公司);DPH(1,6-二苯基1,3,5-乙三烯,Sigma公司);聚乙烯吡咯烷酮PVP(polyvinlpyrolidone,分子量为30kD)。
Bruker ESP300型电子自旋共振波谱仪;日立(HITACHI)850型荧光分光光度计;GYJ-I型自动激光衍射,北京医科大学与北京地质仪器厂联合研制;低温高速离心机LG10-3A北京医用离心机厂
1.2 方法与步骤
1.2.1 红细胞膜(resealed ghost)制备
, 百拇医药
大白兔颈动脉插管取血,肝素抗凝,离心去血浆及白细胞,加入等渗PBS离心,去上清,重复2次,得红细胞。将pH7.9的低渗缓冲液在4℃左右按40∶1的体积加入红细胞中,使之溶血,用高速冷冻离心机在12000rpm下离心,弃上清,如此重复4次,得白色细胞膜放入pH7.4的等渗PBS中使之封闭。
1.2.2 用电子自旋共振波谱技术(ESR)测量经戊二醛处理、马来酰亚胺(MSL)标记的红细胞膜蛋白构象及运动性的变化。
取细胞膜5份,每份200μl,分别用浓度为0、1/4000、1/3000、1/2000、1/1000(V/V)的戊二醛PBS缓冲液悬浮5min,然后立刻离心去上清,再用等渗PBS离心洗涤三次,以终止反应。
将15μl的马来酰亚胺(MSL)溶于800μl的PBS后加入各份样品中进行标记,在冰水中搅拌4min,置于4℃冰箱过夜。上机测试前用PBS洗涤膜3~4次(10000rpm,10min)。
, 百拇医药
1.2.3 用荧光偏振法测定经戊二醛处理的红细胞膜脂流动性
用浓度为0、1/4000、1/3000、1/2000、1/1000和1/500的戊二醛处理细胞膜5min,然后迅速离心清洗终止反应。每份样品含400μg蛋白。
用荧光探剂DPH标记红细胞膜及上机测量荧光偏振度(P)。
1.2.4 用新型激光衍射法测定经戊二醛处理的红细胞在C=0轨道上的小变形(DId)
兔耳缘取血,离心后去血浆及白细胞等,然后用等渗PBS离心清洗得纯净的红细胞。
用戊二醛浓度分别为0、1/4000、1/3000、1/2000、1/1000的PBS缓冲液悬浮红细胞,细胞浓度为2×107个/ml,处理5min后迅速离心终止反应。
, 百拇医药
测量红细胞平均直径。
将处理过的红细胞分别用3%的PVP溶液(分子量30kD,其中含0.04%的牛血清白蛋白)悬浮,用新型激光衍射法测量红细胞在C=0轨道上的小变形(DId),测试条件为:剪切率=200s-1。
1.2.5 用传统激光衍射法测定经戊二醛处理的红细胞在高粘流场中最大变形指数(DImax)及变形恢复半衰减时间(t0.5)。
红细胞准备同(1.2.4)。
用戊二醛处理红细胞同(1.2.4)。
经戊二醛处理后的红细胞用15%PVP悬浮,红细胞浓度仍为2×107个/ml,用激光衍射法测量(i)红细胞最大变形指数(DImax);(ii)红细胞变形恢复半衰减时间(t0.5),测量条件为:最大切变率为1000s-1。
, http://www.100md.com
2 结果与讨论
经戊二醛处理后,红细胞膜的电子自旋共振谱的蛋白强弱固定比(S/W)结果如图1所示。由图可以看出,S/W值随戊二醛浓度的增加而显著增大,表明经戊二醛作用后,红细胞膜蛋白运动性下降。戊二醛是一种常用的同型双功能交联剂,它的两个醛基可以与两个相同或不同分子上的伯氨基形成Schiff氏碱,将两分子以五碳链的桥联接起来[11]。经戊二醛处理后,红细胞膜蛋白产生不同程度的交联,这种交联作用对红细胞膜上的蛋白空间取向、彼此间的相互作用势必产生影响。由于桥联的作用膜蛋白彼此间的约束加强,膜蛋白三级结构趋于收缩。
图1 MSL标记的戊二醛处理的红细胞膜
ESR谱S/W随浓度的变化
采用荧光偏振技术测量的经戊二醛处理后的红细胞膜的荧光偏振度(P),随戊二醛的剂量增加而上升,结果如图2,说明脂流动性下降。由于膜蛋白与膜脂的相互作用,膜蛋白产生不同程度的交联后进而影响了膜脂的流动性。随交联程度的增加对膜脂的流动性影响越大,然而比较图1和图2,可以看到,S/W值的变化趋势与P值的变化趋势是不同的,说明膜蛋白的变化对膜脂流动性的影响是非线性的[2]。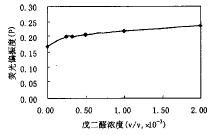
, 百拇医药
图2 DPH标记的红细胞膜荧光偏振度(P)值随
戊二醛浓度的关系曲线
利用文宗曜等[7,9,10]人提出的新型激光衍射法,我们测定了经不同浓度戊二醛处理的红细胞在低粘低切变(η=3cp,γ=200s-1)流场中C=0轨道上的小变形DId,结果见表1。同时测量了经不同浓度戊二醛处理后的兔红细胞直径,平均值为6.5±0.5μm。
表1 经不同浓度的戊二醛处理后红红细胞在
C=0轨道上的DId、t0.5及DImax 戊二醛浓度
(%)
DId
, http://www.100md.com
(%)
T0.5
(s)
DImax
(%)
0
11.8±0.14
0.103±0.011
59.6±0.9
0.025
10.0±0.49
0.087±0.005
, 百拇医药
50.7±0.7
0.033
6.9±0.28
0.080±0.028
39.9±2.1
0.05
5.4±0.56
0.080±0.028
28.9±1.8
0.1
3.0±0.63
0.070±0.028
, 百拇医药
21.9±1.8
利用施岩等人提出的公式[13]:
分别代入不同戊二醛浓度下的小变形值DId以及红细胞平均半径,计算出不同戊二醛浓度下红细胞的剪切弹性模量(E),结果如图3。
利用传统激光衍射法我们分别测得不同戊二醛浓度下的红细胞变形恢复半衰减时间t0.5,及红细胞最大变形指数DImax,结果见表1。
根据施岩等人提出的公式[13]: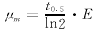
将已得到的E和t0.5代入上式,即可求得不同浓度戊二醛作用下红细胞膜粘度(μm),结果见图4。
, 百拇医药
由图3,4的结果可知,随着膜蛋白交联程度的增加,导致膜剪切弹性模量(E)上升,即红细胞膜刚性程度上升,红细胞粘度(μm)也明显上升。膜剪切弹性模量(E)和膜粘度(μm)主要由红细胞膜蛋白的性质决定,利用传统激光衍射法只能获得红细胞变形性的相对量DImax,而用新型激光衍射法我们得到了描述红细胞微观力学性质的物理量,说明新型激光衍射法在研究红细胞微观力学性质上比利用传统激光衍射法更为优越。E和μm的增加导致了红细胞变形能力的下降。
图3 戊二醛处理的红细胞膜剪切弹性
模量随浓度的变化曲线
图4 红细胞膜粘度(μm)与戊二醛浓度的关系
, 百拇医药
综上所述,戊二醛作用于红细胞膜后造成膜蛋白交联,蛋白间结合位点增多导致膜蛋白运动性下降,构象发生改变,蛋白三级结构趋于收缩;在膜蛋白交联作用的影响下膜脂流动性降低;红细胞膜剪切弹性模量(E)和表面粘度(μm)均呈上升趋势,红细胞刚性增加,红细胞变形能力下降。用新型激光衍射法测得的膜剪切弹性模量(E)和表面粘度(μm),很好地证明了戊二醛作用于红细胞膜蛋白使之交联而产生的膜蛋白构象的改变。
作者简介:孙大公(1966—),男,北京医科大学医学物理教研室讲师。
参考文献
[1] Manno S, Takakuwa Y, Nagao K, et al. Modulation of erythrocyte membrane mechanical function by beta-spectrin phosphorylation and dephosphorylation. J Biol Chem, 1995,270(10):5659—65
, 百拇医药
[2] An XL, Takakuwa Y, Nunomura W, et al. Modulation of band 3-ankyrin interaction by protein 4.1. Functional implications in regulation of erythrocyte membrane mechanical properties. J Biol Chem, 1996,271(52):33187—91
[3] Gwozdzinski K, Janicka M, Brzeszczynska J, et al. Changes in red blood cell membrane structure in patients with chronic renal failure. Acta Biochim Pol,1997,44(1):99—107
[4] 程时。生物膜与疾病。北京医科大学。中国协和医科大学联合出版社,1994
, 百拇医药
[5] Wen Zongyao, Ma Weiyuan, Sun Dagong, et al. The study on RBC deformability of iron deficiency anemia. Clinical Hemorheology. 1995,15(1):81—87
[6] 文宗曜,陶祖莱,孙大公,等。大分子吸附对低粘切变流场中红细胞取向的影响。生物物理学报,1993,9:677—682
[7] 高铁,文宗曜,马维原,等。白蛋白对低粘切变流场中的红细胞流变特性的影响。生物物理学报,1996,12(1):174—178
[8] 孙大公, 施岩, 严宗毅,等.胰蛋白酶对红细胞生物物理特性的影响。生物物理学报,1997,16(3):574—578
[9] 文宗曜,高铁,宋立川,等。用激光衍射法研究红细胞在低粘切变流场中的取向和变形及其生理意义。中国科学C辑,1998,28(1):90—96
, 百拇医药
[10] 陶祖莱,文宗曜,曹实。红细胞变形的动力学行为。生物物理学报,1991,7(2):233—238
[11] 洪孝庄,孙曼霁。蛋白质连接技术。中国医药科技出版社,1993
[12] Wen Zon yao, Yan Zongyi, Tie Gao, et al. The study of effects of WGA and ConA on RCB receptors with a new Ektacytometry. Clinical Heomrhology and Microciulation, 1997,17(6):467—478
[13] 施岩,孙大公,文宗曜。用激光衍射法测量红细胞膜弹性模量和微粘度的方法。中国生物医学工程学报,1997,16(2):103—107
(1999-09-21收稿,1999-11-04修回), 百拇医药
单位:施岩(承德医学院数学教研室 承德 067000);孙大公 陈凯 谢利德 姚伟娟 文宗曜(北京医科大学血液流变学研究中心 北京 100083)
关键词:戊二醛;膜蛋白;新激光衍射法;生物力学特性
北京生物医学工程000208 摘 要 本文通过不同浓度戊二醛作用于红细胞膜。用新型激光衍射法测量了这些红细胞样品的弹性模量E和膜粘度μm。同时通过DPH标记的萤光偏振法测定了这些红细胞膜的流动性,并采用MSL标记的电子自旋共振波谱技术(ESR)测量了红细胞膜蛋白运动性的变化,并取得了与新型激光衍射法一致的结果。发现膜蛋白构象发生改变,膜脂流动性下降,红细胞膜剪切弹性模量(E)和表面粘度(μm)均呈上升趋势,红细胞变形能力下降。并对上述红细胞膜结构改变所引起的微观流变特性的变化进行了初步探讨。
, http://www.100md.com
Effects of Membrane Proteins Cross-Linking on Biomechanical
Properties of The Erythrocyte Membrane
Sun Dagong,Shi Yan, Chen Kai, Xie Lide, Yao Weijuan, Wen Zhongyao
(Department of Medical physics, Beijing Medical University, Beijing 100083)
(Department of mathematics, Chengde Medical college,Chengde 067000)
Abstract
, 百拇医药
Coefficients of elastic modulus(E) and viscosity(μm) of RBCs were measured by new ektacymeatry after treatment of RBC with different doses of Glutaraldehyde. RBC membrane fluidity and dynamic changes of the protein-microstructure of RBC membrane were measured with fluorescence polarization using DPH as a marker, and with electron spin resonance (ESR)using MSL as a marker respectively. It was found that the protein-microstructure of RBC membrane had changed, and membrane lipid. fluidity had decreased with the increase of treament dose of Glutaraldehyde. Moreover, increase of E, and μm and decrease of membrane fluidity as well as RBC deformability, had been observed with the increase of Glutaraldehyde concentratrion.Here presented is also a preliminary discussion of change of micro-hemorheology, resulted from alteration of microstructure of RBC membrane.
, 百拇医药
Key words:Glutaraldehyde, Membrane protein, New ektacytometry, Biomechanical properties
0 前言
红细胞膜的力学性质主要由膜骨架的结构决定,如果构成膜骨架的各种蛋白相互之间的作用异常或某种蛋白有缺陷均可引起红细胞膜力学性质的改变,从而引发多种疾病。如遗传性球形红细胞增多症(HS),阵发性睡眠性血红蛋白尿症(PNH)等都是由于膜蛋白的缺陷或异常引起的。日本学者Manno[1]等人研究了骨架蛋白磷酸化和完整细胞膜的功能之间的关系,他们认为细胞膜力学稳定性受膜酪蛋白激酶I对beta-spectrin的磷酸化调控,beta-spectrin的磷酸化降低增加了细胞膜的力学稳定性;反之磷酸化程度的增加降低了细胞膜的力学稳定性。An XL和Takakuwa[2]等人研究了红细胞膜蛋白4.1和带3蛋白相互作用对膜力学性质的影响,他们发现随着蛋白4.1与带3蛋白的分离,带3蛋白与锚蛋白的相互作用增强,使细胞膜的变形性下降,机械稳定性增加。Gwozdzinski[3]等人利用电子共顺磁共振技术研究了慢性肾衰竭病人的红细胞膜性质,发现慢性肾衰竭病人的红细胞的渗透脆性比正常人有显著增加,而且膜蛋白的运动性下降。即便在正常生理过程中随红细胞的衰老,红细胞膜结构也在不断发生变化,导致红细胞刚性增加,最终被从血液循环系统中清除掉[4]。我们曾先后研究了缺铁性贫血[5]大分子吸附[6],白蛋白[7]对红细胞微观流变特性的影响及胰蛋白酶对红细胞膜的水解作用[8]。本文通过戊二醛作用于红细胞膜,通过DPH标记的萤光偏振法测定了这些红细胞膜的流动性,采用MSL标记的电子自旋共振波谱技术(ESR)测量了红细胞膜蛋白的构象的动态变化,并用新型激光衍射法[7,9,10]测量了这些红细胞样品的弹性模量E和膜粘度μm。获得对红细胞力学性质的定量描述。
, 百拇医药
1 材料与方法
1.1 实验动物、试剂与仪器
北京大白兔,由北京医科大学实验动物部供给;戊二醛(Glutaraldehyde);马来酰亚胺(MSL,Sigma公司);DPH(1,6-二苯基1,3,5-乙三烯,Sigma公司);聚乙烯吡咯烷酮PVP(polyvinlpyrolidone,分子量为30kD)。
Bruker ESP300型电子自旋共振波谱仪;日立(HITACHI)850型荧光分光光度计;GYJ-I型自动激光衍射,北京医科大学与北京地质仪器厂联合研制;低温高速离心机LG10-3A北京医用离心机厂
1.2 方法与步骤
1.2.1 红细胞膜(resealed ghost)制备
, 百拇医药
大白兔颈动脉插管取血,肝素抗凝,离心去血浆及白细胞,加入等渗PBS离心,去上清,重复2次,得红细胞。将pH7.9的低渗缓冲液在4℃左右按40∶1的体积加入红细胞中,使之溶血,用高速冷冻离心机在12000rpm下离心,弃上清,如此重复4次,得白色细胞膜放入pH7.4的等渗PBS中使之封闭。
1.2.2 用电子自旋共振波谱技术(ESR)测量经戊二醛处理、马来酰亚胺(MSL)标记的红细胞膜蛋白构象及运动性的变化。
取细胞膜5份,每份200μl,分别用浓度为0、1/4000、1/3000、1/2000、1/1000(V/V)的戊二醛PBS缓冲液悬浮5min,然后立刻离心去上清,再用等渗PBS离心洗涤三次,以终止反应。
将15μl的马来酰亚胺(MSL)溶于800μl的PBS后加入各份样品中进行标记,在冰水中搅拌4min,置于4℃冰箱过夜。上机测试前用PBS洗涤膜3~4次(10000rpm,10min)。
, 百拇医药
1.2.3 用荧光偏振法测定经戊二醛处理的红细胞膜脂流动性
用浓度为0、1/4000、1/3000、1/2000、1/1000和1/500的戊二醛处理细胞膜5min,然后迅速离心清洗终止反应。每份样品含400μg蛋白。
用荧光探剂DPH标记红细胞膜及上机测量荧光偏振度(P)。
1.2.4 用新型激光衍射法测定经戊二醛处理的红细胞在C=0轨道上的小变形(DId)
兔耳缘取血,离心后去血浆及白细胞等,然后用等渗PBS离心清洗得纯净的红细胞。
用戊二醛浓度分别为0、1/4000、1/3000、1/2000、1/1000的PBS缓冲液悬浮红细胞,细胞浓度为2×107个/ml,处理5min后迅速离心终止反应。
, 百拇医药
测量红细胞平均直径。
将处理过的红细胞分别用3%的PVP溶液(分子量30kD,其中含0.04%的牛血清白蛋白)悬浮,用新型激光衍射法测量红细胞在C=0轨道上的小变形(DId),测试条件为:剪切率=200s-1。
1.2.5 用传统激光衍射法测定经戊二醛处理的红细胞在高粘流场中最大变形指数(DImax)及变形恢复半衰减时间(t0.5)。
红细胞准备同(1.2.4)。
用戊二醛处理红细胞同(1.2.4)。
经戊二醛处理后的红细胞用15%PVP悬浮,红细胞浓度仍为2×107个/ml,用激光衍射法测量(i)红细胞最大变形指数(DImax);(ii)红细胞变形恢复半衰减时间(t0.5),测量条件为:最大切变率为1000s-1。
, http://www.100md.com
2 结果与讨论
经戊二醛处理后,红细胞膜的电子自旋共振谱的蛋白强弱固定比(S/W)结果如图1所示。由图可以看出,S/W值随戊二醛浓度的增加而显著增大,表明经戊二醛作用后,红细胞膜蛋白运动性下降。戊二醛是一种常用的同型双功能交联剂,它的两个醛基可以与两个相同或不同分子上的伯氨基形成Schiff氏碱,将两分子以五碳链的桥联接起来[11]。经戊二醛处理后,红细胞膜蛋白产生不同程度的交联,这种交联作用对红细胞膜上的蛋白空间取向、彼此间的相互作用势必产生影响。由于桥联的作用膜蛋白彼此间的约束加强,膜蛋白三级结构趋于收缩。

图1 MSL标记的戊二醛处理的红细胞膜
ESR谱S/W随浓度的变化
采用荧光偏振技术测量的经戊二醛处理后的红细胞膜的荧光偏振度(P),随戊二醛的剂量增加而上升,结果如图2,说明脂流动性下降。由于膜蛋白与膜脂的相互作用,膜蛋白产生不同程度的交联后进而影响了膜脂的流动性。随交联程度的增加对膜脂的流动性影响越大,然而比较图1和图2,可以看到,S/W值的变化趋势与P值的变化趋势是不同的,说明膜蛋白的变化对膜脂流动性的影响是非线性的[2]。

, 百拇医药
图2 DPH标记的红细胞膜荧光偏振度(P)值随
戊二醛浓度的关系曲线
利用文宗曜等[7,9,10]人提出的新型激光衍射法,我们测定了经不同浓度戊二醛处理的红细胞在低粘低切变(η=3cp,γ=200s-1)流场中C=0轨道上的小变形DId,结果见表1。同时测量了经不同浓度戊二醛处理后的兔红细胞直径,平均值为6.5±0.5μm。
表1 经不同浓度的戊二醛处理后红红细胞在
C=0轨道上的DId、t0.5及DImax 戊二醛浓度
(%)
DId
, http://www.100md.com
(%)
T0.5
(s)
DImax
(%)
0
11.8±0.14
0.103±0.011
59.6±0.9
0.025
10.0±0.49
0.087±0.005
, 百拇医药
50.7±0.7
0.033
6.9±0.28
0.080±0.028
39.9±2.1
0.05
5.4±0.56
0.080±0.028
28.9±1.8
0.1
3.0±0.63
0.070±0.028
, 百拇医药
21.9±1.8
利用施岩等人提出的公式[13]:

分别代入不同戊二醛浓度下的小变形值DId以及红细胞平均半径,计算出不同戊二醛浓度下红细胞的剪切弹性模量(E),结果如图3。
利用传统激光衍射法我们分别测得不同戊二醛浓度下的红细胞变形恢复半衰减时间t0.5,及红细胞最大变形指数DImax,结果见表1。
根据施岩等人提出的公式[13]:
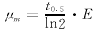
将已得到的E和t0.5代入上式,即可求得不同浓度戊二醛作用下红细胞膜粘度(μm),结果见图4。
, 百拇医药
由图3,4的结果可知,随着膜蛋白交联程度的增加,导致膜剪切弹性模量(E)上升,即红细胞膜刚性程度上升,红细胞粘度(μm)也明显上升。膜剪切弹性模量(E)和膜粘度(μm)主要由红细胞膜蛋白的性质决定,利用传统激光衍射法只能获得红细胞变形性的相对量DImax,而用新型激光衍射法我们得到了描述红细胞微观力学性质的物理量,说明新型激光衍射法在研究红细胞微观力学性质上比利用传统激光衍射法更为优越。E和μm的增加导致了红细胞变形能力的下降。

图3 戊二醛处理的红细胞膜剪切弹性
模量随浓度的变化曲线

图4 红细胞膜粘度(μm)与戊二醛浓度的关系
, 百拇医药
综上所述,戊二醛作用于红细胞膜后造成膜蛋白交联,蛋白间结合位点增多导致膜蛋白运动性下降,构象发生改变,蛋白三级结构趋于收缩;在膜蛋白交联作用的影响下膜脂流动性降低;红细胞膜剪切弹性模量(E)和表面粘度(μm)均呈上升趋势,红细胞刚性增加,红细胞变形能力下降。用新型激光衍射法测得的膜剪切弹性模量(E)和表面粘度(μm),很好地证明了戊二醛作用于红细胞膜蛋白使之交联而产生的膜蛋白构象的改变。
作者简介:孙大公(1966—),男,北京医科大学医学物理教研室讲师。
参考文献
[1] Manno S, Takakuwa Y, Nagao K, et al. Modulation of erythrocyte membrane mechanical function by beta-spectrin phosphorylation and dephosphorylation. J Biol Chem, 1995,270(10):5659—65
, 百拇医药
[2] An XL, Takakuwa Y, Nunomura W, et al. Modulation of band 3-ankyrin interaction by protein 4.1. Functional implications in regulation of erythrocyte membrane mechanical properties. J Biol Chem, 1996,271(52):33187—91
[3] Gwozdzinski K, Janicka M, Brzeszczynska J, et al. Changes in red blood cell membrane structure in patients with chronic renal failure. Acta Biochim Pol,1997,44(1):99—107
[4] 程时。生物膜与疾病。北京医科大学。中国协和医科大学联合出版社,1994
, 百拇医药
[5] Wen Zongyao, Ma Weiyuan, Sun Dagong, et al. The study on RBC deformability of iron deficiency anemia. Clinical Hemorheology. 1995,15(1):81—87
[6] 文宗曜,陶祖莱,孙大公,等。大分子吸附对低粘切变流场中红细胞取向的影响。生物物理学报,1993,9:677—682
[7] 高铁,文宗曜,马维原,等。白蛋白对低粘切变流场中的红细胞流变特性的影响。生物物理学报,1996,12(1):174—178
[8] 孙大公, 施岩, 严宗毅,等.胰蛋白酶对红细胞生物物理特性的影响。生物物理学报,1997,16(3):574—578
[9] 文宗曜,高铁,宋立川,等。用激光衍射法研究红细胞在低粘切变流场中的取向和变形及其生理意义。中国科学C辑,1998,28(1):90—96
, 百拇医药
[10] 陶祖莱,文宗曜,曹实。红细胞变形的动力学行为。生物物理学报,1991,7(2):233—238
[11] 洪孝庄,孙曼霁。蛋白质连接技术。中国医药科技出版社,1993
[12] Wen Zon yao, Yan Zongyi, Tie Gao, et al. The study of effects of WGA and ConA on RCB receptors with a new Ektacytometry. Clinical Heomrhology and Microciulation, 1997,17(6):467—478
[13] 施岩,孙大公,文宗曜。用激光衍射法测量红细胞膜弹性模量和微粘度的方法。中国生物医学工程学报,1997,16(2):103—107
(1999-09-21收稿,1999-11-04修回), 百拇医药